Неспецифическая резистентность при инфекциях
Обновлено: 18.04.2024
Основным клиническим синдромом респираторной инфекции является поражение дыхательных путей на фоне лихорадочного состояния.
Основным клиническим синдромом респираторной инфекции является поражение дыхательных путей на фоне лихорадочного состояния. Вирусы-возбудители играют ведущую роль, обусловливая поражение дыхательных путей, и хотя инфицирование большинством вирусов ведет к накоплению специфических гуморальных антител, их уровень быстро падает, делая возможным повторное инфицирование, способствуя развитию вторичного иммунного ответа, видоизменяя заболевание.
Острые респираторные вирусные инфекции (ОРВИ) относятся к числу повсеместно распространенных заболеваний, которые на протяжении многих лет по числу случаев превосходят все другие инфекции вместе взятые. По данным разных авторов, на ОРВИ приходится от 60 до 90% всей детской инфекционной заболеваемости (Дриневский В. П., 1991), число летальных исходов от острых респираторных заболеваний и их осложнений составляет более 4 млн. случаев в год только у детей до 5 лет, а общее число случаев смерти детей в мире составляет в среднем около 15 млн. в год (ВОЗ, 1991).
Основные причины осложнений при ОРВИ — нарушение функционирования системы иммунитета, что приводит к формированию длительно протекающих иммунодефицитных состояний, сочетающихся с подавлением резистентности организма (Ботвиньева В. В., 1989; Романцов М. Г., 1992). Для этой группы заболеваний вакцинопрофилактика не имеет больших перспектив (Чижов Н. П., 1991; Бектимиров Т. А., 1987; Ершов Ф. И., 1998).
В последние годы обозначилась тенденция к нарастанию числа затяжных, рецидивирующих, хронических бронхолегочных заболеваний у детей. На этом фоне выявляются различные иммунопатологические состояния, наблюдаются несколько раз в год обострения заболевания с отчетливой клинической симптоматикой.
Респираторные вирусные заболевания, поражающие детей различного возраста, увеличивают риск аллергических заболеваний. В свою очередь дети с атопическими состояниями склонны к частым ОРВИ, что рассматривается как проявление их иммунного несовершенства (Ботвиньева В. В., 1985; Назаров В. Ю., 1991; Потемкина А. М., 1990).
Широкое использование дибазола для повышения неспецифической резистентности организма при вышеуказанных заболеваниях нельзя считать оправданным (Ершов Ф. И., 1998). Более перспективным следует считать назначение химиотерапевтических препаратов, обладающих как широким спектром противовирусной активности, так и выраженным иммунокорригирующим действием. К таким препаратам относится циклоферон — отечественный индуктор эндогенного интерферона, который разрешен к применению в педиатрической практике как противовирусное средство.
Исследования, проведенные при лечении взрослых больных с бронхолегочной патологией, показали, что циклоферон, стимулируя нейтрофилы периферической крови, увеличивает их провоспалительный потенциал и возможность к высокой генерации активных форм кислорода, повышая бактерицидные свойства крови.
В связи с тем что в структуре детской заболеваемости превалируют смешанные (вирусно-бактериальные) инфекции, циклоферон является оптимальным средством для повышения неспецифической резистентности детского организма при бронхолегочной (респираторной) патологии, создавая адаптивный противовирусный иммунитет и обладая противовоспалительным и иммунокорригирующим эффектом.
Нами проведена оценка профилактической эффективности циклоферона (таблетированной лекарственной формы) у детей дошкольного и младшего школьного возраста в качестве средства неспецифической профилактики гриппа и ОРВИ в период повышенной заболеваемости ОРВИ и эпидемии гриппа НЗ № 1 и НЗ № 2 в 1998 — 1999 гг. в условиях контролируемого эпидемиологического опыта.
Под наблюдением находилось 122 ребенка в возрасте от 3 до 9 лет, относящихся к группе часто и длительно болеющих детей. Методом случайной индивидуальной выборки сформированы группы — опытная и контрольная. В качестве группы сравнения проанализирована группа детей, получавших адаптоген — настойку аралии (22 человека).
Экстренную профилактику ОРВИ и гриппа проводили по следующим схемам.
1-я схема — детям до 7 лет препарат циклоферон назначался по 150 мг на 1, 2, 4, 6, 8 день терапии (№ 5) и далее по 150 мг через 72 часа (№ 5). Итого № 10 на курс, в курсовой дозе 1500 мг.
2-я схема — детям старше 7 лет по той же схеме, что и детям до 7 лет, но разовый прием 300 мг (две таблетки). Курсовая доза 3000 мг.
Циклоферон получал 51 ребенок.
Контрольную группу составили дети, не получавшие циклоферон, находящиеся на обычной стандартной (симптоматической) терапии (49 человек).
Эффективность профилактического действия препарата оценивали на основании уровня заболеваемости ОРВИ и гриппом в опытной и контрольной группах.
Помимо этого изучена динамика изменения секреторного иммунитета под влиянием циклоферона у детей, находящихся под наблюдением, и проведена оценка показателей функции внешнего дыхания.
В опытной группе из 51 ребенка, получавшего циклоферон, заболело 4 человека; в группе контроля из 49 человек заболел 41 ребенок. Таким образом, индекс эффективности составил 10,7%, а показатель защищенности — 91,0%.
Индекс эффективности и показатель защищенности в группе сравнения (дети, получавшие адаптоген — настойку аралии) составили 1,1 и 8,3% соответственно.
Полученные результаты доказывают целесообразность использования циклоферона в указанных курсовых дозах 1500 и 3000 мг соответственно детям до 7 и старше 7 лет.
У получавших препарат отмечается прирост показателей (соответственно на 34 и 43,8 г/л) уровня иммуноглобулина А и иммуноглобулина G, тогда как у детей, не получавших препарат, выявлено снижение уровня секреторного IgА (7,6 г/л) на фоне незначительного (12,2 г/л) прироста уровня IgG.
Показатели функции внешнего дыхания у детей, получавших циклоферон в качестве средства экстренной профилактики ОРЗ и гриппа
В таблице представлены показатели ФВД детей, получавших циклоферон в двух курсовых дозах — 1500 мг (дети до 7 лет) и 3000 мг (дети старше 7 лет). В группе детей, у которых отмечен четкий эффект от применения циклоферона, отмечен прирост показателей ФВД.
Таким образом, показана целесообразность применения циклоферона в виде таблетированной лекарственной формы в качестве средства экстренной неспецифической профилактики ОРВИ и гриппа по указанной схеме применения препарата, при этом отмечается прирост уровня секреторного IgА и IgG и нормализация показателей функции внешнего дыхания.
При проведении исследования аллергических реакций и негативных эффектов препарата не выявлено. Переносимость препарата хорошая.
Целесообразно рекомендовать препарат циклоферон как средство неспецифической профилактики ОРЗ и гриппа в период повышенного подъема респираторной заболеваемости.
Факторы неспецифической резистентности организма. Система ИФН. Система интерферона (ифн). Функции интерферона (ифн). Механизм антивирусного действия интерферона (ифн).
Система интерферона (ифн) — важнейший фактор неспецифической резистентности организма человека. Следует отметить, что открытие интерферона (ифн) А. Айзексом и Ж. Линденманном (1957) было плодом блестящей случайности, по своей значимости сравнимой с открытием пенициллинов Флемингом: изучая интерференцию вирусов, авторы обратили внимание на то, что некоторые клетки становились резистентными к повторному заражению вирусами. В настоящее время ИФН относят к классу индуцируемых белков клеток позвоночных.
Функции интерферона (ифн)
Важнейшие функции интерферона (ифн): антивирусная, противоопухолевая, иммуномодулирующая и радиопротективная. Различают три интерферона (ифн):
а-ИФН синтезируют лейкоциты периферической крови (ранее был известен как лейкоцитарный ИФН);
b-ИФН синтезируют фибробласты (ранее известен как фибробластный ИФН);
у-ИФН — продукт стимулированных Т-лимфоцитов, NK-клеток и (возможно) макрофагов (ранее был известен как иммунный ИФН).
По способу образования различают ИФН типа I (образуется в ответ на обработку клеток вирусами, молекулами двухцепочечной РНК, полинуклеотидами и рядом низкомолекулярных природных и синтетических соединений) и ИФН типа II (продуцируется лимфоцитами и макрофагами, активированными различными индукторами; действует как цитокин).
ИФН видоспецифичны. Каждый биологический вид, способный к их образованию, продуцирует свои уникальные продукты, похожие по структуре и свойствам, но не способные проявлять перекрёстный антивирусный эффект (то есть действовать в условиях организма другого вида).
Механизм антивирусного действия интерферона (ифн)
Интерферон ( ИФН ) индуцируют антивирусное состояние клетки (резистентность к проникновению или блокада репродукции вирусов). Блокада репродуктивных процессов при проникновении вируса в клетку обусловлена угнетением трансляции вирусной мРНК. При этом противовирусный эффект интерферона (ифн) не направлен против конкретных вирусов; то есть ИФН не обладают вирусспецифтностъю. Это объясняет их универсально широкий спектр антивирусной активности. ИФН взаимодействует с интактными клетками ещё неинфицированными клетками, препятствуя реализации репродуктивного цикла вирусов за счёт активации клеточных ферментов (протеинкиназ).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Причины устойчивости к антибиотикам. Механизмы
Устойчивость к действию антибиотиков отмечают в случае, когда ранее восприимчивые микроорганизмы теряют свою чувствительность к антибактериальному препарату при использовании клинически безопасной дозы. Это происходит в результате генетических изменений, часто возникающих в быстро делящихся клетках с гаплоидным набором хромосом.
Факторы определяющие устойчивость бактерий к антибиотикам
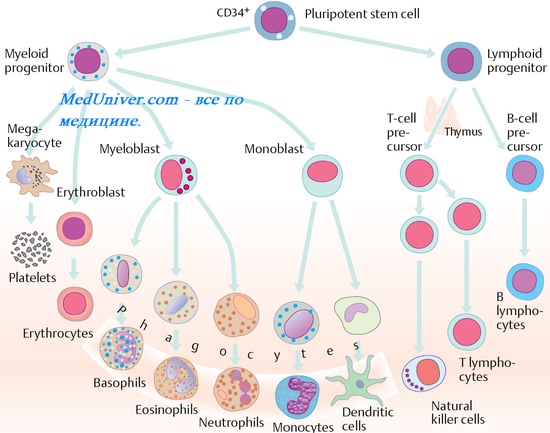
Трансформация бактерий и утойчивость к антибиотикам. Трансформация — процесс захвата бактериями свободной цепи ДНК и встраивания её в собственный геном.
Например, Streptococcus pneumoniae способен захватывать у близкородственных видов часть генов, кодирующих пенициллинсвязывающие белки (обладают меньшим сродством к лекарственному препарату). При продукции изменёнными генами этих белков чувствительность к действию пенициллина заметно снижается, т.е. бактерии продолжают синтезировать пептидогликан, сохраняя структуру клеточной стенки, даже в присутствии препарата.
Устойчивость к действию бензилпенициллина у Neisseria gonorrhoeae развивается по такому же механизму.
Конъюгация бактерий и утойчивость к антибиотику
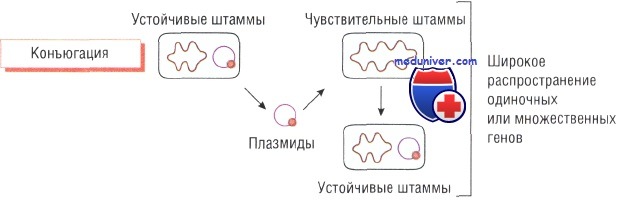
Плазмиды — кольцевые структуры ДНК, расположенные в цитоплазме бактерий. Их может быть достаточно много. Именно поэтому при делении клеток одни и те же плазмиды обнаруживают у всех дочерних микроорганизмов. Плазмиды содержат информацию о различных генах бактерии, в том числе о генах, кодирующих метаболические ферменты, и факторах, определяющих вирулентность и устойчивость к действию антибиотиков.
Конъюгация — процесс передачи плазмид от одной бактерии к другой. В этом случае гены, кодирующие устойчивость, быстро распространяются среди бактерий, находящихся в одной среде обитания (например, в кишечнике). Комбинированное воздействие отдельных антибиотиков (например, в госпитальных условиях) приводит к появлению мультирезистентных штаммов.
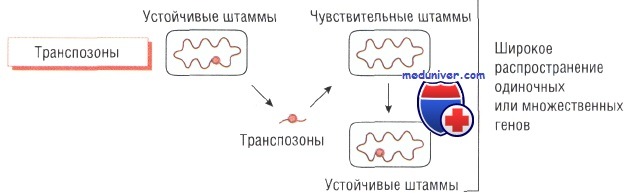
Транспозоны и интегроны бактерий и утойчивость к антибиотику
Транспозоны и интегроны — подвижные гены, способные кодировать транспозицию (внутрихромосомную транслокацию). Они могут перемещаться как между хромосомами и плазмидами, так и между бактериями и содержат большое количество генетической информации (например, антибиотикорезистентность).
Считают, что в основе развития устойчивости к метициллину у Staphylococcus aureus и к тетрациклину у Neisseria gonorrhoeae лежит передача именно этих генетических структур. Интегроны играют важную роль в передаче мультирезистентности у грамположительных микроорганизмов. Кроме того, передачу генов резистентности могут осуществлять бактериофаги.
Механизмы возникновения утойчивости к антибиотикам
Изменение структуры антибактериального препарата. Ферментативная инактивация. Наиболее распространённый механизм развития устойчивости к действию антибиотика — спонтанное продуцирование фермента, разрушающего препарат.
Большинство штаммов Staphylococcus aureus продуцирует экстрацеллюлярный фермент бета-лактамазу, которая инактивирует пенициллины, разрушая бета-лактамное кольцо в их структуре. Ферменты, разрушающие пенициллины и цефало-спорины, синтезируют многие микроорганизмы, в том числе Escherichia coli, Haemophilus influenzae и некоторые представители рода Pseudomonas.
Гены, кодирующие эти ферменты, обычно расположены в подвижных генетических элементах (транспозонах) и могут передаваться как между бактериями одного вида, так и между видами. Распространение различных видов бета-лактамаз расширенного спектра (например, CTXm или АтрС) среди представителей семейства энтеробактерий приводит к возникновению устойчивости к эффектам пенициллинов и цефалоспоринов широкого спектра действия и возникновению внутрибольничных инфекций. Кроме того, эти микроорганизмы могут вызывать опасные внебольничные заболевания.
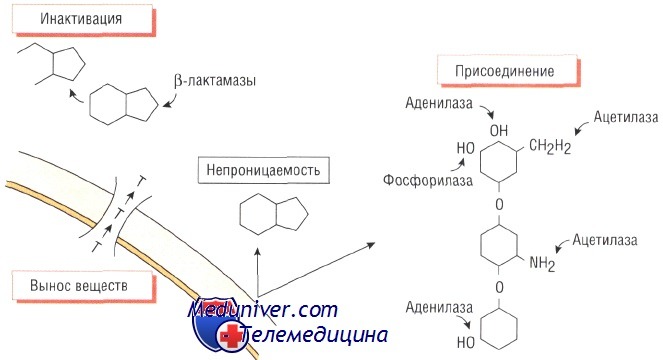
Ферментативное присоединение. Бактерии могут вырабатывать ферменты, способные угнетать активность антибиотиков путём присоединения к последним различных химических групп. Например, устойчивость к действию аминогликозидов возникает в результате присоединения ацетилового, аминового или аденозинового радикала к молекуле препарата.
Влияние такой модификации на эффективность лекарственных средств группы аминогликозидов различно. Так, амикацин наименее восприимчив к этому способу инактивации. Присутствие ферментов, обусловливающих устойчивость к действию аминогликозидов, характерно как для грамположительных (Staphylococcus aureus), так и для грамотрицательных (микроорганизмы рода Pseudomonas) возбудителей.
Непроницаемость клеточной стенки и утойчивость к антибиотику
Устойчивость некоторых бактерий к действию антимикробных средств связана с непроницаемостью их клеточной стенки для молекул препарата. Например, клеточная стенка грамо-трицательных микроорганизмов (особенно рода Pseudomonas) непроницаема для некоторых бета-лактамов.
В то же время аминогликозиды проникают внутрь бактерии посредством кислородозависимой транспортной системы (а потому анаэробы к ним невосприимчивы), в связи с этим анаэробы обладают небольшой чувствительностью к аминогликозидам.
Механизмы выведения веществ из бактериальной клетки и утойчивость к антибиотику
Некоторые бактерии, например Е. coli, становятся невосприимчивыми к действию тетрациклинов, когда приобретают внутримембранный белок, активно выводящий антибиотик из клетки. Устойчивость стрептококков к действию макролидов обусловлена подобным механизмом.
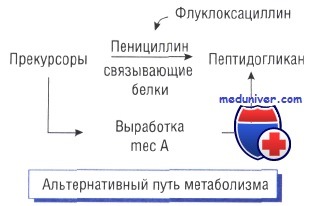
Альтернативные пути метаболизма и утойчивость к антибиотикам
Один из наиболее распространённых механизмов возникновения устойчивости к действию антибактериальных препаратов — развитие альтернативных путей метаболизма, помогающих обходить метаболический блок, вызываемый антибиотиком. Так, Staphylococcus aureus становится невосприимчивым к метициллину или флуклоксациллину, когда у него появляется ген тесА, кодирующий альтернативный пенициллинсвязывающий белок (РВР2), не чувствительный к метициллину.
Несмотря на то что состав бактериальной клеточной стенки изменяется, микроорганизм сохраняет способность к делению. Снижение восприимчивости к бензилпенициллину у Streptococcus pneumoniae также вызвано наличием пенициллинсвязывающих белков.
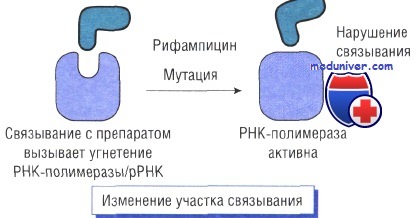
Изменение участка связывания антибиотика
В основе механизма действия рифампицина лежит угнетение бета-субъединицы РНК-полимеразы. Устойчивость возникает при изменении гена РНК-полимеразы в результате точечных мутаций, инсерции или делеции.
При этом новая РНК-полимераза невосприимчива к рифампицину.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В статье обсуждается проблема затяжного осложненного течения острой респираторной инфекции, несмотря на проводимую в соответствии с имеющимися на сегодняшний день рекомендациями терапию. Описан случай неэффективности противовирусной и стандартной антибакт
Resistance of acute respiratory infection agents in clinical practice T. A. Ruzhentsova, D. S. Levitskaya, E. K. Shushakova
The article covers the issue of clinical course of prolonged, acute respiratory infection, in spite of the therapy conducted according to the current guidelines. A case of antiviral and standard antibacterial therapy inefficiency in a patient was described. The clinical case demonstrates that community-acquired pneumonia may develop if there is no estimated effect in the relevant scheme of treatment, and the repeated course of etiotropic drug combination is required, as well as mucolytic and disintoxication therapy.
Острые респираторные инфекции (ОРИ) на сегодняшний день остаются самой распространенной патологией среди всех категорий населения [1, 2]. Многочисленные данные свидетельствуют о значительном влиянии возбудителей на сердечно-сосудистую систему, что напрямую определяет исход заболевания. Наибольшее число осложнений, сопровождающихся летальными исходами, регистрируется при гриппе и пневмококковой инфекции. Были проведены экспериментальные исследования, доказавшие неблагоприятное действие на миокард токсинов Streptococcus pneumoniae у лабораторных животных [3]. Результаты работы подтвердили ранее известные данные о значительном числе случаев нарастания сердечной недостаточности и появления различных вариантов нарушений ритма у пациентов с пневмококковой этиологией внебольничных пневмоний. У зараженных животных в миокарде были обнаружены участки поражения клеток, сопровождавшиеся нарушениями ритма и проводимости, повышением тропонина в сыворотке крови и отложением коллагена в местах повреждений после начала антибактериальной терапии. Отсутствие эффективного лечения приводит к распространенному поражению сердечной мышцы и/или прогрессированию аритмии, что может провоцировать неблагоприятный исход.
В этих ситуациях, безусловно, необходимо применение надежного антибактериального препарата и дезинтоксикационной терапии. На сегодняшний день чрезмерное использование антибиотиков привело к росту устойчивости возбудителей. Ранее проведенные исследования указывали на высокую, по ряду данных, абсолютную чувствительность пневмококка к амоксициллину и левофлоксацину, что позволяло их рекомендовать в группах риска тяжелого течения пневмоний [4, 5].
Однако в настоящее время ситуация изменилась, что иллюстрирует следующий клинический пример.
Пациентка К., 60 лет, обратилась к терапевту с жалобами на слабость, першение в горле, насморк с небольшим количеством водянистых выделений, сухой кашель.
Из анамнеза: заболела 3 дня назад, когда появились указанные жалобы. Температура тела за эти дни не повышалась, однако симптомы усиливались. Контакты с инфекционными больными отрицает. Вакцинирована против гриппа 2 месяца назад (в октябре), других вакцин за последние 10 лет не получала. Аллергических реакций ранее не отмечала. За предшествующий заболеванию год получила 6 курсов антибактериальной терапии, из них — за 1 месяц до настоящего заболевания — амоксициллина клавуланат для лечения пульпита.
Сопутствующая патология: гипертоническая болезнь 2-й стадии, ишемическая болезнь сердца, остеохондроз, артрозо-артрит. Постоянно принимает валсартан 80 мг в сутки, лерканидипин 10 мг в сутки, ацетилсалициловую кислоту (ТромбоАСС) 100 мг в сутки, розувастатин 10 мг в сутки. Дополнительно, почти ежедневно в течение года, употребляет ибупрофен 400 мг или парацетамол 500 мг для купирования болевого синдрома в области коленных и плечевых суставов, в сумме 5–10 таблеток за неделю.
При осмотре: состояние удовлетворительное. Дыхание через нос затруднено. Зев умеренно гиперемирован, миндалины не визуализируются. При аускультации в легких дыхание жесткое, проводится равномерно, хрипов нет. Тоны сердца звучные, ритмичные, 75 ударов в минуту. Стул, мочеиспускание — в норме.
Диагноз: острая респираторная вирусная инфекция.
Назначено: имидазолилэтанамид пентандиовой кислоты (Ингавирин) 90 мг в сутки, полоскания горла и промывания носа солевыми растворами — 4 раза в сутки. Режим — домашний.
Через 3 суток (7-й день болезни/2-й осмотр) на фоне лечения состояние с некоторым ухудшением: появились осиплость голоса, потливость. Дополнительных контактов с инфекционными больными не было. Температура тела по-прежнему в норме.
При осмотре: состояние удовлетворительное. Дыхание через нос слегка затруднено. Аускультативно в легких жесткое дыхание с единичными рассеянными сухими хрипами, в остальном — без существенной динамики.
Диагноз: острое респираторное заболевание, острый бронхит.
К терапии добавлены левофлоксацин 500 мг в сутки, амброксол 90 мг в сутки.
Через 7 суток от начала лечения (11-й день болезни/3-й осмотр) на фоне лечения отмечена отрицательная динамика: отмечает усиление сухого кашля, осиплости голоса. Новые контакты с инфекционными больными отрицает. Температура тела сохраняется в норме.
При осмотре: состояние удовлетворительное. Дыхание через нос свободное. Зев слегка гиперемирован. В легких — дыхание жесткое, сухие, в нижних отделах обструктивные хрипы. Тоны сердца звучные, ритмичные, 84 удара в минуту.
Диагноз: острый обструктивный бронхит, аллергическая реакция.
Терапия: Беродуал, Пульмикорт — ингаляторно, Супрастин. Ранее назначенные препараты отменены.
Через 9 суток от начала лечения (13-й день болезни/4-й осмотр). На фоне лечения — отрицательная динамика: отмечает усиление слабости, кашля с отхождением желтовато-зеленоватой мокроты, осиплость голоса сохраняется; температура тела устойчиво в норме.
При осмотре: состояние средней тяжести. Дыхание через нос свободное. Зев гиперемирован. В легких — дыхание жесткое, ослаблено в нижних отделах, там же выслушиваются влажные и сухие хрипы. ЧСС — 95 ударов в мин.
По данным лабораторной диагностики, методом полимеразной цепной реакции в мокроте выявлены S. pneumoniae, а также вирусы парагриппа 4-го типа и коронавирус NL-63, 229E. По результату анализа крови: лейкоциты — 12,5 × 10 9 /л, нейтрофилы — 70%, палочкоядерные — 3%, сегментоядерные — 67%, лимфоциты — 21%, моноциты — 7%, СОЭ — 18 мм/ч.
Диагноз: двусторонняя пневмония (подтвержден рентгенологически).
Терапия: цефтриаксон 1,0 внутримышечно 1 раз в сутки, кларитромицин 0,5 перорально — 2 раза в сутки, инозина пранобекс 1,0–3 раза в сутки, ацетилцистеин 0,6 в сутки, пробиотик, биологически активная добавка (БАД) Зостерин-Ультра 60 (0,5 г) 2 раза в сутки. На фоне терапии со вторых суток отмечена положительная динамика, через 7 дней антибактериальная терапия завершена, через 21 день отмечено выздоровление.
По-видимому, отсутствие одного из основных клинических симптомов острой респираторной инфекции — повышения температуры тела — стало следствием регулярного приема нестероидных противовоспалительных препаратов. С одной стороны, эта терапия нивелирует лихорадочный синдром, а с другой, безусловно, способствует затяжному течению с развитием осложнений, что является прямым следствием подавления закономерных воспалительных реакций, способствующих элиминации возбудителей. Учитывая клиническую картину в начале заболевания и имеющиеся на сегодняшний день данные об эффективности противовирусной терапии, Ингавирин был назначен правильно [6]. Однако последующие результаты обследования пациентки свидетельствовали о сохранении вирусовыделения, несмотря на проведенный 7-дневный курс. Добавление к схеме при отсутствии эффекта антибиотика из группы резерва, с учетом недавних повторных курсов антибактериальной терапии в анамнезе, также не противоречит общепринятой тактике ведения пациентов. Широкий спектр бактерицидной активности левофлоксацина позволяет его относить к достаточно надежным лекарственным средствам. Добавление муколитика амброксола при таких симптомах, как правило, повышает эффективность антибактериальных средств. Отсутствие положительного результата на этом этапе, наиболее вероятно, связано с развитием резистентности пневмококка (S. pneumoniae). Устойчивость возбудителя может быть обусловлена повторными короткими курсами антибактериальной терапии при бактерионосительстве. На этом фоне отмена этиотропной терапии с назначением препаратов с бронхолитическим и активным противовоспалительным действием способствовала активному размножению микроорганизмов и распространению их по нижним дыхательным путям с развитием пневмонии.
Последующее лечение проведено по схемам, принятым для ситуаций с неэффективной стартовой терапией. Противововирусный препарат инозина пранобекс имеет широкий спектр действия против большого числа ДНК- и РНК-содержащих вирусов, в том числе против коронавирусов и вирусов парагриппа, выявленных у пациентки. Препарат имеет дополнительное иммуномодулирующее и антиастеническое действие, помогающее в лечении таких больных.
При ведении пациентов с затяжными инфекционно-воспалительными процессами на фоне хронической патологии с применением комплекса лекарственных средств базисной и дополнительной терапии, сочетанной этиологии, обусловленной наличием двух и более возбудителей, необходима активная дезинтоксикационная терапия. В отсутствие адекватной коррекции возможно ухудшение состояния, в первую очередь сердечно-сосудистой системы, с последующей декомпенсацией фонового заболевания вплоть до летального исхода. При этом введение избыточного количества жидкости, как парентерально, так и перорально, нередко сопровождается нарастанием отечного синдрома, застойными явлениями по малому кругу кровообращения и возможным развитием отека легких. В таких ситуациях необходимо ориентироваться на терапию с помощью энтеросорбентов. Выбранная группа БАД Зостерин-Ультра, помимо этого действия, имеет и свойства гемосорбента. Это действие обусловлено наличием в его составе рамногалактуронана, обладающего низкой степенью метоксилирования. Известно, что неметоксилированные участки соединяются с положительно заряженными молекулами тяжелых металлов, радионуклидов, токсинов, забирая их из окружающей среды, в том числе из крови или из содержимого кишечника. Дополнительное разветвление молекулы в области ксилогалактуронана позволяет образовывать сетчатую ячеистую структуру, в которой захватываются и прочно удерживаются токсичные вещества. В то же время эта молекула является естественной для человека, присутствующей в ежедневном питании. Особая технология изготовления группы БАД Зостерин-Ультра из морской травы без применения каких-либо химических веществ позволяет во много раз повысить концентрацию действующего вещества и получить контролируемый результат лечения пациентов [7]. Помимо рамногалактуронана, группа БАД Зостерин-Ультра содержит апиозу, арабинозу, рамнозу, рибозу, галактозу и маннозу. Апиоза отсутствует в наземных растениях, обладает свойством устойчивости к действию ферментов желудочно-кишечного тракта, что сохраняет макромолекулу в ее неизмененном виде на протяжении всего желудочно-кишечного тракта.
Таким образом, в настоящее время наблюдается нарастание резистентности возбудителей острых респираторных инфекций к проводимой этиотропной терапии. При этом растет риск развития осложнений и неблагоприятных исходов, особенно среди пациентов пожилого возраста с хронической коморбидной патологией. В лечении таких больных необходимо учитывать стертость клинической симптоматики на фоне постоянного приема противовоспалительных препаратов, что способствует затяжному и тяжелому течению. Активный инфекционно-воспалительный процесс, в особенности при неэффективности стартовой терапии и необходимости продолжения приема препаратов по хроническому заболеванию, требует включения в схемы терапии сорбентов. Наибольший результат может быть достигнут при назначении средств комплексного энтеро- и гемосорбирующего действия, которыми обладает группа БАД Зостерин-Ультра.
Литература
Т. А. Руженцова 1 , доктор медицинских наук, профессор
Д. С. Левицкая, кандидат медицинских наук
Е. К. Шушакова
ФБУН ЦНИИЭ Роспотребнадзора, Москва
Резистентность возбудителей острых респираторных инфекций в клинической практике/ Т. А. Руженцова, Д. С. Левицкая, Е. К. Шушакова
Для цитирования: Лечащий врач № 11/2019; Номера страниц в выпуске: 29-31
Теги: респираторная инфекция, осложнения, этиотропная терапия
Рисунок 1. Впервые вовремя не разработан новый тип препаратов, способных сдержать уровень резистентности к антибиотикам Насколько актуальна проблема резистентности? Можно ли (и если можно, то как) контролировать резистентность?
 |
| Рисунок 1. Впервые вовремя не разработан новый тип препаратов, способных сдержать уровень резистентности к антибиотикам |
Кризис, наблюдаемый сегодня, не похож на предыдущие. Его особенность прежде всего в количестве вовлеченных микроорганизмов и в отсутствии немедленного ответа на антибактериальную терапию. В прошлом фармацевтическая промышленность решала проблему резистентности путем производства нового, более эффективного антибиотика. Однако на сегодняшний день не существует никакого принципиально нового класса антибиотиков, приемлемого для клинического применения, а разработка новых препаратов может занять 10 — 15 лет.
Расширение спектра используемых в популяции антибиотиков поддерживает выборочное воздействие на целый ряд микроорганизмов, и, в частности, на те из них, которые в настоящее время являются резистентными к большинству антибиотиков (см. табл. 1). Но растет и перечень антибактериальных препаратов, к которым вырабатывается резистентность.
Таблица 1. Бактерии, проявляющие резистентность к антибиотикам
- Грамположительные кокки: ванкомицин-резистентный Enterococcus, метициллин-резистентный S. aureus, пенициллин-резистентный S. pneumoniae, макролид-резистентный Streptococcus
- Грамотрицательные кокки: пенициллин-резистентный Meningococcus, мультирезистентный Gonococcus
- Грамотрицательные бациллы: Enterobacter с расширенным спектром бета-лактамаз, мультирезистентная Salmonella, мультирезистентный Pseudomonas spp., Serratia и Acinetobacter.
- Микобактерии: мультирезистентная M. tuberculosus и M. avian- intracelllulare.
В целом в Англии наблюдалось 45%-ное увеличение случаев назначения антибиотиков за период между 1980 и 1991 гг., что составляет 5%–ное увеличение в год и связано с использованием антибиотиков для лечения респираторных заболеваний.
Следует отметить участившиеся случаи назначения цефалоспоринов, макролидов и хинолонов. Повышение резистентности к этим препаратам вызывает особое беспокойство, так как они используются для лечения очень опасных заболеваний, причем ситуация может усугубиться в случае, если резистентность будет расти.
Последствиями возросшей резистентности микроорганизмов являются увеличение сроков госпитализации, большие затраты на лечение, растущий уровень заболеваемости и смертности.
При современных масштабах международного туризма проблема резистентности к антибиотикам носит не только локальный, но и глобальный характер. Например, путешествия в развивающиеся страны обычно связаны с риском приобретения резистентной бактерии — Escherichia coli.
Структура восприимчивости имеет свои географические особенности, так как показатели резистентности в разных странах разные, что само по себе отражает уровень использования антибиотиков. Например, если взять Европу, то к югу от Скандинавии, в сторону стран Средиземноморья, наблюдается увеличение резистентности патогенных микроорганизмов к антибиотикам.
Степень проявления резистентности зависит не только от географических условий, но и от типа патогенных микроорганизмов, которые теоретически попадают под воздействие антибиотиков. Например, резистентность к пенициллину очень быстро возникла у Staphylococcus aureus, но понадобилось целых 50 лет, чтобы ее обрела Streptococcus pneumoniae, а у Streptococcus pyogenes это явление вообще начало проявляться лишь недавно. В настоящее время никто не может адекватно объяснить такой временной разницы.
В целом существует несколько резервуаров формирования резистентности к антибиотикам, к примеру животноводческие фермы, человеческая облигатная и условно-патогенная флора, клиническая изоляция. Степень значимости каждого из резервуаров не выявлена.
Основными условиями существования упомянутых выше резервуаров является плохое качество питьевой воды, антисанитарные условия, бесконтрольное применение антибиотиков, продающихся без рецептов, и их использование на животноводческих фермах для лечения животных, а также в малых дозах для ускорения роста молодняка.
Таблица 2 Новые подходы к борьбе с инфекциями
- Разработка принципиально новых антибиотиков
- Модификация известных химических структур
- Патентование известных антибиотиков
- Разработка препаратов, направленных на бактериальные клеточные функции
- Ингибирование вирулентных детерминант
- Нуклеотиды
Например, известно, что использование триметоприма для лечения скота является одной из вероятных причин появления триметоприм-резистентной сальмонеллы. Кроме того, вызывает тревогу лицензирование таких ветеринарных препаратов, как квинолон и энрофлоксацин, поскольку хинолины могут потерять свою эффективность как основные препараты для лечения инвазивного сальмонеллеза.
Каковы бы ни были причины резистентности Salmonella, фактически зафиксировано 4-кратное увеличение мультирезистентности к антибиотикам за последние 13 лет. Существует предположение, что использование авопарцина (в ветеринарии — гликопептида) могло спровоцировать появление ванкомицин-резистентных энтерококков, микроорганизмов, которые могут соперничать с метициллин-резистентными Staphylococcus aureus по возможному отрицательному воздействию на макроорганизм.
Настораживает увеличение резистентности у ряда часто встречающихся микроорганизмов. Одним из наиболее устойчивых к антибиотикам патогенных микроорганизмов является пенициллин-резистентный пневмококк, впервые выявленный в 1967 г., а в настоящее время являющийся мультирезистентным. Штаммы этого пневмококка в настоящее время распространены во всем мире, особенно часто они встречаются в Испании, Южной Африке и Болгарии.
В Великобритании масштабы бедствия не столь велики: резистентность к пенициллину здесь повысилась с 1,5% в 1990 до 4% в 1995 г. Следует особо отметить появление резистентности пневмококков к эритромицину (до 9 % в 1995 г.), что делает бессмысленным использование этого препарата у пациентов с аллергической реакцией на пенициллин.
 |
| Рисунок 2. Антибиотики используются для ускорения роста домашних животных и в терапевтических целях |
Механизм, формирующий устойчивость к эритромицину, вызывает перекрестную резистентность к азитромицину и кларитромицину, что означает способность данного патогенного микроорганизма противостоять двум наиболее часто используемым антибиотикам первейшей необходимости.
Сегодняшний уровень резистентности пневмококков пока не может повлиять на основные направления лечения инфекционных заболеваний. Но при непрерывном повышении устойчивости к антибиотикам ситуация в будущем может измениться. Пневмонию, вызванную пневмококком, резистентным к пенициллину, сейчас можно лечить с помощью больших доз пенициллина (порядка 18 мегаединиц), но в случае менингита, вызванного тем же микроорганизмом, целесообразно использовать цефалоспорины.
В 70-х годах с Haemophilus influensae успешно боролись с помощью ампициллина. Однако приобретение данным патогенным микроорганизмом бета-лактамазы, способной ферментативно расщеплять бета-лактамное кольцо пенициллина, привело к тому, что 23% H. Influenzae стало ампициллин-резистентным.
Согласно исследованиям британских ученых, примерно в 10% случаев туберкулезная палочка резистентна хотя бы к одному противотуберкулезному препарату, хотя в США ситуация еще хуже, там нормой становится резистентность, равная 30%. Эти мультирезистентные штаммы не менее вирулентны и плохо поддаются лечению — иногда требуется длительная (в некоторых случаях многолетняя) терапия нового типа.
Работники больниц, где на патогенные микроорганизмы оказывается мощное селективное воздействие при помощи антибиотиков, много сил отдают борьбе с метициллин-резистентным Staphylococcus aureus, ванкомицин-резистентным enterococcus, мультирезистентными Escherichia coli и мультирезистентными Pseudomonas.
В 60-х годах главный хирург США объявил победу над инфекционными заболеваниями. Конечно, он был не прав, но действительно ли мы стоим на пороге эры постантибиотиков?
Терапевтические возможности для лечения ряда заболеваний сейчас сильно ограничены.
Таблица 3. Схема приобретения резистентности организмов к антибиотикам
- Хинолоны: мутации в ДНК-гиразе, механизмы оттока, изменения проницаемости;
- Ванкомицин и телькопланин: подвижные гены, которые определяют производство предшественников клеточных стенок , резистентных к связыванию ванкомицина;
- Ингибиторы бета-лактамазы: гиперпродукция бета-лактамаз, выработка новых резистентных бета-лактамаз;
- Цефалоспирины: расширенный спектр бета-лактамаз;
- Аминогликозиды: сниженная проницаемость клеточной стенки бактерий, механизмы вывода вещества, аминогликозид-модифицирующие ферменты, инактивирующие антибиотик;
- Противотуберкулезные препараты: одиночные мутации в генах определенных белков вызывают снижение связывающей активности антибиотика.
Энтерококки стали серьезным источником внутрибольничной инфекции, главным образом из-за того, что пациенты в больницах представляют из себя наиболее ослабленную часть населения, требующую серьезной защиты от инфекций. Энтерококки являются резистентными ко многим антибиотикам, таким как цефалоспорины, хинолоны, аминогликозиды и некоторые пенициллины. К тому же недавно они обрели способность вырабатывать бета-лактамазу, стали устойчивыми к повышенным дозам аминогликозидов и, самое главное, у них появилась резистентность к ванкомицину и тейкопланину.
Возможен ли такой сценарий? Уже известно, что гены, ответственные за резистентность к ванкомицину, способны в лабораторных условиях передаваться к S. aureus, хотя полученная резистентность нестабильна.
Также известно, что резистентность энтерококков к гентамицину была приобретена от стафилококка. Если это так, то генетические элементы у них совместимы и генетический барьер может быть легко перейден.
Как снизить вероятность формирования резистентности к антибиотикам? Главное — устранение селективного воздействия антибиотиков на бактерии путем. Для этого необходимо соблюдение следующих условий.
- Назначение антибиотиков только при четких клинических показаниях
- Более эффективное использование простейших антибиотиков (пенициллин V при инфекции верхних дыхательных путей, вызванных S. pyоgenes, наиболее эффективен)
- Использование только кратких курсов лечения, скажем, по возможности однократную дозу или трехдневный курс для лечения инфекций мочевого тракта без осложнений
Привлечение к работе местной микробиологической лаборатории, которая располагает информацией о чувствительности к антибиотикам в данном регионе. Строгий контроль за применением антибактериальных препаратов в каждом конкретном регионе.
Время бездумного использования антибиотиков прошло. Сейчас особенно важен ответственный подход к назначению антибиотиков, позволяющий контролировать резистентность микроорганизмов в лечебных учреждениях и в обществе в целом.
1. Service R. F. Antibiotics that resist resistance. Science 1995; 270:724-727.
2. Davey P. G., Bax R. P., Reeves D., Rutherford D., Slack, et al. Growth in the use of antibiotics in the community in England and Scotland in 1980-93. Br Med J 1996; 312:613
3. Holmberg SSSSD, Solomon S. L, Blake P. A. Health and economic aspect of antimicrobial resistance. Rev Inf Dis 1987; 9:1065-1078.
4. Hughes V. M., Datta N. Conjugative plasmids in bacteria of the ‘pre-antibiotic’ era. Nature 1983; 302:725-726.
5. Shanahan P. M. A., Thomson C. J., Amyes S. G. B. The global inpact of antibiotic-resistant bacteria: their sources and reservoirs. Rev Med Micro 1994; 5:1740-1782.
6. Frost J. A, Threfall E. J., Rowe B. Antibiotic resistance in salmonellas from humans in England and Waales: the situation in 1994. PHLS Microbiologi Digest 1996; 12: 131-133.
7. Johson A. P., Speller D. C. E., George R. C., Warner M., Domingue G., Efstratiou A. Prevalence of antibiotic resistance and serotypes in pneumococci in England and Wales:: results of observational surveys in 1990 and 1995. Br Med JJ 1996; 312:: 1454-1456.
8. James P. A., Lewis D. A., Cribb J., Dawson S. J., Murray S. A. The incidence and epidemiology of Beta-lactam resistance in Haemophilus influenzae. J Antimicrobial Chemo 1996; 37: 737-746.
9. Warburton A. R. E., Jenkins P. A., Waight P. A., Watson J. M. Drug resistance in initial isolates of Mycobacterium tuberculosis in England and Wales 1982-1991. CDR Rev 1993; 13:175-179.
10. Young L. Mycobacterial disease in the 1990’s. J Antimicrobial Chemo 1993; 32:179-174.
11. Report of the Expert Group on animal feeding stuffs. HMSO 1992.
12. Noble W. C., Virani Z., Cree R. G. A. Co-transfer of vancomycin and other resistance genes from E faecalis NCCTTC 12201 to S aureus. FEMS Microbiol Lett 1992; 93:195-198.
Природа резистентности
Как удалось бактериям всего за 60 лет научиться противостоять всем известным антибактериальным препаратам? Антибиотики являются естественными субстанциями (или химически модифицированными), вырабатываемыми рядом микроорганизмов.
Эти микроорганизмы экскретируют антибиотикоподобные вещества в окружающую среду, чтобы получить преимущество в условиях естественного отбора. Однако сам микроорганизм должен обладать защитными механизмами против собственного токсина. Таким образом, механизмы, позволяющие ликвидировать воздействие антибиотиков, появились в природе задолго до того, как они стали широко использоваться человеком. Поэтому можно утверждать, что резистентность к антибиотикам является предвестником эры постантибиотиков.
Механизмы резистентности (см. табл. 3) получают все более широкое распространение и укрепляют прежде восприимчивые популяции микроорганизмов.
Распространение резистентности обусловлено не только способностью микроорганизмов развивать устойчивость и существовать в определенной экологической нише (клональная экспансия), но и возможностью независимого переноса механизмов резистентности между различными видами бактерий с помощью мобильных генетических элементов.
В качестве примера можно привести следующий факт: пенициллин-резистентные пневмококки развивались клонально, и рассеивание плазмидов (мобильных генетических элементов) обусловило появление способности вырабатывать бета-лактамазу у таких разных организмов, как E. coli и H. influenzae.
Мероприятия против бактериальной инфекции
Возможно ли контролировать резистентность? Главным условием сдерживания резистентности является улучшение качества питьевой воды и санитарных условий. Антибиотики, используемые для лечения людей, не должны применяться в ветеринарной практике, что и было рекомендовано 5 лет назад экспертной группой по питанию животных.
В ряде стран следует ввести жесткий контроль за безрецептурной продажей антибиотиков. Селективное воздействие антибактериальных препаратов, связанное с неправильным назначением, можно и следует свести до минимума.
Фармацевтическая промышленность ищет принципиально новые химические структуры, нуклеотиды, способные ингибировать клеточные функции микроорганизмов, а также стремится разработать препараты, основное назначение которых — ликвидация механизмов резистентности путем блокирования ферментов и создание условий, исключающих удаление антибиотиков при помощи клеточных насосов.
Многие актуальные на сегодня методы лечения потеряют свою эффективность в будущем. Таким образом, крайне необходим постоянный контроль на международном, национальном и региональном уровнях за использованием антибиотиков и формированием к ним бактериальной резистентности.
Читайте также:

