Новорожденные с инфекционно воспалительными заболеваниями
Обновлено: 18.04.2024
Для цитирования: Яцык Г.В., Бомбардирова Е.П. Особенности антибактериальной терапии у недоношенных новорожденных. РМЖ. 2000;18:749.
Научный центр здоровья детей РАМН, Москва
И нфекционно-воспалительные заболевания – наиболее частая патология у детей периода новорожденности, что объясняется своеобразием защитных механизмов на данном этапе онтогенеза. Наиболее выражена недостаточность гуморального и клеточного иммунитета, незрелость барьерных функций кожи и слизистых у детей, родившихся преждевременно. В структуре диагнозов в отделениях второго этапа выхаживания недоношеных детей удельный вес гнойно-воспалительных заболеваний приближается к 80%, при этом большинство заболеваний составляют так называемые малые инфекции – гнойничковые сыпи, омфалит, дакриоцистит, отит; у 1% детей выявляются серьезные воспалительные заболевания (флегмона и пузырчатка новорожденных, остеомиелит, менингоэнцефалит, пневмония, сепсис).
В последние годы проблемы инфекционной патологии у незрелых детей приобрели особую актуальность в связи с изменением особенностей как макро-, так и микроорганизмов, что отразилось на течении инфекционного процесса. Утяжелилось течение фоновых состояний, создающих благоприятную почву для манифестации и прогрессирования инфекции – это перинатальные поражения мозга, врожденные пороки развития, пневмопатии; причем достижения современной реаниматологии и интенсивной терапии позволяют обеспечить выживание даже детей с крайне малой массой тела, перенесших тяжелую асфиксию. В свою очередь реанимационные мероприятия, прежде всего длительная ИВЛ и катетеризация магистральных сосудов, создают условия для микробной агрессии. Одним из важных факторов, способствующих бактериальной контаминации и утяжелению течения бактериальных инфекций, является наличие смешанной вирусно-бактериальной внутриутробной инфекции. Внутриутробные паразитарные и вирусные инфекции (так называемый TORCH-синдром) в 13–45% случаев являются основной причиной смертности в периоде новорожденности. Перенесенная внутриутробно специфическая инфекция резко нарушает защитные механизмы ребенка, что способствует присоединению и бурному течению интранатальных и постнатальных бактериальных инфекций.
Современная этиология возбудителей
В этиологической структуре возбудителей бактериальных инфекций у недоношенных детей 10–15 лет назад отмечалось увеличение удельного веса грамотрицательной флоры (клебсиела, протей, псевдомонас). Однако в последующие годы вновь среди этиологических агентов локальных гнойно-воспалительных поражений первое место занимает грамположительная флора (стафилококки, стрептококки). Для недоношенных детей характерны сочетание микроорганизмов, выделяемых из различных очагов (например, из гнойного очага высеваются золотистый и эпидермальный стафилококки, из кала – кишечная палочка и стафилококки), а также смена ведущих возбудителей в процессе лечения (первоначальные агенты воспаления подавляются, их место занимают другие бактерии, часто в сочетании с грибами).
Среди населения циркулируют преимущественно чувствительные к антибиотикам штаммы возбудителей (В.К.Таточенко), а в стационарах дети обсеменяются преимущественно устойчивыми штаммами (внутрибольничная флора), так как условно-патогенные и сапрофитные микроорганизмы многократно пассируются на ослабленных незрелых новорожденных и происходит их селекция под воздействием терапии (Г.В.Яцык, И.В.Маркова). Кроме того, устойчивые штаммы (клебсиеллы, стрептококк В) передаются новорожденным от больных матерей.
Специфика фармакокинетики антибиотиков
У новорожденных детей фармакокинетика любого препарата существенно отличается от таковой у детей более старшего возраста; в наибольшей мере это относится к незрелым (недоношенным) новорожденным. Крайне важной представляется незрелость выделительной функции почек и ферментных систем печени – эти особенности в первую очередь характерны для глубоконедоношенных детей с массой тела менее 1500 г. Помимо этого, незрелость других органов и систем (желудочно-кишечного тракта, нервной системы, органов дыхания), а также общая лабильность метаболизма накладывают на фармакокинетику антибиотиков у недоношенных детей индивидуальные особенности предопределяя высокий риск нежелательных побочных эффектов антибактериальной терапии. Общая особенность фармакокинетики любых препаратов у недоношенных детей – это ее замедление, что способствует кумуляции лекарств и влияет на выбор дозы (уменьшение ее на 1/3–1/4), путей и кратности введения препаратов. В то же время повышенная проницаемость естественных барьеров (кожи и слизистых) способствует всасыванию многих медикаментов. В настоящее время проводятся исследования суточных ритмов фармакодинамики различных препаратов, но в отношении антибиотиков у недоношенных детей таких исследований практически нет.
Показания и выбор антибиотика
Безусловным показанием для назначения антибиотикотерапии недоношенному новорожденному является наличие у него любого инфекционно-воспалительного процесса, включая так называемые малые инфекции, например, нераспространенные гнойничковые поражения кожи, гнойные конъюнктивиты, отиты (в том числе катаральный отит). Лишь в редких случаях легкого течения неосложненной ОРВИ (ринофарингит) антибиотик не назначается – и то только у детей с относительно благополучным фоном (незначительная степень недоношенности, отстутствие анамнестических указаний на внутриутробную инфекцию, нетяжелая перинатальная энцефалопатия).
Безусловным показанием для назначения антибиотикотерапии недоношенному новорожденному является наличие у него любого инфекционно-воспалительного процесса, включая так называемые малые инфекции, например, нераспространенные гнойничковые поражения кожи, гнойные конъюнктивиты, отиты (в том числе катаральный отит). Лишь в редких случаях легкого течения неосложненной ОРВИ (ринофарингит) антибиотик не назначается – и то только у детей с относительно благополучным фоном (незначительная степень недоношенности, отстутствие анамнестических указаний на внутриутробную инфекцию, нетяжелая перинатальная энцефалопатия).
Спорный вопрос о так называемом профилактическом применении антибиотиков у маловесных недоношенных из группы риска по реализации внутриутробной и интранатальной инфекции (больная мать, длительный безводный период и т.п.), как правило, решается в пользу назначения антибиотика, так же как и в случаях так называемых неинфекционных пневмопатий. К условно “профилактическим” можно отнести также назначение антибиотика для “прикрытия” гормональной кортикостероидной терапии и некоторых вмешательств (катетеризации, переливания крови и т.п.).
Выбор антибиотика для недоношенного ребенка – ответственный момент, во многом определяющий эффективность лечения. При выборе препарата следует учитывать следующие факторы:
• вид возбудителя (в начале лечения часто лишь предполагаемый) и его штамм;
• чувствительность возбудителя (также в начале лечения – предполагаемую, через 2–3 дня после получения результатов бактериологических анализов в терапию могут быть внесены коррективы). В последние годы высказывается мнение о том, что параметры чувствительности микробов in vitro не всегда совпадают с таковыми in vivo и нет необходимости строго следовать им при назначении препаратов;
• локализация и степень тяжести инфекционного процесса (при нетяжелых локальных поражениях возможно пероральное применение препарата; при тяжелых, как правило, – сочетание пероральных и парентеральных средств);
• сопутствующие состояния и премобидный фон (предпочтение парентеральных препаратов при тяжелом дисбактериозе или внутривенного введения у крайне маловесных детей с неразвитой мышечной тканью).
Все антибиотики можно условно разделить на 2 группы – препараты первого выбора назначают, когда нет оснований думать о лекарственной устойчивости флоры (полусинтетические пенициллины, аминогликозиды I поколения, цефалоспорины I поколения); препараты второго выбора направлены на преодоление устойчивых штаммов (аминогликозиды и цефалоспорины III–IV поколения, современные макролиды). Существуют и препараты третьего выбора (или препараты резерва), применяемые при крайне тяжелых формах заболеваний с полирезистентной флорой (карбапенемы).
У недоношенных детей в основном сразу используются препараты второго выбора: применение антибиотиков первого ряда у них неэффективно и лишь способствует отсрочке манифестных проявлений инфекционного процесса, маскирует клинические симптомы. У детей периода новорожденности даже по жизненным показаниям не должны использоваться препараты, обладающие высокой токсичностью (фторхинолоны).
Схема 1. Допустимые сочетания антибиотиков у недоношенных детей при одновременном применении (Г.В. Яцык)
Особенности дозировки антибиотиков
Дозировки используемых в неонатологии антибиотиков для недоношенных детей и кратность их введения представлены в табл. 1 (Г.В. Яцык, 1998 г.) Общий принцип подбора дозы для новорожденного ребенка – большее по сравнению со старшими детьми количество препарата на 1 кг массы тела – сохраняется и у недоношенных детей. Это обусловлено большим процентным содержанием воды в организме новорожденного и большей относительной поверхностью тела.
Дозировки используемых в неонатологии антибиотиков для недоношенных детей и кратность их введения представлены в табл. 1 (Г.В. Яцык, 1998 г.) Общий принцип подбора дозы для новорожденного ребенка – – сохраняется и у недоношенных детей. Это обусловлено большим процентным содержанием воды в организме новорожденного и большей относительной поверхностью тела.
Комбинированная терапия
Комбинированная антибактериальная терапия у недоношенных детей должна проводиться с большой осторожностью; одновременное сочетание 2 (очень редко – 3) антибиотиков применяется лишь у детей с тяжелыми гнойно-воспалительными процессами (прежде всего при сепсисе), вызванными смешанной флорой. Допустимые сочетания антибиотиков представлены в табл. 2 и на схеме 1 (данные Н.В. Белобородовой).
Пути и кратность введения антибиотиков недоношенному ребенку
В связи с высокой проницаемостью и ранимостью слизистой желудочно-кишечного тракта у незрелых новорожденных, а также опасностью развития дисбиоза и язвенно-некротического энтероколита пероральные антибиотики использовались ограниченно. К тому же большинство инфекционных заболеваний у недоношенных детей по тяжести состояния требует более мощной терапии. В последние годы появились достаточно действенные антибактериальные и противогрибковые препараты для перорального применения (макролиды, амоксициллин/клавуланат и др.) Кроме того, установлено крайне негативное воздействие болевых раздражений на грудных детей, что делает необходимым ограничение внутримышечных и внутривенных инъекций.
У новорожденных (особенно недоношенных) детей период полувыведения препаратов увеличен вследствие незрелости почек и печени. Поэтому кратность введения большинства препаратов не превышает у них 2 раз в течение суток (за исключением пенициллинов); особенно популярными в неонатологии остаются препараты пролонгированного действия (рокситромицин, цефтриаксон), допускающие однократное применение. Некоторые исследователи (Н.В. Белобородова, О.Б. Ладодо) большинство парентеральных препаратов (в том числе аминогликозиды, цефалоспорины) предлагают вводить однократно – внутривенно или внутримышечно.
Продолжительность терапии
Продолжительность антибактериальной терапии и последовательность применяемых антибиотиков у недоношенного ребенка определяются индивидуально, они зависят от эффективности первичного курса антибактериальной терапии, которая оценивается по традиционным клиническим и лабораторным параметрам. Как правило, недоношенным детям со среднетяжелыми инфекционными процессами (омфалит, пневмония, отит и т.д.) проводят два последовательных курса антибиотика (второй курс с учетом чувствительности микрофлоры), каждый по 7–10 дней. При тяжелых заболеваниях (менингит, остеомиелит, сепсис) обычно используют не менее 3–4 курсов антибиотиков (или 2–3 курса; при первом – сочетание антибиотиков, обычно аминогликозида и цефалоспорина III–IV поколения).
Побочные явления и их профилактика
Наиболее распространенные у недоношенных новорожденных нежелательные побочные эффекты антибактериальной терапии обусловлены подавлением симбионтной микрофлоры и, как следствие, колонизацией организма условно-патогенными сапрофитами. В связи с этим даже после короткого курса антибактериальной терапии у недоношенных детей возможно развитие дисбиозов – кандидоза кожи и слизистых, кишечного дисбактериоза. Реже у недоношенных отмечаются токсические (по типу идиосинкразии) и аллергические реакции на антибиотики.
Профилактика осложнений антибактериальной терапии начинается уже с ее правильного подбора, тщательного индивидуального контроля. Одновременно с назначением антибиотиков ребенку необходимо назначать противогрибковые средства (леворин, флуконазол, амфотерицин В) и средства, восстанавливающие микрофлору кишечника (бифидум-бактерин и др.); причем использование последних продолжается не менее недели после окончания курса антибиотиков.
С целью снижения нагрузки антибиотиками на незрелый организм недоношенного ребенка в последние годы делаются попытки сочетания антибактериальной терапии со средствами, усиливающими неспецифическую защиту: иммуноглобулинами, лазеротерапией (использование низкоинтенсивного лазерного излучения на магистральные сосуды с целью иммуностимуляции), метаболитной коррекцией.
Касохов Т.Б. 1 Цораева З.А. 1 Мерденова З.С. 1 Цораева Л.К. 1 Шляйхер А.Н. 1 Касохова В.В. 2 Мазур А.И. 1
В статье представлены данные исследования иммунного статуса у новорожденных недоношенных детей с инфекционно-воспалительными заболеваниями (пневмония, омфалит, менингит, сепсис). У новорожденных детей исследовали содержание в сыворотке иммуноглобулинов класса А.М,G, CD 3, CD 4, CD 8, CD 19, CD4/CD8 популяций лимфоцитов, активность лизоцима и комплемента, фагоцитарную активность и циркулирующих иммунных комплексов. Доказана выраженная депрессия клеточного и гуморального иммунитета и неспецифических факторов защиты у новорожденных недоношенных детей с инфекционно-воспалительными заболеваниями. Полученные в результате исследования выявленные данные свидетельствуют о выраженных нарушениях клеточного иммунитета, факторах неспецифической защиты у новорожденных недоношенных детей с инфекционно-воспалительными заболеваниями, приводящей к вто¬ричной иммунной недоста¬точности, что диктует необходимость включения в комплексную терапию инфекционно-воспалительных заболеваний препаратов иммуномодулирующего действия.

1. Антонов А. Г., Байбарина Е. Н., Соколовская Ю. В., Евтеева. Н. В. Объективные диагностические критерии сепсиса у новорожденных // Вопросы гинекологии, акушерства и перинатологии. – 2005. – Т. 4, № 5-6. – С.113-115.
2. Бочарова И. И. Клинико-иммунологические варианты патологических состояний у новорожденных, родившихся у матерей с урогенитальной инфекцией (диагностика, прогнозирование, технологии ведения): автореферат. – Москва, 2008.
3. Володин Н. Н., Дегтярева М. В., Солдатова И. Г., Ашиткова Н. В. Интерлейкин-2: опыт клинического применения в неонатологии. – М., 2008. – 17 с.
4. Дегтярева М. В. Иммунитет новорожденных в норме и патологии. Иммунотерапия Ликопидом (обзор клинических исследований). Лекция для практикующих врачей. – М., 2010. – 24 с.
6. Касохов Т. Б., Касохова В. В., Цораева З. А. Становление иммунной системы и иммунопатологические состояния у детей. – 2015. – 35 с.
7. Касохов Т. Б., Мерденова З. С., Фидарова А. М., Безроднова С. М. Физиология и патология детей раннего возраста. – 2013. – Ч. 2. – 49 с.
10. Brilli R. J., Goldstein B. Pediatric sepsis definitions: Past, present, and future // Pediatr: Crit. Care Med. – 2005. – Vol. 6, No. 3 (Suppl.). – S. 6-S8.
11. Casado F. J., Blanco Q. A. Procalcitonin. A new marker for bacterial-infection // An Esp. Pediatr. – 2001. – 54 (l):69-73.
12. Dammann O., Kuban K. C., Leviton A. Perinatal infection, fetal inflammatory response, white matter damage, and cognitive limitations in children born preterm // Ment. Retard. Dev. Disabil. Res. Rev. – 2002. – 8 (l):46-50.
Проблема инфекционно-воспалительных заболеваний новорожденных остается крайне актуальной, что связано с высоким уровнем неонатальной смертности от инфекций, где они являются основной причиной смерти или осложняют течение основного заболевания. Развитие инфекционно-воспалительных заболеваний, по мнению многих авторов, во многом связано с особенностями иммунологической резистентности новорожденных. В литературе имеются данные об изменениях со стороны иммунной системы, однако полностью не изучены все изменения звеньев иммунитета при инфекционно-воспалительных заболеваниях у новорожденных. Углубленное изучение иммунопатогенеза неонатальных инфекционных заболеваний бактериальной и смешанной этиологии позволит улучшить качество диагностики и прогноза течения болезни, обосновать и использовать рациональные методы иммунокоррекции в комплексной интенсивной терапии у новорожденных детей.
Генерализации инфекционных заболеваний различной этиологии у детей способствует широкое применение в отделениях реанимации и интенсивной терапии искусственной вентиляции легких, катетеризации центральных вен, большого количества других инвазивных процедур при недостаточно совершенной системе инфекционного контроля.
Сепсис и пневмонии считаются наиболее тяжелыми проявлениями гнойно-воспалительных заболеваний у новорожденных и занимают существенное место в структуре заболеваемости и смертности детей. Пневмонии встречаются с частотой от 1:1600 до 1:400 живорожденных. На фоне проведения искусственной вентиляции легких (ИВЛ) детям с тяжелой дыхательной недостаточностью, катетеризации центральных сосудов с целью проведения инфузионной терапии и парентерального питания, антибактериальной терапии часто происходит смена возбудителя и развитие нозокомиальных поствентиляционных пневмоний, а также грибковой инфекции. Крайне актуальной остаётся проблема хронизации воспалительного процесса в бронхолёгочной системе, возникновения бронхолёгочной дисплазии у недоношенных новорожденных детей, которым проводилась ИВЛ.
Показатели летальности от неонатального сепсиса остаются высокими и составляют по данным разных авторов от 30 до 60 %. Самые высокие показатели отмечаются у глубоко недоношенных детей с экстремально низкой массой тела при рождении (менее 1000 г.).
В настоящее время доказана ведущая роль провоспалительных цитокинов и баланса их с антагонистами в выраженности и направленности системной воспалительной реакции. Известно, что грамположительные и грамотрицательные бактерии способны быть причиной синтеза и выделения провоспалительных цитокинов. В ответ на захват и процесс ингибирования моноцитами/макрофагами и нейтрофилами компонентов клеточной стенки грамотрицательных и грамположительных бактерий происходит выделение провоспалительных цитокинов, которые являются ответственными за возникновение симптомов инфекционного воспаления и интоксикации (температура, лейкоцитоз, лимфопения, сдвиг лейкоцитарной формулы влево; появление белков острой фазы).
Клиническая картина и особенности течения инфекционных заболеваний напрямую зависят от уровней продукции про- и противовоспалительных цитокинов и их влияния на иммунорегуляторные и эффекторные иммунные механизмы. В то же время в литературе имеется мало информации о динамике цитокинового статуса у новорожденных детей при физиологическом и осложненном течении неонатального периода, о влиянии провоспалительных цитокинов на функциональные свойства неонатальных нейтрофилов и лимфоцитов.
Иммунная система новорожденных находится в состоянии физиологической депрессии. Иммунная регуляция осуществляется противовоспалительными цитокинами – ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, фактором некроза опухоли (ФНО-α), альфа- и гамма-интерферонами и др., а также цитокинами, непосредственно регулирующими направление и спектр иммунного ответа (ИЛ-2, ИЛ-5, ИЛ-7). Другие участвуют на этапе более ранней регуляции миеломоноцитопоэза и лимфопоэза (ИЛ-3, колониестимулирующие факторы). В клинической практике обычно используется определение ограниченного набора цитокинов, отражающих интенсивность локального и/или системного ответа на инфекцию. Инфекционную природу осложнений подтверждает значительный подъем уровня ИЛ-6 при сниженном содержании ФНО-α, тогда как неинфекционные осложнения сопровождаются повышенными концентрациями –ИЛ-1 без изменений в содержании ФНО-α и ИЛ-6.
В силу несостоятельности иммунной системы ребенка раннего возраста основные защитные функции выполняют пассивно приобретенные сывороточные и секреторные антитела. Сывороточные антитела в основном представлены материнским IgG, которые совершили трансплацентарный переход в эмбриональной стадии. Содержание IgG в крови новорожденного не отличается от содержания этого иммуноглобулина в крови матери (около 12 г/л). Ни IgM, ни IgA не способны к трансплацентарному переходу из организма матери в организм ребенка, поэтому IgM обнаруживается в сыворотке новорожденного в очень небольшом количестве (0,01 г/л). При инфицировании иммунная система новорожденного способна к первичному гуморальному иммунному ответу с преимущественным синтезом IgM, иммунологическая память еще не функционирует. Повышенный уровень этого иммуноглобулина (более 0,02 г/л) может свидетельствовать о внутриутробной инфекции или о внутриутробной антигенной стимуляции иммунной системы плода.
По данным Шабалова Н. П., Иванова Д. О., дети с инфекционными заболеваниями имеют задержку внутриутробного развития, хроническую внутриутробную гипоксию, у большинства детей отмечается тяжелая асфиксия и у всех детей имеют место низкие уровни IgG при высоком содержании Ig М. У недоношенных, детей и родившихся от матерей с длительным гестозом, в асфиксии имеется особенно резко выраженная недостаточность функции иммунного усиления эффекторных реакций полиморфноядерных лейкоцитов, хемотаксиса. Установлен неонатальный дефект незавершенности фагоцитоза полиморфноядерных лейкоцитов, также наиболее резко выраженный у детей, родившихся с негладким течением внутриутробного периода. К особенностям реактивности новорожденных, обуславливающих повышенную чувствительность к инфекциям, относятся – сниженный хемотаксис, низкая бактерицидность фагоцитов, низкий уровень пропердина, комплемента, Т-хелперов, низкая продукция фактора некроза опухоли, низкие уровни IgM, IgA. Характерна гипоиммуноглобулинемия класса IgG, низкий индекс завершенности фагоцитоза.
Одной из важнейших проблем современной перинатологии является изучение процессов адаптации новорожденных детей к внеутробной жизни. Несмотря на растущий арсенал антисептических и химиотерапевтических средств и совершенствование лечебных технологий, показатели заболеваемости и смертности вследствие гнойно-септических заболеваний различной этиологии и локализации продолжают оставаться высокими. В связи с этим разработка методов терапевтического воздействия на иммунную систему больных с гнойно-септической патологией является чрезвычайно актуальной научно-практической задачей. Углубленное изучение иммунопатогенеза неонатальных инфекционных заболеваний бактериальной и смешанной этиологии позволит улучшить качество диагностики и прогноза течения болезни, обосновать и использовать рациональные методы иммунокоррекции в комплексной интенсивной терапии.
К факторам риска развития инфекционно-воспалительных заболеваний, к которым относится пневмония, омфалит, менингит, сепсис, относятся – гестационный возраст менее 32 недель, масса тела менее 1500 г, внутриутробное инфицирование, безводный промежуток более 12 часов, преждевременный разрыв околоплодных оболочек, тяжелая перинатальная гипоксия, снижение оценки по шкале Апгар менее 5 баллов, пребывание в отделении реанимации и интенсивной терапии более 5 дней, необходимость применения инвазивных методов лечения (ИВЛ, катетеризация сосудов боле 3 суток, зондирование желудка более 7 суток).
Загрязнения окружающей среды отходами промышленного производства, неблагоприятные социальные условия, рост потребления различных лекарственных препаратов, интенсивное использование средств дезинфекции в быту и на производстве, применение пестицидов и гербицидов в сельском хозяйстве, использование генетически модифицированных продуктов – сочетанное воздействие данных факторов на организм человека создает условия для высоких аллергенных нагрузок.
БА у детей больше распространена в регионах с массивным загрязнением окружающей среды химическими соединениями. Доказано, что в экологически неблагополучных регионах распространенность бронхиальной астмы среди детского населения в 1,8 раза превышает таковую у детей, проживающих в сравнительно благополучных в экологическом отношении районах.
Иммунная система новорожденных находится в состоянии физиологической депрессии. Биологический смысл супрессорной направленности иммунных реакций в периоде новорожденности состоит в предупреждении риска тяжелой иммунокомплексной патологии и других иммунопатологических реакций, неизбежных при контакте родившегося ребенка с огромным числом антигенов. Имеются сведения о том, что только после рождения впервые активно и широко включаются механизмы иммунного реагирования Т- и В-систем. В силу несостоятельности иммунной системы ребенка раннего возраста основные защитные функции выполняют пассивно приобретенные сывороточные и секреторные антитела.
Структурные и функциональные особенности клеточных и гуморальных механизмов иммунного ответа в детском возрасте определяют повышенную восприимчивость детей к различным инфекциям, склонность к генерализации инфекционного процесса, что диктует необходимость углубленного изучения патологии и разработки тактики лечения и прогноза течения.
Иммунная система больных бронхиальной астмой характеризуется снижением количества Т-лимфоцитов, обладающих супрессорной активностью, Th2 типом иммунного ответа, дисрегуляцией цитокинового каскада, активацией эозинофилов и нарушением нейрогенной и эндокринной регуляции. Первичное воспаление БА состоит в аккумуляции CD4+ хелперов 2 типа и эозинофилов в слизистой верхних дыхательных путей. Th2-клетки управляют астматическим воспалением через секрецию серии цитокинов, особенно ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-13. У детей с бронхиальной астмой обычно отмечается функциональная несостоятельность Thl-клеточной системы, сниженный синтез ИНФ-γ на фоне гиперпродукции ИЛ-4 и ИЛ-10.
Множество отечественных и зарубежных работ в последнее время посвящено изучению различных аспектов патогенеза БА. Однако роль отдельных цитокинов в развитии этого заболевания до сих пор остается спорной. Таким образом, изучение цитокинового профиля у пациентов с бронхиальной астмой является чрезвычайно актуальной задачей на сегодняшний день.
Чрезвычайно важной функцией цитокинов, благодаря которой они играют важную роль в патогенезе БА у детей, является регуляция воспаления. В группе провоспалительных цитокинов выделяют несколько подгрупп:
а) цитокины, обладающие хемотоксической активностью и активирующие клетки воспаления;
б) цитокины, губительно действующие на измененные клетки, усиливающие пролиферацию и дифференцировку клеток воспаления;
в) цитокины, усиливающие пролиферацию и дифференцировку костномозговых предшественников клеток воспаления и выброс их в кровь;
г) цитокины, подавляющие функцию клеток, участвующих в воспалении, и таким образом угнетающие развитие воспалительных процессов;
Цель настоящего исследования заключалась в анализе клинико-лабораторных характеристик с инфекционно-воспалительными заболеваниями у недоношенных новорожденных.
Материалы и методы
Под наблюдением находилось 58 новорожденных недоношенных детей с инфекционно-воспалительными заболеваниями (пневмония, менингит, омфалит, сепсис). Гестационный возраст в среднем составил 34–36 недель. Новорожденные дети были разделены на две группы: 1 – 33 больных группа с инфекционно-воспалительными заболеваниями, 2 группа – 25 ребенка без очагов инфекции.
Осуществлялся тщательный сбор соматического и акушерско-гинекологического анамнеза матерей, оценка факторов риска развития осложнений в раннем периоде адаптации, клиническое наблюдение и лабораторное обследование (общий анализ крови, мочи, рентгенография грудной клетки, ультразвуковое исследование головного мозга и органов брюшной полости, биохимический анализ крови). Микробиологическое исследование включало посев крови, а по показаниям – посев ликвора и мочи и анализ чувствительности выделенной микрофлоры к антибиотикам.
Всем пациентам производилась оценка иммунного статуса при помощи иммунофенотипирования лейкоцитов с использованием моноклональных антител, фагоцитарных показателей, активность лизоцима и комплемента, определения уровня иммуноглобулинов A, М, G в сыворотке методом иммуноферментного анализа.
Определяли в крови относительное содержание CD популяций лимфоцитов: CD3, CD8 и CD4 клеток, а также содержание клеток CD19.
Результаты
Состояние иммунитета у новорожденных недоношенных детей с инфекционно-воспалительными заболеваниями характеризуется повышением ранних предшественников Т- и В- лимфоцитов, незрелых Т-лимфоцитов и нейтрофилов, дефицитом зрелых иммунокомпетентных клеток (Т- и В-лимфоцитов, моноцитов и нейтрофилов), угнетением фагоцитоза.
Сравнительная характеристика показателей клеточного иммунитета у детей с инфекционно-воспалительными заболеваниями
Врожденная пневмония – это воспалительный процесс, который возникает в легком внутриутробно и/или во время родов и клинически проявляется течение первых 72 ч жизни ребенка. Вследствие воспалительного процесса возникают нарушения как свободной проходимости дыхательных путей, так и газообмена и перфузии. Эти нарушения могут значительно изменить газовый обмен и клеточный метаболизм во многих жизненно важных тканях и органах. Ситуация осложняется тем, что воспалительный процесс развивается на фоне перестройки работы сердечно-легочной системы, связанной с переходом от внутриматочной к внематочной жизни, что является серьёзным испытанием для незрелого организма, особенно в случае преждевременного рождения ребенка.

У новорожденных детей слизистая дыхательных путей обычно стерильна при рождении, в последующем происходит заселение микроорганизмами матери и окружающей среды. Инфицирование плода обычно происходит одним из трёх путей – через плаценту, с инфицированной амниотической жидкостью или с содержимым родовых путей.
Особенностью иммунной системы новорожденного является то, что действие многих компонентов иммунитета запаздывают, иммунный ответ наступает медленнее, чем в последующие возрастные периоды.
Возбудители пневмоний у новорожденных существенно отличается от других возрастных периодов. При внутриутробном пути инфицирования особое значение имеет цитомегаловирусная, герпетическая инфекции, краснуха, туберкулез, сифилис, стрептококкам группы В, кишечная палочка, анаэробные бактерии, хламидии, микоплазма, уреаплазма, цитомегаловирус, гемофильная палочка, листерии.
Повышенный риск развития врождённой пневмонии при наличии следующих факторов:
- преждевременные роды,
- преждевременный разрыв плодных оболочек,
- лихорадка (температура тела у матери более 38 o C),
- болезненность матки,
- мутные амниотические воды с неприятным запахом,
- инфекционно-воспалительные заболевания уро-генитального тракта
- рождение детей с признаками инфекционного процесса в анамнезе,
- признаки внутриутробного страдания плода,
- тахикардия плода,
- наличие мекония в амниотической жидкости.
У новорожденных труднее, чем у более старших детей, выявить те типичные клинические проявления, которые хорошо известны педиатрам (изменения перкуторного тона, хрипы, крепитация).
Часто дети рождаются в критическом состоянии, требующем проведения реанимационных мероприятий. Кашель может отсутствовать или быть не выраженным, отмечается пенистое отделяемое изо рта. На фоне ослабленного дыхания выслушиваются влажные хрипы и/или крепитация. Клинический диагноз основывается на совокупности признаков, а также результатов рентгенографических, микробиологических и лабораторных исследований (гематологические изменения и наличие признаков системной воспалительной реакции).
Для определения возбудителя проводится микробиологическое исследование крови, отделяемого из зева, трахео-бронхиального аспирата и в настоящее время является самым информативным; идентификация грибов, вирусов, U urealyticum и других небактериальных возбудителей требует использования специальных методов -
молекулярно-биологических (полимеразная реакция в режиме реального времени и проведение сиквенирования), масспектрометрии - принципиально нового метода диагностики инфекций. При помощи этого метода можно определить не установленные виды микроорганизмов с определением резистентности к антибиотикам.
Серологические методы могут прояснить состояние врождённой пневмонии при некоторых инфекциях, например цитомегалии, герпесвирусов, токсоплазмозе, сифилисе и др. Для определения маркеров системной воспалительной реакции проводится клинический анализ крови, мочи, а также количественные измерения С-реактивного белка, прокальцитонина, цитокинов (интерлейкин-6).
Все новорожденные дети с наличием пневмонии должны проходить лечение в условиях отделения патологии новорожденных и недоношенных детей, если требуется проведение респираторной поддержки – в условиях отделения реанимации и интенсивной терапии новорожденных. При необходимости дыхательной поддержки по показаниям - проведение традиционной ИВЛ, неинвазивной (бифазик, назальная СРАР).
Противомикробная терапия при неизвестном возбудителе проводится антибиотиками, которые обеспечивают значительную противомикробную эффективность против патогенов, которые обычно вызывают серьёзную инфекцию в первые дни жизни или при предполагаемом возбудителе у конкретного пациента. При определении возбудителя и его чувствительности проводится целенаправленная антибактериальная терапия. Иммунотерпия проводиться строго по показаниям и предпочтение отдается обогащенным иммуноглобулинам поколения.
Для успешного лечения пневмонии очень важно правильное вскармливание ребенка, обеспечивающее его потребности в калориях и пищевых ингредиентах. При тяжелом течении пневмонии требуется проведение внутривенного полного или частичного парэнтерального питания с включением аминокислот, жировых эмульсий, микроэлементов. При возможности энтерального питания, предпочтительно грудное вскармливание, или вскармливание сцеженным грудным молоком. В случае отсутствия молока назначается адаптированная молочная смесь.
После выписки из неонатологического стационара родители должных обратить внимание на следующую информацию:
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
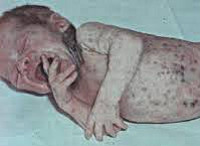
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
Читайте также:

