Новые российские лекарства в лечении волчанки
Обновлено: 19.04.2024
Полвека кряду это аутоиммунное заболевание оставалось без специфической фармакотерапии.

Изображение: Daniel Schreurs/Dreamstime.
Несмотря на множество проведенных клинических испытаний экспериментальной терапии системной красной волчанки, только одно таргетное лекарственное средство, белимумаб (belimumab), смогло за минувшие 60 лет добиться регуляторного одобрения. Разработка новых препаратов связана с рядом проблемных факторов, включающих вопросы к протоколам клинических исследований и гетерогенность пациентской популяции. Особенно удручает нехватка достоверных показателей эффективности лечения.
Так, для системной красной волчанки не предложено ни надежного золотого стандарта измерения активности заболевания, ни унифицированного способа оценки ответа на терапию. Фактически разработка лекарств движется быстрее, чем разработка методов анализа их эффективности. Зачастую фармкомпаниям приходится внедрять собственные конечные точки результативности лечения, являющиеся, впрочем, модификациями хорошо известных инструментов, и потому существует весомый риск, что какой-либо препарат-кандидат, который в действительности работает, не уложится в существующие каноны регуляторов ввиду негибкости их парадигм одобрения новых медикаментов.
Узнать подробности
Baricitinib for systemic lupus erythematosus: a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet 2018; 392: 222–31. [PDF ] [источник ]
A double-blind, randomized, placebo-controlled, phase II trial of baricitinib for systemic lupus erythematosus: how to optimize lupus trials to examine effects on cutaneous lupus erythematosus. Br J Dermatol. 2019 May; 180(5): 964–965. [PDF ] [источник ]
Тем не менее фармотрасль вплотную подошла к тому, чтобы предложить новые и весьма эффективные лекарственные препараты против системной красной волчанки. Рассмотрим некоторые из них.

Таргетные биологические препараты против системной красной волчанки. Изображение: F1000Research 2018, 7(F1000 Faculty Rev):970.
Системная красная волчанка
Системная красная волчанка (SLE) — хроническое гетерогенное аутоиммунное заболевание соединительной ткани, характеризующееся наличием аутоантител против ядерных антигенов, ремиссиями и обострениями, а также чрезвычайно изменчивыми клинической картиной, течением болезни и ее прогнозом. Патология может поражать почти любой орган, включая почки, кожу, опорно-двигательный аппарат, сердечно-сосудистую систему, центральную и периферическую нервную систему, кровь. Заболеванию чаще подвержены женщины. Причина остается неизвестной: считается, что развитию системной красной волчанки способствует потеря аутотолерантности, приводящая к аутоиммунным реакциям, у генетически предрасположенных лиц после воздействия определенных факторов окружающей среды в условиях иммунологической и гормональной нестабильности.
Терапия системной красной волчанки направлена на минимизацию органных повреждений, предотвращение обострений в периоды стабильности, оптимизацию качества жизни пациентов. Среди назначаемых препаратов: противомалярийные (гидроксихлорохин), глюкокортикостероиды (преднизон/преднизолон, метилпреднизолон), иммуномодуляторы и иммуносупрессанты (метотрексат, азатиоприн, микофенолата мофетил, циклофосфамид).
Анифролумаб
Анифролумаб (anifrolumab) — полностью человеческое моноклональное антитело, связывающее субъединицу 1 интерферонового рецептора типа I (IFNAR1), и тем самым, в отличие от множества антител только против интерферона альфа (IFN-α), блокирующее все интерфероны типа I, включая IFN-α, интерферон бета (IFN-β) и интерферон омега (IFN-ω). Указанные цитокины вовлечены в воспалительные сигнальные пути. Приблизительно 60–80% пациентов с системной красной волчанкой характеризуются усиленным профилем экспрессии генов, регулирующих интерфероны типа I, что напрямую коррелирует с активностью заболевания.
Клиническое исследование TULIP 2 (NCT02446899) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое, международное) охватило взрослых пациентов (n=365) с активной умеренно-тяжелой системной красной волчанкой с наличием аутоантител. Участники получали стандартное лечение. Каждые четыре недели внутривенно назначали анифролумаб в дозе 300 мг или плацебо. Первичная конечная точка была установлена пропорцией пациентов, по истечении 52 недель терапии показавших ответ, установленный композитным показателем на базе индекса Британской группы по изучению системной красной волчанки (BICLA).
В группе анифролумаба к первичной конечной точке вышли 47,8% пациентов против 31,5% в группе плацебо, что оказалась статистически и клинически значимым (p=0,001). Анифролумаб также обеспечил статистически значимое расхождение с контрольной группой в отношении ряда вторичных конечных точек, включая уменьшение необходимости применения пероральных кортикостероидов (p=0,014) и снижение индекса распространенности и степени тяжести кожной красной волчанки (CLASI) [p=0,039]. Назначение анифролумаба отметилось численно меньшим количеством обострений заболевания в пересчете на год: 0,43 против 0,64 (p=0,081).


Профиль безопасности анифролумаба выдал повышенную частоту развития опоясывающего лишая (Herpes zoster), который, всё же носил легко-умеренную степень выраженности, был исключительно кожным и проходил после антивирусной терапии.
Узнать подробности
Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med. 2020 Jan 16;382(3):211-221. [PDF ] [источник ]
Впрочем, не всё так радужно: в августе 2018 года анифролумаб провалил аналогичное по дизайну клиническое исследование TULIP 1 (NCT02446912) фазы III, когда у него не получилось достичь первичной конечной точки, оформленной пропорцией участников, показавших снижение индекса активности заболевания SLEDAI-2K как минимум на 4 балла (SRI-4) вкупе с другими обязательными условиями.
Узнать подробности
Узнать подробности
Anifrolumab in lupus: the promise and the caution – Author’s reply. [PDF ] [источник ]
Anifrolumab, a monoclonal antibody to the type I interferon receptor subunit 1, for the treatment of systemic lupus erythematosus: an overview from clinical trials. Mod Rheumatol. 2020 Sep 17;1-12. [PDF ] [источник ]
Efficacy of anifrolumab in systemic lupus erythematosus: a critical analysis of the TULIP trials. Lupus. 2020 Jul;29(8):1002-1003. [PDF ] [источник ]
Spotlight on anifrolumab and its potential for the treatment of moderate-to-severe systemic lupus erythematosus: evidence to date. [PDF ] [источник ]
Анализ объединенного пула данных, собранных в TULIP 1 и TULIP 2, подтвердил клиническую состоятельность анифролумаба для лечения системной красной волчанки.
Узнать подробности
Early and sustained responses with anifrolumab treatment in patients with active systemic lupus erythematosus (SLE) in 2 phase 3 trials. [PDF ] [источник ]
Efficacy of anifrolumab in active systemic lupus erythematosus: patient subgroup analysis of BICLA response in 2 phase 3 trials. [PDF ] [источник ]
Flare assessments in patients with active systemic lupus erythematosus treated with anifrolumab in 2 phase 3 trials. [PDF ] [источник ]
Ценеримод


Узнать подробности
First use of cenerimod, a selective S1P1 receptor modulator, for the treatment of SLE: a double-blind, randomised, placebo-controlled, proof-of-concept study. Lupus Sci Med. 2019; 6(1): e000354. [PDF ] [источник ]
Ценеримод (cenerimod) представляет собой пероральный избирательный агонист сфингозин-1-фосфатных рецепторов подтипа 1 (S1PR1). Ценеримод, связываясь с S1PR1 на поверхности T- и B-лимфоцитов, приводит к интернализации первого, тем самым последние теряют способность считывать градиент сфингозин-1-фосфата (S1P), циркулирующего в периферической крови, и перестают мигрировать из лимфоузлов в направлении высокой концентрации S1P. Ценеримод, сдерживая выход лимфоцитов из вторичных лимфоидных органов, не дает им мигрировать к местам воспаления.
Телитацицепт


Телитацицепт (telitacicept, RC18) — рекомбинантный гибридный белок, состоящий из внеклеточного домена рецептора трансмембранного активатора и партнера кальциевого модулятора и лиганда циклофилина (TACI) и Fc-домена иммуноглобулина IgG человека. Телитацицепт, нейтрализуя BAFF и индуцирующий пролиферацию лиганд (APRIL), подавляет развитие и выживаемость зрелых B-клеток, тем самым препятствуя образованию аутоантител, что является основополагающим в патофизиологии аутоиммунных воспалительных заболеваний.
Телитацицепт проходит параллельную проверку в терапии множества других аутоиммунных патологий: ревматоидного артрита, нейромиелита зрительного нерва со спектральным расстройством, рассеянного склероза, IgA-нефропатии (болезнь Берже), миастении гравис, синдрома Шегрена.
Ригеримод
Ригеримод (rigerimod, IPP-201101, P140) — полипептид, соответствующий последовательности 131–151 малого ядерного нуклеопротеина и компонента сплайсосомы snRNP70 с фосфорилированным серином в позиции 140. Механизм действия ригеримода до конца не ясен, но, есть мнение, что он выступает иммуномодулятором: путем связывания с главным комплексом гистосовместимости (MHC) класса II осуществляется подавление T-клеточной реактивности с сопутствующим восстановлением иммунной толерантности. Не исключено, одним из центральных эффектов ригеримода является аутофагия: лекарственное соединение вмешивается в сигнальный путь лизосомальной деградации, вызывая нестабильность MHCII-молекул, которые должны презентировать эндогенные антигены аутореактивным T-клеткам; при этом работа нормальных лимфоцитов не затрагивается. На мышиных моделях показано , что ригеримод сдерживает протеинурию, васкулит и дерматит, препятствует выработке аутоантител против dsDNA.
Устекинумаб
В клиническом испытании NCT02349061 фазы II (рандомизированном, двойном слепом, плацебо-контролируемом, многоцентровом, международном) среди взрослых пациентов (n=102) с умеренно-тяжелой системной красной волчанкой назначение устекинумаба поверх стандартной терапии привело к тому, что по истечении 24 недель 62% участников добрались до показателя SRI-4 — против 33% больных в контрольной группе (p=0,006). Указанное достижение сохранилось по прошествии 48 недель у 63,3% участников, получавших устекинумаб.
Узнать подробности
Efficacy and safety of ustekinumab, an IL-12 and IL-23 inhibitor, in patients with active systemic lupus erythematosus: results of a multicentre, double-blind, phase 2, randomised, controlled study. Lancet. 2018 Oct 13;392(10155):1330-1339. [PDF ] [источник ]
Maintenance of Efficacy and Safety of Ustekinumab Through One Year in a Phase II Multicenter, Prospective, Randomized, Double-Blind, Placebo-Controlled Crossover Trial of Patients With Active Systemic Lupus Erythematosus. Arthritis Rheumatol. 2020 May;72(5):761-768. [PDF ] [источник ]
Энтузиазм следует умерить до подведения итогов продолжающегося клинического исследования NCT03517722 фазы III, поскольку чрезвычайно гетерогенная природа волчанки зачастую не оставляет шансов на успех в ходе завершающей проверки.
Устекинумаб (ustekinumab) — полностью человеческое моноклональное антитело, которое связывается с белковой p40-субъединицей, общей для интерлейкина 12 (IL-12) и интерлейкина 23 (IL-23). Считается, что оба этих цитокина вовлечены в патогенез системной красной волчанки: IL-12 необходим для клеточного развития T-хелперов типа 1 (Th1) и фолликулярных T-хелперов (TFH), а также цитотоксической T-клеточной активации и функционирования, а IL-23 отвечает за экспансию и выживаемость патогенных Th17 и других клеток, продуцирующих интерлейкин 17 (IL-17), который промотирует воспаление в тканях.

Обзор
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
Автор
Редакторы


Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.

Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).

Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.

Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.

Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].

Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.

Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].

Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).

Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
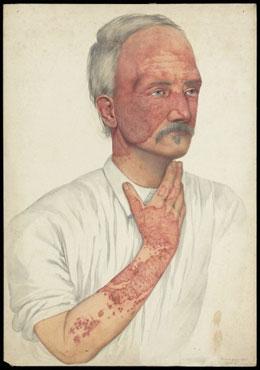
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди

Литературный обзор, посвященный анализу современных данных об эффективности белимумаба (БЛМ) при системной красной волчанке (СКВ). Приводятся данные о высокой эффективности БЛМ при высокой и средней активности СКВ у пациентов с поражением суставов, кожи и высокой иммунологической активностью. Описаны случаи комбинированного применения БЛМ и ритуксимаба (РТМ) при СКВ.
Prospects for anti-BLyS treatment of systemic lupus erythematosus
Solovyev S.K., Mesnyankina A.A., Aseeva E.A., Federal State Budgetary Institution Research Institute of Rheumatology named after V.A. Nasonova
Review of literature on the analysis of current data on the efficacy of belimumab (BLM) in systemic lupus erythematosus (SLE). It provides data on the high efficacy of BLM in high and medium activity of SLE in patients with joints damage, skin lesions and high immunological activity. The paper describes clinical cases of a rituximab and belimumab combination therapy in SLE patients.
Системная красная волчанка (СКВ) - мультисистемное аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов [1, 2]. В последние полвека значительно улучшилась пятилетняя выживаемость пациентов с СКВ (с 50 до 92-96%) [3], что может быть связано с появлением новых препаратов и методов терапии (пульс-терапия (ПТ), применение цитостатических препаратов, высоких доз преднизолона, генно-инженерных биологических препаратов (ГИБП), плазмаферез и др.), а также с более глубоким пониманием патогенеза заболевания и ранней диагностикой.
Основой терапии СКВ является применение глюкокортикоидов (ГК) и цитостатиков. Они оказывают мощный противовоспалительный и иммуносупрессивный эффект неизбирательного действия. Применение терапии ГК, цитостатиками и их комбинации способствует уменьшению частоты рецидивов, увеличению продолжительности жизни и значительному снижению ранней и поздней летальности [4]. Однако многолетнее применение ГК у пациентов СКВ приводит к целому ряду негативных последствий, тяжесть которых нередко сопоставима с основным заболеванием. Так, назначение массивных доз ГК для купирования обострения и многолетнее применение средних доз с целью поддержания низкой активности заболевания приводит к необратимым органным повреждениям (НОП), которые связаны с влиянием ГК на костно-мышечную систему (остеопороз, остеонекроз, переломы костей), гомеостаз (тромбозы), эндокринную (гипергликемия, диабет, надпочечниковая недостаточность, дисплазия щитовидной железы), сердечно-сосудистую систему (атеросклероз, артериальная гипертензия), зрение (катаракта, глаукома) и др., что приводит к не только к снижению качества жизни больных, но и существенно повышает стоимость лечения. Кроме того, применение этих препаратов ассоциировано с риском возникновения тяжелых бактериальных и вирусных инфекций [5, 6, 7].
Комбинированная терапия ГИБП. Предпосылками для комбинации ГИБП у больных СКВ служат различные механизмы действия РТМ и БЛМ, в частности их взаимодействие с определенными субпопуляциями В-клеток. К РТМ чувствительны преимущественно наивные В-клетки и В-клетки памяти [27]; в свою очередь, БЛМ, блокируя BlyS, воздействует на транзиторные, наивные В-клетки и ПК, а также на В-клетки маргинальной зоны [28]. Терапия РТМ приводит к деплеции В-клеток, однако одновременно с этим через 3–4 мес. в плазме в несколько раз увеличивается уровень BlyS, а по некоторым данным, его концентрация в периферической крови превосходила исходные значения (до применения ГИБП) [29]. Такое увеличение цитокина после деплеции В-клеток может быть связано с уменьшением рецепторов связывания BAFF или замедлением обратной регуляции транскрипции генов BAFF [30]. Различные перекрывающие друг друга механизмы способствуют более эффективному подавлению аутореактивных В-клеток. Применение комбинированной терапии способствует не только эффективной деплеции В-клеток с момента подключения РТМ [31], но и подавляет формирование новых аутореактивных клеток после присоединении БЛМ, благодаря снижению выживаемости, а также дифференцировки В-клеток памяти в аутоантитело-продуцирующие клетки [18], тем самым приводя к терапевтическому эффекту, и последующему достижению и поддержанию ремиссии. Перспективы комбинированной терапии ГИБП у больных СКВ подтверждаются результатами реальной клинической практики. Так T. Kraaij и соавт. [32] представили два клинических случая, где пациентам с высокой активностью СКВ и превалированием люпус-нефрита с протеинурией >8 г/сут была выполнена инфузия РТМ с последующим назначением БЛМ. На фоне проведенного лечения достигнуто уменьшение протеинурии ниже 1,5 г/сут, увеличение содержания С3-, С4-компонентов комплемента, снижение уровня АТ к дс-ДНК и поддержание количества аутореактивных В-клеток на низком уровне. На протяжении последующих 12 мес наблюдения сохранялась минимальная активность заболевания (SLEDAI-2К 6–4 балла). В работе E. Simonetta и соавт. [33] также было отмечено, что последовательное применение РТМ и БЛМ у пациентки с люпус-нефритом способствовало более эффективному подавлению активности СКВ благодаря ингибированию BLyS при использовании БЛМ на фоне В-клеточной деплеции, достигнутой после введения РТМ. В недавно опубликованной работе R. Gualtierotti и соавт. [34] также продемонстрирован отличный результат комбинированного лечения РТМ+БЛМ у трех больных СКВ. В настоящий момент ведутся два перспективных клинических исследования (NCT02260934; NCT02284984), целью которых является определение эффективности последовательного применения РТМ и БЛМ у больных СКВ. В исследовании эффективности комбинации РТМ и БЛМ у 7 больных СКВ, проведенном в Институте ревматологии им. В.А. Насоновой было установлено, что принципиальной особенностью комбинированной терапии являлась возможность ведения больных на средних и низких дозах ГК на протяжении всего периода наблюдения (12 месяцев), с момента назначения ГИБП. Среди пациентов, получавших такую терапию, обострение СКВ зафиксировано только в одном случае и было связано с задержкой очередной инфузии БЛМ на 2 недели. Еще одним позитивным фактором, влияющим на выбор тактики лечения, является возможность снижения риска развития НОП. В нашем исследовании при использовании БЛМ и комбинированной терапии нарастания НОП не было отмечено [35].
Таким образом, назначение БЛМ является эффективным методом лечения, способствующим достижению основных целей терапии СКВ – максимальное и длительное снижение активности, уменьшение частоты обострений, минимизации ежедневной дозы ГК, снижение риска развития НОП, улучшение качества жизни и, наконец, развитие стойкой ремиссии. Важно подчеркнуть, что применение БЛМ не ассоциировано с развитием серьезных побочных эффектов и в целом хорошо переносится [36]
Читайте также:

