Нозокомиальная инфекция в отделении интенсивной терапии
Обновлено: 15.04.2024
Возбудители нозокомиальных инфекций (НКИ). Причины послеоперационной раневой инфекции
Послеоперационные раневые инфекции (РИ) могут быть обусловлены широким спектром микроорганизмов, включая аэробные, факультативно-анаэробные и строго анаэробные бактерии, а также микобактерии и грибы. Для клинициста и клинического микробиолога важно получить информацию о точной идентификации микроорганизма, поскольку определенный вид микроба часто связан и с конкретным инфекционным осложнением, с типом послеоперационной раны. Микроскопия присланного в лабораторию биоматериала есть первое и обязательное условие грамотно организованной работы лаборатории.
Благодаря микроскопии можно не только решить, целесообразно ли делать посев присланного материала, по и во многих случаях дать предварительный результат (палочки, кокки, грибы, смешанная микрофлора или отсутствие микроорганизмов), а также рационально выполнить дальнейшие этапы микробиологического исследования. Результаты микроскопии следует всегда связывать с данными культуралыюго метода (посев на искусственные питательные среды, получение чистой культуры микроорганизма и точной идентификации).
Диагноз анаэробной инфекции, как правило, на первом этапе ставят по клиническим проявлениям. Что касается определения токсина С. difficile, результат может быть неспецифичеп, но тест весьма подходит как скрининг. При инфекции, обусловленной С. tetani (столбняк), микроскопия и посев часто дают отрицательные результаты (> 50%). При актиномикозе и нокардиозе очень важна предварительная микроскопия, поскольку в этих случаях (обнаружение морфологически сходных микроорганизмов) необходимо использовать специальные среды и длительную инкубацию, причем в случае актиномикоза инкубация посевов требует анаэробной атмосферы.
Структура лидирующих возбудителей в том или ином стационаре зависит от его профиля, принятых методов диагностики и лечения основного заболевания, применяемых схем антимикробной профилактики и терапии послеоперационных осложнений, а также от качества инфекционного контроля в клинике. Согласно кооперированным зарубежным данным, спектр возбудителей в клиниках Северной Америки, Европы, Азии, Австралии и даже Африки в основном сходный.
Наши данные по составу возбудителей также не отличаются от данных крупных международных исследований. Но частота их выделения, состав лидирующих возбудителей зависят от различных факторов, в т. ч. от профиля конкретного лечебного учреждения. Все связанные с НКИ проблемы наиболее ярко представлены в отделениях реанимации. При сравнении собственных результатов н данных Системы государственного надзора за нозокомнальными инфекциями США (NNIS) за 2003 г. очевидны значительные различия в частоте выделения всех основных возбудителей послеоперационных РИ, кроме E. coli и Enterococcus spp..
Частота выделения основных возбудителей нозокомиальных инфекций (НКИ) различна. Так, S.aureus, лидирующий в клиниках США, в РОНЦ выделяется более чем в 4 раза реже, остальные возбудители, напротив, чаще. Различия обусловлены многими факторами, в т. ч. и различным уровнем инфекционного контроля, отличной политикой антибиотикопрофилактики и антибиотикотерапии.
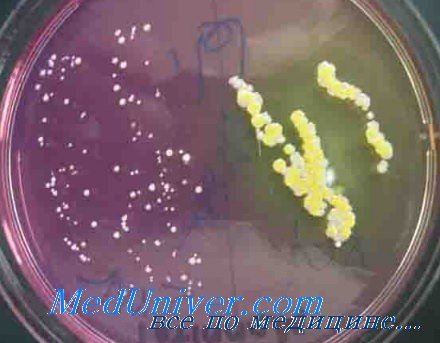
S. aureus занимает 1-е место в структуре возбудителей послеоперационных инфекционных осложнений в 50% рассматриваемых Н.В. Дмитриевой отделений РОНЦ, особенно в отделениях опухолей молочной железы (32,6%) и нейрохирургии (25,9%).
Е. coli лидирует как возбудитель в сравнении с S. aureus только в пяти отделениях: проктологии (22,7%), гинекологии (21,4%), рентген-хирургических методов диагностики и лечения (15,5%), отделениях радиохирургии (14,1%) и абдоминальной хирургии (11,9%). Значительную роль как возбудитель инфекций Е. coli играет в таких отделениях, как отделение опухолей женской репродуктивной системы (13,8%), урология (12,5%), диагностическое (10,8%), опухолей печени и поджелудочной железы (10,7%), опухолей верхних дыхательных и пищеварительных путей (8,7%).
Доля P. aeruginosa в отделениях реанимации в целом составила 18,5% (426 или 2297), что достоверно выше частоты инфекций, обусловленных Candida spp. (12,0%, 276 из 2297), A. baumannii (10,8%, 249 из 2297), К. pneumoniae (9,2%, 212 из 2297) и E.faecium (9,1 %, 210 из 2297), значение которых в данных отделениях также высоко. Следует отметить, что в ОРИТ № 1 (основное отделение реанимации для пациентов после хирургических операций) P. aeruginosa имеет первостепенное значение и составляет 19,6% (384 из 1958 штаммов), на 2-м месте A. baumannii (12,4%, 243 из 1958), затем идет Candida spp. (11,4%, 223 из 1958). В то же время в ОРИТ № 4 (отделение кардиореанимации) на 1-м месте стоит Candida spp. (15,6%, 53 из 339 штаммов), а уже затем P. aeruginosa (12,4%, 42 из 339). В обоих отделениях реанимации значение стафилококков как возбудителей инфекционных осложнений невелико.
Помимо отделений реанимации P. aeruginosa имеет либо основное, либо весьма существенное значение для всех остальных отделений. Так, в отделениях торакоабдоминальной хирургии и опухолей верхних дыхательных и пищеварительных путей это лидирующий возбудитель (14,5 и 16,3% соответственно). Отделения проктологии, урологии, нейрохирургии, радиохирургии, рентген-хирургических методов диагностики и лечения, опухолей головы и шеи, опухолей молочной железы также имеют значительную долю инфекций, обусловленных синегнойной палочкой.
A. baumannii занимает 1-е место (12,4%) в структуре возбудителей НКИ в отделении опухолей печени и поджелудочной железы, но статистически значимых различий по сравнению с Е. coli не наблюдается (10,7%). Частота выделения P. aeruginosa, К. pneumoniae, Е. faecalis и E.faecium ниже и примерно одинакова (около 8% для каждого возбудителя). Кроме отделения опухолей печени и поджелудочной железы A. baumannii составляет также значительную долю (12,5%) возбудителей в отделении опухолей головы и шеи после P. aeruginosa (13,2%) и лидирующего в этом отделении S. aureus (18,8%), хотя статистически значимой разницы в частоте их выявления в данном отделении не наблюдается.
Candida spp. — лидирующий возбудитель в ОРИТ № 4 (15,6%), а в четырех других отделениях стоит на 2-м месте по частоте выделения: ОРИТ № 1 (11,4%), торакоабдоми-нальной хирургии (11,2%), абдоминальной хирургии (10,7%) и опухолей верхних дыхательных и пищеварительных путей (8,7%).
E. faecalis занимает 1-е место в структуре возбудителей послеоперационных инспекционных осложнений только одного отделения — урологического (15%), на 2-м месте в этом отделении Е. coli (12,5%) и P. aeruginosa (11,8%), хотя статистически значимых различий в частоте их выделения не отмечается.
Группа коагулазонегативных стафилококков (КГС) в основном представлена двумя клинически значимыми видами: S. epidermidis и S. haemolyticus. В отделении реконструктивной и сосудистой хирургии S. epidermidis (19,5%) наравне с S. aureus (19,1 %) — наиболее значимые возбудители, статистически значимо реже встречается E.faecalis (11,4%). В трех отделениях S. epidermidis занимает 2-е место после 5. aureus: отделение опухолей молочной железы (23,9%), отделение опухолей женской репродуктивной системы (18,2%) и отделение общей онкологии (14,1 %).
К. pneumoniae составляет в целом по клинике 7,4%. Только в одном отделении (нейрохирургия) этот вид энтеробактерий имеет существенное значением занимает 2-е место, составляя 16,7%.
S. maltophilia, несмотря на то что нечасто выделяется из биоматериалов пациентов хирургических отделений и составляет только 3,7%, имеет большое значение как возбудитель НКИ. С каждым годом доля этого вида грамотрицательных неферментирующих палочек в общей структуре возбудителей растет во всех странах. Кроме того, при инфекции, обусловленной S. maltophilia, весьма ограничен выбор антимикробных препаратов (триметоприм/сульфаметоксазол [Бисептол] и тикарпиллип/клавулаповая кислота [Тиментин]).
Таким образом, несмотря на то что в целом по клинике лидирующим возбудителем следует считать P. aeruginosa, отделения отличаются но спектру возбудителей и микроорганизмам, имеющих основное значение. Принципиально важно понимать, что эмпирическая антимикробная терапия должна быть конкретизирована и адаптирована к условиям определенного стационара. Следует отметить, что применение антибиотика с уровнем резистентности 10-20% является достоверно высоким, поэтому рекомендуется избегать их назначения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
С.В. ЯКОВЛЕВ, кандидат медицинских наук, старший научный сотрудник кафедры внутренних болезней № 4 лечебного факультета. ЭТИОЛОГИЯ, КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ И ПОДХОДЫ К АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
Инфекции являются наиболее частым осложнением у пациентов, находящихся в отделениях интенсивной терапии (ОИТ) и ведущей причиной летальности у этих больных. Частота развития инфекционных осложнений существенно возрастает при увеличении сроков пребывания больного в ОИТ. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов, результаты лечения инфекций остаются неудовлетворительными.
Сложности лечения бактериальных инфекций в ОИТ определяются многими факторами, среди которых следует отметить тяжесть состояния больных, как правило полимикробный характер инфекции, частое выделение так называемых проблемных микроорганизмов, высокий уровень резистентности микробов к традиционным антибиотикам, быстрое развитие устойчивости микробов в процессе лечения, частые рецидивы инфекции во время и после окончания антибактериальной терапии. Кроме того, необоснованное, бессистемное применение антибактериальных препаратов ведет к быстрой селекции и распространению по больнице устойчивых штаммов микроорганизмов.
В связи с тяжестью состояния больных и опасностью для них инфекционных осложнений антибактериальную терапию следует начинать неотложно при первых признаках инфекции, не дожидаясь результатов бактериологического исследования, так как промедление с назначением антибиотика у этих больных может иметь фатальные последствия. В таких случаях обычно назначают комбинацию двух или более антибактериальных средств, чтобы охватить максимально возможный спектр потенциальных возбудителей.
Среди факторов, способствующих развитию инфекции у больных в ОИТ, следует выделить:
основное заболевание
тяжесть состояния больного (АРАСНЕ II > 20)
возраст старше 60 лет
диагностические и лечебные инвазивные процедуры (интубация, ИВЛ, катетеризация мочевого пузыря, катетеризация центральных и периферических вен)
использование антацидов и Н2-блокаторов
длительность нахождения в ОИТ
бессистемное или широкое профилактическое использование антибиотиков.
Источником инфекции является либо сам пациент (эндогенная инфекция в результате орофарингеальной колонизации или аспирации), либо экзогенный источник (дыхательная аппаратура, катетеры, медицинский персонал, другие больные).
Распределение инфекций в ОИТ отличается от других отделений. В отделениях общего профиля превалируют инфекции мочевыводящих путей и раневая инфекция, в то время как в ОИТ наиболее частой является инфекция нижних дыхательных путей (45%), и прежде всего пневмония (около 30%). Сходные данные о преобладании в ОИТ инфекций нижних дыхательных путей получены 29 апреля 1992 года в ходе многоцентрового исследования, проведенного в 1417 отделениях интенсивной терапии в 17 странах Европы - EPIC Study (Evropean Prevalence of Infection in Intensive Care). Примерно с одинаковой частотой (10-15%) в ОИТ встречаются инфекции других локализаций (мочевыводящих путей, интраабдоминальная, кожи и мягких тканей).
Наиболее частые возбудители инфекций в ОИТ характеризуются множественной устойчивостью к традиционным антибактериальным средствам.
Наиболее частыми возбудителями инфекций в реанимации, по данным EPIC Study, являются различные стафилококки (Staphylococcus aureus - 30%, Staphylococcus spp. - 19%) и P. aeruginosa (29%). Частыми патогенами являются также другие грамотрицательные бактерии, прежде всего Escherichia coli (13%), Acinetobacter spp. (9%), Klebsiella spp. (8%), Enterobacter spp. (7%), Proteus spp. (6%). Среди грамположительных микроорганизмов большое значение имеют также Enterococcus spp. (12%) и Streptococcus spp. (7%). Возбудители различных инфекций в отделениях общего профиля и в отделениях реанимации во многих случаях существенно различаются. В ОИТ преобладают так называемые проблемные микроорганизмы, к которым относятся прежде всего S. aureus и коагулазонегативные стафилококки, энтерококки, некоторые грамотрицательные энтеробактерии (Enterobacter cloaceae, Serratia spp., Proteus vulgaris, Klebsiella spp.), неферментирующие грамотрицательные палочки (P. aeruginosa и Pseuctomonas spp., Acinetobacter spp., Stenotrophomonas, maltophilia), а также некоторые анаэробы (Bacteroides fragilis). Эти микроорганизмы, как правило, характеризуются устойчивостью ко многим антибактериальным средствам.
Большинство штаммов S. aureus (85-95%) продуцирует пенициллиназу и устойчиво к бензилпенициллину и пенициллинам широкого спектра, но чувствительно к оксациллину и цефалоспоринам. Частота метициллинрезистентных штаммов S. aureus варьирует в различных регионах и в ОИТ в среднем составляет от 10 до 30%. Эти штаммы стафилококка характеризуются устойчивостью к оксациллину и другим бета-лактамным антибиотикам, а также в большинстве случаев к антибактериальным средствам других классов (макролидам, аминогликозидам, фторхинолонам). Гликопептидные антибиотики (ванкомицин, тейкопланин) являются единственными средствами, сохраняющими высокую активность в отношении этих микроорганизмов.
Коагулазонегативные стафилококки (S. epiderminis, S. haemolyticus, S. hominis) в последние годы стали значительно чаще выделяться у больных в ОИТ в связи с широким использованием внутрисосудистых катетеров. Для этих стафилококков характерна продукция пенициллиназ и более частое, чем у S. aureus, развитие резистентности к метициллину.
P. aeruginosa, второй по частоте микроорганизм, вызывающий инфекции в ОИТ, характеризуется множественной резистентностью. Многие штаммы продуцируют хромосомальные цефалоспориназы, гидролизующие цефалоспорины 3-го поколения, в том числе цефтазидим. Кроме того, Р. aeruginosa может продуцировать бета-лактамазы класса ТЕМ-1, разрушающие антисинегнойные пенициллины, и плазмидные бета-лактамазы, определяющие устойчивость микроорганизма к большинству пенициллинов и цефалоспоринов.
Acinetobacter spp., как правило, проявляет устойчивость к большинству бета-лактамов, аминогликозидам и фторхинолонам. Xanthomonas maltophilia продуцирует металлоэнзимы, разрушающие все бета-лактамы, в том числе карбапенемы. Таким образом, наиболее частые возбудители инфекций в ОИТ характеризуются множественной устойчивостью к традиционным антибактериальным средствам, что определяет сложности лечения этих больных.
Принципы антибактериальной терапии
Учитывая указанные сложности лечения инфекций у больных в ОИТ (тяжесть состояния пациентов, полимикробный характер инфекции, частое выделение возбудителей с множественной устойчивостью к антибактериальным средствам), для проведения адекватной и эффективной антибактериальной терапии необходимо соблюдать следующие положения:
лечение следует начинать неотложно при первых признаках инфекции или наличии лихорадки выше 38°С;
лечение должно быть обязательно программируемым и стандартизованным;
лечение, как правило, эмпирическое, по крайней мере на начальном этапе;
первичная оценка эффективности антибактериальной терапии проводится в течение 48 часов после начала лечения по уменьшению выраженности лихорадки и интоксикации;
лечение должно проводиться под строгим бактериологическим контролем (мокрота, кровь, моча);
на первом этапе предпочтительна монотерапия.
Преимущества монотерапии перед комбинированным использованием антибактериальных средств:
уменьшение риска неадекватного взаимодействия антибактериальных средств;
уменьшение риска нежелательных взаимодействий с другими лекарственными средствами;
уменьшение риска развития токсических явлений;
уменьшение времени введения лекарств;
облегчение работы медперсонала;
уменьшение использования антибиотиков и их попадания в окружающую среду;
уменьшение стоимости лечения.
Как правило, лечение больных, находящихся в ОИТ, имеет эмпирический характер, т.к. должно начинаться неотложно при первых признаках инфекции. До настоящего времени общепринятым подходом к лечению этих больных было назначение бета-лактамного антибиотика (уреидопенициллин или цефалоспорин 2-3-го поколения) в комбинации с аминогликозидом. В последние годы в клиническую практику внедрены новые антибактериальные средства с широким спектром антимикробной активности, позволяющие проводить монотерапию и избегать использования высокотоксичных аминогликозидных антибиотиков. К таким препаратам относятся некоторые цефалоспорины 3-го поколения (цефтазидим) и 4-го поколения (цефепим, цефпиром), фторхинолоны (ципрофлоксацин), защищенные пенициллины широкого спектра с антисинегнойной активностью (пиперациллин/тазобактам, тикарциллин/ клавулановая кислота) и карбапенемовые антибиотики - меропенем и имипенем.
Антибактериальный препарат, назначаемый в режиме монотерапии, должен удовлетворять определенным требованиям:
широкий спектр бактерицидного действия, включающий Staphilococcus spp., P.aeruginosa, Enterobacteriaceae;
стабильность к бета-лактамазам;
невысокий уровень резистентности бактерий, выделяемых у больных в ОИТ;
благоприятная фармакокинетика, хорошее проникновение в ткани;
удобство дозирования и применения;
хорошая переносимость в больших дозах;
хорошее соотношение стоимость-эффективность;
доказанная эффективность в контролируемых клинических исследованиях.
Программа эмпирической антибактериальной терапии инфекций в ОИТ
В кратком обзоре нет возможности подробно рассмотреть все инфекции, встречающиеся в ОИТ. Поэтому представляется целесообразным привести рекомендации по антибактериальной терапии наиболее частых и тяжелых инфекций - пневмонии и интраабдоминальных инфекций.
1. Внебольничная пневмония. Наиболее частыми возбудителями внебольничной пневмонии тяжелого течения у больных, госпитализированных в ОИТ, являются S. pneumoniae, Legionella pneumoniae, Enterobacteriaceae, реже наблюдаются S. aureus и Mycoplasma pneumoniae. Эта пневмония характеризуется быстропрогрессирующим течением и высокой летальностью: по данным British Thoracic Society, летальность может достигать 50-75%. К сожалению, на основании анамнестических данных и клинической картины не представляется возможным установить этиологию пневмонии. В то же время для уточнение возбудителя заболевания или требуется несколько дней, или необходимы специальные и дорогостоящие серологические исследования. В связи с этим выбор схем антибактериальной терапии внебольничной пневмонии тяжелого течения основан на эмпирическом подходе с учетом наиболее вероятных возбудителей.
В настоящее время стандартной схемой начальной эмпирической терапии внебольничной пневмонии в ОИТ является комбинированное применение парентерального цефалоспорина 3-го поколения (высокоактивного в отношении пневмококка и грамотрицательных энтеробактерий) и парентерального макролидного антибиотика (активного в отношении легионеллы и микоплазмы). Среди цефалоспоринов 3-го поколения предпочтительны цефтриаксон (1 г с интервалом 24 ч) или цефотаксим (1-2 г с интервалом 8 ч); к парентеральным макролидам относятся эритромицин (1 г с интервалом 6 ч), спирамицин (1,5 млн ME с интервалом 8 ч) и кларитромицин (0,5 г с интервалом 12 ч). В качестве альтернативы цефалоспоринам 3-го поколения могут быть использованы фторхинолоны (ципрофлоксацин 0,2 г с интервалом 12 ч или офлоксацин 0,2 г с интервалом 12 ч) или цефалоспорины 4-го поколения (цефепим 1 г с интервалом 12 ч или цефпиром 1 г с интервалом 12 ч). При установленной легионеллезной этиологии пневмонии к лечению добавляют рифампицин в/в 0,5 г с интервалом 12 ч.
2. Госпитальная пневмония. Является наиболее частым инфекционным осложнением в ОИТ, особенно у больных, находящихся на ИВЛ. Риск развития вентилятор-ассоциированной пневмонии (ВАЛ) значительно увеличивается при продолжительности ИВЛ более 48 ч. Наиболее важньми факторами для прогнозирования этиологии ВАП являются предшествующая антибактериальная терапия и продолжительность механической вентиляции. У больных с ранней ВАП (к ней относятся случаи пневмонии, развившейся при искусственной вентиляции менее 7 дней), не получавших предшествующей антибактериальной терапии, ведущими этиологическими агентами являются микроорганизмы, обычно колонизирующие верхние дыхательные пути и верхние отделы ЖКТ, такие, как S. pneumoniae, Н. influenzae, S. aureus, Enterobacteriaceae. Для этих микроорганизмов характерен естественный уровень антибиотикочувствительности. В этиологии поздних ВАП (развитие пневмонии при продолжительности ИВЛ свыше 7 суток) ведущую роль играют P. aeruginosa, Acinetobacter spp., S. aureus (в том числе метициллинрезистентные штаммы), Enterobacteriaceae (см. табл. 1). Практически все возбудители поздних ВАП характеризуются множественной резистентностью к антибактериальным препаратам, поскольку такие пневмонии, как правило, развиваются на фоне длительной антибактериальной терапии или профилактики.
Таблица 1
ЭМПИРИЧЕСКАЯ ТЕРАПИЯ ГОСПИТАЛЬНОЙ ПНЕВМОНИИ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
| Микроорганизмы | Режим монотерапии | Режим комбинированной терапии |
| 1. Раннее начало | ||
| Enterobacteriaceae S.pneumoniae Н.influenzae S.aureus | Цефалоспорин III 1) Фторхинолон | Цефалоспорин II 2) + аминогликозид Ко-амоксиклав + аминогликозид Оксациллин + аминогликозид АСПен 3) + аминогликозид |
| 2. Позднее начало | ||
| S.pneumoniae S.aureus Enterobacteriaceae | Цефтазидим Цефалоспорин IV 4) Ципрофлоксацин Пиперациллин/тазобактам Тикарциллин/клавуланат Имипенем Меропенем | Цефалоспорин III + аминогликозид АСПен 3) + аминогликозид Фторхинолон + аминогликозид Ванкомицин + амикацин |
2)цефуроксим, цефамандол
3)тикарциллин, пиперациллин, азлоциллин
4)цефепим, цефпиром
Начальная антибактериальная терапия ВАП основана на эмпирическом подходе, однако до назначения антибактериального препарата обязательным является забор мокроты (желательно получение материала инвазивными методами с количественной оценкой результатов) и крови для микробиологического исследования.
В качестве начальной терапии ранней ВАП может быть использована монотерапия цефалоспоринами 3-го поколения (цефтриаксон 2 г с интервалом 24 ч или цефотаксим 2 г с интервалом 6-8 ч) или фторхинолонами (ципрофлоксацин 0,2-0,4 г с интервалом 12 ч или офлоксацин 0,2-0,4 г с интервалом 12 ч). В качестве альтернативных режимов терапии применяют комбинацию аминогликозидного антибиотика с цефалоспоринами 2-го поколения, ко-амоксиклавом или антисинегнойными пенициллинами. При назначении аминогликозидов следует учитывать высокую частоту устойчивых штаммов бактерий к гентамицину; предпочтительнее использовать амикацин 7,5 мг/кг с интервалом 12 ч или нетилмицин в суточной дозе 4-6 мг/кг (в 2-3 введения).
3. Интраабдоминальные инфекции. Являются одной из наиболее частых причин сепсиса в ОИТ и характеризуются неудовлетворительным прогнозом: частота летального исхода при абдоминальном сепсисе составляет 30-60%. Фактором, определяющим тяжесть течения абдоминального сепсиса, является количественная оценка по АРАСНЕ II: при количестве баллов до начала антибактериальной терапии 20 летальность составила
Возбудителями первичного перитонита, как правило, являются грамотрицательные энтеробактерии. Наиболее часто в ОИТ наблюдается вторичный перитонит, имеющий смешанную аэробно-анаэробную этиологию (см. табл. 2).
Таблица 2
ЭМПИРИЧЕСКАЯ ТЕРАПИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
| Микроорганизмы | Режим монотерапии | Режим комбинированной терапии |
| 1. Перитонит первичный | ||
| Е. coli Klebsiella spp. Proteus spp. Enterobacter spp. S. pneumoniae Enterococcus spp. | Цефалоспорин III 1) Цефалоспорин IV 2) Фторхинолон Пиперациллин/тазобактам Тикарциллин/клавуланат | АСПен 3) + аминогликозид АМП/СБ + аминогликозид Цефалоспорин II 4) + аминогликозид Цефокситин + аминогликозид |
| 2. Перитонит вторичный | ||
| Как правило, полимикробной этиологии: Enterobacteriaceae P. aeruginosa Enterococcus spp. Анаэробы | Пиперациллин/тазобактам Тикарциллин/клавуланат Имипенем Меропенем | Цефалоспорин III 1) + клиндамицин Цефалоспорин IV 2) + клиндамицин Фторхинолон + метронидазол Аминогликозид + клиндамицин АСПен 3) + аминогликозид АМП/СБ + аминогликозид |
2)Цефепим, цефпиром
3)Тикарциллин, пиперациплин, азлоциллин
4)Цефуроксим, цефамандол
5)АМП/СБ - ампициллин/сульбактам
В качестве стандартной схемы начальной эмпирической терапии перитонита обычно используют комбинацию аминогликозидного антибиотика (гентамицин, тобрамицин, нетилмицин или амикацин) и препарата с антианаэробной активностью (метронидазол или клиндамицин). В качестве альтернативы могут применяться цефалоспорины 3-го поколения (цефотаксим, цефтриаксон, цефтазидим или цефоперазон) или фторхинолоны (ципрофлоксацин, офлоксацин, пефлоксацин) в сочетании с антианаэробными средствами.
В последние годы в клинической практике появились антибактериальные средства, обладающие широким спектром в отношении аэробных грамположительных и грамотрицательных бактерий в сочетании с высокой антианаэробной активностью. К ним относятся защищенные антисинегнойные пенициллины (пиперациллин/тазобактам и тикарциллин/клавуланат) и карбапенемы (имипенем, меропенем). Наличие у этих препаратов аэробной и анаэробной активности позволяет применять их в режиме монотерапии при лечении тяжелых интраабдоминальных инфекций в ОИТ, в том числе при абдоминальном сепсисе. В многочисленных контролируемых исследованиях показано, что монотерапия указанными препаратами не уступает по эффективности стандартным схемам комбинированной терапии.
Полученные в зарубежных и отечественных исследованиях данные свидетельствуют о возможности проведения монотерапии тяжелых интраабдоминальных инфекций в ОИТ.
Приведенные рекомендации по антибактериальной терапии наиболее тяжелых инфекций позволяют оптимизировать лечение и улучшить прогноз больных в ОИТ. В то же время следует подчеркнуть, что представленные схемы терапии являются наиболее общими рекомендациями. Программа эмпирической антибактериальной терапии инфекций в ОИТ в конкретном медицинском учреждении должна разрабатываться и корректироваться на основании локальных данных о возбудителях и их чувствительности к антибиотикам.
Инфекции в ОРИТ представляют собой немаловажную проблему. Инфекционные осложнения в виде нозокомиалных инфекций занимают ведущее место, летальность при этом возрастает в несколько раз. С начала 60-х годов основными возбудителями данных инфекций стали и остаются таковыми по сегодняшний день грам-отрицательные бактерии [4, 18]. Их особенностью является высокая резистентность к антибактериальной терапии: нередки ассоциации двух и более микроорганизмов. Пациенты с тяжелыми внегоспитальными инфекциями, протекающими с системными расстройствами, также госпитализируются в ОРИТ, часто после длительной и безуспешной терапии в профильных отделениях. Поэтому в условиях ургентности, когда нет возможностей или времени на подбор антибиотика по результатам лабораторных тестов, необходим препарат с ультрашироким спектром действия, минимальной резистентностью к нему микроорганизмов, высокой биодоступностью и минимальными побочными эффектами.
Одной из возможных альтернатив являются бета-лактамные антибиотики - карбапенемы. Это имипенем/циластатин (Тиенам, MSD) и меропепем (Меронем, Zeneca). Спектр действия обоих препаратов охватывает большинство патогенных и условно патогенных микроорганизмов от грам-положитсльных кокков до анаэробов. При этом меропенем проявляет большую активность по сравнению с имипенсмом в отношении такого важного для ОРИТ возбудителя, как - Ps.aeruginosae, МПК90 - 4 мг/л против 8 мг/л [5, 7, 8, 10]. По некоторым данным, в РФ только 7% штаммов устойчивы к карбапенемам [7], в США 4,2% штаммов устойчивы к меропенему и 12,5% - к имипенему [17]. Отмечают, что некоторые штаммы, устойчивые к имипенему, сохраняют чувствительность к меропенему [8]. По североамериканским данным, 43% устойчивых к имипенему штаммов чувствительны к меропенему [17]. Возможно, это объясняется тем, что часть продуцируемых псевдомонадами бета-лактамаз, разрушающих имипенем, не влияет на меропепем [6], а с учетом того, что проницаемость клеточной стенки играет важную роль в резистентности данных микроорганизмов [19], меропенем, обладающий меньшей молекулярной массой, лучше пенетрирует клеточную мембрану. Устойчивых к карбапенемам штаммов Е.coli, Kl. pneumoniae в РФ не выделено [6].
В отношении других возбудителей нозокомиальных инфекций отмечают несколько большую активность имипенема в отношении Staph.aureus и Staph.spp., а также Streptococci [7, 10]; по другим данным, их активность идентична [5]. Есть данные, что МПК90 меропенема для стрептококков составляет 0,009-0,86 мг/л [10], а имепенема - 0,01-0,43 мг/л [8].
По анаэробам активность меропенема, например, в отношении клостридий и бактероидов в 4-8 раз выше активности имипенема [6, 8, 10, 15].
Enterococcus faecium и Xanthomonas maltophilia, продуцирующая хромосомные металлоэнзимы, устойчивы к обоим препаратам; впрочем, последний возбудитель является большой редкостью в ОРИТ [6, 8].
В отличие от других бета-лактамных антибиотиков карбапенемы индуцируют постантибиотический эффект в отношении грам-отрицатсльных палочек, причем меропенем оказывает гораздо более продолжительное действие на одни и те же микроорганизмы по сравнению с имипенемом [8]. Выраженный эффект in vitro описан для энтеробактерий, S.aureus, P.aeniginosaе, Acinetobacter, К.pneumoniae, В.fragilis [8].
По фармакокинетическим параметрам имипенем и меропенем существенно не различаются [6, 15]. Период полувыведения составляет около 1 ч, вне зависимости от введенной дозы. Выводятся почками (до 98%) - клубочковой фильтрацией и канальцевой секрецией, в виде неизмененного препарата и метаболитов. В отличие от имипенема, меропенем стабилен к действию почечной дегидропептидазы. При нарушении функции почек, а также у пожилых людей (старше 65 лет) наблюдается снижение общего и почечного клиренса и увеличение периода полувыведения, который при тяжелой почечной недостаточности достигает 7 ч [8, 10]. Отмечается высокая биодоступность; так, в перитонеальной жидкости концентрация меропенема составляет 60-220% содержания в плазме крови, в легочной паренхиме - 40% [10], в ликворе - 1-52%[10,16].
Учитывая спектр действия препаратов, их применение возможно при большинстве инфекций в ОРИТ. Инфекции нижних дыхательных путей, пневмонии, а в особенности - так называемые "респиратор-ассоциированные" пневмонии, занимают более 60% всех инфекций в ОРИТ [91]. Причем, именно здесь более всего наглядна некая "ступенчатость" антибактериальной терапии, начинающаяся с "профилактического" назначения пенициллинов в начале ИВЛ и заканчивающаяся селекцией мультирезистентных штаммов микроорганизмов [18]. Наиболее частыми возбудителями при инфекциях этой локализации в ОРИТ, по данным EPIC Study, являются Ps.aeruginosae (20,8%), S.aureus (17,l%) [9].
По другим, отечественным, данным, при "респиратор-ассоциированной" пневмонии, вызванной часто ассоциацией возбудителей, Ps.aeruginosae высевается в 78% случаев, S.aureus - в 30%, Proteus spp. - в 13%. При этом чувствительность выделенной флоры к цефалоспоринам III поколения (включая цефтазидим) составила 58,2%, к новым аминогликозидам - 65,8%, к полусинтетическим пенициллинам - 40% [1]. Карбапенемы показали высокую эффективность при терапии инфекций данной локализации. Клинический и микробиологический эффект достигает 71-81% при нозокомиальной флоре и 93-100% - при других патогенах [8, 10]. Эффект усиливается в комбинации с аминогликозидами [10].
Инфекции ЦНС представляют собой отдельную проблему. Здесь, кроме антибактериального спектра, необходимо учесть проникновение препарата через гематоэнцефаличсский барьер (ГЭБ), а также возможные побочные эффекты. До 80% бактериальных менингитов у взрослых вызывают S.pneumoniae, Н.influenzae и N.meningitidis [9, 11, 23]. Отдельная группа - это госпитальные менингиты, осложнения нейрохирургических вмешательств, вызванные чаще Ps.aeruginosa [12]. Кроме того, встречаются септические менингиты, возбудителем которых может быть любой микроорганизм. Стандартная терапия - это полусинтетические пенициллины, цефалоспорины III поколения с аминогликозидами. Однако, по данным исследований, в США более 25% штаммов S.pneumoniae устойчивы к пенициллинам и цефалоспоринам, а в Европе, по тем же данным, цифра превышает 35% [9, 11, 23]. Устойчивость Ps.aeruginosae оговорена выше. Поэтому в условиях ОРИТ карбапенемы могут являться препаратами выбора при бактериальных менингитах [9, 11, 16]. Однако отмечена высокая эпилептогенность имипенема [8, 10, 11], подтвержденная в эксперименте [15]. Меропенем не обнаруживает данных качеств. При назначении в дозе 20-40 мг/кг в спинномозговой жидкости создается концентрация до 6,5 мг/л [16], что более чем достаточно даже для Ps.aeruginosae. Однако концентрация в СМЖ в большой степени зависит от проницаемости ГЭБ, а последняя, в свою очередь, от возбудителя, терапии (например, назначение глюкокортикоидов, считающееся обязательным при менингите, вызванным Н.influenzae), и т. д. [16].
Кроме того, применение меропенема в высоких дозах значительно повышает стоимость терапии. У нас имеются собственные наработки по регионарной антибактериальной терапии менингитов путем круглосуточной интракаротидной инфузии препарата. Небольшие пока данные позволяют предположить, что возможна терапия меньшими дозами препарата при равной эффективности. Так, например, для терапии пневмококкового менингита, резистентного к пенициллинам и цефалоспоринам, оказались достаточными дозы 500-1000 мг/сут. При псевдомонадном же менингите после неэффективной терапии меропенемом в дозе 6 г/сут системно комбинация путей введения препарата (2 г/сут интракаротидно и 4 г/сут системно) привела к элиминации возбудителя [3].
Уроинфекции, причинами которых в ОРИТ могут быть нарушения пассажа мочи при нарушении иннервации мочевыводящих путей (травма ЦНС, оперативные вмешательства), восходящее ннфицирование при длительной катетеризации мочевого пузыря, являются серьезным осложнением в интенсивной терапии. Возбудителями оказываются самые различные микроорганизмы [9, 14]. При сопутствующей нефропатии или: почечной недостаточности резко снижается эффективность традиционных уросептиков ввиду снижения почечного клиренса. При применении карбапенемов, напротив, повышается количество препарата, выводимого в неизмененном, активном виде [10]. В одном многоцентровом сравнительном исследования [14] показано, что при серьезных уроинфекциях клиническая эффективность меропенема и имипенема составила - 99%, бактериологическая - 90 и 81% соответственно. Побочные эффекты в группе меропенема составили 8%, в то время как в группе имипенема - 12%.
Состояние пациентов в ОРИТ вводит особые требования к побочным эффектам медикаментозной терапии. Системные расстройства той или иной степени выраженности могут стать необратимыми при неизбежном или неучтенном действии препарата. Известна, например, выраженная нефротоксичность амниогликозидов, приводящая к ограничению применения этих высокоэффективных препаратов при сопутствующей нефропатии. Это же относится и к развитию геморрагического синдрома и гемолиза при назначении цефалоспоринов III поколения, особенно при совместном применении антикоагулянтов. Сульфаниламиды по количеству и выраженности побочных эффектов вообще могут считаться потенциально опасными для пациентов ОРИТ [10].
Необходимо остановиться на стоимости препаратов. При сравнении идентичных доз Меронем оказывается дороже Тиенама (26,8 USD против 18,7 USD). Однако в справочной литературе (VIDAL, 1998) и в инструкциях по применению препаратов указано, что при тяжелых инфекциях Тиенам применяется в максимальной дозе 4 г/сут, а Меронем, соответственно, в дозе 3 г/сут. Минимальные дозы составляют 2 и 1,5 г/сут соответственно. Такая же рекомендация содержится в ряде работ [7, 9, 13]. При фармакоэкономической оценке 10-дневных курсов антибиотикотерапии данными препаратами (Таблицы 1 и 2) видно, что курсовая стоимость терапии Меронемом существенно дешевле аналогичной терапии Тиенамом. При этом для одного введения может использоваться любая доза, так как меропенем стабилен в растворе до 48 ч в отличие от имипенема, раствор которого готовится ex tempore.
Таблица 1
Стоимость лечения (USD) при использовании максимальных дозировок карбапенемов.
| Препарат | Стоимость препарата | Стоимость введения | Итого | ||
| Доза 1,0 | Курс | Доза | Курс | ||
| Тиенам (0,5) | 37,40 | 1496,00 | 2,52 | 100,80 | 1596,80 |
| Меронем (1,0) | 42,90 | 1287,00 | 0,37 | 11,10 | 1298,10 |
| Разница стоимости лечения | 298,70 | ||||
Таблица 2
Стоимость лечения (USD) при использовании минимальных дозировок карбапенемов.
| Препарат | Стоимость препарата | Стоимость введения | Итого | ||
| Доза 1,0 | Курс | Доза | Курс | ||
| Тиенам (0,5) | 18,70 | 748,00 | 2,52 | 100,80 | 848,80 |
| Меронем (1,0) | 21,45 | 643,50 | 0,37 | 11,10 | 654,60 |
| Разница стоимости лечения | 194,20 | ||||
В заключений необходимо отметить, что карбапенемы - это мощное средство для борьбы с инфекцией в ОРИТ. Препараты во многом аналогичны, однако по ряду указанных выше свойств меропенем может иметь преимущество перед имипенемом в повседневной практике врача интенсивиста.
ЛИТЕРАТУРА
1. А.В. Боровик, В.А. Руднов. Нозокомиальная пневмония при проведении продленной искусственной вентиляции легких.// Вестн. интенс. терапии, 1995. - №2-3. - с.29-34.
2. Б.Р. Гельфанд, В.А. Гологорский, С.З. Бурневич и др. Абдоминальный сепсис: современный взгляд на нестареющую проблему, стратегия и тактике лечения.// Вестн. интенс. терапии. Меренем. - 1997.
3. О.Д. Незнамов, А.В. Куликов, В.В. Панов. Опыт интракаротидного применения меропенема при терапии вторичного гнойного менингита.// Здравоохранение сегодня. Воронеж, 1997. - №7. - с. 28.
4. Н.А. Семина, Л.С. Страчунский, Р.С. Козлов и др. Состояние антибиотикорезистентности грам-отрицательных возбудителей нозокомиальных инфекций в отделениях интенсивной терапии. Информационное письмо. - Смоленск, 1997.
5. С.В. Сидоренко, С.П. Резван и др. Сравнительная оценка меропенема и других антибиотиков в отношении возбудителей нозокомиальных инфекций.// Антибиотики и химиотерапия, 1998. - т. 43. - №1. - с. 4-14.
6. С.В. Сидоренко. Характеристика карбапенемовых антибиотиков: Материалы конференции "Карбапенемы в педиатрии". Москва, 1997. - с. 3-7.
7. Л.С. Страчунский, Р.С. Козлов и др. Проблемы выбора карбапенемовых антибиотиков в конце 90-х гг.// Клиническая фармакология и терапия, 1997. - 6(4). - с. 59-62.
8. С.М. Шатунов, Ю.Б. Белоусов. Меропенем.// Антибиотики и химиотерапия, 1996. - т. 41. - №6.
9. С.В. Яковлев. Клиническая химиотерапия бактериальных инфекций. Москва: Ньюдиамед-АО, 1997.
10. С.В. Яковлев, В. П. Яковлев. Меропенем - новый бета-лактамный карбапенемовый антибиотик для лечения тяжелых нозокомиальных инфекций.// Вестн. интенс. терапии. Меронем, 1997.
11. Bradiey J.S., Scheld W.М. Тhе Challenge of Penicillin Resistant Streptococcus pneumonlae Meningitis; Current Antibiotic Therapy in 1990s// Clinical Infectious Diseases, 1997. - v.24. - Suppl.2. - p. 213-222.
12. Chmelic V., Gutvirth J. Meropemem treatment of post-traumatic meningitis due to Ps.aeruginosae.// The Journal of Antimicrobial Chemotherapy, 1993.- v. 32. - №6. - p. 922-923.
13. Colardyn F., Faulkner K.L. Intravenous meropenem versus imipenem-cilastatin in the treatment of serious bacterial infections in hospitalized patients.// The Journal of Antimicrobial Chemotherapy, 1995.- v. 38. - №3. - p. 523-527.
14. Сох C.E., Holtoway W.J., Geckler R.W. A Multicenter Comparative Study of Meropenem and Imipenem/Cilastatin in Treatment of Complicated Urinary Tract infections in Hospitalized Patients// Clin. Infect. Diseases, 1995. - v. 21.- №1.- P.86-92.
15. Craig W.A. The Pharmacology of Meropenen, A New Carbapenem Antibiolic.// Clin. Int. Dis., 1997. - v. 24. - Suppl. 2. - p. 266-275.
16. Dagan R.,Velghe L, Rodda J.L. et al. Penetration of meropenem into the cerebrospinal fluid of patient with inflammed meninges.// The Journal of Antimicrobial Chemotherapy, 1994.- v.34. - №1. - p.175-179.
17. Iaconis J.P., Pitkin D.H., Waheed Sheikh et al. Comparison of Antibacterial Activities of Meropenem and Six Other Antibiotics Against Ps.aeruginosae isolates from North America Studies and Clinical Trials.// Clin. Int. Dis., 1997. - v.24. - Suppl 2. - p. 191-197.
18. Infection Reference Guide, v.2. Blackwell Science: 1997.- p.129-136.
19. Huizinga W.K.J., Warren B.L. et al. Antiblolic monotherapy with meropenem in the surgical management of intra-abdominal infections.// The Journal of Antimicrobial Chemotherapy, 1995. - v. 36. - Suppl. A. - p. 179-189.
20. Nakai Т. Multiantibiotic resistance caused by active drug extrusion In Pseudomonas aeruginosae and other Gram-negative bacteria.* nakae® is.ice.u-tokal.ac.jp.
21. Norrby S.R., Newell P.A. Faulkner K.L. et al. Safety profile of meropenem: international clinical experience based on the first 3125 patients treated with meropenem.// The Journal of Antimicrobial Chemotherapy. - v. 36. - Suppl. A. - p. 207-223.
22. Takeda К., Matsuno S., Sunamura M. et al. Continuous Regional Arterial infusion of Protease Inhibitor and Antibiotics In Acute Necrosing Pancreatitis.// American Journal Surgery. 1996. - v. 171. - №.4. - p. 394-396.
23. Tunkel A.R., Scheld W.M. Issues in Management of Bacterial Meningitis, it American Family Physician, 1997. - v. 56. - №5.
24. Sakata К., Hirai К., Itano S. et al. Evaluation of Treatment for Liver Abscess: Significance of Intra-Arterial Antibiotic Infection Therapy.// Clin. Ther, 1994. - v. 16. - №3. - p. 446-457.
25. Wilson S.E. Meropenem in the Treatment of Intra-Abdominal Infection: Review of the Clinical Trials.// Advances in Therapy, 1997. - v. 14. - №3.- P.110-115.
26. Wittmann D.H. Intra-Abdominal Infections. Pathophysiology and Treatment. - New York, 1991.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Нозокомиальная инфекция (от лат nosocomium - больница и греч nosokomeo - ухаживать за больным; синонимы: внутрибольничные инфекции, госпитальные инфекции, health care associated infection) - это любое клинически распознаваемое инфекционное заболевание, которое развивается у пациента в результате его обращения в больницу за лечебной помощью или пребывания в ней, а также любое инфекционное заболевание сотрудника больницы, развившееся вследствие его работы в этом учреждении, вне зависимости от времени появления симптомов (после или во время нахождения в больнице) - Европейское региональное бюро ВОЗ, 1979. Инфекции считают госпитальными, если они развиваются не менее чем через 48 ч после поступления в клинику (исключая те случаи, когда пациент поступает в лечебное учреждение в инкубационном периоде инфекционного заболевания, длительность которого более 48 ч).
К нозокомиальной инфекции относят и случаи, когда пациент повторно поступает в стационар с установленной инфекцией, явившейся следствием предыдущей госпитализации.
Нозокомиальные инфекции (НИ) - серьезная медико-социальная, экономическая и юридическая проблема в отделениях интенсивной терапии всего мира Частота их развития зависит от профиля и архитектурно-технических особенностей отделения, а также от адекватности программы инфекционного контроля и составляет в среднем 11%. Развитие инфекционных осложнений у пациента ОРИТ существенно повышает летальность, увеличивает длительность и стоимость стационарного лечения.
Распространённость нозокомиальных инфекций, связанных с применением различных инвазивных методик, рассчитывают по формуле:
Число случаев нозокомиальных инфекций за определенный период х 1000 - общее количество дней применения инвазивного устройства

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Код по МКБ-10
Нозологическая структура нозокомиальных инфекций в интенсивной терапии
- Нозокомиальная пневмония, в том числе связанная с проведением ИВЛ.
- Нозокомиальный трахеобронхит.
- Инфекции мочевыводящих путей.
- Ангиогенные инфекции.
- Интраабдоминальные инфекции.
- Инфекции области хирургического вмешательства.
- Инфекции мягких тканей (целлюлит, постинъекционные абсцессы, инфицированные пролежни).
- Нозокомиальный синусит.
- Нозокомиальный менингит.
- Источники внутрибольничного инфицирования пациентов ОРИТ.
- Эндогенный источник (~4/5) - микрофлора больного, имевшаяся до поступления и приобретенная в стационаре
- кожа, зубы, носоглотка, придаточные пазухи носа, ротоглотка, ЖКТ, мочеполовая система, альтернативные очаги инфекции.
- медперсонал, другие пациенты, медицинское оборудование, инструменты, предметы ухода, воздух, контаминированные аэрозоли и газы, нестерильные катетеры и шприцы, вода и пищевые продукты.
Возбудители, населяющие экзогенный и эндогенный резервуары, находятся в динамическом взаимодействии. Инфекция, вызванная прорывом возбудителя из эндогенного источника у одного пациента, может привести к вспышке нозокомиальной инфекции в отделении вследствие перекрестного заражения. Это явление заключается в передаче возбудителя от одного пациента к другому через промежуточный резервуар, которым служит медицинское оборудование, предметы ухода, руки и перчатки медперсонала. В литературе есть указания на роль мобильных телефонов и фонэндоскопов в распространении госпитальной микрофлоры.
Большое значение в патогенезе нозокомиальной инфекции играет транслокация условнопатогенных бактерий из ЖКТ. Под влиянием хирургического стресса, травм, нарушений гемодинамики, метаболизма и при других патологических состояниях развивается ишемия кишечника, ведущая к повреждению энтероцитов и нарушению его моторной, секреторной и барьерной функций. Происходит ретроградное заселение верхних отделов ЖКТ патогенными микроорганизмами, а также транслокация бактерий и их токсинов в портальный и системный кровоток.
Полисистемный бактериологический анализ у больных ОРИТ подтвердил, что динамика контаминации брюшной полости, ЖКТ, кровяного русла, мочевыводящих путей, а также легочной ткани зависит от морфофункциональной недостаточности кишечника.
Микробиологическая структура нозокомиальной инфекции в ОРИТ
- Грамположительные бактерии
- S aureus,
- CoNS,
- энтерококки.
- Enterobacteriaceae (E. coli, К. pneumoniae, Proteus spp, Enterobacter spp, Serratia spp),
- неферментирующие бактерии (Pseudomonas spp, Acinetobacter spp, Xanthomonas maltophilia),
- анаэробы (Bacteroides spp, Clostridium difficile).
- Candida spp,
- Aspergillus spp.
- вирусы гепатита В и С,
- ВИЧ,
- вирус гриппа,
- респираторный синцитиальный вирус,
- вирус герпеса.
- Legionella spp,
- М. tuberculosis,
- Salmonella spp.
При лечении внутрибольничных инфекций следует различать эмпирическую и этиотропную терапию.
Получение образца крови из катетера не производят, за исключением тех случаев, когда есть подозрение на катетер-ассоциированную инфекцию. Забор крови осуществляют до назначения противомикробных средств. Если же антибактериальную терапию уже проводят, кровь забирают перед очередным введением (приемом) препарата.
Основные механизмы развития катетер-ассоциированных ангиогенных инфекций
- колонизация наружной поверхности катетера с последующей миграцией из пространства между катетером и кожей к внутреннему (внутрисосудистому) концу катетера,
- колонизация коннектора с последующей миграцией по внутренней поверхности катетера.
Ведущим элементом патогенеза инфекции катетеров, имплантатов и протезов считают формирование бактериальных биопленок Среди клинически значимых бактерий способность образовывать биопленки установлена для представителей семейства Enterobactenaceae, Staphylococcus spp., Streptococcus spp., Enterococcus spp., Actinomyces spp., Pseudomonas spp. и Haemophilus spp.
Возбудители ангиогенной инфекции S. aureus, CoNS, Enterococcus spp, E. coli, К pneumoniae, грибы.
В настоящее время коагулазонегативные стафилококки вызывают до четверти всех ангиогенных инфекций, тогда как в прошлом эти микроорганизмы рассматривали только как контаминанты. Это не только микробиологический феномен или следствие плохой асептики. Свою патогенность этот сапрофит смог проявить лишь в условиях всё усугубляющейся, характерной для современной жизни иммунодепрессии и нарастающих экологических последствий широкого применения антибиотиков.
![trusted-source]()
[11], [12], [13], [14], [15], [16], [17], [18], [19]
Внутрибольничные инфекции мочевыводящих путей
Источники и пути инфицирования мочевыводящих путей
До 80% всех внутрибольничных инфекций мочевыводящих путей связаны с использованием мочевых катетеров и инструментальными вмешательствами на мочевыводящих путях. Наиболее частые причины проникновения бактерий в мочевой пузырь у больных с уретральным катетером
- несоблюдение правил асептики при установке катетера,
- разъединение катетера и дренажной трубки,
- контаминация во время промывания мочевого пузыря,
- колонизация дренажного мешка и ретроградное поступление контаминированной мочи в мочевой пузырь.
Диагностические критерии внутрибольничной уроинфекции
- лихорадка >38 °С, лейкоцитоз, протеинурия, цилиндрурия, нарушение функции почек,
- лейкоцитурия или пиурия (>10 лейкоцитов в 1 мм 3 ),
- выделение возбудителя при количественном микробиологическом исследовании мочи в титре >10 5 КОЕ/мл.
Мочу получают с помощью катетеризации мочевого пузыря стерильным уретральным катетером с соблюдением правил асептики и немедленно направляют в микробиологическую лабораторию.
При таком диагностическом подходе инфекции мочевыводящих путей регистрируют у 3,7% пациентов ОРИТ.
Возбудители внутрибольничной уроинфекции Е. coli, Klebsiella spp., Proteus spp., Enterococcus spp., Enterobacter spp., Staphylococcus spp., Acinetobacter spp., грибы рода Candida.
![trusted-source]()
[20], [21], [22], [23], [24], [25], [26], [27]
Антибактериальные препараты для лечения внутрибольничных инфекций мочевыводящих путей
![trusted-source]()
[28], [29], [30], [31], [32], [33], [34], [35], [36]
Острый неосложненный цистит
- фторхинолоны внутрь (левофлоксацин, пефлоксацин, офлоксацин, ципрофлоксацин),
- фосфомицин, трометамол
![trusted-source]()
[37], [38], [39], [40], [41], [42], [43], [44],
Пиелонефрит у пациентов ОРИТ
- цефтазидим,
- цефоперазон,
- цефепим,
- карбапенемы,
- фторхинолоны внутривенно.
Длительность лечения - не менее 14 дней с обязательным бактериологическим контролем.
Нозокомиальные инфекции области хирургического вмешательства
Ведущим возбудителем раневой внутрибольничной инфекции остаётся S. aureus, CoNS наиболее часто вызывают посттрансплантационные инфекции, Е. coli и другие представители семейства Enterobacteriaceae - доминирующие возбудители в абдоминальной хирургии и инфекциях в акушерстве и гинекологии.
Нозокомиальные интраабдоминальные инфекции
Выделяют следующие инфекции:
- послеоперационный вторичный перитонит,
- третичный перитонит,
- нарушения мезентериального кровообращения (ишемия/инфаркт),
- акалькулезный холецистит,
- инфицированный панкреонекроз,
- перфорации ЖКТ (язвы, опухоли),
- псевдомембранозный колит, связанный с применением антибиотиков.
В микробиологической структуре нозокомиальных интраабдоминальных инфекционных осложнений преобладают грамотрицательные микроорганизмы (63,8%), из которых наиболее часто выделяют Acinetobacter baumanu (12,8%), Pseudomonas aeruginos и E. coli (no 10,6%). Грамположительная микрофлора представлена различными штаммами Enterococcus spp. (19,2%), Staphylococcus aureus - 10,6% (80% выделенных золотистых стафилококков резистентны к оксациллину). Этиологическая структура нозокомиальных интраабдоминальных инфекций доказывает их типичный госпитальный характер. Преобладают внутрибольничные патогены, в то время как при внебольничных интраабдоминальных инфекциях наиболее значимую этиологическую роль играют эшерихии, протеи и бактероиды.
Препараты для лечения псевдомембранозного колита, вызванного С. difficile
- метронидазол (внутрь),
- ванкомицин (внутрь)
Профилактика внутрибольничных инфекций
Качественные программы профилактики нозокомиальной инфекции, основанные на доказательных данных, способны снизить частоту их развития, длительность пребывания больных в стационаре и стоимость лечения. Доля нозокомиальных инфекций, развитие которых можно предотвратить путем проведения мероприятий инфекционного контроля, составляет от 20 до 40% Мероприятия инфекционного контроля должны иметь приоритетное финансирование.
Необходимо соблюдение следующих принципов:
- подготовка персонала,
- эпидемиологический контроль,
- прерывание механизмов передачи инфекции,
- устранение факторов угнетения противоинфекционной защиты больного (экзогенных и эндогенных).
Профилактика нозокомиальных инфекций
Перегруженность отделений, концентрация в ОРИТ больных с инфекциями, нехватка площадей и персонала
Изоляция пациентов с НИ, создание отдельных сестринских постов
Строгое соблюдение правил антисептической гигиены рук
Применение стерильных перчаток
Применение высокоэффективных антисептиков
Предпочтительное использование одноразовых расходных материалов
Стерилизация и дезинфекция высокого уровняСелекция высокорезистентных штаммов возбудителей в условиях широкого применения антимикробных препаратов (селективное давление антибиотиков)
Создание службы инфекционного контроля в стационаре (клиницисты + аптеки + материально-ответственные лица)
Выработка внутрибольничных протоколов и формуляров
Тщательный локальный микробиологический мониторинг Обеспечение адекватной стартовой терапии тяжелых инфекций (деэскалационная эмпирическая терапия)
Адекватное дозирование антибиотиков, при необходимости - мониторинг плазменной концентрации
Соблюдение сроков проведения антибактериальной терапии Исключение неэффективных препаратов Ротация антибиотиковСКН, транслокация микробов и их токсинов у больных в критических состояниях
Селективная деконтаминация ЖКТ у больных с высоким риском развития НИ Показания
распространенный перитонит, тяжелый сепсис и ПОН (любой этиологии),
панкреонекроз, пересадка печениВысокая вероятность прорыва грибковой микрофлоры из эндогенных экотопов у больных в критических состояниях
Профилактика системного кандидоза Показания
панкреонекроз и оперативные вмешательства на поджелудочной железе,
перфорация толстой кишки
несостоятельность анастомозов ЖКТ,
постспленэктомический синдром,
длительная (>7 сут) ИВЛ,
длительное парентеральное питание,
ПОН
иммунодепрессивные состояния (в частности, длительная глюкокортикоидная терапия)Интубация трахеи и ИВЛ
Катетеризация сосудов строго по показаниям и соблюдение сроков катетеризации
Соблюдение контактных мер предосторожности во время установки катетера (стерильные перчатки халат маска, обкладывание стерильным бельем)
Обеспечение максимальной стерильности в месте катетеризации
Применение современных антисептиков с доказанной эффективностью для обработки рук медперсонала, кожи пациента инъекционных портов
Тщательный уход за местом введения катетера (адекватная обработка кожи, предотвращение скопления влаги, стерильная повязка - марлевая или прозрачная полупроницаемая наклейка, ежедневная пальпация места катетеризации или наблюдение через прозрачную наклейку)
Немедленная смена инфузионных систем после переливания компонентов крови и жировых эмульсийКонтроль качества инфузионных сред
При отсутствии признаков инфекции не проводить рутинную замену центрального венозного катетера
В случае развития инфекции не выполнять замену катетера по проводнику (менять место катетеризации)
Подкожная туннелизация катетера у пациентов из группы высокого
Проводить замену катетеров, установленных в неотложной ситуации без полного соблюдения правил асептики и антисептики сразу по стабилизации гемодинамики пациента, но не позднее 48 чОбучение персонала методикам катетеризации
Катетеризация мочевого пузыря только по строгим показаниям
Строгое соблюдение правил асептики и антисептики при катетеризации
Прерывистая катетеризация
Использование закрытых дренажных систем
Обеспечение свободного тока мочи
Своевременная замена катетера
Отказ от рутинного промывания дренажной системы и мочевого пузыряПеред обработкой антисептиком следует очищать операционное поле моющим средством
Для подготовки кожи операционного поля следует использовать антисептики с доказанной эффективностью
Следует адекватно контролировать уровень глюкозы у всех пациентов с диабетом особенно избегая гипергликемии в периоперационный период
Периоперационную антибактериальную профилактику следует назначать только по показаниям с учетом риска развития инфекционных осложнений и выбирать препарат для ее проведения, основываясь на его активности против наиболее распространенных возбудителей инфекций области операции при конкретных вмешательствах и на опубликованных рекомендациях
Хирургические аспекты профилактики инфекции области операции эффективный гемостаз, предупреждение гипотермии,Внутрисосудистые / внутрисердечные катетеры и имплантаты
Обучение персонала правилам работы с катетерами, приборами и уходу за ними, периодическая оценка знаний правил асептики и антисептики, навыков катетеризации и ухода за катетерами
Организационные и санитарно-гигиенические мероприятия, необходимые для профилактики различных видов нозокомиальной инфекции:
Читайте также:

