Объем инфузионной терапии при отравлении
Обновлено: 24.04.2024
Кровопотеря – скорее, правило, нежели исключение при тяжелых травмах, любых оперативных вмешательствах, в травматологии и ортопедии, при остром или хроническом заболевании. В патогенезе развития синдрома острой кровопотери принято выделять три основных фактора:
1) уменьшение объема циркулирующей крови (ОЦК) – это критический фактор для поддержания стабильной гемодинамики и системы транспорта кислорода в организме) ;
2) изменение сосудистого тонуса;
3) снижение работоспособности сердца.
В ответ на острую кровопотерю в организме больного развивается комплекс ответных компенсаторно-защитных реакций универсального характера. Патогенетическая роль гиповолемии в развитии тяжелых нарушений гомеостаза предопределяет значение своевременной и адекватной коррекции волемических нарушений и ее влияние на исходы лечения больных отделений реанимации. Невозможно представить высокий уровень медицинской помощи тяжело больному пациенту без проведения инфузионной терапии.
Различные растворы для инфузий используются на всех этапах оказания медицинской помощи: от догоспитального до отделения интенсивной терапии и реанимации. Вместе с тем эффективность инфузионной терапии во многом зависит от фармакологических свойств препарата и патогенетически обоснованной программы.
Острая кровопотеря приводит к выбросу надпочечниками катехоламинов, вызывающих спазм периферических сосудов и уменьшение объема сосудистого русла, что частично компенсирует возникший дефицит ОЦК. Централизация кровообращения позволяет временно сохранить кровоток в жизненно важных органах и обеспечить поддержание жизни при критических состояниях. Однако впоследствии этот компенсаторный механизм может стать причиной развития тяжелых осложнений острой кровопотери. Спазм периферических сосудов вызывает серьезные расстройства кровообращения в микроциркуляторном русле; это в свою очередь приводит к возникновению гипоксемии и гипоксии, накоплению недоокисленных продуктов метаболизма и развитию ацидоза, что и обусловливает наиболее тяжелые проявления геморрагического шока.
Острая кровопотеря остается главным показанием к проведению интенсивной терапии, направленной прежде всего на восстановление системной гемодинамики. Патогенетическая роль снижения ОЦК в развитии тяжелых нарушений гомеостаза предопределяет значение своевременной и адекватной коррекции волемических нарушений на исходы лечения больных с острой массивной кровопотерей. В этой связи инфузионно-трансфузионной терапии принадлежит ведущая роль в восстановлении и поддержании адекватного гемодинамическим запросам ОЦК, нормализации реологических свойств крови и водно-электролитного баланса.
По современным представлениям, эффективная инфузионная терапия включает следующие этапы:
I этап – восполнение объема циркулирующей крови (ОЦК) и интерстициальной дегидратации;
II этап – коррекция дисгидрий, дезинтоксикация, коррекция водно-электролитных нарушений;
III этап – энергетически-пластическое обеспечение.
Поддержание циркуляторного гомеостаза во время операции – одна из важнейших задач анестезиологии. Довольно эффективным методом ОЦК при острой кровопотере может быть изо- или гиперволемическая гемодилюция синтетическими плазмозаменителями [1].
Появление в клинической трансфузиологии плазмозаменителей на основе гидроксиэтилкрахмала (ГЭК) сделало возможным повысить эффективность инфузионно-трансфузионной терапии, так как эти препараты при внутривенном введении не вызывают выброса гистамина [2], мало влияют на свертывающую и антисвертывающую систему крови, практически не вызывают аллергических реакций и не нарушают иммунные реакции [3].
Синтетические коллоидные плазмозамещающие препараты делятся:
· на производные желатина;
· декстраны – среднемолекулярные с мол. массой 60-70 кДа, низкомолекулярные с мол. массой 40 кДа;
· производные гидроксиэтилированного крахмала (ГЭК) – высокомолекулярные с мол. массой 450 кДа; среднемолекулярные с мол. массой около 200 кДа; среднемолекулярные с мол. массой 130 кДа.
Желатин – это денатурированный белок, выделяемый из коллагена, основная часть которого выводится почками, небольшая доля расщепляется пептидазами или удаляется через кишечник. Внутривенное введение раствора желатина приводит к увеличению диуреза, но не вызывает нарушений функции почек даже при повторном введении. Плазмозамещающие средства на основе желатина оказывают относительно слабое влияние на систему гемостаза; имеют ограниченную продолжительность объемного действия, что обусловлено их молекулярной массой.
Плазмозамещающие средства на основе ГЭК интенсивно применяются в реанимации, на этапах лечения больных с геморрагическим, травматическим, септическим и ожоговым шоками, когда имеют место выраженный дефицит ОЦК, снижение сердечного выброса и нарушение транспорта кислорода.
Инфузионные растворы на основе ГЭК производятся путем частичного гидролиза амилопектина, входящего в состав кукурузного или картофельного крахмала, до заданных параметров молекулярной массы с последующим гидроксиэтилированием. Основными параметрами, отражающими физико-химические свойства препаратов на основе ГЭК, являются молекулярная масса, молекулярное замещение, степень замещения. Величина молекулярного замещения является основным показателем, отражающим время циркуляции ГЭК в сосудистом русле. Период полувыведения препарата со степенью замещения 0, 7 составляет около двух суток, при степени замещения 0, 6 – 10 часов, а при степени замещения 0, 4-0, 55 – еще меньше. Молекулярная масса различных растворов ГЭК представлена, например, такими препаратами, как Рефортан 6 % со средней молекулярной массой 200 кД, молекулярным замещением 0, 5, осмолярностью 300 мОсм/л, коллоидно-осмотическим давлением (КОД) 28 мм рт. ст. и рН раствора 4, 0-7, 0; Стабизол 6 % со средней молекулярной массой 450 кД, молекулярным замещением 0, 7 осмолярностью 300 мОсм/л, КОД 18 мм рт. ст. и рН раствора 4, 0-7. Чем меньше молекулярная масса и молекулярное замещение, тем меньше время циркуляции препарата в плазме. Данное обстоятельство следует учитывать при выборе конкретного препарата на основе ГЭК для проведения целенаправленной инфузионной терапии. Одной из причин длительной задержки ГЭК в сосудистом русле считается его способность образовывать комплекс с амилазой, вследствие чего получается соединение с большей относительной молекулярной массой. Характерно, что осмолярность растворов ГЭК составляет в среднем 300-309 мОсм/л, а значения КОД для 10 % и 6 % растворов крахмала равны 68 и 36 мм рт. ст. соответственно, что в целом делает эти растворы более предпочтительными для возмещения дефицита ОЦК.
В последнее время вызывает значительный интерес группа препаратов для так называемой малообъемной реанимации. Это комбинированные препараты на основе 7, 5 % гипертонического раствора натрия хлорида и коллоидных препаратов – гидроксиэтилкрахмала или декстрана. При однократном внутривенном струйном введении гипертонический раствор натрия хлорида увеличивает ОЦК путем перемещения интерстициальной жидкости в сосудистое русло. Немедленный волемический эффект (не менее 300 %) продолжается не более 30-60 минут, снижаясь до 20 % первоначального. Введение коллоидов в гипертонический раствор натрия хлорида удлиняет продолжительность волемического эффекта.
В настоящее время достаточно большое внимание уделяется изучению влияния различных плазмозамещающих растворов на гемодинамику, компенсацию волемических нарушений, показатели системы гемостаза при проведении инфузионной коррекции острой гиповолемии при различных критических состояниях.
Клиническое исследование, проведенное с целью оценки эффективности коллоидных плазмозамещающих растворов на основе декстрана и гидроксиэтилкрахмала в коррекции синдрома острой гиповолемии у пострадавших с тяжелой сочетанной травмой, сопровождающейся травматическим шоком, продемонстрировало высокую эффективность применения плазмозаменителей на основе ГЭК в сравнении с декстраном полиглюкином.
Хотя стабилизация гемодинамических, волемических и гемоконцентрационных показателей у всех пострадавших начиная с первых суток оказания хирургической помощи и интенсивной терапии была однонаправлена и не носила критического характера, “цена” достижения их адекватного уровня в исследуемых группах была различной. При использовании полиглюкина объем и сроки инфузий СМП, гемотрансфузий были в 1, 5-2 раза больше, чем при применении коллоидных растворов 6 % и 10 % Рефортана, что значительно повышает риск осложнений инфузионно-трансфузионной терапии и увеличивает материальные затраты. Это обусловлено выявленными при исследовании позитивными свойствами ГЭК улучшать перфузию тканей, увеличивать доставку и потребление кислорода тканями, обеспечивать стойкий волемический эффект (волемический эффект Стабизола 6 % и Рефортана 6 % составляет 100 %, Рефортана 10 % – 140 %; продолжительность объемного действия соответственно 3-4 и 5-6 ч; КОД – 28 мм рт. ст. ; суточная доза Стабизола 6 % составляет 20 мл/кг, Рефортана 6 % – 33 мл/кг, Рефортана 10 % – 20 мл/кг). Все это не только повышает безопасность инфузионной терапии, включающей растворы ГЭК, но и расширяет возможности реализации больших объемов с высокой скоростью введения, особенно показанной при неотложных состояниях и в экстремальных условиях [4].
Эффективность коллоидных плазмозамещающих растворов на основе декстрана и ГЭК в коррекции синдрома острой гиповолемии подтверждена у 127 тяжело пострадавших (возраст от 22 до 57 лет). Частота 1, 2 и 3-й степени тяжести шока составила 10, 30 и 50 % соответственно. Тяжесть состояния пострадавших по APACHE II – 19-21 балл.
Величина общей кровопотери, включая травму и оперативное вмешательство, у всех обследованных пострадавших составила в среднем 38, 5 ± 1, 9 % ОЦК (29, 2 ± 3, 7 мл/кг). Объем ИТТ превышал объем кровопотери в 2-2, 5 раза. Методы исследования включали оценку гемодинамического профиля, объема циркулирующей крови, гемоконцентрационных показателей, кислородно-транспортной функции крови, показателей гемостаза.
В зависимости от состава программы ИТТ пострадавшие были рандомизированы на две группы. Контрольную группу составили 63 больных. Программа ИТТ, с учетом операционного периода, в первые сутки включала полиглюкин 971, 4 ± 80, 7 мл (23, 9 % от общего объема), растворы кристаллоидов 2060, 5 ± 55, 4 мл (53, 2 %), эритроцитную массу 833, 4 ± 67, 3 мл (22, 9 %). В последующие 2-3 суток послеоперационного периода объем инфузий полиглюкина в среднем составил 784, 3 ± 53, 9 мл в сутки, эритроцитной массы – 875, 5 ± 49, 3 мл в сутки (3-4 дозы). Соотношение эритроцитной массы, коллоидов и кристаллоидов – 1: 1: 2.
Во 2-й группе (основная – 65 больных) инфузионно-трансфузионную терапию проводили в первые сутки (включая интраоперационную инфузию) с применением 10 % раствора ГЭК (Рефортан ГЭК 10%) 1245, 5 ± 52, 5 мл (32, 4 % от общего объема ИТТ), растворов кристаллоидов 1755, 8 ± 80, 8 мл (46, 3 %), эритроцитной массы 505, 1 ± 48, 3 мл (13, 9 %). В последующем на 2-3 сутки объем инфузий 6 % ГЭК (Рефортан ГЭК 6%) составил 987, 8 ± 65, 8 мл в сутки, эритроцитной массы – 369, 7 ± 84, 3 мл в сутки (1-2 дозы). Соотношение эритроцитной массы, коллоидов и кристаллоидов – 1: 2: 3.
В обеих группах с 5-х по 7-е сутки использование синтетических коллоидов осуществлялось по показаниям. Как правило, со 2-3 суток в программу инфузионной терапии включали растворы для парентерального питания. Как показал анализ показателей гемодинамики, во всех исследуемых группах артериальное давление (АД) и частота сердечных сокращений (ЧСС) изменялись в первые часы после травмы. Так, АД снижалось до 80-90/50-60 мм рт. ст. , а ЧСС возрастала до 120-130 уд. в минуту. После окончания операции и на всех этапах исследования эти показатели быстрее восстанавливались во второй группе по сравнению с первой. Начиная с первых суток послеоперационного периода в группе 2 показатели гемодинамики стабилизировались в пределах 115-120/70-80 мм рт. ст. , пульс 84-86 уд. в минуту. В то же время у пострадавших группы 1 нормализация показателей гемодинамики происходила медленнее. Так, АД оставалось в пределах 100-110/60-65 мм рт. ст, ЧСС – 100-110 в минуту до 3-х суток и только к 5-7 суткам достигало уровня 117-120/70-75 мм рт. ст. при урежении ЧСС до 84-86 уд.
Известно, что величина кровопотери, в равной мере дефицит ОЦК и нарушения гемодинамики не имеют между собой четкой корреляционной зависимости в силу компенсаторных возможностей организма. Артериальное давление начинает снижаться при потерях более 20-25 % ОЦК. Следовательно, стабилизация гемодинамических показателей в более короткие сроки у пострадавших 2-й группы по сравнению с 1-й группой дает возможность оценить степень компенсации кровообращения у тяжело пострадавших при имеющемся волемическом состоянии, а значит, в определенной степени судить об адекватности, эффективности и преимуществах инфузионной терапии ГЭК.
Результаты исследований ОЦК и ее компонентов показали, что в первые часы после травмы у всех обследованных пострадавших дефицит ОЦК составил 19-21% как за счет ГО (42-43 %), так и ОП (5-7 %). При этом показатели гемоглобина были в пределах 80-90 г/л, гематокрита – 29-30 %, количество эритроцитов на уровне 3, 02-3, 15 × 1012/л. (табл. 1, 2).
В первые сутки после операции на фоне проводимой ИТТ в группе 2 отмечено повышение ОЦК до 64-67 мл/кг, ГО – до 23-26 мл/кг, гемоглобина – до 110-120 г/л, гематокрит увеличился до 34-37 %, а количество эритроцитов – до 3, 11-3, 42 × 1012/л. В последующем было выявлено постепенное увеличение волемических и концентрационных показателей к 7 суткам: ОЦК до 67-68мл/кг, ГО – 25-26мл/кг, гемоглобина – 115-121 г/л, гематокрита – 35-37 %, количества эритроцитов – 3, 54-3, 67 × 1012/л (р
В группе 1 в первые сутки после операции также отмечено повышение ОЦК до 64- 66 мл/кг, ГО – 24-25 мл/кг, гемоглобина – 106-116 г/л, гематокрит увеличился до 33, 5-34, 8 %, а количество эритроцитов – до 3, 49-3, 56 × 1012/л.
Таким образом, полученные нами результаты свидетельствуют, что в послеоперационном периоде на фоне избранной тактики возмещения кровопотери изменения ОЦК и ГО носили однонаправленный характер. Однако в поэтапном уменьшении их дефицита между группами имеются определенные различия. Если к 7-м суткам в группе 2 дефицит ОЦК не превышал 10 %, а ГО – 17 %, то в группе 1 эти показатели были равны соответственно 14 % (ОЦК) и 20 % (ГО). Отмеченные особенности в группе 2 со стороны ОЦК и ГО прослеживаются и при сравнении показателей гемоглобина, гематокрита, количества эритроцитов. Можно предположить, что ИТТ в 1 группе была неадекватна как по объему, так и по составу. Однако, анализируя проведенную инфузионно-трансфузионную терапию, видно, что в обеих группах объем кровопотери восполнен с превышением в 2-2, 5 раза. Кроме того, в течение 7 суток после операции объем инфузий эритроцитной массы, белковых препаратов, плазмы в группе 1превышал таковые в группе 2 в 1, 5-2 раза. Вместе с тем, волемические и гемоконцентрационные показатели у пострадавших группы 1оставались ниже, чем в группе 2 даже на 7 сутки.
Кроме этого, известна способность коллоидных плазмозамещающих растворов снижать общий белок после переливания рефортана на 25, 8 %. Восполнение операционной кровопотери Стабизолом при брюшнополостных операциях в объеме 16-20 % к ОЦК вызывает достоверное. Влияние Рефортана на свертывающую систему крови во время операции и через 24 часа после ее окончания представлена в табл. 4.
Проведенное рандомизированное исследование по оценке эффективности коррекции синдрома острой гиповолемии у реаниматологических больных синтетическими коллоидными растворами продемонстрировало высокую эффективность применения плазмозаменителей на основе гидроксиэтилкрахмала в сравнении с принятым на табельном оснащении декстраном. При его использовании объем и сроки инфузий свежезамороженной плазмы, гемотрансфузий были в 1, 5-2 раза больше, чем при применении коллоидных растворов, что значительно повышает риск осложнений инфузионно-трансфузионной терапии и увеличивает материальные затраты. Это обусловлено, выявленными при исследовании, позитивными свойствами гидроксиэтилкрахмала улучшать перфузию тканей, увеличивать доставку и потребление кислорода тканями, обеспечивать стойкий волемический эффект.
Разработка и производство новых инфузионных растворов на основе ГЭК дало новые возможности оптимизировать инфузионную терапию у больных в критических состояниях и создали выгодную альтернативу компонентам крови. Коллоидные плазмозамещающие препараты на основе ГЭК в изотоническом растворе хлорида натрия Рефортан и Стабизол обладают выраженным гемодинамическим эффектом, поддерживают среднединамическое артериальное давление, сохраняя при этом нормодинамический тип кровообращения. Инфузия этих препаратов в объеме 15-20 мл/кг массы тела существенно не влияет на показатели свертывающей и антисвертывающей системы крови. Все это не только повышает безопасность инфузионной терапии, включающей растворы ГЭК, но и расширяет возможности реализации больших объемов с высокой скоростью введения, особенно показанной при неотложных состояниях и в экстремальных условиях.
2. Asskali F. , Fix F. U. , Hoos J. , Fo rster H. , Dudziak R. Histaminfreisetzug nach i. v. Applikation von Hydroxyethylsta rke unter Verwendungeines empfind-lichen und spezifischen Nachweises bei Probanden und Patienten // Der Anaesthesist. 1987. Bd. 36. S. 243.
3. Maurer P. H. , Berardinelli B. Immunologic studies with hydroxyethyl-starch (HES). A proposed plasma expander // Transfusion. 1986. V. 8. P. 265. 4. Шестопалов А. Е. , Пасько В. Г. Объемзамещающая терапия острой кровопотери
у пострадавших с тяжелой сочетанной травмой // Трудный пациент. 2005. № 4. С. 7-11.
Принципы и задачи поддерживающей инфузионной терапии. Расчет энергозатрат
Принципы поддерживающей терапии лежат в основе всех видов инфузионной терапии у детей. В целом они заключаются в том, что правильно проведенная поддерживающая терапия должна в точности компенсировать потери жидкости и воды (в состоянии покоя и нормотермии), тем самым сохраняя нормоволемию.
Объем вводимой жидкости рассчитывается таким образом, чтобы получить мочу с осмолярностью 280—310 мосм/л (то есть изотоничную) и удельным весом 1,010, не перенапрягая при этом почечные компенсаторные механизмы. Поддерживающая терапия подбирается исходя из уровня энергозатрат. Холидей и Сигар обнаружили, что суточные энергозатраты у детей можно приблизительно рассчитать по формуле: 100 ккал/кг для первых 10 кг + 50 ккал/кг для следующих 10 кг (до 20 кг) + 20 ккал/кг для следующих 60 кг (до 80 кг).
Потребность в воде составляет 100 мл на 100 ккал (помимо метаболической и поступающей с пищей воды), поэтому по этой же формуле можно рассчитать и объем поддерживающей инфузионной терапии. Например, для ребенка весом 14 кг объем поддерживающей терапии составляет 1000 мл (для первых 10 кг) + 50 мл/кг (для следующих 4 кг), что составляет 1200 мл/сут и соответствует энергозатратам 1200 ккал/сут. Аналогично рассчитывается и почасовая скорость введения жидкости: 40 мл/ч для первых 10 кг + 2 мл/кг/ч для следующих 4 кг, итого — 48 мл/ч.
У больных весом более 80 кг соотношение между весом и потребностями в воде отличается и применение данной формулы может дать завышенные результаты.
Стандартная поддерживающая инфузионная терапия возмещает только потери жидкости при испарении через легкие и кожу (так называемые скрытые потери), атакже через почки и ЖКТ. Однако в патологии возможны и другие пути потери воды и электролитов, называемые выходом в третье пространство. В таких случаях объем поддерживающей терапии увеличивают.

Потери воды с испарением через кожу и легкие называют скрытыми потерями, так как их объем сложно оценить. Около 2/3 скрытых потерь составляют потери через кожу, а 1/3 — через легкие. Испарение через легкие и дыхательные пути является одним из механизмов теплоотдачи и увлажнения вдыхаемого воздуха. Испарение с поверхности кожи также служит важнейшим механизмом теплоотдачи (надо отметить, что вода выделяется на поверхность кожи не только путем потоотделения). В обычных условиях на восполнение скрытых потерь приходится около трети объема поддерживающей инфузионной терапии.
Они выше у новорожденных (около 40%), ниже у подростков (около 25%) и существенно зависят от температуры и влажности окружающей среды. Скрытые потери увеличены при гипертермии, тахипноэ, нахождении вблизи источника тепла (в частности, обогревателя), а также в условиях сухой и жаркой окружающей среды. При температуре тела выше 38°С скрытые потери возрастают с каждым градусом на 12,5%. И, наоборот, при пониженной температуре тела или высокой влажности воздуха потери воды с испарением снижены.
Объем поддерживающей инфузионной терапии рассчитывают исходя из того, что моча должна быть изостенурической (с удельным весом 1,010) и изотоничной (с осмолярностью 280—310 мосм/л). На компенсацию почечных потерь приходится 2/3 объема поддерживающей инфузионной терапии. У детей младшего возраста диурез составляет примерно 2 мл/кг/ч. Когда нарушена концентрационная функция почек (например, при несахарном диабете, у недоношенных, больных серповидноклеточной анемией) или повышена почечная осмотическая нагрузка (например, при парентеральном питании), выделяется либо большое количество изотоничной мочи, либо гипотоничная моча; при этом следует соответственно увеличить объем вводимой жидкости.
При выделении концентрированной мочи (например, при гиперсекреции АДГ или сердечной недостаточности) объем вводимой жидкости снижают.
Состав инфузионных растворов подбирается таким образом, чтобы удовлетворялись энергетические потребности и потребность в электролитах (Na+, К+, Cl-). Эмпирическим путем выявлено, что на каждые 100 ккал или 100 мл жидкости требуется по 3 мэкв Na+ и Cl- и 2 мэкв К+. Такой состав способствует поддержанию гомеостаза и клеточного роста. Добавление 5 г глюкозы на каждые 100 мл жидкости позволяет восполнить дефицит энергии и предотвратить развитие кетоацидоза и распад белков.
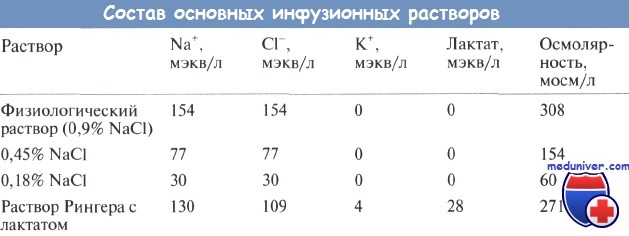
Таким образом, для поддерживающей инфузионной терапии рекомендуется использовать растворы, содержащие 30 мэкв/л натрия хлорида, 20 мэкв калия и 50 г/л глюкозы, например 0,18% NaCl с 5% глюкозы и 20 мэкв/л КО. Калий обычно добавляют в виде калия хлорида, из-за чего содержание хлора превышает расчетное, но не вызывает клинически значимой гиперхлоремии. Содержание натрия и хлора в различных растворах указано в таблице.
После введения рассчитанного количества жидкости следует оценить адекватность поддерживающей инфузионной терапии по изменению веса, сывороточной концентрации натрия и общему состоянию больного. Поддерживающая инфузионная терапия обеспечивает только 20% энергетических потребностей, поэтому больные, получающие только такую терапию, теряют в сутки от 0,5 до 1 % веса. Если количество вводимой жидкости меньше должного для поддерживающей терапии, а концентрация глюкозы в ней не увеличена, то потеря веса будет еще больше.
При правильном подборе поддерживающей инфузионной терапии сывороточная концентрация натрия составляет 130—140 мэкв/л. Повышение веса в сочетании со снижением сывороточной концентрации натрия или с появлением отеков указывает либо на введение избыточного количества жидкости, либо на нарушения выделения воды через легкие, кожу или почки, в том числе ятрогенного происхождения. Наоборот, быстрая потеря веса в сочетании с повышением сывороточной концентрации натрия и(или) постоянной тахикардией может быть обусловлена недостаточным введением или повышенным расходом жидкости; важно искать возможные причины такого повышенного расхода.
Таким образом, инфузионная терапия у детей требует непрерывного контроля за постоянно меняющимися клиническими и физиологическими показателями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Проведена оценка эффективности использования реамберина в программе инфузионной терапии у 38 больных с тяжелым отравлением уксусной кислотой. Выявлено положительное влияние реамберина на ряд конечных результатов проводимой интенсивной терапии: в 2 раза уменьшилась длительность экзотоксического шока, что позволило использовать меньшие объемы инфузируемых растворов; в 3 раза уменьшилось число случаев развития пневмонии, в 5 раз — число случаев развития делирия и в 5 раз — число случаев развития острой почечной недостаточности в раннем посттравматическом периоде. Использование реамберина при тяжелых отравлениях уксусной кислотой позволяет в 1,2 раза уменьшить время пребывания больных в отделении реанимации и интенсивной терапии и на 18,5% снизить летальность при указанных отравлениях.
Ключевые слова: реамберин, экзотоксический шок, уксусная кислота.
Efficacy of reamberin infusion therapy was estimated in 38 patients with severe acetic acid intoxication. Reamberin was shown to have positive effect on certain end-points of the treatment, viz. caused a 2-fold decrease in duration of exotoxic shock (which allowed to use smaller volumes of infusion solutions), 3-fold decrease in the frequency of pneumonia, 5-fold reduction in the frequency of delirium and acute renal insufficiency in the early post-traumatic period. The use of reamberin allowed to reduce duration of patients stay in intensive therapy and resuscitation wards by 1.2 times and mortality rate by 18.5%.
Key words: reamberin, exotoxic shock, acetic acid
Целью работы явилась оценка влияния реамберина на конечный результат интенсивной терапии у больных с тяжелой химической травмой, имеющих на момент отравления тяжелый метаболический ацидоз, гипоксию сложного генеза и абсолютную гиповолемию.
Заключение
Своевременное энергообеспечение путем активации процессов фосфорилирования и аэродного гликолиза положительно влияет на восстановление метаболических процессов в головном мозге и миокарде. Об этом свидетельствует (по сравнению с показателями во 2-й группе) достоверно меньшая длительность экзотоксического шока и делирия, что подтверждается использованием гораздо меньших доз вазопрессоров и в целом обусловливает менее выраженные органные расстройства.
Своевременное устранение явлений экзотоксического шока и профилактика полиорганной недостаточности (за счет восстановления метаболических и энергетических ресурсов, характерных для реамберина) существенно влияет на конечный результат проводимой терапии. Это позволяет в 1,2 раза уменьшить срок пребывания пациентов в критическом состоянии и практически в 2 раза снизить летальность (с 38,5 до 20%) при тяжелых отравлениях уксусной кислотой.
С учетом отраженного в литературе опыта использования реамберина в медицине критических состояний можно говорить о том, что реамберин, обладающий свойствами энергетического субстрата (натрия сукцинат), позволяет защитить клетки головного мозга и миокарда от повреждающего действия метаболической гипоксии, характерной при тяжелых отравлениях уксусной кислотой. Включение в программу интенсивной терапии реамберина является патогенетически обоснованным и эффективным, так как позволяет значительно улучшить результаты лечения больных с этой патологией.
Клинические критерии эффективности интенсивной терапии у больных с отравлением уксусной кислотой (M±m)
Инфузионная терапия является неотъемлемой частью лечения различных категорий больных. О возможностях применения ее достижений в клинической практике рассказывает профессор-консультант Центра экстракорпоральной детоксикации (ВМедА), д-р мед. наук Альфред Львович Костюченко.
История
В начале 30-х годов XIX столетия английский врач Т. Latta в журнале "Lancet" опубликовал работу о лечении холеры внутривенным вливанием растворов соды.
10 июля 1881 года Landerer успешно провел вливание больному "физиологического раствора поваренной соли", обеспечив бессмертие этой инфузионной среде, с которой мировая медицинская практика вошла в XX век - век становления и развития инфузионной терапии.
1915 год - использован на практике кровезаменитель на основе желатины (Hogan) - первый из коллоидных кровезаменителей;
1940 год - внедрен в практику "Перистой", первый из кровезаменителей на основе синтетического коллоида поливинилпирролидона (Reppe, Weese и Несht);
1944 год - разработаны кровезаменители на основе декстрана (Gronwall и Ingelman). Последующие четверть века были эрой безраздельного господства декстрановых кровезаменителей;
1962 год - началось клиническое внедрение растворов гидроксиэтидированного крахмала (Thompson, Britton и Walton), однако настоящий расцвет эры ГЭК происходит только к концу 20-го столетия.
В 60-х годах, одновременно в США (Rabiner) и СССР в ЛИПКе (академик АН. Филатова с сотр.) ведутся работы по созданию кровезаменителей на основе очищенного от стромы человеческого гемоглобина. В результате в нашей стране создается клинически доступный препарат "Эригем", успешно использованный для кровезамещения во время операций на легких (ВМедА, академик И.С. Колесникова с сотр.).
1966 год - первые публикации по перфторуглеродам (ПФУ) как возможным искусственным переносчикам кислорода в организме человека (L.Clark, LF. Gollan).
1979 год - В СССР создан первый в мире, в последующем клинически апробированный, кровезаменитель на основе ПФУ - "Перфторан" (ГР. Граменицкий, ИЛ. Кунъянц, Ф.Ф. Белоярцев).
1992 год - введен в клиническую практику оригинальный кровезаменитель на основе полиэтиленгликоля - "Полиоксидин" (Петербургский НИИГПК, Л А Седова, ЛГ. Михайлова и др.).
1997 год - прошел клинические испытания созданный в Петербургском НИИГПК полимеризированный человеческий гемоглобин "Геленпол" (ЕА Селиванов с сотр.). Разрешен к медицинскому применению с 1998 года.
Сегодня повсеместно для лечения больных используется инфузионная терапия - вливание в организм больного больших количеств различных жидкостей в течение значительного времени.
Цели проведения инфузионной терапии разнообразны: от психологического воздействия на пациента (как же - ведь "ставится капельница!") и разведения до безопасного уровня необходимых сильнодействующих лекарственных средств до решения ряда задач реанимации и интенсивной терапии.
Именно последние - задачи реанимации и интенсивной терапии, возникающие перед врачом в конкретных клинических ситуациях - и определяют основные направления инфузионной терапии:
- волюмокоррекция - востановление адекватного объема циркулирующей крови (ОЦК) и нормализация ее состава при кровопотере;
- гемореокоррекция - нормализация гомеостатических и реологических свойств крови;
- инфузионная регидратация - поддержание нормальной микро- и макроциркуляции (в частности - при клинически отчетливой дегидратации);
- нормализация электролитного баланса и кислотно-основного равновесия;
- активная инфузионная дезинтоксикация;
- обменкорригирующие инфузии - прямое воздействие на тканевой метаболизм за счет активных компонентов кровезаменителя.
Волюмокоррекция
При кровопотере и для востановления адекватного ОЦК могут быть использованы инфузионные среды с различным волемическим эффектом.
Изотонические и изоосмотические электролитные растворы моделируют состав внеклеточной жидкости, обладают малым непосредственным волюмическим эффектом (не более 0.25 от объема введенной среды, даже при отсутствии гипопротеинемии), но являются предпочтительными при сочетании кровопотери и дегидратации.
В настоящее время из группы коллоидных кровезаменителей все большую популярность приобретают растворы гидроксиэтилкрахмала (ГЭК) - инфукол, рефортан, стабизол, ХАЭС-стерил. Они обладают высоким непосредственным волемическим эффектом (1.0 и более) и большим периодом полувыведения при относительно небольшом количестве побочных реакций.
Сохраняют свои клинические позиции волюмокорректоры на основе декстрана (полиглюкин, реополиглюкин, реоглюман, лонгастерил, реомакродекс, неорондекс) и желатины (желатиноль, модежель, гелофузин). Все больше внимания привлекает новый препарат на основе полиэтиленгликоля - полиоксидин. В интенсивной терапии для восстановления адекватного ОЦК используются препараты крови. Однако применение донорской плазмы значительно ограничено редкостью препарата, побочными реакциями, опасностью переноса вирусной инфекции. Поданным некоторых авторов, при внутривенном использовании человеческого сывороточного альбумина (ЧСА), из-за повышенной проницаемости эндотелия для альбумина, препарат быстро выходит из кровеносного русла в интерстициальное пространство, усиливая отек, в том числе в органах жизнеобеспечения (легкие, тонкая кишка).
Появляется все больше публикаций о преимуществах терапии острого дефицита ОЦК и шока так называемой низкообъемной гиперосмотичной волюмокоррекцией (НГВ). Она заключается в последовательном внутривенном введении гипертонического электролитного раствора (например, 7.5% раствора NaCl из расчета 4 мл/кг массы тела (МТ) больного) с последующей инфузией коллоидного кровезаменителя (например, 250 мл полиглюкина или рефортана) для закрепления эффекта перемещения в сосуды интерстициальной жидкости.
- рациональный доступ к сосудистой системе с помощью канюлирования или катетеризации сосудов или в целом к внутренней среде организма больного;
- техническое обеспечение - применение пассивного, гравитационного инфузионного тракта (системы) или активного - на основе насосов-инфузоров;
- медицинскими и коммерческими возможностями выбора инфузионной среды, соответствующей конкретной клинической задаче;
- контролем достигнутого эффекта с помощью клинико-лабораторных критериев, а в трудных случаях - с помощью мониторного наблюдения, позволяющего оценивать on line центральную гемодинамику, состояние жидкостных пространств организма больного, изменение микроциркуляции крови.
Вариантами подобной волюмокоррекции, кроме указанных веществ, могут быть гипертонический раствор смеси хлорида и ацетата натрия, реополиглюкин с добавлением маннитола (реоглюман) или гипертоническая плазма, донорская или аутологичная, заготовленная в ходе аппаратного плазмафереза во флаконы с лиофилизированным сорбитолом. Методами доказательной медицины установлено, что НГВ способствует:
быстрому и стойкому повышению АД и сердечного выброса на фоне шока;
Гемореокоррекция
Одновременно с волюмокоррекцией или без нее может использоваться инфузионная гемореокоррекция. В ее основе может лежать изоволемическая гемодилюция с извлечением части крови или без нее.
Для решения этой задачи ранее получили признание декстраны, особенно низкомолекулярные, а в настоящее время - растворы ГЭК. Значимые для клинического применения результаты получены при использовании кислородпереносящего кровезаменителя на основе фторированных углеродов перфторана. Его гемореокорригирующее действие определяется не только эффектом гемодилюции и повышением электрического распора между клетками крови, но и изменением вязкости крови и восстановлением микроциркуляции в отечных тканях.
Регидратация
Для инфузионной регидратации используются сбалансированные по основным электролитам и гипоосмотичные или изоосмотичные электролитные растворы: натрия хлорида, Рингера, ацесоль, лактосол и другие. При проведении регидратации можно использовать различные пути введения жидкости:
сосудистый (в условиях функциональной сохранности сердца и легких - лучше внутривенно, при перегрузке правого сердца и синдроме острого легочного повреждения (ОЛП) -предпочтительно внутриаортальный путь);
Для быстрой нормализации электролитного баланса и купирования внутриклеточных электролитных расстройств созданы специальные инфузионные среды (калия-магния аспарагинат, ионостерил, раствор Хартмана).
Для инфузионной коррекции некомпенсированных метаболических расстройств кислотно-основного равновесия применяют:
- ри ацидозе - растворы бикарбоната илилактата натрия, трисаминол, трометамоп:
- при алкалозе - разведенный на растворе глюкозы 1н. раствор HCl (например, при сочетании алкалоза и гипохпоремии), алкамин.
Детоксикация
Различают интракорпоральный способ активной детоксикации с применением инфузионной терапии и экстракорпоральный
(сорбционные и аферезные методы), который также не обходится без инфузионного сопровождения. Для интракорпоральной детоксикации используют:
-
растворы глюкозы и/или кристаллоидов, обеспечивающие гемодилюцию (уменьшение повреждающего действия экзогенных и эндогенных токсических субстанций за счет их разведения) и улучшение кровоснабжения тканей и органов, что вызывает ускоренное вымывание токсических веществ;
При применении обеих групп инфузионных детоксикационных средств целесообразно использовать инфузионно-форсированный или медикаментозно-форсированный диурез, обеспечивающий высокий темп мочевыделения (оптимально 4-5 мл/кг МТ в час) на протяжении часов и суток.
Обменкорригирующая инфузия
Обменкорригирующая инфузия - прямое воздействие на тканевой метаболизм за счет активных компонентов кровезаменителя; по сути дела - направление инфузионной терапии, пограничное с медикаментозной терапией.
Первой в ряду обменкорригирующих инфузионных сред следует считать так называемую поляризующую смесь, предложенную французским патофизиологом А. Лабори как среду стрессовых ситуаций. Ее основу составлял раствор глюкозы с инсулином с добавлением солей калия и магния, что позволяло предотвращать развитие микронекрозов миокарда на фоне гиперкатехоламинемии.
Другим направлением следует считать полиионные среды, содержащие субстратные антигипоксанты - фумарат (мафусол, полиоксифумарин) и сукцинат (реамберин).
К обменкорригирующим инфузиям можно относить вливание перфторана и кислородпереносящих кровезаменителей на основе модифицированного гемоглобина - геленпола и гелевина, которые оптимизируют энергетический обмен в органах и тканях за счет повышения доставки к ним кислорода.
Благоприятная коррекция нарушенного обмена веществ достигается применением инфузионных гепатопротекторов. Они нормализуют не только метаболизм в поврежденных гепатоцитах, но и связывают маркеры летального синтеза при гепатоцеллюлярной несостоятельности, в частности, аммиак (гепастерил А). В некоторой степени к обменкорригирующим инфузиям можно отнести парентеральное искусственное питание. Купирование персистирующей белково-энергетической недостаточности и нутриционная поддержка больного достигается инфузиями специальных питательных сред.
Другие возможности
Определенное значение в интенсивной терапии имеют ситуации, в которых используют не плазмозамещающие свойства кровезаменителей. Например:
- использование перфторана для купирования ОЛП при травматической жировой эмболии или в остром периоде черепно-мозговой травмы, что позволяет уменьшить выраженность отека и набухания головного мозга;
- предотвращение капиллярной утечки внутрисосудистой жидкости при генерализованной инфекции средами на основе ГЭК;
- внутрисосудистое связывание воспалительных медиаторов и свободных радикалов (например, N0) растворами модифицированного гемоглобина.
Все это показывает, как далеко шагнула медицинская наука за 100 лет планомерного использования инфузионной терапии в клинической практике.
Читайте также:

