Обои что такое вич
Обновлено: 26.04.2024
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
1. Мой тест на ВИЧ положительный. Могло ли это быть ошибкой?
Хотя ложноположительный результат встречается нечасто, для проверки полученных результатов необходимо провести контрольный тест, то есть повторить анализ. Вероятность получения двух ложноположительных результатов теста крайне низка. Если первый тест проводился в домашних условиях, для выполнения повторного анализа обратитесь к врачу или в медицинскую лабораторию.
2. Если у моего партнера отрицательный результат теста на ВИЧ, то он не инфицирован?
3. Как я мог получить ВИЧ?
4. Это моя вина?
5. Но я думал, что активные партнеры не могут заразиться ВИЧ?
Действительно, вероятность инфицирования ВИЧ для активного партнера значительно ниже как при анальном, так и при вагинальном сексе. Согласно данным одного исследования, проведенного в 2012 году, для партнеров, занимающих активную позицию при анальном сексе, характерно снижение риска заражения на 86 процентов. Однако это не отменяет того факта, что активные партнеры могут инфицироваться и инфицируются ВИЧ при незащищенных половых контактах.
6. Правда ли, что у многих ВИЧ-положительных людей есть гепатит С?

7. Если я ВИЧ-положительный, значит у меня СПИД?
8. Я умру?
Да, но не завтра и не потому, что у вас ВИЧ. Дело в том, что при надлежащем лечении ВИЧ-положительные пациенты могут жить так же долго и полноценно, как и здоровые люди. Вы имеете гораздо больше шансов погибнуть в автомобильной катастрофе, чем умереть от ВИЧ. Конечно, как и при любом хроническом заболевании (например, сахарном диабете), у вас могут развиться определенные осложнения. Кроме того, вы можете быть подвержены различным заболеваниям, как и все люди. Существуют данные, что при длительном применении антиретровирусных препаратов, которые необходимо принимать ВИЧ-положительным, увеличивается риск раннего развития некоторых заболеваний, связанных с возрастом, таких как остеопороз. Однако не забывайте, что приверженность лечению позволит вам прожить долгую и активную жизнь, несмотря на ВИЧ.

9. Когда необходимо начать лечение?
Прямо сейчас. Лечение должно быть начато как можно скорее, лучше всего в день получения положительного результата анализа на ВИЧ. Раннее начало лечения ВИЧ-инфекции приводит к значимым долгосрочным преимуществам. Но даже при отсутствии симптомов инфекция ослабляет иммунную систему. По мнению ученых, откладывание начала антиретровирусной терапии приводит к увеличению объемов скрытых резервуаров ВИЧ-инфекции. Напротив, раннее начало лечения уменьшает вирусную нагрузку. Содержание вируса в крови может снизиться до уровня ниже определяемого, при котором вероятность передачи ВИЧ партнеру крайне мала. Так что немедленно получите рецепт и начните прием препаратов.
10. Я должен принимать антиретровирусные препараты каждый день?
Всю жизнь? И да, и нет. По данным исследования, проведенного в 2015 году, только при сочетании раннего начала лечения с регулярным приемом препаратов соотношение CD4 и CD8 клеток становится близким к норме. Чем ближе этот показатель к нормальному, тем больше клеток борются с ВИЧ и дают вам силы, здоровье и продолжительность жизни человека без ВИЧ-инфекции. Не стоит пренебрегать такой ощутимой пользой для здоровья. Однако и врачи, и фармацевтические компании понимают, что необходимость ежедневно принимать лекарства превращается в настоящее испытание, и поэтому разрабатывают новые возможности лечения. В этом году было проведено исследование, по результатам которого было выявлено, что инъекция препарата два раза в месяц так же эффективна, как и ежедневный прием таблеток (хотя может пройти один-два года, прежде чем такие препараты станут продаваться в аптеках). Да, пока вам придется придерживаться лечения с религиозным рвением (представьте, будто это поход в спортзал или ежедневный прием витаминов), однако это не означает, что вы обречены до конца жизни ежедневно принимать таблетки.

11. Если я ВИЧ-положителен, значит, мне нельзя заниматься сексом?
Нет, это не так. На самом деле большинство врачей поощряют продолжение полноценных сексуальных отношений. Оргазм сам по себе может быть чудесным лекарством: чувство сексуального удовлетворения помогает заснуть, стимулирует повышение уровня иммуноглобулинов (которые борются с инфекцией), уменьшает стресс, чувство одиночества и депрессию. Однако присутствие ВИЧ в организме подразумевает, что необходимо защищать себя и своих сексуальных партнеров.
12. Как я могу защитить моих сексуальных партнеров?
Есть разные способы защитить себя и своего партнера. Честно и подробно обсудите свой ВИЧ-статус и связанный с ним риск передачи инфекции. Всегда используйте презерватив и поддерживайте сексуальные отношения с партнером, применяющим доконтактную профилактику (PrEP). Следите за поддержанием вирусной нагрузки ниже определяемого уровня. Важен даже правильный выбор смазки для презерватива (избегайте двух составляющих: поликватерниума и поликватерниума-15, так как оба типа полимера увеличивают риск передачи ВИЧ).
14. Что такое ДКП (PrEP)? ДКП (PrEP)
15. Какой риск у людей, употребляющих неинъекционные наркотики и алкоголь?
Люди, употребляющие неинъекционные наркотики и алкоголь, более склонны к рискованному сексуальному поведению и незащищенным контактам. Многие люди, принимающие наркотики или алкоголь, прежде всего, выбирают сексуальных партнеров из своего круга общения. Сюда могут войти люди, которые употребляли наркотики внутривенно, занимались сексом за деньги или наркотики, стали жертвами травматической ситуации, или сидели в тюрьме. Во всех этих уязвимых группах риск передачи ВИЧ высокий.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
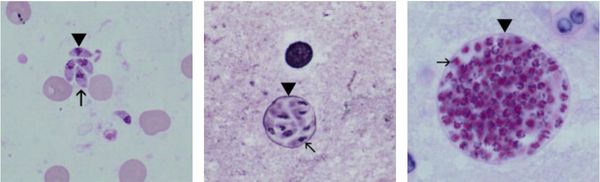
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
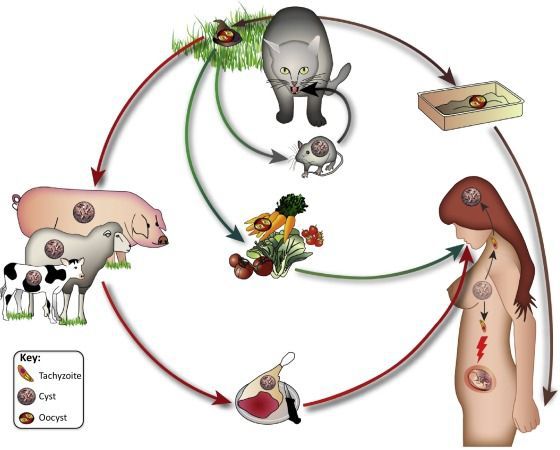
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
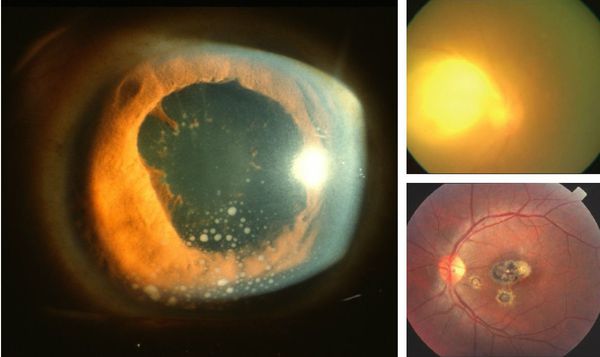
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
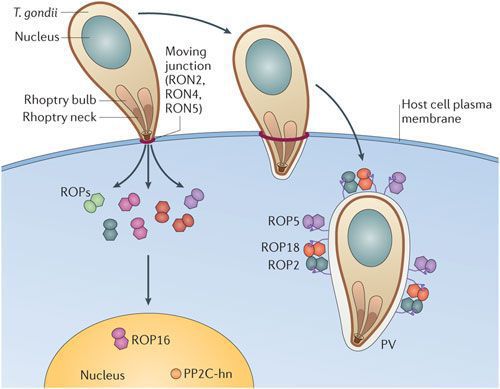
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
На сегодняшний день ВИЧ-инфекция неизлечима полностью. Но своевременная и грамотно подобранная высокоактивная антиретровирусная терапия (ВААРТ), успешно сдерживает прогрессирование заболевания и его переход в стадию СПИД. Прием терапии позволяет ВИЧ-инфицированному пациенту жить полноценной жизнью – учится, работать, создавать семью, заниматься любимым делом и даже иметь здоровых детей. При своевременном выявлении ВИЧ, на время приема терапии вирус в крови не обнаруживается, человек безопасен для окружающих, инфекция не влияет на продолжительность жизни.

Каждый год для борьбы с ВИЧ разрабатывают новые препараты.
Что такое антиретровирусная терапия?
Высокоактивная антиретровирусная терапия – это современный метод терапии ВИЧ-инфекции. Она подразумевает прием 3-4 препаратов, действие которых направлено на подавление вируса иммунодефицита. Проводимая терапия преследует сразу 3 жизненно важных цели.
- Вирусологическая – подавляет самовоспроизведение вирионов вируса в организме пациента.
- Иммунологическая – поддерживает стабильность иммунной системы для формирования адекватного иммунного ответа.
- Клиническая – тормозит развитие СПИДа и сопутствующих ему заболеваний, тем самым повышая качество жизни и увеличивая ее продолжительность.
Отказ от терапии неизбежно приводит к осложнениям и развитию СПИДа. Люди, живущие без терапии, сталкиваются с онкологическими патологиями и оппортунистическими инфекциями, вызывающими развитие туберкулеза, менингита, энцефалита, пневмонии и других заболеваний. Продолжительность жизни на стадии СПИД без лечения не превышает 6-9 месяцев.
Принцип действия терапии анти-ВИЧ
В основе ВААРТ лежит комбинация 3-4 препаратов, действие которых подавляет ВИЧ на всех стадиях развития, в том числе и его мутации. Проблема в том, что помимо способности создавать собственные копии (репликации), вирус иммунодефицита характеризуется высокой мутагенностью – он способен подстраиваться под любые неблагоприятные условия, продолжая создавать свои репликации и мутации.
Как принимать АРВТ?
Антиретровирусная терапия проводится с соблюдением следующих принципов.
- Лекарства принимаются в строго определенное время!
- Пропускать прием препаратов нельзя!
- Самостоятельно увеличивать или уменьшать дозу препарата недопустимо!
- Препараты, режим приема и дозу препарата назначает только врач!
В процессе лечения состав АРВТ может корректироваться, что позволяет добиться максимальной эффективности проводимого лечения.
Важно понимать, что вопросы по типу, “принимать ли мне сегодня лекарства или не принимать?”, в данном случае не уместны. Конечно, соблюдать столь строгий режим, по понятным причинам, по силу не каждому пациенту. Но жить с ВИЧ без терапии – это равносильно собственноручно подписанному смертному приговору, когда у человека есть выбор и возможности для спасения.
Где выписать лекарства от ВИЧ?
Лечением ВИЧ-инфекции занимается врач-инфекционист Свердловского областного центра профилактики и борьбы со СПИД. Главное помнить – самолечение не допустимо! При подозрении на ВИЧ и после подтверждения диагноза, лечением инфекции должен заниматься исключительно профильный специалист.
Большая часть лекарств от ВИЧ находятся в списке жизненно необходимых и важнейших лекарственных препаратов. Поэтому расходы на лечение пациентов оплачиваются государством – за счет федерального и регионального бюджета. Препараты выдаются ВИЧ-позитивным пациентам в Свердловском областном центре профилактике и борьбе со СПИДили в аптеках при наличии рецепта от лечащего врача. Для их получения, пациента в обязательном порядке ставят на диспансерный учет.
Какие лекарства лечат ВИЧ?
Для общего ознакомления перечислим классы лекарств, принцип их действия и препараты с помощью наглядной таблицы.
Нуклеозидные ингибиторы* обратной транскриптазы
Подавляют обратную транскриптазу - фермент ВИЧ, который отвечает за создание ДНК репликаций
Абакавир, Зальцитабин, Ламивудин, Ставудин и др.
Ненуклеозидные ингибиторы обратной транскриптазы
Воздействуют на обратную транскриптазу
Невирапин, Рилпивирин, Эфавиренз, Элсульфавирин и др.
Блокируют фермент-протеазу вируса, в результате чего образуются вирионы, не способные заражать новые клетки организма
Ампренавир, Индинавир, Нелфинавир, Ритонавир и др.
Блокируют фермент вируса, который участвует в процессе встраивания вирусной ДНК в геном клетки-мишени
Ралтегравир, Долутегравир, Элвитегравир.
Препятствуют проникновению вирионов ВИЧ в клетку-мишень
Блокируют последний этап проникновения вирионов ВИЧ в клетку-мишень
*Ингибиторы – вещества, подавляющие течение физиологических процессов.
Несмотря на важность и жизненную необходимость лечения, в некоторых случаях, пациенты могут не выдерживать график приема лекарств, что затрудняет проведение терапии и снижает ее эффективность. Поэтому сегодня специалисты активно разрабатывают новые схемы ВААРТ, предполагающие однократный прием препарата - 1 раз в сутки. Для однократного приема уже одобрены такие лекарства, как Атазанавир, Абакавир, Диданозин, Тенофовир, Ламивудин, Эмтрицитабин, Эфавиренз и другие самые современные антиретровирусные средства.
Популярные вопросы и проблемы ВААРТ
Можно ли заразиться, если партнер принимает терапию?
Грамотно проводимая ВААРТ угнетает активность вируса, поэтому риск заражения минимальный. Но только в том случае, если у ВИЧ-позитивного пациента зафиксированы низкие или неопределяемые показатели вирусной нагрузки на организм. Если же вирусная нагрузка высокая, то риск инфицирования возрастает.
Половые партнеры должны быть информированы о ВИЧ-статусе друг друга. Наличие сопутствующих инфекций, передающихся половым путем, а также гепатита, увеличивает вероятность передачи инфекции в 3-5 раз. Даже при условии, что уровень вирусной нагрузки снижается до 3500 копий РНК ВИЧ и ниже в 1 мл крови, все равно риск передачи инфекции сохраняется. Поэтому половым партнерам необходимо использовать презервативы при любой форме полового акта.
Можно ли пить алкоголь во время терапии?
Препараты антиретровирусной терапии не совместимы с алкоголем. Более того! Прием алкоголя угнетает функции и без того ослабленной иммунной системы, создает повышенную нагрузку на организм и усиливает токсическое влияние ингибиторов – принимаемые в ходе ВААРТ препараты.
Можно ли родить здорового ребенка, если принимать ВИЧ терапию?
Применение грамотной ВААРТ позволяет снизить риск передачи инфекции до 2% и ниже. Поэтому у новорожденных от ВИЧ-инфицированной матери есть все шансы не унаследовать заболевание. Подтвердить или опровергнуть ранний диагноз позволяет своевременная диагностика методом ПЦР (полимеразной цепной реакции). Для этого кровь малыша исследуют два раза - в возрасте 1-4 месяцев, и в возрасте старше 4 месяцев. Если оба раза результаты ПЦР отрицательные, то можно говорить о том, что ребенок родился здоровым.
Мне назначили ВААРТ, но мне от нее хуже, что делать?
Антиретровирусные препараты для лечения ВИЧ обладают побочным действием, собственно, как и любые лекарства. Часть побочных эффектов проявляется практически сразу. Например, у пациента повышается температура, появляются проблемы с желудочно-кишечным трактом, кожные высыпания, увеличивается уровень инсулина в крови. ВИЧ-позитивный пациент может заметно худеть или набирать вес. Возникающие побочные эффекты создают дополнительную нагрузку на организм. Чтобы избежать этого, необходимо регулярно проходить обследование и при необходимости корректировать схему проводимой ВААРТ. Именно корректировать, а не отказываться от лечения!
Можно ли заразиться ВИЧ, если принять терапию после вероятного заражения?
У моего полового партнера ВИЧ, нужно ли мне проходить терапию, чтобы не заразиться?
Проходить ВААРТ здоровому человеку с целью профилактики ВИЧ не нужно. Достаточно использовать презерватив во время каждого полового контакта в любой форме.
Важно знать! Продолжительность жизни ВИЧ-инфицированного пациента зависит не только от эффективности ВААРТ, но и общего состояние здоровья и иммунитета. Организм людей с крепким иммунитетом, которые не имеют в своем анамнезе хронических заболеваний и врожденных патологий, лучше противостоит развитию ВИЧ-инфекции. И наоборот, ослабленный организм не в состоянии бороться с вирусом. Поэтому помимо антиретровирусной терапии, всем ВИЧ-положительным пациентам рекомендован здоровый образ жизни и правильное питание. Они должны беречь себя от инфекционных и простудных заболеваний. Укреплять свой иммунитет и в обязательном порядке проходить регулярное обследование организма.
Все интересующие вопросы лучше задавать профильным специалистам Свердловского СПИД-центра или лечащему врачу по месту жительства.
Читайте также: