Обструктивная уропатия с инфекцией
Обновлено: 10.05.2024
Непроходимость мочевыводящих путей — это закупорка, препятствующая прохождению мочи по мочевыводящих путям, включая почки, мочеточники, мочевой пузырь и мочеиспускательный канал. Непроходимость в любом месте мочевыводящих путей — от почек, где образуется моча, до мочеиспускательного канала, через который моча выходит из организма, может повысить давление внутри мочевыводящих путей и замедлить выделение мочи.
Непроходимость может возникнуть внезапно или развиваться постепенно в течение нескольких дней, недель или даже месяцев. При непроходимости мочевыводящие пути могут блокироваться полностью или только частично. В некоторых случаях поражается только одна почка, в других случаях — обе почки.
Причины
- Камни в почках или в мочеточнике, либо другом участке мочевыводящих путей
- Доброкачественная гиперплазия предстательной железы (ДГПЖ)
- Рак предстательной железы
- Стриктуры (сужения, вызванные рубцовой тканью) мочеточника или мочеиспускательного канала (после лучевой терапии, хирургического вмешательства или процедур, выполненных на мочевыводящих путях)
- Полипы в мочеточнике
- Кровяной сгусток в мочеточнике
- Опухоли в самом мочеточнике или рядом с ним
- Заболевания мышц или нервов в мочеточнике или мочевом пузыре
- Образование фиброзной ткани (рубца) в самом мочеточнике или вокруг него вследствие хирургического вмешательства, лучевой терапии или приема лекарственных препаратов
- Выпячивание нижнего конца мочеточника в мочевой пузырь (грыжа мочеточника)
- Опухоль, абсцессы и кисты мочевого пузыря, матки, шейки матки, предстательной железы и других органов таза
- Каловая пробка (закупорка прямой кишки калом)
Симптомы
- Боль, иррадиирующая в яички или вагинальную область
- Тошнота или рвота
- Затрудненное мочеиспускание
- Анурия (отсутствие мочеиспускания)
- Никтурия (учащенное мочеиспускание в ночное время)
- Полиурия (увеличение объема мочи)
Непроходимость может остановить мочеиспускание или уменьшить объем выводимой при мочеиспускании мочи, если закупорка затронет мочеточники обеих почек или мочеиспускательный канал. Непроходимость мочеиспускательного канала или выходного отверстия мочевого пузыря может причинять боль, давление и растяжение мочевого пузыря.
У лиц с медленно прогрессирующей непроходимостью, которая вызывает гидронефроз, может не быть никаких симптомов, или же у них могут быть приступы тупой боли в боку на пораженной стороне. Иногда камень в почках временно блокирует мочеточник и причиняет периодически возникающую боль.
Непроходимость, которая приводит к гидронефрозу, может стать причиной общих симптомов со стороны пищеварительного тракта (тошнота, рвота и боль в животе). У лиц с инфекциями мочевыводящих путей (ИМП) может быть гной в моче, лихорадка и дискомфорт в области мочевого пузыря или почек.
Возможные осложнения
- Гидронефроз
- Повышение вероятности образования камней мочевыводящих путей
- Почечная недостаточность
Диагностика
С учетом причины заболевания и имеющихся симптомов врач может назначить следующие виды обследования:
- анализы крови;
- анализы мочи;
- катетеризацию мочевого пузыря;
- ультразвуковое исследование (УЗИ) мочевыводящих путей;
- компьютерную томографию (КТ) мочевыводящих путей;
- магнитно-резонансную томографию (МРТ) мочевыводящих путей;
- цистоуретрографию во время мочеиспускания;
- цистоскопию.
Лечение
Как правило, лечение направлено на снятие симптомов непроходимости и зависит от причины и симптомов болезни, тяжести течения, а также наличия сопутствующих заболеваний и медикаментозной терапии, получаемой по сопутствующей патологии. С учетом этого врач может назначить:
Пузырно-мочеточниковый рефлюкс — это патология, характеризующаяся обратным током урины из мочевого пузыря в мочеточник. Возникает при аномалиях выделительной системы, высоком давлении внутри пузыря или на фоне воспалительных процессов. Рефлюкс может стать причиной пиелонефрита, гидронефроза, почечной недостаточности. Основные симптомы — болевые ощущения в поясничной области после мочеиспускания, помутнение мочи, отеки, лихорадка. Методы диагностики: общие анализы мочи, крови, УЗИ почек, экскреторная урография, микционная цистография. Лечение сводится к терапии воспалительного заболевания или хирургическому устранению аномалий мочевыделительной системы.
МКБ-10
Общие сведения
Пузырно-мочеточниковый, или везикоуретеральный, рефлюкс — одно из самых распространенных урологических заболеваний, особенно среди детей. Обнаруживается у 1% пациентов урологического профиля, доля двустороннего процесса составляет 50,9%. Регургитация мочи выявляется у 40% больных с инфекционными заболеваниями мочевых путей.
Распространенность патологии, высокий риск осложнений (почечная недостаточность, вторичная артериальная гипертензия, гнойные заболевания почек) обусловливают большой процент инвалидизации пациентов. Врожденный рефлюкс наблюдается у 1 ребенка из 100, при этом соотношение детей женского и мужского пола на первом году жизни составляет 5:1. По мере взросления частота встречаемости патологии у мальчиков растет с изменением ситуации на противоположную.

Причины
Этиологическими факторами нефизиологического движения мочи являются процессы, ведущие к недостаточности сфинктера области мочеточникового соустья. Сфинктер — физиологический барьер, разделяющий мочеточники и мочевой пузырь, препятствующий обратному току урины. Дополнительные предпосылки для регургитации создает высокое давление жидкости в мочевом пузыре. Основные группы факторов, ведущие к развитию рефлюкса, включают:
- Аномалии развития выделительной системы. Снижение замыкательной функции сфинктера развивается вследствие неправильного формирования этого сегмента выделительной системы на этапе внутриутробного развития. Аномальное строение может проявляться в виде постоянно открытого устья мочеточника, отсутствия или уменьшения мышечного слоя констриктора, его дисплазии, тканевой дегенерации.
- Высокое внутрипузырное давление мочи. Повреждение головного, спинного мозга, тазовых нервов приводит к нарушению регуляции тонуса мышц мочевого пузыря. Мышечная стенка находится в постоянном напряжении, что создает повышенное гидростатическое давление. Это приводит к неспособности здорового сфинктера сдерживать мочу. Причинными факторами такого состояния являются врожденные (детский церебральный паралич, агенезия крестца) и приобретенные (опухоли мозга, инсульт, болезнь Паркинсона, сахарный диабет) патологии.
- Воспалительный процесс. Уменьшение барьерной функции пузырно-мочеточникового соустья возможно при воспалении мочевых путей. Рефлюкс обычно является следствием запущенных острых и хронических форм цистита или восходящего уретрита. Инфекция чаще вызывается условно-патогенными микроорганизмами, особенно кишечной палочкой, на фоне снижения местного или общего иммунитета.
- Ятрогенные причины. Формирование ретроградного заброса урины через пузырно-мочеточниковое соустье возможно после перенесенного оперативного вмешательства в области дистальных отделов выделительного аппарата. Наиболее частыми операциями, приводящими к рефлюксу, являются простатэктомия, рассечение уретероцеле, резекция шейки мочевого пузыря. При любой из них существует вероятность нарушения нормальной анатомической структуры мочевого пузыря и пузырно-мочеточникового сегмента.
К факторам, увеличивающим риск развития рефлюкса, относят его наличие в семейном анамнезе, особенно у ближайших родственников (родителей, братьев, сестер). Также повышают вероятность нарушений регуляции тонуса мочевого пузыря или сфинктера соустья опухоли спинного мозга, врожденные аномалии позвоночника, например, его расщепление.
Патогенез
Область соединения мочеточников с полостью мочевого пузыря анатомически представляет собой сфинктерный антирефлюксный аппарат, который обеспечивает ток урины только в нисходящем направлении. Это достигается благодаря определенному углу, под которым мочеточник впадает в мочевой пузырь, и внутристеночным гладким циркулярным мышцам. Главное патологическое звено формирования рефлюкса — снижение эффективности работы сфинктера в результате дисплазии мышечных волокон, их воспалительного повреждения, нарушения нервной регуляции. Морфофункциональные изменения приводят к срыву антирефлюксного механизма и нефизиологическому ретроградному движению мочи.
Высокое гидростатическое давление обуславливает деформацию и дилатацию мочеточника и почечных лоханок. Создаются условия для переноса бактерий из нижних сегментов выделительной системы в верхние, что приводит к развитию острой или хронической рецидивирующей инфекции в паренхиме почек с замещением ренальной ткани на нефункциональную соединительную. Нефросклероз является причиной дисфункции почечного фильтра и развития жизнеугрожающих состояний.
Классификация
Современная клиническая урология стремится к выработке единой общепризнанной классификации, поскольку именно от степени пузырно-мочеточникового рефлюкса (ПМР) во многом зависит выбор дальнейшей терапевтической тактики. На сегодняшний день наиболее широкое распространение получила систематизация процесса в зависимости от уровня обратного заброса мочи:
- Iстепень. Вследствие недостаточности сфинктера рефлюкс небольшого количества мочи ограничивается дистальным тазовым отделом мочеточника. Расширения мочеточника не происходит. Риск осложнений инфекционного и неинфекционного характера минимален, симптоматика отсутствует. Обнаружение ПМР обычно происходит при обследовании по поводу других заболеваний выделительной системы.
- IIстепень. Заброс урины отмечается на всем протяжении мочеточника, но без его дилатации. При этом моча не достигает почек, чашечно-лоханочной системы. Данной степени свойственно отсутствие ярко выраженных симптомов, небольшой риск инфекционных осложнений, но высокая скорость прогрессирования рефлюкса, быстрый переход на следующие уровни развития. Обнаруживается случайно при плановом профилактическом обследовании или диагностике иных патологий.
- IIIстепень. Моча достигает почек, но расширения лоханок не наблюдается. Возможно снижение почечной функции на 20%, обнаруживаемое при биохимических анализах. Мочеточник расширен, есть признаки дегенеративного трофического перерождения тканей. Риск присоединения инфекции повышается вследствие застоя мочи в выделительной системе, что часто является поводом для обращения к специалисту. Симптомы имеют среднюю степень выраженности.
- IVстепень. Регистрируется существенное расширение, деформация чашечно-лоханочной области и мочеточников. Функция почек снижается значительно (до 50%) с уменьшением продукции мочи, особенно на фоне инфекционных осложнений. Симптоматика выраженная, с фебрильной температурой, генерализованными отеками. При двустороннем процессе возможно развитие угрожающих жизни состояний, что требует скорейшего обращения к специалистам.
- Vстепень. Диагностируется тяжелая степень поражения почек с истончением их паренхимы наряду со всеми признаками, характерными для предыдущих степеней. Мочеточник вследствие чрезмерного расширения имеет коленообразные изгибы. Нарастающие симптомы почечной недостаточности (снижение диуреза, тошнота, рвота, кожный зуд) требуют немедленного обращения за квалифицированной помощью.
Существуют классификации пузырно-мочеточникового рефлюкса, основанные на других признаках, например, на этиологическом факторе (врожденный, приобретенный), характере процесса (одно-, двусторонний), клиническом течении (интермиттирующий, постоянный). Но ключевым показателем является расширение структур мочевыводящих путей. Даже незначительная дилатация мочеточника или лоханок почек может значительно ухудшить их функцию.
Симптомы ПМР
Специфических проявлений пузырно-мочеточниковый рефлюкс не имеет, на ранних стадиях может протекать бессимптомно. Появление признаков ПМР чаще всего служит результатом длительного отсутствия лечения или присоединившихся инфекционных осложнений. Симптомы периода обострения схожи с проявлениями воспалительных патологий почек и зависят от возраста пациента.
Для детей с врожденным или приобретенным в раннем возрасте рефлюксом характерны бледность кожных покровов, болезненный вид, сниженная масса тела, рост и развитие, не соответствующие возрасту, беспокойное поведение, боли в области живота, поясницы. Обратиться к нефрологу родителей часто вынуждает утяжеление состояния ребенка (высокая температура, задержка мочи), что свидетельствует о присоединении инфекции.
У взрослых не описано специфических признаков рефлюкса. В большинстве случаев они наслаиваются на проявления других болезней мочевыделительной системы. К общим симптомам относят генерализованные отеки, повышенную жажду, увеличенный диурез (при условии нормальной или незначительно сниженной функции почек), ощущение распирания и боли ноющего характера в пояснице, внизу живота.
При остром пиелонефрите возможно помутнение урины из-за гноя, появление кровянистых выделений, повышение температуры до 39-40°С. Могут наблюдаться несвойственные для инфекции мочевыводящих путей признаки: диарея, отсутствие аппетита, энурез, повышенная нервная возбудимость, тахикардия.
Осложнения
Возникновение рефлюкса, независимо от его этиологических факторов, — возможная причина развития дополнительных патологий, ухудшающих функцию почек и, следовательно, состояние пациента. К наиболее часто встречающимся в практике осложнениям относят пиелонефрит, гидронефроз, почечную гипертензию, хроническую почечную недостаточность. Эти состояния, несмотря на разную природу, обусловлены единым патогенетическим звеном — нарушением нормального тока мочи.
Застойные явления в мочевыделительной системе повышают риск развития инфекционных осложнений, которые приводят к уменьшению притока к почкам насыщенной кислородом артериальной крови. Гипоксия стимулирует выброс ренальными клетками биологически активных веществ, сужающих сосуды и вызывающих артериальную гипертензию.
Диагностика
Устранение рефлюкса и его последствий начинается с полноценной диагностики, установления причины и степени патологии. Первая и вторая степени регургитации обнаруживаются урологами случайно при профилактическом осмотре или во время обследования по поводу другого заболевания мочевыделительной системы со схожими симптомами. Диагностика включает в себя:
Дифференциальная диагностика рефлюкса проводится со стенозом устья мочеточника, дающим схожую клиническую картину. Также исключается мочекаменная болезнь, рак матки и простаты, туберкулез выделительной системы.
Лечение ПМР
Выбор терапевтической тактики зависит от ряда факторов: причины заболевания, пола, возраста, степени тяжести, длительности проводимой консервативной терапии. Если рефлюкс вызван воспалительными процессами нижних отделов мочевыделительной системы, то чаще всего изменения соответствуют I-II степени, не затрагивают почки и дают возможность ограничиться консервативной терапией. При своевременном обращении за помощью и отсутствии органических причин этот вид лечения позволяет устранить ПМР в 60-70% случаев. Консервативная терапия рефлюкса включает следующие компоненты:
- Диета. Специальное питание повышает выведение продуктов обмена и оказывает противовоспалительное воздействие. Больному рекомендуется ограничить прием соли до 3 грамм в сутки, существенно или полностью исключить жирные блюда, но увеличить количество овощей, фруктов, зерновых. Запрещается употребление алкоголя, газированных напитков, крепкого кофе.
- Медикаментозные средства. При наличии воспалительных или инфекционных очагов показан прием соответствующих лекарств — антибиотиков, противовоспалительных, спазмолитических средств. Высокие цифры артериального давления требуют применения антигипертензивных препаратов. В целях профилактики застойных явлений в органах выделительной системы больному рекомендуется каждые 2 часа опорожнять мочевой пузырь, для чего возможно применение диуретиков средней силы действия.
- Физиотерапия. Дополнительно возможно использование физиопроцедур: электрофореза, магнитотерапии, лечебных ванн. Воздействие физических факторов способствует устранению воспалительного процесса, спазма гладких мышц мочевыводящих путей, восстанавливает физиологический ток мочи. Лицам с развившейся вследствие пиелонефрита хронической почечной недостаточностью показано санаторно-курортное лечение.
Отсутствие в течение полугода существенных изменений состояния или возможное его ухудшение (рецидивирующий пиелонефрит, снижение функциональности почек на 30% и более, высокая степень тяжести патологии), требует планового хирургического вмешательства в условиях урологического стационара. К базовым вариантам оперативного лечения рефлюкса относят:
- Эндоскопическая коррекция. При начальных (I-II) стадиях процесса возможно эндоскопическое инъекционное введение в область устья мочеточника объемообразующих имплантатов, укрепляющих эти структуры. Основой могут выступать коллаген, силикон, тефлон, обладающие низким риском развития аллергических реакций, прочностью, биосовместимостью.
- Лапароскопическая уретероцистонеостомия. Проводится при III-V степени ПМР. Тяжелые изменения стенки мочеточника, органическая патология сфинктера требуют создания нового искусственного соединения мочеточника с мочевым пузырем (уретероцистоанастомоз) и удаления патологически измененных тканей. Возможно сочетание операции с резекцией дистальной части мочеточника или пересадкой почки.
Прогноз и профилактика
Своевременная диагностика рефлюкса, назначение комплексного лечения дает положительный исход терапевтических мероприятий. Присоединение осложнений, сопровождающихся необратимым повреждением почек с их недостаточной функцией, значительно ухудшает прогноз. Специфической профилактики данной патологии не разработано. Общими мероприятиями являются своевременное обращение к врачам с любыми заболеваниями выделительной системы, уменьшение потребления соли, предупреждение травм спины, малого таза, потребление достаточного количества жидкости, периодические профилактические обследования.
2. Современные подходы к лечению пузырно-мочеточникового рефлюкса у детей (обзор литературы)/ Добросельский М.В., Чепурной Г.И., Коган М.И., Сизонов В.В.// Медицинский вестник Юга России. – 2014.
4. Пузырно-мочеточниковый рефлюкс у детей: лечебная тактика/ Павлов А.Ю., Маслов С.А., Поляков Н.В., Лисенок А.А., Симонян Г.В.// Лечащий врач. – 2006.
Болезнь Ормонда – это вариант мезинхимопатии, неспецифический фибросклеротический процесс, развивающийся в соединительной ткани забрюшинного пространства. Проявления обусловлены сдавлением мочеточников, сосудов и почек. Основные симптомы – поясничные и абдоминальные боли, дискомфорт в паховой области. В запущенных случаях присоединяется ХПН, наблюдаются отеки, тошнота, снижение диуреза. Диагноз подтверждают данные КТ, МРТ, ПЭТ и морфологического исследования, определения уровня IgG4. Лечение консервативное (гормонотерапия), при нарушении уродинамики – оперативное.
МКБ-10
Общие сведения
Забрюшинный фиброз впервые описал французский исследователь И. Альбарран в начале XX века, более объемную работу по изучению патологии провел американский уролог Д.К. Ормонд в 1948 году. Специалисты в сфере современной урологии рассматривают большинство случаев болезни как иммунозависимую системную патологию, ассоциированную с иммунными комплексами IgG4-СЗ, характеризующуюся тотальной или частичной воспалительной инфильтрацией органов и тканей плазматическими клетками. Именно они вырабатывают IgG4, что инициирует облитерирующий флебит и фибросклероз. Болезнь Ормонда – частный случай мезинхимопатии, аналогичные изменения регистрируются в других органах и системах. Патологию чаще диагностируют у мужчин старше 50 лет.

Причины
Причины забрюшинного фиброза до настоящего времени остаются дискутабельными. Считается, что этиологические факторы провоцируют иммунный ответ, что способствует воспалительному поражению брюшины, исходом которого становится фиброз. Агрессивность патологии различается, причины вариативности неизвестны. Основным патогенетическим триггером называют повышенную экспрессию комплекса IgG4 плазматическими клетками. Болезнь Ормонда может быть вторичной, специалисты выделяют ряд состояний, которые потенциально приводят к ретроперитонеальному фиброзу:
- Некоторые заболевания. Воспаление почек, мочеточников и других органов, прилегающих к забрюшинной клетчатке, может инициировать фиброзно-склеротические процессы. Злокачественные новообразования (рак прямой кишки, простаты, мочевого пузыря), инфекции (туберкулез, токсоплазмоз, бруцеллез) также провоцируют забрюшинный фибросклероз. Пиелоренальный рефлюкс, экстравазация мочи с растворенными антибиотиками играют особую роль в инфильтрации мочеточника и часто приводят к гидронефрозу.
- Повреждение тканей. Травма живота, особенно с образованием забрюшинной гематомы, может осложниться лимфопролиферативными нарушениями плазматических клеток. Аналогичные изменения иногда потенцируют хирургические вмешательства: лимфаденэктомия, колэктомия, операции по поводу аневризмы аорты. Фиброз той или иной степени регистрируют после прохождения лучевой терапии на органах малого таза.
- Прием ряда препаратов. Бромокриптин, гидралазин, метилдопа, производные спорыньи при длительном приеме вызывают склерозирующий забрюшинный гранулематоз. Некоторые специалисты в качестве причины патологии упоминают лечение высокими дозами антибиотиков и бета-адреноблокаторов. Ормонд был убежден, что фиброзно-склеротические разрастания становятся следствием реакции гиперчувствительности на лекарства или химические вещества.
К предрасполагающим факторам относят курение, воздействие асбеста. Наличие нескольких больных в пределах одной семьи указывает на возможную роль генетических факторов. У некоторых пациентов, страдающих фибросклерозом Ормонда, выявляют человеческий лейкоцитарный антиген HLA–B27 (иммуногенетический маркер), носительство которого свидетельствует о предрасположенности к аутоиммунным заболеваниям, включая забрюшинный фиброз. Существуют и другие генетические ассоциации, повышающие вероятность патологии.
Патогенез
По последним данным, в 50-75% болезнь Ормонда связана с присутствием плазматических клеток, продуцирующих IgG4. Патология чаще проявляется системно, аналогичные изменения тканей почти всегда выявляют в поджелудочной железе, лимфатических узлах, гипофизе. Наблюдается опухолевидный отек вовлеченных органов, лимфоплазматическая инфильтрация и фиброзно-склеротический процесс различной степени выраженности. Измененная клетчатка сдавливает мочеточник, крупные магистральные сосуды, лимфатические пути, реже – почки.
Инфильтрат состоит из многочисленных лимфоцитов, плазматических клеток, макрофагов, иногда нейтрофилов. Воспалительные клетки вкраплены в коллагеновые пучки, организованы узловыми скоплениями вокруг мелких сосудов. Патология классифицируется как связанная с IgG4 при наличии сториформного фиброза, инфильтрации эозинофилов, облитерирующего флебита. Тучные клетки находятся в дегранулированном состоянии, что согласуется с их активным участием в фиброзно-воспалительной реакции.
Классификация
Забрюшинный фиброз может быть изолированным, связанным с аутоиммунными болезнями, или возникшим на фоне многоочагового фиброзно-воспалительного заболевания, ассоциированного с IgG4. Поражение чаще затрагивает оба мочеточника. Стандартизированные критерии для классификации ретроперитонеального фиброза отсутствуют, патология рассматривается в одном ряду с хроническим периаортитом, перианевризматическим фиброзом и воспалительными аневризмами брюшной аорты, которые имеют общие гистологические и клинические признаки. Формы ретроперитонеального фиброза:
- Первичная (идиопатическая). Причина заболевания не может быть обнаружена. Системные аутоиммунные патологии, факт травматизации, онкологические процессы отсутствуют.
- Вторичная. Есть связь с лекарственными препаратами, травмой, радиационным облучением. У 10% больных ретроперитонеальный фибросклероз обусловлен прогрессированием злокачественного новообразования.
- IgG4- ассоциированная. Примерно половина случаев является симптомом относительно клинически гетерогенного заболевания, связанного с IgG4.
Симптомы болезни Ормонда
Вначале в 60-90% случаев наблюдаются системные симптомы: слабость, анорексия, потеря веса. Клинические проявления развернутой формы многообразны, включают дискомфорт в поясничной области, животе и над лоном (70-90%). Боль обычно тупая, не изменяется в зависимости от положения тела, временно реагирует на нестероидные противовоспалительные средства. При поражении мочеточника имитирует почечно-мочеточниковую колику, для которой типичны резкая болезненность, положительный симптом поколачивания, рвота.
В 20% случаев компрессия нарушает нормальную перистальтику кишечника, провоцируя запоры. У 35% мужчин с болезнью Ормонда присутствуют тестикулярные боли, ретроградная эякуляция и эректильная дисфункция. К менее распространенным урологическим симптомам относят учащенное мочеиспускание, рези и примесь крови в моче. Повышение температуры до фебрильных цифр, потрясающий озноб и выраженные поясничные боли свидетельствуют о присоединении острого пиелонефрита.
Компрессия сосудов проявляется гидроцеле и варикоцеле (30%). Характерны жалобы на дискомфорт в промежности, чувство распирания мошонки. Сдавление нижней полой вены и лимфатических путей вызывает отеки нижних конечностей и хромоту у каждого десятого больного. При вовлечении почечных артерий возникает рено-сосудистая гипертензия. Повышение давления носит устойчивый характер. При существовавшей ранее гипертонии ее течение ухудшается. Высокое давление при постановке диагноза выявляют у трети пациентов.
Осложнения
Осложнения заболевания весьма серьезны, связаны с высокой летальностью (10-20%). Сужение просвета мочеточников и их гипотония приводят к рецидивирующему пиелонефриту, гидронефротической трансформации почек (55-100%), хронической почечной недостаточности (40-90%). У 32% больных диагностируют атрофию почки, связано ли это с обструкцией мочеточника, стенозом почечной артерии или другими причинами – остается неясным. Часто после поражения одного мочеточника другой вовлекается в процесс в период от нескольких недель до нескольких лет.
Тромбоз глубоких вен и легочная эмболия – грозные осложнения венозной компрессии при синдроме Ормонда – встречаются редко, что обусловлено компенсаторными возможностями организма (формированием коллатеральных путей для оттока крови). При забрюшинном фибросклерозе могут поражаться брыжеечные и чревные артерии с развитием стеноза и ишемических осложнений, напоминающих брыжеечный васкулит. У 30% больных ретроперитонеальным фиброзом изменена грудная аорта, что может привести к ее аневризме.
Диагностика
Аутоиммунное склерозирующее заболевание сложно заподозрить из-за многообразия жалоб. Изменения в анализах неспецифичны, встречаются при других патологиях. Нередко недообследованные пациенты получают неполноценное лечение у уролога или гастроэнтеролога, что ухудшает прогноз. Доказано, что на начальной стадии можно добиться ремиссии болезни с помощью исключительно консервативной терапии, поэтому специалисты считают приоритетным раннее выявление патологического процесса. Алгоритм обследования при забрюшинном фиброзе Ормонда включает:
- Лабораторные анализы. Воспалительные маркеры (СОЭ, С-реактивный белок) выше нормы более чем у половины пациентов, но этот показатель не позволяет дифференцировать идиопатический и вторичный забрюшинный фибросклероз. Повышение уровня IgG4 сыворотки крови >135 мг/дл в сочетании с гистологическими признаками является основным критерием для подтверждения IgG4-СЗ. При всех формах патологии оценивают уровень мочевины, креатинина и СКФ для определения функциональной способности почек. Анализ мочи показывает низкий удельный вес, протеинурию, гематурию.
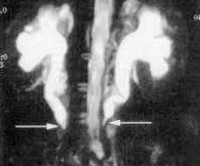
- Визуализационные методики. МРТ и КТ – основные исследования при болезни Ормонда. Послойное сканирование помогает различить идиопатическую и вторичную формы фибросклероза. УЗИ проводят для подтверждения болезни на начальных стадиях, оценки степени гидронефроза, обнаружения аневризмы и дилатации аорты. Для улучшения визуализации используют контрастное вещество. В последние годы выполняют ПЭТ, которая выявляет скрытые опухолевые и инфекционные процессы.
- Биопсию. При неоднозначных результатах инструментальных исследований и отсутствии ответа на стероидную терапию обосновано проведение биопсии. В качестве ограничения к исследованию рассматривают подозрение на опухолевый процесс с риском распространения раковых клеток. На ранних стадиях фиброза определяется гиперваскулярная ткань с периваскулярным лимфоцитарным инфильтратом, макрофаги с жировыми включениями. Для поздней стадии типична бессосудистая масса, лишенная клеточных структур.
Дифференциальную диагностику проводят с опухолями забрюшинного пространства, обструктивной уропатией другого генеза (при нефролитиазе, лучевых повреждениях, неспецифическом уретерите). Схожая картина наблюдается при воспалительных процессах клетчатки, посттравматических состояниях и новообразованиях мочеточника. Дифференциальный диагноз между идиопатическим, связанным с IgG4, и вторичным фибросклерозом имеет решающее значение, поскольку тактика ведения может кардинально различаться.
Лечение болезни Ормонда
Лечебные мероприятия направлены на сохранение функциональной способности органов мочевыделения, предотвращение распространения патологического процесса на соседние структуры, облегчение или купирование неблагоприятных симптомов. Тактика лечения (консервативное или хирургическое с приемом лекарств) зависит от стадии ретроперитонеального фиброза. При отсутствии уропатии и выраженного сдавления сосудов возможна медикаментозная терапия с обязательным наблюдением (КТ, МРТ и УЗИ органов брюшной полости и почек, оценка СОЭ, уровня С-реактивного белка).
Консервативная терапия
Консервативное лечение позволяет добиться положительной динамики у 80-83% пациентов. Эффект кортикостероидов обусловлен их противовоспалительным действием, способностью замедлять созревание соединительной ткани. Тамоксифен назначают при наличии противопоказаний к кортикостероидам или одновременно с гормональными средствами. Комбинация глюкокортикоидов с азатиоприном наиболее полезна при воспалении. Азатиоприн также применяют в качестве иммуносупрессивного препарата при неэффективности глюкокортикоидной терапии. Иммунодепрессант микофенолат угнетает синтез пурина и пролиферацию лимфоцитов.
Оперативные вмешательства
Обструктивная уропатия с нарушениями уродинамики и тенденцией к гидронефрозу почек подразумевает решение вопроса об отведении мочи. Первичное лечение забрюшинного фиброза включает уретеролиз, латеральную или внутрибрюшинную транспозицию мочеточников, их изоляцию. Далее обязательно проводят курс противорецидивной терапии, позволяющий снизить вероятность рецидивирования с 50 до 10%.
- Уретеролиз. Операция заключается в удалении фиброзной ткани, сдавливающей мочеточник. Не всегда обеспечивает удовлетворительный результат, поскольку уропатия вызвана не только компрессией, но и гипотонией мышечного слоя. Вмешательство выполняют открытым и лапароскопическим способом. Последний менее травматичен, его эффективность достигает 93,8%. Уретеролиз с окутыванием мочеточника большим сальником производят чаще и считают операцией выбора, что связано с меньшим количеством рецидивов (10%).
- Манипуляции для восстановления оттока урины.Стентирование мочеточника используют как первичную помощь для восстановления уродинамики. После купирования воспаления возможно оперативное вмешательство. У пожилых пациентов, при выявлении противопоказаний и тяжелом состоянии, не позволяющем выполнить операцию, катетер типа стент может длительно функционировать с заменой по мере необходимости. Иногда выполняют чрескожную пункционную нефростомию – под контролем ультразвукового оборудования в лоханку устанавливают дренаж.
- Инновационные методы. Описаны новые хирургические методики: уретеролиз и обертывание мембранными дышащими тканями, иссечение мочеточника и реанастомоз, почечная аутотрансплантация. Уропатию разрешают посредством баллонной дилатации – эндоурологическим способом вводят баллон, а затем под визуальным контролем расширяют его в нужном участке мочеточника. Результативность перечисленных вмешательств вариативна.
Экспериментальные способы
В последнее время начали применять эффективные экстракорпоральные методы терапии, основанные на выведении из крови болезнетворных и токсичных субстанций. Существует несколько вариантов: плазмаферез, лимфоцитаферез (отдельное извлечение лимфоцитарных клеток), каскадная фильтрация плазмы. Хорошие результаты получают при перфузии жидкой части крови через носитель, отсекающий соответствующие антитела.
Из новых лекарственных препаратов, обеспечивающих улучшение при идиопатических и IgG4-связанных патологиях, выделяют ритуксимаб (моноклональные антитела, полученные методом генной инженерии). Его назначают в качестве монотерапии или в комбинации с кортикостероидами. Ритуксимаб используют в профилактических целях по достижении ремиссии. Крупные рандомизированные исследования не проводилось, подходы к терапии во многом находятся на стадии разработки.
Прогноз и профилактика
Если болезнь диагностирована на ранней стадии с условием адекватной терапии, прогноз благоприятный. Гидронефроз и хроническая болезнь почек ухудшают исход. Улучшение функции почек происходит за 14-18 дней, далее пациенты подлежат тщательному наблюдению: сначала каждые три месяца, если нет отрицательной динамики – 1 раз в полгода. Забрюшинный фиброз, инициированный опухолевыми заболеваниями, имеет неблагоприятный прогноз с летальностью в течение полугода.
Профилактические мероприятия для предотвращения идиопатических форм заболевания не разработаны. Для предупреждения вторичного забрюшинного фиброза следует отказаться от курения, придерживаться здорового образа жизни. Недопустим прием лекарственных препаратов с превышением рекомендованных дозировок и длительности терапии, самолечение. Ранее обращение к специалисту при появлении неприятных симптомов, прохождение полной диагностики значительно увеличивает шансы на благоприятный исход – лечению лучше поддаются острые формы фиброза или существующие не более 6 месяцев.
1. Диагностика новой нозологической группы: IgG4-ассоциированное системное заболевание/ Седышев С. Х., Васильев В.И., Ковригина А.М.// Научно-практическая ревматология. Сборник материалов II конгресса ревматологов России – 2011.
2. Заболевание, связанное с IgG4: характеристика группы больных и терапия ритуксимабом/ Седышев С.Х., Васильев В.И. и др.// Лікарю-практику – 2013 - №52.
3. Ритуксимаб для идиопатического и IgG4-связанного забрюшинного фиброза/ Медицина (Балтимор) – 2018 - №97.
Почечный тубулярный ацидоз – это разновидность тубулопатии, которая сопровождается дисбалансом электролитов из-за сбоя экскреции ионов водорода (I), нарушением обратного всасывания бикарбонатов (II), аномальной продукцией альдостерона или взаимодействия с ним (IV). Тип III встречается казуистически редко. Течение может быть бессимптомным или с проявлениями электролитных расстройств: слабостью, тошнотой, костными деформациями. Диагностика почечной ацидемии базируется на измерениях рН мочи и электролитов, данных генетических анализов, УЗИ. Лечение предполагает восстановление кислотно-щелочного баланса: ощелачивающие средства, устранение гипо- гиперкалиемии и пр.
МКБ-10
N25.8 Другие нарушения, обусловленные дисфункцией почечных канальцев. Почечно-канальцевый ацидоз БДУ.
Общие сведения
Почечный канальцевый ацидоз (RTA, тубулярный, трубчатый, ацидоз почечных канальцев) определяется нефрологами как синдром, при котором нарушается выведение ионов водорода или реабсорбция фильтрованного бикарбоната, что приводит к хроническому метаболическому нарушению гомеостаза с гипохлоремией. Наиболее распространенным вариантом является генерализованный тип заболевания, второе место занимает поражение дистальных канальцев нефронов, форма с патологией проксимальных канальцев встречается реже. Точный уровень заболеваемости отследить сложно, поскольку латентные формы часто не распознаются. Наследственные почечные тубулопатии встречаются реже приобретенных.

Причины
Основная причина патологии – утрата способности почек подкислять мочу. Существует множество состояний, которые вызывают ацидоз почечных канальцев, при одних заболеваниях поражаются дистальные отделы, при других – проксимальные, иногда патология носит сочетанный характер или вызывается рядом нарушений, связанных с альдостероном. Характерными причинами для каждого типа являются:
- Первый (классический). При врожденных состояниях кислотно-щелочное равновесие изменяют мутации генов ATP6V1B1, ATP6V0A4 S1C4A, что инициирует дистальный почечный тубулярный ацидоз (синдром или болезнь Батлера-Олбрайта). Вторичная форма становится результатом приема лекарств, трансплантации почек и некоторых заболеваний (серповидноклеточной анемии, системной красной волчанки, синдрома Шегрена). Медуллярная губчатая почка, цирроз и хроническая обструктивная уропатия также рассматриваются как потенциальные триггеры.
- Второй (проксимальный). Проксимальный почечный канальцевый ацидоз сопровождает синдром Фанкони, нефропатию на фоне множественной миеломы, как осложнение развивается при длительном приеме ацетазоламида, сульфонамидов, ифосфамида, тетрациклина. Реже имеет другую этиологию: дефицит витамина Д, хроническую гипокальциемию с вторичным гиперпаратиреозом, ряд наследственных патологий: непереносимость фруктозы, окулоцереброренальный синдром, цистиноз.
- Четвертый (обобщенный, генерализованный). Почечный тубулярный ацидоз обусловлен дефицитом альдостерона или нарушением его взаимодействия с рецепторами. Как первопричину нарушения рассматривают прием калийсохраняющих диуретиков, циклоспорина, гепарина, других препаратов. Из нефрологических заболеваний тубулопатию провоцируют ХБП, хронический интерстициальный нефрит, ВИЧ-инфекция с поражением почек, в урологии – все ситуации, связанные с обструкцией мочевыводящих путей. Тубулярный почечный ацидоз (IV) вызывает аутоиммунная дисфункция (СКВ), серповидноклеточная анемия, диабет.
К утяжеляющим факторам относят диарею, отравление солями тяжелых металлов, оперативные вмешательства на органах ЖКТ с установлением дренажей, которые выводят основания вместе с жидким содержимым или секретом (например, поджелудочной железы). Длительная диарея и увеличение объема стула приводят к дополнительной потере бикарбонатов. Прием некоторых лекарственных препаратов – кальция хлорида, магния сульфата, холестирамина нарушают гомеостаз, в сочетании с почечной патологией усугубляют состояние.
Патогенез
При первом типе имеет место сбой секреции или всасывания ионов водорода в дистальных канальцах, что вызывает высокую кислотность крови с гиперхлоремией. При этом нарушается способность почек поддерживать нормальный градиент концентрации водородных ионов между кровью и тубулярной жидкостью. Гипотетически это может быть связано с уменьшением активности клеток, секретирующих ионы водорода, дефектом энергетического механизма, дефицитом систем транспортировки, патологическими изменениями А и Р-клеток нефрона, ответственных за выработку Н+. Гиперкальциурия, сниженная экскреция цитратов приводит к нефролитиазу.
При II типе присутствует дисфункция проксимальных трубочек с нарушением процессов реабсорбции бикарбонатов, НСО3-, но ацидогенетическая функция дистальных структур нефрона остается сохранной. Патогенез проксимального тубулярного ацидоза объясняют дефицитом или полным отсутствием карбоангидразы И-(С), снижением активности карбоангидразы 1-(В) крови и/или митохондриальной НСО3-АТФ-азы в мембранах эпителия проксимальных канальцев. Механизмы развития остеомаляции и остеопении (в том числе, рахита у детей) включают гиперкальциурию, гиперфосфатурию, дисметаболизм витамина Д.
Тип IV инициирует дефицит альдостерона или невосприимчивость к нему дистальных канальцев. Характерен дисбаланс электролитов: натрия, калия, хлора и гидрокарбоната. Гипокалиемия способствует уменьшению секреции аммиака, приводя к метаболической ацидемии. Это расстройство – наиболее распространенный вариант почечной дистальной тубулопатии – имеет вторичный или спорадический характер по отношению к нарушению оси ренин-альдостерон-ренальной системы.
Классификация
- Первый (тубулярный классический, дистальный). Заболевание вызвано уменьшением выработки молекул водорода дистальными канальцами, повышением экскреции HCO3- . Часто сопровождается нефрокальцинозом, камнеобразованием. Выделяют врожденный (аутосомно-доминантный, аутосомно-рецессивный с тугоухостью, аутосомно-рецессивный без нарушения слуха) и приобретенный варианты.
- Второй (тубулярный проксимальный). Возникает из-за патологии проксимального отдела почечных трубок. Ацидемия менее выражена из-за сохранности дистальных интеркалированных клеток, вырабатывающих кислоту. Основной особенностью синдрома является деминерализация костной ткани (остеомаляция, рахит) из-за истощения фосфатного обмена. Различают аутосомно-рецессивный, аутосомно-доминантный, спорадический (транзиторный детский и персистирующий взрослый) почечный ацидоз.
- Третий (тубулярный ювенильный). Представляет собой сочетание классического и второго типа почечной ацидемии. Аутосомно-рецессивная патология, связанная с генетической мутацией. Регистрируется крайне редко. Тубулопатию поддерживает унаследованный дефицит углекислой ангидразы 2.
- Четвертый (тубулярный гиперкалиемический). Вызван дефицитом или резистентностью к альдостерону. Сопутствующая гиперкалиемия приводит к патологическим процессам в миокарде. Почечная функция не нарушена или страдает незначительно. Состояние встречается преимущественно у взрослых, в большинстве наблюдений имеет вторичный характер.
Симптомы
Симптомы вариативны, связаны с причинными факторами. При первичном генетически обусловленном дистальном почечном тубулярном ацидозе до появления развернутых клинических проявлений у детей обнаруживается бледность кожных покровов, мышечная гипотония, полиурия и, как следствие, полидипсия. В ряде случаев наследственную патологию сопровождает тугоухость, глазные аномалии. Температура тела незначительно повышена, есть склонность к запорам. Иногда единственным симптомом становится отставание в физическом развитии от сверстников.
В тяжелых случаях без лечения примерно по достижении 2-летнего возраста происходит деформация костей скелета. К 3-4 годам, если патология не диагностирована, и ребенок не получает лечения, прогрессирует задержка роста и интеллектуальных способностей. Кости нижних конечностей Х-образно искривляются, грудная клетка приобретает бочкообразную форму, голова выглядит непропорционально большой. Патологические переломы, костные боли, снижение мышечного тонуса свидетельствуют о прогрессировании патологического процесса.
Реакциями со стороны нервной системы при длительно существующих обменных нарушениях являются раздражительность, агрессивность. Типично раннее наступление пубертата. На фоне развившегося нефрокальциноза присоединяются рецидивирующие инфекции мочевыводящих путей, которые проявляются резями при учащенном мочеиспускании, поясничными болями, повышением температуры. Нефролитиаз и самостоятельное отхождение конкрементов сопровождаются почечной коликой, тошнотой, рвотой.
Проксимальный тип тубулярного почечного ацидоза имеет схожую симптоматику, но рахитоподобные изменения развиваются раньше, а нефрокальциноз выявляется значительно реже. Для второго варианта тубулопатии характерно более тяжелое течение, без лечения патология может прогрессировать до ацидемической комы. Типичен эксикоз (обезвоживание) с обмороками, резким цианозом, одышкой. Изменению подвергается волосяной покров: волосы колючие, жесткие, при соответствующей терапии становятся мягче. Иногда патологическое состояние проходит самостоятельно без какого-либо лечения к 3-10 годам.
У взрослых электролитные расстройства протекают бессимптомно или порождают более мягкую симптоматику. Гипокалиемия вызывает мышечную слабость, снижение рефлексов, параличи. Проявления со стороны опорно-двигательного аппарата включают остеомаляцию, боли. Подобные признаки более типичны для проксимального почечного ацидоза, но могут определяться и при дисфункции дистальных канальцев. Четвертый тип чаще бессимптомный, диагностируется при выявлении незначительной ацидемии. Существует риск нарушений сердечного ритма, особенно если состояние сопровождается выраженной гиперкалиемией.
Осложнения
Без надлежащего лечения хроническая кислотность крови осложняется задержкой роста, нефролитиазом, переломами. У пациентов наблюдают рецидивирующий пиелонефрит, нефрокальциноз, постепенную утрату почечной функции вплоть до терминальной стадии ХПН. Основным последствием дистальной тубулопатии является гипокалиемия, которая сопровождается аритмией, нередко становящейся причиной летального исхода. У детей отсутствие терапии ведет к тяжелым деформациям костей, задержке психического развития. Выраженная гиперкалиемия (IV) осложняется перепадами АД, бронхоспазмом, кишечными коликами.
Диагностика
Ведущая роль в диагностике принадлежит лабораторным анализам. Инструментальные исследования назначаются для определения основной патологии при вторичном почечном тубулярном ацидозе. При наличии в роду наследственных заболеваний необходима консультация генетика, при признаках обструктивной нефропатии требуется осмотр уролога. У детей с наследственными формами, сопровождающимися врожденной глухотой, в обследовании принимает участие сурдолог. Алгоритм диагностики индивидуален, результаты анализов и инструментальных методов вариативны.
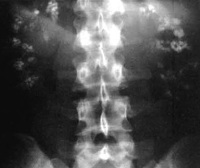
Инструментальная диагностика включает УЗИ почек и мочевого пузыря, КТ и МРТ для исключения обструктивных уропатий, нефролитиаза. При тубулярном ацидозе (I) на сонограммах всегда определяется патология почек, для проксимального типа она нехарактерна. На рентгенограммах у детей визуализируются рахитические изменения скелета, поражение трубчатых костей голеней, кистей. Минеральную плотность костной ткани определяют с помощью денситометрии. Деминерализация костей без явного рахита или остеомаляции сопутствует 1 и 4 типам, витамин Д-ассоциированный рахит, остеомаляция характерны для 2 варианта.
Дифференциальную диагностику проводят между возможными типами нарушения кислотно-щелочного равновесия, почечными патологиями иного генеза. Синдром Фанкони имеет схожие проявления с проксимальным и дистальным тубулярным ацидозом. Генетически обусловленные формы дистального почечного ацидоза различают с псевдогипоальдостеронизмом, первичной гипероксалатурией, нефрокальцинозом иного генеза. Иногда требуется дифференциация с почечной недостаточностью, сахарным диабетом, салицилатной нефропатией.
Лечение почечного тубулярного ацидоза
Лечение направлено на коррекцию дисбаланса электролитов (калия, кальция, фосфатов), предотвращение осложнений, коррелирует с типом патологии. Операции выполняют только для исправления тяжелых деформаций костей. Основным мероприятием остается назначение ощелачивающей терапии, без лечения при тубулярном почечном ацидозе у детей замедляется рост, страдает умственное развитие. Щелочные агенты помогают достичь относительно нормальной концентрации бикарбонатов плазмы, скорректировать нарушения.
Медикаментозная терапия
Лечение классического почечного тубулярного ацидоза необходимо для поддержки роста у детей, ликвидации костных изменений, профилактики накопления интерстициальной тканью кальция. Назначают бикарбонат натрия, калия-натрия гидроген цитрат. При остеопатии используют активные метаболиты витамина Д3, что требует осторожности из-за риска развития гиперкальциурии. Терапия проксимального варианта включает пероральное введение цитрата калия. При резистентности в схему добавляют гидрохлортиазид. При ювенильном варианте применяют цитрат натрия или цитрат калия. Дозы подбирают индивидуально.
Основное лечение четвертого варианта направлено на восполнение или замещение альдостерона. Пациентам рекомендуют исключить из питания продукты, богатые калием. Дополнительно вводят NaCl на фоне мониторинга К крови, альдостерона, ренина плазмы. Необходимо прекратить прием лекарств, поддерживающих гиперкалиемию, осуществлять лечение основной патологии (ЗГТ минералокортикоидами). Назначают диуретики (фуросемид, гидрохлортиазид). При отсутствии ответа на лечение используют флудрокортизон, бикарбонат натрия для компенсации ацидемии и усиления экскреции К.
Прогноз и профилактика
Своевременно начатое лечение улучшает исход для всех случаев. При дистальной тубулопатии прием препаратов до присоединения нефрокальциноза благоприятно влияет на прогноз. Проксимальная транзиторная форма с возрастом может купироваться самостоятельно, но подщелачивающая терапия обеспечивает нормальный рост и препятствует деминерализации, рахиту, у взрослых лечение предотвращает развитие остеомаляции. Прогноз почечного ацидоза (IV) определяется тяжестью основного заболевания. За пациентами наблюдают, контролируют электролиты крови каждые 12 недель, проводят УЗИ почек 1 раз в 6 месяцев.
Меры профилактики для врожденной патологии отсутствуют, при отягощенном семейном анамнезе показана консультация генетика. Важно своевременное лечение урологических и нефрологических заболеваний, которые могут приводить к тяжелым формам тубулопатий. Особого наблюдения требуют пациенты с почечным канальцевым ацидозом на фоне уремии (почечная недостаточность с нарушением скорости клубочковой фильтрации, высоким уровнем креатинина, мочевины). Больные, получающие адекватное лечение, обычно не имеют выраженных симптомов, многие из них могут вести нормальную жизнь.
1. Федеральные клинические рекомендации по оказанию медицинской помощи детям с тубулопатиями/ Баранов А.А. – 2015.
2. Ренальный тубулярный ацидоз (обзор литературы)/ Вашурина Т.В., Сергеева Т.В.// Нефрология и диализ – 2003 - №2.
Читайте также:

