Обструктивные бронхиты при цитомегаловирусе
Обновлено: 24.04.2024
В статье представлены данные о значимости инфекции при формировании бронхообструктивного синдрома у детей. Особое внимание уделено рецидивирующим эпизодам обструктивного бронхита. Представленный клинический пример подтверждает оптимальную тактику ведения
Management strategy for recurrent broncho-obstructive syndrome in children T. A. Ruzhentsova, N. A. Meshkova, E. K. Shushakova
The article presents the data on infection significance in broncho-obstructive syndrome formation in children. Special attention is paid to the recurrent episodes of obstructive bronchitis. The introduced clinical case proves the optimum management strategy using, mainly, etiotropic therapy. It was shown, that, in revealing the virus of herpes 6th type, inosine pranobex is effective.
Согласно данным Российского респираторного общества, 25% детей переносит бронхообструктивный синдром в возрасте до 6 лет, причем более чем у половины из них этот симптомокомплекс рецидивирует [1].
Бронхиальной обструкции способствуют прежде всего анатомо-физиологические особенности раннего возраста: гиперплазия желез, выделение вязкой мокроты, малый диаметр просвета дыхательных путей, возрастная физиологическая недостаточность местного иммунитета. Стоит отметить, что любое неблагоприятное воздействие на дыхательные пути ребенка: инфекции, загрязненный или холодный воздух, приводит к повышению вязкости и количества секрета, что влечет за собой застой слизи и нарушение проходимости бронхиального дерева [2]. Бронхообструктивный синдром может быть вызван спазмом на уровне мелких бронхов аллергического происхождения (у детей раннего детства проявляется нетипично в силу слабого развития гладких миоцитов бронхов), аспирацией инородного тела, врожденными аномалиями и патологиями дыхательных путей [3]. Из всех перечисленных факторов в настоящее время в формировании бронхиальной обструкции особо значимую роль играют инфекционно-воспалительные очаги. Значение имеют как бактерии, так и вирусы: респираторно-синцитиальный вирус, парагрипп, вирусы группы герпеса. Нередко у детей отмечается вторичный иммунодефицит, способствующий длительной персистенции возбудителей, пролонгированному течению острых респираторных инфекций с быстрым присоединением осложнений, в том числе и обструктивного бронхита. В таких случаях часто в течение года регистрируются многократные эпизоды ОРВИ с практически непрерывно протекающим бронхообструктивным синдромом.
Частота проявления бронхиальной обструкции на фоне вирусных инфекций у детей достигает 50%. В 30–50% таких случаев сложно провести дифференциальную диагностику с бронхиальной астмой [3].
В настоящее время появляются новые подтверждения значимости вирусов группы герпеса, инфицированность которыми очень высока. От 0,5% до 2,5% новорожденных являются носителями цитомегаловируса (ЦМВ). В первый год жизни вероятно приобретение данной инфекции от окружающих. Частота выявления ЦМВ у детей старше года достигает 60% [4]. Заражение может произойти воздушным, контактно-бытовым и оральным путями, в том числе через грудное молоко матери. ЦМВ выявляется в грудном молоке у 30% инфицированных женщин [4]. В работе В. К. Котлукова и соавт. отмечена непосредственная связь цитомегаловирусной инфекции (ЦМВ-инфекции) у детей раннего возраста с частой заболеваемостью респираторной патологией и рецидивирующим бронхообструктивным синдромом [5]. Первичное инфицирование ЦМВ влечет за собой иммуносупрессорный эффект, влекущий за собой развитие новых инфекций [6, 7]. Также известно, что как первичное инфицирование, так и латентная персистенция в организме инициируют развитие хронического воспаления I типа [8]. Объясняется это появлением Т-лимфоцитов, лишенных антигена CD-28.
В целом клинические проявления ЦМВ-инфекции очень неспецифичны и разнообразны, что затрудняет раннюю своевременную диагностику этого заболевания [9].
К той же группе относится и вирус герпеса 6-го типа (ВГЧ 6-го типа). Он может становиться причиной различных симптомов, помимо хорошо известной внезапной экзантемы. В РФ, по данным проведенных исследований, антителами к ВГЧ 6-го типа обладают 72–95% детей в возрасте до 3 лет [10]. В исследовании, проведенном на базе ФГБУ НИИ вирусологии им. Д. И. Ивановского, бронхообструктивный синдром на фоне ОРВИ с выявленисм маркеров активности ВГЧ 6-го типа был зафиксирован у 31 из 95 детей (33%). Большие концентрации ДНК вируса в слюне детей до 3 лет подтверждают тот факт, что слюнные железы играют роль резервуара для вируса [11, 12]. При исследованиях роли герпесов были получены результаты, говорящие о том, что у детей с рецидивирующими респираторными заболеваниями необходимо проводить диагностику для уточнения типа и варианта течения герпетической инфекции [13].
В другой работе было показано, что частые рецидивы респираторных заболеваний у детей в 87% случаев обусловлены тем или другим типом герпесвирусов: Эпштейна–Барр, ЦМВ или ВГЧ 6-го типа, в 44% случаев при этом присоединяется бактериальная флора [14].
Стандартная терапия бронхообструктивного синдрома включает применение бронхолитиков и кортикостероидов. Однако, эффективно снимая симптомы обструкции, эти препараты не подавляют вирусный процесс. В отсутствие эффективной противовирусной терапии сохраняющийся этиологический фактор способствует повторению эпизодов обструкции, может приводить к непрерывно рецидивирующему течению с формированием типичной картины бронхиальной астмы. В то же время правильно подобранная этиотропная терапия способна снизить частоту рецидивов бронхообструкции вплоть до полного прекращения. Как правило, вместе с этим существенно снижается общая частота острых респираторных инфекций. Эффективность противовирусной терапии для профилактики повторных эпизодов бронхообструкции показывает следующий клинический пример.
Мальчик Ж., 4 лет, впервые консультирован врачами ФБУН ЦНИИЭ Роспотребнадзора 8 апреля 2015 г. Со слов мамы, беспокоит сильный приступообразный, преимущественно сухой кашель, в том числе и в ночное время, умеренная потливость.
Из анамнеза жизни: родился доношенным, получал грудное вскармливание до 5 месяцев, до 2 лет на учете у специалистов не состоял, перенес 1 эпизод ОРВИ, развитие — по возрасту, вакцинирован согласно календарю. Аллергических реакций отмечено не было. Сопутствующей патологии нет.
Объективно: состояние среднетяжелое. Температура тела 37 °C. Кожные покровы бледные, периорбитальный цианоз. Частота дыхательных движений 30 в минуту. Дыхание через нос, выдох удлинен, слышен на расстоянии. Лимфатические узлы увеличены в переднешейной группе до 2,5 см в диаметре, плотные, безболезненные. Зев обычной окраски. Миндалины увеличены до 2-й степени, рыхлые, налетов нет. Аускультативно дыхание жесткое, рассеянные сухие свистящие хрипы над всеми отделами легких. Тоны сердца звучны, ритмичны, 102 удара в минуту. Живот мягкий. Стул и мочеиспускание в норме. Очаговой неврологической и менингеальной симптоматики нет.
По результатам дополнительного обследования: на рентгенограмме органов грудной клетке очаговых и инфильтративных теней нет. В анализе крови клиническом: гемоглобин — 128 г/л, лейкоциты — 5,6 × 10 9 , нейтрофилы сегментоядерные — 19%, эозинофилы — 3%, моноциты — 9%, лимфоциты — 69%, СОЭ — 7 мм/ч. По анализу мазка из зева методом полимеразно-цепной реакции обнаружен ВГЧ 6-го типа в количестве 7 × 10 6 копий/мл, другие показатели: ЦМВ, вирус Эпштейна–Барр — отрицательно. В анализе крови обнаружены антитела к ВГЧ 6-го типа IgG — 5,8 (коэффициент позитивности, норма 0–0,79), антитела к ВГЧ 6-го типа IgМ — отсутствуют, ДНК ВГЧ 6-го типа в крови отсутствует.
Проведено лечение: инозин пранобекс 50 мг/кг в сутки в 3 приема в течение 10 дней с повторением курса через 8 дней, монтелукаст 5 мг в сутки на ночь в течение 1 месяца. Во время лечения было рекомендовано при отсутствии затрудненного дыхания и приступов кашля ингаляции Беродуала не применять, будесонид продолжать.
После курса лечения кашель стал значительно реже, ночные приступы отсутствовали, температура тела устойчиво в норме. Аускультативно хрипы не выслушивались, дыхание имело жесткий оттенок. На этом фоне была рекомендована отмена будесонида с продолжением приема монтелукаста. Через еще 1 месяц жалобы отсутствовали, аускультативных отклонений не было, терапия полностью отменена. При лабораторном обследовании в мазке из зева ВГЧ 6-го типа не обнаружен.
При последующем наблюдении за ребенком в течение 4 лет отмечались редкие эпизоды ОРВИ: 2–3 в год, 2 раза к назофарингиту присоединялся бронхообструктивный синдром. С учетом ранее выявленной инфекции ВГЧ 6-го типа курсы инозина пранобекса и монтелукаста в этих ситуациях повторяли, при повторных осмотрах через 7 дней обструктивных хрипов не регистрировали. В период между эпизодами ОРВИ кашля не было, в поддерживающей терапии ребенок не нуждался.
Таким образом, представленный клинический пример подчеркивает важность и эффективность этиотропной терапии при бронхообструктивном рецидивирующем синдроме у детей. Многочисленные исследования и наблюдения показывают необходимость при хронических или рецидивирующих бронхитах целенаправленного поиска инфекционных агентов, в первую очередь вирусов группы герпеса с последующим соответствующим лечением. Антагонисты лейкотриеновых рецепторов (монтелукаст) имеют достаточно активное противовоспалительное действие, которое часто необходимо при бронхитах. Комплексное противовирусное и иммуномодулирующее действие инозина пранобекса в ситуации с длительным бронхообструктивным синдромом обеспечивает устойчивый результат при персистирующих вирусных инфекциях, в частности, обусловленных ВГЧ 6-го типа.
Литература
Т. А. Руженцова* , 1 , доктор медицинских наук, профессор
Н. А. Мешкова**
Е. К. Шушакова*
* ФБУН ЦНИИЭ Роспотребнадзора, Москва
** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва
Тактика ведения рецидивирующего бронхообструктивного синдрома у детей/ Т. А. Руженцова , Н. А. Мешкова, Е. К. Шушакова
Для цитирования: Лечащий врач № 10/2019; Номера страниц в выпуске: 17-19
Теги: вирус герпеса, бронхиальная обструкция, дети.
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10
Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Цитомегаловирусная инфекция у детей — это инфекционное заболевание, которое вызвано цитомегаловирусом и поражает слюнные железы, внутренние органы, ЦНС. В детстве патология чаще возникает при трансплацентарном или интранатальном заражении. Локализованные формы проявляются сиаладенитом, гепатитом, нефритом и т. д., распространенный вариант инфекции характеризуется поражением головного мозга, легких, почек и органов ЖКТ. Диагностика предполагает идентификацию возбудителя цитологическими, гистологическими, серологическими и молекулярно-биологическими методами. Лечение цитомегаловирусной болезни проводится специфическим иммуноглобулином и противовирусными препаратами.
МКБ-10
Общие сведения
Заражение цитомегаловирусной инфекцией (ЦМВИ) наблюдается у 20%‒60% всего детского населения, но в большинстве случаев оно протекает бессимптомно. Внутриутробное инфицирование вирусом от больной матери происходит в 30-50% случаев, при этом до 18% младенцев после рождения имеют клинические симптомы. Учитывая полиморфизм клинической картины, ранняя диагностика и лечение у детей затруднены. Цитомегаловирусная инфекция представляет серьезную опасность, особенно для плода и новорожденного, у которых заболевание, как правило, вызывает необратимые осложнения.

Причины
Болезнь вызвана герпесвирусом 5 типа — Cytomegalovirus hominis. Он имеет 6 штаммов: Davis, AD 169, Kerr, C-87, Esp, Towne, причем ребенок может быть инфицирован сразу несколькими подтипами возбудителя. Цитомегаловирус (ЦМВ) имеет ДНК-геном, отличается медленной репликацией и сравнительно низкой вирулентностью. Он термолабилен, уничтожается при температуре более 56°С, но длительно сохраняет жизнеспособность в комнатных условиях.
При врожденной ЦВМИ передача вируса к плоду происходит трансплацентарно, при перинатальной инфекции — путем контакта с вагинальными выделениями матери, грудным молоком или препаратами крови. Риск заражения увеличивается, если мать с острой формой болезни не получает специфическое лечение. В постнатальном периоде ребенок чаще всего заражается от ближайших родственников и сверстников воздушно-капельным или контактно-бытовым путем.
Патогенез
Попадая в кровь, вирус реплицируется в лейкоцитах, моноцитах и макрофагах и в дальнейшем он пожизненно сохраняется в лимфоцитарных органах. Зачастую процесс выражается в виде латентной инфекции, при которой у ребенка нет симптомов, и ему не требуется лечение. Активность цитомегаловируса зависит от состояния иммунитета: при физиологической иммунной недостаточности, которая наблюдается у детей раннего возраста, риск манифестной цитомегаловирусной инфекции возрастает в разы.
Классификация
В детской инфектологии различают врожденную (внутриутробную) и приобретенную формы патологии. По течению инфекция бывает острой (до 3 месяцев), подострой (3-6 месяцев), затяжной (6-12 месяцев) и хронической (более 1 года). По клиническим признакам выделяют локализованный (сиаладенит, нефрит, гепатит, энцефалит) и генерализованный вариант. С учетом тяжести течения цитомегаловирусную болезнь делят на 3 степени:
- Легкая. Отличается незначительными патоморфологическими изменениями во внутренних органах, которые не сказываются на их функциональной активности.
- Среднетяжелая. Проявляется выраженными органическими поражениями в сочетании с клиническими симптомами и расстройством функции некоторых внутренних органов.
- Тяжелая. Манифестирует тяжелыми органическими патологиями, резко выраженной интоксикацией и генерализованным характером поражения.
Симптомы
Врожденная ЦМВИ
У пациентов с манифестной врожденной форме цитомегаловирусной болезни признаки наблюдаются с первых дней жизни. Типичный комплекс симптомов у новорожденных детей включает недоношенность и/или низкую массу тела, поражение гепатобилиарной системы (увеличение печени, желтуха, гепатиты и циррозы), лимфаденопатии и геморрагическую сыпь на коже. Если инфицирование произошло на ранних сроках беременности, ребенок рождается с аномалиями — микроцефалией, гипоплазией легких, атрезией пищевода.
Приобретенная ЦМВИ
Приобретенная цитомегаловирусная болезнь обычно протекает в субклинической или латентной форме, когда у ребенка возникают гриппоподобные симптомы, субфебрильная температура без видимой причины. После заражения инфекция может длительное время себя не проявлять и давать обострения при снижении иммунного статуса, действии неблагоприятных эндо- или экзогенных факторов.
Течение манифестной приобретенной формы напоминает инфекционный мононуклеоз. У ребенка внезапно появляется слабость, повышается температура, беспокоят недомогание, головные боли, отсутствует аппетит. Позже присоединяются сильные боли в горле, увеличиваются подчелюстные и шейные лимфоузлы. Если цитомегаловирусная инфекция проявляется сиаладенитом, наблюдается резкое увеличение и болезненность слюнных желез на фоне фебрильной лихорадки.
Генерализованная ЦМВИ
При генерализованном варианте течения инфекции у детей поражается бронхолегочная система (пневмонии, дыхательная недостаточность), ЖКТ (энтероколит, мальабсорбция), печень (желтуха, цитомегаловирусный гепатит, билиарный цирроз). Особенно опасно вовлечение в процесс нервной системы, что проявляется судорожным синдромом, парезами и параличами, задержкой психомоторного развития.
Осложнения
Поражение клеток при цитомегаловирусной болезни создает благоприятные условия для возникновения аутоиммунных поражений — системной красной волчанки, рассеянного склероза, гломерулонефрита. Иногда после малосимптомной врожденной цитомегаловирусной инфекции осложнения наблюдаются в отдаленном периоде (в возрасте ребенка 2-5 лет). В основном они проявляются неврологическими расстройствами и поражением органов чувств.
Диагностика
Цитомегаловирусная инфекция отличается многообразием клинических признаков и часто протекает под маской других патологий, что затрудняет работу детского инфекциониста. На первичном приеме, помимо стандартного физикального осмотра, врач собирает детальный акушерский анамнез, чтобы выявить факторы риска антенатального инфицирования. Диагноз ЦМВИ правомочен только при лабораторном подтверждении, для чего используют следующие методы:
Инструментальные методы подбираются соответственно форме заболевания. Для оценки структурно-функциональных особенностей печени и билиарного тракта назначают УЗИ органов брюшной полости. КТ и МРТ головного мозга информативны для выявления врожденных пороков и кальцификатов. Рентгенография ОГК необходима при симптомах дыхательных расстройств. По показаниям ребенка направляют на консультации к профильным специалистам— кардиологу, неврологу, отоларингологу.
Лечение цитомегаловирусной инфекции у детей
Препаратом выбора у новорожденных и детей первого года жизни является специфический антицитомегаловирусный иммуноглобулин, который имеет повышенную концентрацию IgG. Лечение начинают при манифестных формах заболевания и проводят по схеме: вначале вводится высокая доза препарата, а спустя 9-10 дней дозировку постепенно уменьшают, контролируя степень ответа на терапию и активность процесса.
В старшем возрасте перечень препаратов, применяемых при цитомегаловирусной инфекции, значительно расширяется. Лечение включает противовирусные средства из группы нуклеозидов и нуклеотидов (ганцикловир, валганцикловир), производные ортофосфорной кислоты (фоскарнет). При легкой и среднетяжелой формах назначают интерфероны, иммуностимуляторы.
Для купирования интоксикации показано обильное питье (при легких формах), при среднетяжелых и тяжелых клинических вариантах рекомендована инфузионная терапия. Патогенетическая терапия подбирается в соответствии с характером течения болезни и может включать пищеварительные ферменты, ингибиторы протеиназ, гемостатики. Для предупреждения вторичных бактериальных осложнений используют антибиотики (макролиды, цефалоспорины, гликопептиды).
Прогноз и профилактика
При малосимптомных приобретенных вариантах цитомегаловирусная болезнь протекает без осложнений, зачастую у ребенка выявляется только латентное носительство. Угрозу для жизни и здоровья представляют тяжелые генерализованные инфекции, которые в 50-60% случаев сопровождаются осложнениями, несмотря на проводимое лечение. Особо опасно поражение цитомегаловирусом для детей с иммунодефицитными состояниями.
Основу профилактики врожденной ЦМВИ составляет обязательное лабораторное обследование женщин на носительство цитомегаловируса, которое проводится при планировании зачатия и во время беременности. Если в семье есть пациент с цитомегаловирусной инфекцией, необходимо ограничить его общение с ребенком и обеспечить лечение. Карантинно-изоляционные мероприятия в отношении заболевших и контактных лиц не производятся.
2. Клинические рекомендации (протокол лечения) оказания медицинской помощи детям больным цитомегаловирусной инфекцией. — 2015.
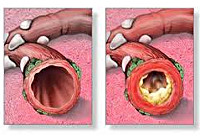
Обструктивный бронхит у детей - воспалительное поражение бронхиального дерева, протекающее с явлением обструкции, т. е. нарушением проходимости бронхов. Течение обструктивного бронхита у детей сопровождается малопродуктивным кашлем, шумным свистящим дыханием с форсированным выдохом, тахипноэ, дистанционными хрипами. При диагностике обструктивного бронхита у детей учитываются данные аускультации, рентгенографии грудной клетки, спирометрии, бронхоскопии, исследования крови (общего анализа, газов крови). Лечение обструктивного бронхита у детей проводится с помощью ингаляционных бронхолитиков, небулайзерной терапии, муколитиков, массажа, дыхательной гимнастики.
Общие сведения
Бронхиты у детей являются самими распространенными заболеваниями респираторного тракта. У детей раннего возраста воспаление бронхов нередко протекает с бронхообструктивным синдромом, обусловленным отеком слизистой, повышенной бронхиальной секрецией и бронхоспазмом. В первые три года жизни обструктивный бронхит переносят около 20% детей; у половины из них в дальнейшем эпизоды бронхообструкции повторяются, как минимум 2-3 раза.
Дети, неоднократно болеющие острыми и обструктивными бронхитами, составляют группу риска по развитию хронической бронхолегочной патологии (хронического бронхита, облитерирующего бронхиолита, бронхиальной астмы, бронхоэктатической болезни, эмфиземы легких). В связи с этим вопросы трактовки этиологии и патогенеза, клинического течения, дифференциальной диагностики и современного терапевтического лечения являются приоритетными для педиатрии и детской пульмонологии.

Причины
В этиологии обструктивного бронхита у детей первостепенную роль играют респираторно-синцитиальный вирус, вирус парагриппа 3 типа, энтеровирусы, вирусы гриппа, адено- и риновирусы. Подтверждением ведущего значения вирусных возбудителей служит тот факт, что в большинстве наблюдений манифестации обструктивного бронхита у ребенка предшествует ОРВИ.
При повторных эпизодах обструктивного бронхита у детей в смыве с бронхов часто выявляется ДНК персистирующих инфекций - хламидий, микоплазм, герпесвирусов, цитомегаловируса. Часто бронхит с обструктивным синдромом у детей провоцируется плесневым грибком, который интенсивно размножается на стенах помещений с повышенной влажностью. Оценить этиологическое значение бактериальной флоры довольно затруднительно, поскольку многие ее представители выступают условно-патогенными компонентами нормальной микрофлоры дыхательных путей.
Немаловажную роль в развитии обструктивного бронхита у детей играет аллергический фактор – повышенная индивидуальная чувствительность к пищевым продуктам, лекарственным препаратам, домашней пыли, шерсти животных, пыльце растений. Именно поэтому обструктивному бронхиту у детей часто сопутствуют аллергический конъюнктивит, аллергический ринит, атопический дерматит.
Рецидивам эпизодов обструктивного бронхита у детей способствует глистная инвазия, наличие очагов хронической инфекции (синуситов, тонзиллита, кариеса и др.), активное или пассивное курение, вдыхание дыма, проживание в экологически неблагоприятных регионах и т. д.
Патогенез
Патогенез обструктивного бронхита у детей сложен. Вторжение вирусного агента сопровождается воспалительной инфильтрацией слизистой бронхов плазматическими клетками, моноцитами, нейтрофилами и макрофагами, эозинофилами. Выделение медиаторов воспаления (гистамина, простагландинов и др.) и цитокинов приводит к отеку бронхиальной стенки, сокращению гладкой мускулатуры бронхов и развитию бронхоспазма.
Вследствие отека и воспаления увеличивается количество бокаловидных клеток, активно вырабатывающих бронхиальный секрет (гиперкриния). Гиперпродукция и повышенная вязкость слизи (дискриния) вызывают нарушение функции реснитчатого эпителия и возникновение мукоцилиарной недостаточности (мукостаза). Вследствие нарушения откашливания, развивается обтурация дыхательных путей бронхиальным секретом. На этом фоне создаются условия для дальнейшего размножения возбудителей, поддерживающих патогенетические механизмы обструктивного бронхита у детей.
Некоторые исследователи в бронхообструкции видят не только нарушение процесса внешнего дыхания, но и своего рода приспособительные реакции, которые в условиях поражения реснитчатого эпителия защищают легочную паренхиму от проникновения в нее патогенов из верхних дыхательных путей. Действительно, в отличие от простого бронхита, воспаление с обструктивным компонентом значительно реже осложняется пневмонией у детей.
По течению обструктивный бронхит у детей может быть острым, рецидивирующим и хроническим или непрерывно-рецидивирующим (при бронхолегочной дисплазии, облетирующем бронхиолите и др.). По степени выраженности бронхиальной обструкции выделяют: легкую (I), среднетяжелую (II), тяжелую (III) степень обструктивного бронхита у детей.
Симптомы обструктивного бронхита у детей
Чаще всего первый эпизод обструктивного бронхита развивается у ребенка на 2-3-м году жизни. В начальном периоде клиническая картина определяется симптомами ОРВИ – повышенной температурой тела, першением в горле, насморком, общим недомоганием. У детей раннего возраста нередко развиваются диспептические симптомы.
Бронхиальная обструкция может присоединяться уже в первые сутки заболевания или через 2-3 дня. При этом отмечается увеличение частоты дыхания (до 50-60 в мин.) и продолжительности выдоха, который становится шумным, свистящим, слышимым на расстоянии. Кроме тахипноэ, экспираторной или смешанной одышки у детей с обструктивным бронхитом отмечается задействованность в акте дыхания вспомогательной мускулатуры, увеличение переднезаднего размера грудной клетки, втяжение ее уступчивые мест при дыхании, раздувание крыльев носа. Кашель у детей с обструктивным бронхитом малопродуктивный, со скудной мокротой, иногда мучительный, приступообразный, не приносящий облегчения. Даже при влажном кашле мокрота отходит с трудом. Отмечается бледность кожных покровов или периоральный цианоз. Проявления обструктивного бронхита у детей могут сопровождаться шейным лимфаденитом. Бронхообструкция держится 3-7 дней, исчезает постепенно по мере стихания воспалительных изменений в бронхах.
У детей первого полугодия, особенно соматически ослабленных и недоношенных, может развиваться наиболее тяжелая форма обструктивного синдрома - острый бронхиолит, в клинике которого преобладают признаки тяжелой дыхательной недостаточности. Острый обструктивный бронхит и бронхиолит нередко требуют госпитализации детей, поскольку данные заболевания приблизительно в 1% случаев заканчиваются летальным исходом. Затяжное течение обструктивного бронхита наблюдается у детей с отягощенным преморбидным фоном: рахитом, хронической ЛОР-патологией, астенизацией, анемией.
Диагностика
Клинико-лабораторное и инструментальное обследование детей с обструктивным бронхитом проводится педиатром и детским пульмонологом; по показаниям ребенку назначаются консультации детского аллерголога-иммунолога, детского отоларинголога и других специалистов. При аускультации выслушивается удлиненный выдох, разнокалиберные влажные и рассеянные сухие хрипы с двух сторон; при перкуссии над легкими определяется коробочный оттенок.
На рентгенограммах органов грудной клетки выражены признаки гипервентиляции: повышение прозрачности легочной ткани, горизонтальное расположение ребер, низкое стояние купола диафрагмы. В общем анализе крови может выявляться лейкопения, лимфоцитоз, небольшое увеличение СОЭ, эозинофилия. При исследовании газового состава крови обнаруживается умеренная гипоксемия. В случае необходимости дополнительно проводится иммунологическое, серологическое, биохимическое исследование крови; определение ДНК основных респираторных патогенов в крови методом ПЦР, постановка аллергологических проб. Выявлению возбудителей могут способствовать микроскопическое исследование мокроты, бакпосев мокроты на микрофлору, исследование смывов из носоглотки.
При обструктивном бронхите у детей необходимо исследование дыхательных объемов (ФВД), в том числе с лекарственными пробами. С целью визуальной оценки состояния слизистой оболочки бронхов, проведения бронхоальвеолярного лаважа, цитологического и бактериологического исследования промывных вод детям с обструктвиным бронхитом выполняется бронхоскопия.
Повторные эпизоды обструктивного бронхита требуют дифференциальной диагностики с бронхиальной астмой у детей.
Лечение обструктивного бронхита у детей
Терапия обструктивного бронхита у детей раннего возраста проводится в стационаре; более старшие дети подлежат госпитализации при тяжелом течении заболевания. Общие рекомендации включают соблюдение полупостельного режима и гипоаллергенной (преимущественно молочно-растительной) диеты, обильное питье (чаи, отвары, морсы, щелочные минеральные воды). Важными режимными моментами служат увлажнение воздуха, регулярная влажная уборка и проветривание палаты, где лечатся дети с обструктивным бронхитом.
При выраженной бронхообструкции активно применяется кислородотерапия, горячие ножные ванны, баночный массаж, удаление слизи из верхних дыхательных путей электроотсосом. Для снятия обструкции целесообразно использовать ингаляции адреномиметиков (сальбутамола, тербуталина, фенотерола) через небулайзер или спейсер. При неэффективности бронхолитиков лечение обструктивного бронхита у детей дополняется кортикостероидами.
Для разжижения мокроты показано применение препаратов с муколитическим и отхаркивающим эффектами, лекарственных и щелочных ингаляций. При обструктивном бронхите детям назначаются спазмолитические и противоаллергические средства. Антибактериальная терапия проводится только в случае присоединения вторичной инфекции.
С целью обеспечения адекватного дренажа бронхиального дерева детям с обструктивным бронхитом показана дыхательная гимнастика, вибрационный массаж, постуральный дренаж.
Прогноз и профилактика
Около 30-50% детей склонны к повторению обструктивного бронхита в течение одного года. Факторами риска рецидива бронхообструкции служат частые ОРВИ, наличие аллергии и очагов хронической инфекции. У большинства детей эпизоды обструкции прекращаются в дошкольном возрасте. Бронхиальная астма развивается у четверти детей, перенесших рецидивирующий обструктивный бронхит.
К мерам профилактики обструктивного бронхита у детей относится предупреждение вирусных инфекций, в том числе при помощи вакцинации; обеспечение гипоаллергенной среды, закаливание, оздоровление на климатических курортах. После перенесенного обструктивного бронхита дети находятся на диспансерном наблюдении у педиатра, возможно - детского пульмонолога и аллерголога.
Читайте также:

