Обзор литературы по сепсису
Обновлено: 12.05.2024
информацию о наличии сепсиса, о его тяжести и о текущем прогнозе его развития.
Идеальный маркер сепсиса должен также обеспечивать надежный мониторинг
эффективности терапии и оперативно менять ее тактику.
Традиционные маркеры сепсиса, такие как С-реактивный белок,
прокальцитонин, лактат, эндотоксин и др. не отвечают вышеперечисленным
требованиям. Однако недавние клинические исследования нового биомаркера,
названного пресепсином, показали, что он является многообещающим ранним и
прогностическим маркером сепсиса [6, 7].
Пресепсин (ПСП) – это белок (мол. масса 13 КДа) являющийся N-концевым
фрагментом рецептора макрофагов CD14. CD14 – это белок, существующий в двух
формах: 1) связанной с мембраной (mCD14) и присутствующей на поверхности
макрофагов, моноцитов и гранулоцитов и 2) в растворимой (sCD14, s – soluble,
растворимый), циркулирующей в кровотоке. mCD14 – рецептор, ответственный за
трансдукцию эндотоксинового сигнала внутрь клеток. Выход mCD14 в кровоток и
образование sCD14 связаны с инфекцией и с некоторыми другими патологическими
состояниями. При активации бактериального фагоцитоза sCD14 и mCD14
расщепляются лизосомальными протеиназами с образованием фрагмента, исходно
названного sCD14-subtype (sCD14-ST), а потом переименованного в пресепсин [6, 7].
Один из механизмов образования ПСП связан с бактериальным фагоцитозом и
расщеплением mCD14 лизосомальными ферментам (рис. 1) [8].
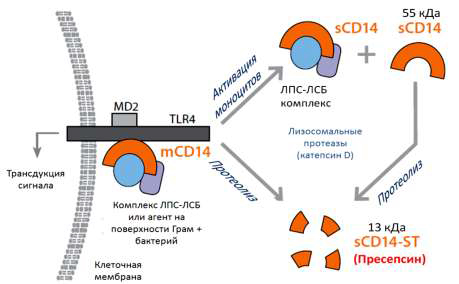
Рис. 1. Механизм образования ПСП.
mCD14 – СD14, связанный с мембраной, sCD14 – растворимый CD14, sCD14-ST – пресепсин, ЛПС –
липополисахарид, ЛСБ – липополисахарид связывающий белок, TLR4 – толл-подобный рецептор 4; MD2 – белок,
связанный с TLR4. Подробности в тексте.
Показано, что ПСП повышается в связи с инфекцией и специфически
продуцируется при сепсисе, связанном с грамотрицательными и
грамположительными бактериями, с грибками, при вирусных инфекция ПСП не
продуцируется [9, 10]. Недавно был разработан новый диагностический инструмент –
хемилюминесцентный иммуноферментный анализатор PATHFAST, который _______за 17
мин проводит полностью автоматические измерения важнейших биомаркеров
различных критических состояний и в особенности – пресепсина.
Эффективность ПСП для диагностики сепсиса. Измерения уровней ПСП при
разных патологических состояниях помощью экспресс-анализатора PATHFAST
показали, что этот маркер является высоко специфическим по отношении к сепсису
[7]. Анализ чувствительности и специфичности ПСП, проведенный в различных
исследованиях, продемонстрировал, что он обеспечивает: 1) раннюю диагностику
сепсиса непосредственно при поступлении пациента, 2) прогнозирование течения
заболевания и 3) оценку риска неблагоприятных исходов. Согласно результатам
клинических исследований уровни ПСП имеют сильную связь со степенью тяжести
сепсиса и 30-дневной смертностью.
В недавнем проспективном исследовании 859 пациентов с ССВО, поступивших
в отделения неотложной терапии (ОНТ) подтверждено, что ПСП – высоко
эффективный биомаркер, действительно пригодный для ранней диагностики сепсиса,
стратификации риска, мониторинга терапии и прогнозирования исходов у септических
пациентов [11]. Данное исследование показало, что одновременное измерение
уровней ПСП и оценка тяжести пациентов с помощью шкал MEDS и APACHE II
значительно улучшает точность прогнозирования развития тяжелого сепсиса.
Предварительные исследования показали также, что ПСП – весьма
перспективный маркер неонатального и педиатрического сепсиса [12].
К сожалению, несмотря на широкое применение современных антибиотиков и
высокотехнологичных методов реанимации, сепсис все еще является главной
причиной смертности пациентов в ОНТ и в ОРИТ, поэтому ранняя диагностика
сепсиса сразу при поступлении пациентов – ключевой момент для повышения
выживаемости таких больных. ПСП - многообещающий маркер для решения этой
Эффективность ПСП для прогнозирования сепсиса. При сепсисе
повышение ПСП сильно связано с повышением риска неблагоприятного исхода, а
снижение – с повышением шансов выживания. Более того, как показано в
специальном исследовании, именно ПСП, по сравнению с другими маркерами
сепсиса, наилучшим образом отражает динамику тяжести сепсиса (рис. 2) [13].
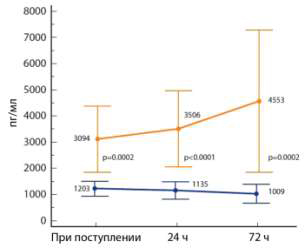
Рис. 2. Динамика ПСП у септических пациентов
с благоприятным исходом (внизу) и у не выживших (вверху).
Недавнее многоцентровое ретроспективное рандомизированное исследование,
в котором наблюдались пациенты, поступившие в ОИТ с сепсисом и септическим
шоком, показало, что уровни ПСП адекватно отражают изменение тяжести патологии
у впоследствии выживших и не выживших пациентов [14].
1.Согласно существующей практике, измерение широко используемых
маркеров сепсиса проводится в центральной лаборатории, что ведет к существенной
задержке получения срочной и жизненно важной диагностической информации.
2. Ни один из ныне широко используемых маркеров сепсиса не сочетает в себе
возможности для ранней диагностики сепсиса, стратификации рисков, с ним
связанных, прогнозирования и мониторинга течения сепсиса.
3. Пресепсин – новый, многообещающий маркер, который позволяет через 17
минут после взятия крови проводить:
а) раннюю и точную дифференциальную диагностику ССВО и сепсиса,
б) оценку тяжести сепсиса,
в) оперативный мониторинг эффективности его терапии,
г) прогнозирование его исхода, особенно эффективное при параллельной
оценке тяжести пациента согласно шкалам APACHEII, SOFA и MEDS.
4. Измерение уровней ПСП возможно оперативно проводить непосредственно
при поступлении пациента в ОНТ, ОИТ, ОРИТ и в операционном блоке (тестирование
Point-of-Care), что обеспечит своевременное принятие обоснованных клинических
Диагностические уровни пресепсина, пг/мл
Умеренный риск развития системой инфекции (тяжелого
сепсиса / септического шока).
Высокий риск 30-дневной смертности, сравнимый с таковым
1. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions
Conference. Crit Care Med. 2003;31(4):1250-6.
2. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of
innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of
Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644-55.
prospectively derived and validated clinical prediction rule. Crit Care Med. 2003;31(3):670-5.
4. Kumar A, Roberts D, Wood KE, et al. Duration of hypotension before initiation of effective antimicrobial
therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006;34(6):1589-96.
5. Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for
management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580-637.
6. Shozushima T, Takahashi G, Matsumoto N, et al. Usefulness of presepsin (sCD14-ST) measurements as
a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory
response syndrome. J Infect Chemother. 2011;17(6):764-9.
7. Spanuth E, Wilhelm J, Loppnow H, et al. Diagnostic and Prognostic Value of Presepsin (Soluble CD14
Subtype) in Emergency Patients with Early Sepsis Using the New Assay PATHFAST Pesepsin. IFCC World
Lab/EuroMedLab. 2011 May.
8. Naitoh K, Shirakawa K, Hirose J, et al. The new sepsis marker, sCD14-ST (PRESEPSIN), induction
mechanism in the rabbit sepsis models. SEPSIS 2010; poster:P-19.
9. Yaegashi Y, Shirakawa K, Sato N, et al. Evaluation of a newly identified soluble CD14 subtype as a marker
for sepsis. J Infect Chemother. 2005;11(5):234-8.
10. Kojika M, Takahashi G, Matsumoto N, et al. Serum levels of soluble CD14 subtype reflect the APACHE II
11. Liu B, Chen YX, Yin Q, et al. Diagnostic value and prognostic evaluation of Presepsin for sepsis in an
emergency department. Crit Care. 2013;17(5):R244.
12. Mussap M, Puxeddu E, Burrai P et al. Soluble CD14 subtype (sCD14-ST) presepsin in critically ill preterm
newborns: preliminary reference ranges. J Matern Fetal Neonatal Med. 2012;25(Suppl 5):51-3.
13. Endo S, Suzuki Y, Takahashi G, et al. Presepsin as a powerful monitoring tool for the prognosis and
treatment of sepsis: A multicenter prospective study. J Infect Chemother. 2013,
14. Masson S, Caironi P, Spanuth E, et al. Presepsin (soluble CD14 subtype) and procalcitonin levels for
Клиническая больница №1
Центральная клиническая больница с поликлиникой Управления делами Президента РФ, Москва
Современные возможности лечения сепсиса на основе сорбционных методик (обзор литературы)
Клиническая больница №1
Сепсис и септический шок (СШ) остаются важной проблемой медицины, поскольку являются одной из наиболее частых причин смерти в отделении интенсивной терапии. Согласно данным литературы, внутрибольничная летальность от сепсиса колеблется в пределах 14—41%. Сепсис запускает каскад клеточных и иммунологических реакций, главную роль в которых играют эндотоксин (ЭТ) и провоспалительные цитокины. Массированный выброс ЭТ и провоспалительных цитокинов приводит к тканевому и капиллярному повреждению, вызывая нарушение микроциркуляции, генерализованную вазодилатацию, что в итоге приводит к циркуляторную и тканевую гипоксию и полиорганную недостаточность (ПОН) с высокой летальностью. В настоящее время методом, который может снизить летальность больных с сепсисом/СШ, является сорбция ЭТ. Цель обзора — обобщение результатов применения экстракорпоральной сорбции ЭТ и цитокинов как одного из методов терапии сепсиса/СШ. В обзоре представлены данные зарубежных и отечественных авторов о результатах применения сорбционных методик у больных сепсисом/СШ. Анализ мировой литературы показал, что на сегодняшний день наиболее эффективным и широко используемым в клинической практике является картридж с иммобилизированным полимиксином В. Часть сорбентов находится в стадии клинических исследований и накопления полученных результатов. Перспективным и многообещающим является использование сорбентов, способных элиминировать цитокины, участвующие в развитии ПОН. Таким образом, представленные данные литературы показывают, что в настоящее время сорбция ЭТ и цитокинов является методом, позволяющим улучшить результаты лечения больных сепсисом/СШ.
Клиническая больница №1
Центральная клиническая больница с поликлиникой Управления делами Президента РФ, Москва
Повышенное внимание к сепсису и септическому шоку (СШ) со стороны клиницистов и специалистов по лабораторной диагностике обусловлено следующими причинами: увеличением числа случаев, высоким уровнем летальности и сложностями при установлении диагноза.
Согласно данным литературы, в США ежегодно диагностируется 650—750 случаев сепсиса на 100 тыс. населения, СШ развивается в 58% случаев [1]. Число больных сепсисом в Европе варьирует от 79 в Словакии до 295 случаев на 100 тыс. населения в Нидерландах [2—5].
Прогноз при сепсисе зачастую непредсказуем, летальность даже в ведущих клиниках развитых стран достигает 40%, а при СШ — 80—90% [6].
Необходимо констатировать, что внутрибольничная летальность при сепсисе остается на высоком уровне, несмотря на современные возможности медицины. По данным международного многоцентрового исследования Sepsis Occurrence In Acutely ill Patients (SOAP) (представлены результаты 198 европейских медицинских центров), средняя внутрибольничная летальность составила 24,1% (от 14% в Швейцарии до 41% в Португалии) [7]. Результаты другого многоцентрового исследования — Promoting Global Research Excellence in Severe Sepsis (PROGRESS) показали, что внутрибольничная летальность достигает 49,6% [8].
По данным Европейского эпидемиологического проспективного исследования SOAP, первичный очаг при сепсисе в 68% случаев локализуется в легких, в 22% — в брюшной полости [3]. Имеются определенные особенности развития источника первичного очага инфекции в зависимости от региона мира. В частности, в странах Западной Европы и Северной Америке в качестве источника преобладают легкие и брюшная полость. В странах Восточной Европы, включая 8 центров из России, очагами первичной инфекции были легкие и мочевыводящие пути [9].
Представление о патогенезе сепсиса и методах его лечения за последние 30 лет неоднократно менялись. В 2016 г. были приняты новые консенсусные дефиниции сепсиса (Сепсис-3) и СШ, авторами которых являлись эксперты Society of Critical Care Medicine (SCCM) и Europan Society Intensive Care Medicine (ESICM) [10]. В них сепсис определяется как угрожающая жизни дисфункция, причина которой — дис-регуляторный ответ на инфекцию. Новые дефиниции позволяют раньше выявлять больных с сепсисом и начинать лечение в кратчайшие сроки [6, 10, 11].
При сепсисе и СШ важная роль в возникновении ПОН отводится эндотоксину (ЭТ) грамотрицательных бактерий, который выявляется приблизительно у 80% больных [13]. Высокий уровень ЭТ в крови больных сепсисом коррелирует с высоким риском летального исхода. Повышенный уровень ЭТ регистрируется при бактериологически подтвержденной грамотрицательной инфекции, однако имеются сведения, что уровень ЭТ увеличивается при грамположительной флоре, грибковой инфекции, а также при СШ, когда источник инфекции не установлен микробиологическими методами. В настоящее время известно, что желудочно-кишечный тракт является резервуаром Э.Т. Поэтому нарушение перфузии и барьерной функции слизистой оболочки желудочно-кишечного тракта приводит к транслокации ЭТ и манифестации сепсиса [13, 14].
ЭТ представляет собой облигатный липополисахарид бактериальной стенки грамотрицательных бактерий. Структура Э.Т. включает длинную цепь жирных кислот (липид А) и полисахаридное ядро. К сердцевине ядра прикреплена вариабельная углеводная цепочка (О-антиген), которая уникальна для каждой бактерии и определяет ее серотип. В результате разрушения бактериальной стенки грамотрицательной бактерии происходит высвобождение Э.Т. Поступление Э.Т. в кровь вызывает активацию различных биологически активных систем. Кроме того, ЭТ, взаимодействуя с макрофагами, усиливает продукцию свободных кислородных радикалов, что приводит к инициации диссеминированного внутрисосудистого свертывания крови. Высокую чувствительность к ЭТ имеют почки, легкие и сердечно-сосудистая система [15, 16].
Удаляя ЭТ из крови больных сепсисом и СШ, можно уменьшить выраженность ПОН, а следовательно, снизить летальность. Для реализации этой идеи были разработаны специальные методы.
Метод сорбции заключается в способности притягивать растворенные вещества к сорбенту. Сорбенты обладают высокой адсорбционной емкостью, что делает их идеальными для применения у больных с сепсисом и С.Ш. Сорбенты могут применяться как самостоятельно, так и в комбинации с другими широко известными экстракорпоральными методами лечения (ЭМЛ).
Наиболее изученным и широко используемым у больных с сепсисом и СШ является картридж с иммобилизированным ПМ-В. ПМ-В представляет собой катионный полипептидный антибиотик с высокой активностью по отношению к грамотрицательным бактериям и аффинной способностью к Э.Т. Внутривенное применение ПМ-В ограничено из-за его высокой нефро- и нейротоксичности. Возможность фиксации ПМ-В на полистиреновом волокне картриджа позволяет удалять ЭТ без риска развития побочных эффектов. Картридж с ПМ-В был разработан и разрешен к клиническому применению в Японии в 1993 г. В 1998 г. применение ПМ-В одобрено в Европе.
Таким образом, наибольший опыт использования препарата накоплен в Японии, где на протяжении 17 лет методика картриджа с ПМ-В включена в комплексное лечение СШ, вызванного грамотрицательными бактериями. Имеется лабораторное подтверждение эффективности картриджа с ПМ-В как компонента ЭМЛ: после процедуры в крови больных снижалась концентрация ЭТ, цитокинов, фактора некроза опухоли (ФНО) и интерлейкина-6 (ИЛ-6) [17].
В России также имеется большой опыт применения ПМ-В у больных, находящихся в критических состояниях. Первые публикации, посвященные сепсису и СШ, появились в 2008 г. [21, 22].
LPS Adsorber состоит из серии пористых полиэтиленовых пластин, покрытых пептидом, специфичным к Э.Т. Этот адсорбент предназначен для сорб-ции ЭТ из крови. В настоящее время в мировой литературе встречается мало публикаций, посвященных применению LPS Adsorber у больных сепсисом. В отечественной литературе представлены результаты использования LPS Adsorber при лечении больных сепсисом и СШ [24]. Авторы указывают, что включение адсорбента в комплексную терапию приводит к снижению концентрации ЭТ, медиаторов воспаления и клиническому улучшению течения заболевания, которое проявляется восстановлением респираторных и гемодинамических показателей.
Сравнительный анализ эффективности ПМ-В и LPS Adsorber у больных с грамотрицательным сепсисом не выявил существенных различий в исходе заболевания [25, 26].
MATISSE-Fresenius system — система для сорбции ЭТ, основанная на способности альбумина сыворотки крови ковалентно связываться с макропористыми шариками акрилового полимера. Результаты рандомизированного исследования [27] не обнаружили какого-либо значимого эффекта в сравнении со стандартной терапией у больных сепсисом.
Отчеты о применении системы CytoSorb указывают на хороший клиренс цитокинов и улучшение гемодинамики у больных сепсисом и ПОН [37—39]. K. Kogelmann и соавт. [37] в 2017 г. представили результаты применения CytoSorb у 26 больных с хирургическим и терапевтическим сепсисом и С.Ш. Использование CytoSorb, особенно в первые часы от момента постановки диагноза СШ, сопровождалось быстрой стабилизацией гемодинамики, летальность составила 69% при ожидаемой (расчетной) — 92%. В настоящее время опубликованы данные двух работ по изучению эффективности CytoSorb у больных СШ: пилотного рандомизированного контролируемого исследования [40] и проспективного одноцентрового исследования [41]. Согласно их результатам, применение CytoSorb сопровождается гемодинамической и метаболической стабилизацией у больных СШ, одновременно сообщается о снижении концентрации прокальцитонина и эндотелина-1.
Безусловно, большинство описанных методик находится на начальных стадиях изучения и их клиническую эффективность еще предстоит оценить в рандомизированных исследованиях.
До сих пор нет однозначного мнения по поводу эффективности СПФА у больных сепсисом и С.Ш. Ряд авторов указывают, что СПФА эффективно снижает концентрацию медиаторов воспаления и оказывает стабилизирующее действие на гемодинамику у больных сепсисом и СШ. В работах, представленных А.В. Ватазиным и соавт. [46] и А.М. Фоминым и А.А. Зацепиной [47], отмечается, что на фоне СПФА наблюдаются повышение среднего артериального давления, улучшение газообмена в легких и снижение потребности в вазопрессорной поддержке у больных сепсисом.
В 2014 г. S. Livigni и соавт. [48] опубликовали работу по изучению эффективности СПФА у больных СШ. В 18 отделениях интенсивной терапии Италии изучали влияние СПФА на 90-дневную и стационарную летальность. Как показали результаты исследования, смертность в группе СПФА не отличалась от контрольной группы. Кроме того, авторы отметили частое тромбирование экстракорпорального контура и высокую стоимость методики, что затрудняет проведение СПФА в полном объеме.
В 2017 г. международное сообщество Current Surviving Sepsis Campaign (Компания за выживание при сепсисе) опубликовало очередной релиз рекомендаций по лечению сепсиса и СШ [49]. Акцент в них был сделан на раннюю диагностику и лечение, поскольку сепсис легче лечить на начальных стадиях, чем бороться с манифестированной ПОН.
Вместе с тем необходимо признать, что кардинального прорыва в терапии сепсиса не наступило. Основа успешного результата заключается в ранней диагностике сепсиса (шкалы sepsis-related organ failure assessment (SOFA) и quick-SOFA) и начале терапевтических мероприятий до перевода в ОРИТ. Важная роль отводится мультидисциплинарному подходу. Стартовая терапия подразумевает внутривенное введение кристаллоидных растворов, назначение при необходимости вазопрессоров, проведение искусственной вентиляции легких, определение уровня лактата в крови, идентификацию возбудителя инфекции, эффективную антибактериальную терапию, санацию очага инфекции.
Отношение к ЭМЛ в этих рекомендациях не определено и остается на усмотрение лечащего врача. Во многом это связано с ошибками, допущенными в предыдущих рекомендациях (2008 г.), когда недостаточно проверенные методики оказывались не-эффективными. Безусловно, необходимы дальнейшие исследования, разработка новых сорбционных методик, которые позволят определить вид ЭМЛ, подходящий для тех или иных состояний. Хотя, на взгляд авторов настоящей статьи, единый универсальный подход к лечению сепсиса и СШ выработать невозможно, так как уже сейчас очевидно, что превалирование того или иного компонента ПОН диктует применение различных методов детоксикации.
Авторы подтверждают, что статья или ее части ранее не были опубликованы.
Для цитирования: Свиридова С.П., Патютко Ю.И., Сотников А.В. Сепсис и дисфункция печени – современное состояние проблемы. Вестник интенсивной терапии. 2016;1:3–12.
В данном обзоре литературы представлены клеточные и молекулярные механизмы повреждения печени при сепсисе. В процессе сепсиса печень играет ведущую роль в регулировании широкого спектра ключевых метаболических, гомеостатических и защитных реакций – связывании бактерий и производстве воспалительных медиаторов, а также в модуляции иммунитета. На основании многочисленных исследований доказаны основные патогенетические механизмы поражения печени при сепсисе – окислительный стресс и цитокин/эндотоксин опосредованное повреждение. Новые трансляционные исследования молекулярных механизмов развития тяжелого сепсиса, проведенные группами ученых из Австрии, Германии и Великобритании, предоставляют ценный новый взгляд на патогенез нарушений функций печени при сепсисе. Авторами установлены изменения содержания в плазме желчных кислот в ранние часы развития сепсиса, которые указывают на дисфункцию печени с высокой чувствительностью и специфичностью, и клинические исходы были связаны с тяжестью этих изменений в печени и коррелировали с прогнозом. Метаболические изменения и воспалительная реакция приводят к снижению биотрансформационной функции печени, особенно снижению активности цитохрома Р450, что вызывает значительное ухудшение выведения из организма эндобиотиков и ксенобиотиков. Установлено, что сепсис индуцирует перепрограммирование метаболических функций печени параллельно выраженности нарушений не только I и II фазы этапа биотрансформации, но и канальцевого транспорта. Провоспалительные цитокины, продуцируемые клетками Купфера, ведут к подавлению в гепатоцитах регуляции различных АТФ-зависимых транспортеров, вовлеченных в ток желчи, координируемых ядерными рецепторами и факторами транскрипции, что служит причиной внутридолькового холестаза. Печень при сепсисе вовлечена во многие патологические процессы, её повреждения вызывают серьезные нарушения метаболизма, иммунного ответа, процессов коагуляции, детоксикации и антимикробной защиты. Лучшее понимание патофизиологического ответа печени на сепсис, раннее выявление дисфункции печени и начало соответствующего лечения тяжелого сепсиса имеют решающее значение для улучшения показателей выживаемости.
Ключевые слова: сепсис, полиорганная недостаточность, печеночная недостаточность, печеночная дисфункция, цитокины.
Литература
(Полный список литературы находится в редакции – 135 источников).
Реферат
Гликокаликс представляет собой гелеобразный слой, покрывающий поверхность сосудистых эндотелиальных клеток. Он состоит из прикрепленных к мембране протеогликанов, гликозаминогликановых цепей, гликопротеинов и адгезивных белков плазмы. Гликокаликс играет ключевую роль в поддержании гомеостаза сосудов, контролирует проницаемость сосудов и тонус микроциркуляторного русла, предотвращает микрососудистый тромбоз и регулирует адгезию лейкоцитов. При сепсисе и септическом шоке происходит повреждение и сброс гликокаликса. Деградация гликокаликса активируется активными формами кислорода и провоспалительными цитокинами, такими как фактор некроза опухоли (TNF) и интерлейкин-1β (ИЛ-1β). Опосредованная воспалением деградация гликокаликса приводит к гиперпроницаемости сосудов, нерегулируемой вазодилатации, тромбозу микрососудов и усиленной адгезии лейкоцитов. Клинические исследования продемонстрировали корреляцию между уровнями гликокаликсных компонентов в крови и дисфункцией органов и смертностью при сепсисе и септическом шоке. Индуцированное воспалением повреждение гликокаликса может быть причиной ряда специфических клинических эффектов сепсиса, включая острое повреждение почек, дыхательную недостаточность и дисфункцию печени. Инфузионная терапия является неотъемлемой частью лечения сепсиса, но сверхагрессивные методы инфузионной нагрузки (приводящие к гиперволемии) могут усиливать деградацию гликокаликса. Более того, некоторые маркеры деградации гликокаликса, такие как циркулирующие уровни синдекана-1 или гепарансульфат, могут использоваться в качестве маркеров эндотелиальной дисфункции и тяжести сепсиса.
Ключевые слова: эндотелиальный гликокаликс, эндотелий, сепсис, септический шок, сброс гликокаликса, сосудистая проницаемость
Поступила: 08.02.2019
Принята к печати: 26.03.2019
Эндотелиальный гликокаликс (ЭГ) представляет собой важную часть сосудистого барьера. Гликокаликс — это гелеобразная структура, расположенная между потоком крови и эндотелиальными клетками сосудистой стенки. Сепсис и септический шок сопровождаются тяжелым повреждением эндотелиальной системы и деградацией ЭГ, что приводит к нарушениям регуляции гомеостаза и проницаемости сосудистой стенки, вызывая повреждение микроциркуляторного русла [1, 2]. ЭГ играет ключевую роль в физиологии системы микроциркуляции и эндотелия и участвует в регуляции тонуса микроциркуляторного русла и сосудистой проницаемости, поддержании онкотического градиента через эндотелиальный барьер, а также адгезии/ миграции лейкоцитов и профилактике тромбообразования [3–6]. Конформационные изменения в структуре ЭГ приводят к высвобождению оксида азота, что способствует регуляции вазомоторного тонуса и тканевой перфузии [6]. Локальное и системное воспаление ведет к изменениям в структуре и физиологии гликокаликса и в результате — к дисфункции эндотелия. Разрушение гликокаликса при воспалении связано с усилением капиллярной проницаемости и выходом альбумина и жидкости в межклеточное пространство [5]. Деградация гепарансульфата ведет к возникновению прокоагулянтного состояния с последующим микротромбозом и потере антиоксидантных свойств с прогрессирующим окислительным повреждением эндотелия [7–12].
Строение эндотелия и эндотелиального гликокаликса
Эндотелий является одной из крупнейших клеточных систем человеческого организма. Его общий вес и площадь составляют приблизительно 1 кг и 5000 м2 соответственно, а его толщина варьирует от 0,1 до 1 мкм [13]. Гликокаликс — важная часть сосудистого барьера и представляет собой гелеобразную структуру, расположенную между потоком крови и эндотелиальными клетками сосудистой стенки. ЭГ взаимодействует с плазмой и липидами [14] и представляет собой поверхностный слой, состоящий из гликопротеинов, протеогликанов и боковых цепей гликозаминогликанов. Протеогликаны имеют в своей структуре протеиновое ядро, к которому прикрепляются отрицательно заряженные гликозаминогликаны. К протеиновым ядрам относят, в частности, синдеканы, глипиканы, мимеканы, перлаканы и бигликаны. Их основными задачами являются передача сигнала из внеклеточного окружения в клетку и везикулярный транспорт. Выделяют пять типов боковых цепей гликозаминогликанов, которые на 50–90 % состоят из гепарансульфата, а также включают дерматансульфат, кератансульфат и гиалуронан [3, 4, 15]. Известно, что гликозаминогликаны участвуют в процессах передачи клеточного сигнала, эмбрио- и ангиогенеза, регуляции коагуляции крови, а также в развитии и метастазировании опухоли [16]. Такие растворимые компоненты, как альбумин, несвязанные молекулы гиалуроновой кислоты, тромбомодулин и различные сывороточные протеины (например, супероксиддисмутаза и антитромбин III), могут быть связаны с поверхностью гликокаликса [17]. Структура ЭГ схематически представлена на рис. 1.
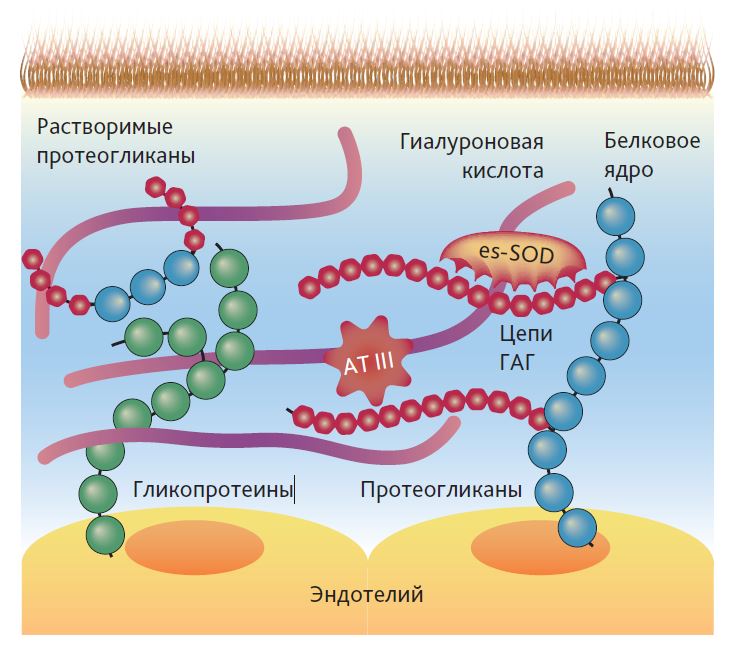
Рис. 1. Структура эндотелиального гликокаликса [18] Ec-SOD — супероксиддисмутаза 3; АТ III — антитромбин III; ГАГ — гликозаминогликаны
Повреждение ЭГ приводит к росту в плазме компонентов его деградации, таких как синдекан-1 (S1), гепарансульфат-протеогликан (HSPG) и гиалуронан, которые могут быть определены методом иммуноферментного анализа [19].
Шок-индуцированная гиперактивация симпатоадреналовой системы приводит к повреждению эндотелиальных клеток и ЭГ [15]. К наиболее частым причинам эндотелиопатии относят сепсис и септический шок [20], геморрагический шок [21], атеросклероз [22], острый коронарный синдром [23], заболевания почек [24], сахарный диабет [25], гиперволемию [26], обширные хирургические вмешательства, ишемию/ реперфузию [27–29], искусственное кровообращение (ИК) [19, 30]. Структура интактного и поврежденного ЭГ представлена на рис. 2.
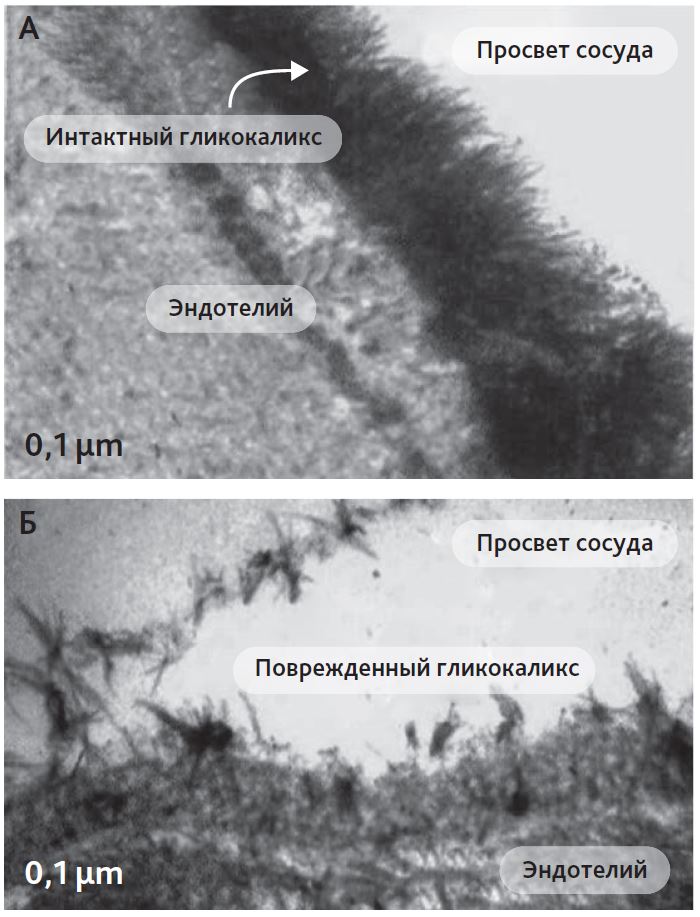
Рис. 2. Структура неповрежденного (А) и поврежденного (Б) эндотелиального гликокаликса [Josef Pflug. Vascular Laboratory, 2016]
Функции эндотелиального гликокаликса
ЭГ регулирует сосудистую проницаемость и взаимодействие между клетками крови и сосудистой стенкой, реологические свойства крови и микросреду [13]. Adamson et al. в своих работах доказали, что ЭГ (ранее не рассматриваемый в концепции Старлинга) непосредственно определяет процессы фильтрации в сосудистом русле через создание градиентов гидростатического и онкотического давления, что играет важную роль в регуляции проницаемости сосудистой стенки [13, 31, 32].
ЭГ отталкивает эритроциты от люминальной поверхности эндотелия, способствуя их дальнейшему продвижению по сосудистому руслу. Таким же образом ЭГ препятствует адгезии тромбоцитов к сосудистой стенке [18]. Кроме того, ЭГ ослабляет взаимодействие между тромбоцитами и лейкоцитами. Во-первых, его отрицательный заряд отталкивает клетки, во-вторых, в структуру ЭГ входят молекулы адгезии, такие как PECAM-1 (platelet/endothelial cell adhesion molecule-1, молекула адгезии тромбоцитов с эндотелием-1), VCAMs (vascular cell adhesion molecule, сосудистая молекула клеточной адгезии) и ICAMs (intercellular adhesion molecule, молекула клеточной адгезии) [13, 18]. Эти молекулы становятся активными во время воспаления и облегчают скольжение и адгезию клеток во время диапедеза [33].
Гликокаликс защищает эндотелиальные клетки от напряжения сдвига, индуцированного потоком крови, путем генерации адаптивного клеточного ответа на воздействие кровотока, необходимого для поддержания гемостаза. Напряжение сдвига — это сила, прикладываемая к верхнему слою ламинарно текущей жидкости, вызывающая смещение нижележащих слоев относительно друг друга в направлении прикладываемой силы [34]. Таким образом, увеличение напряжения сдвига, опосредованное через ЭГ, увеличивает выработку оксида азота (NO), что, в свою очередь, расширяет сосуды и снижает напряжение сдвига [35]. Кроме того, эндотелиальные клетки, подверженные напряжению сдвига, усиливают в 2 раза выработку гиалуроновой кислоты в гликокаликсе, что также уменьшает напряжение сдвига [14]. Повреждение гликокаликса нарушает эти механизмы и реакцию эндотелия на напряжение сдвига, что может приводить к развитию тромбоза и атеросклероза [36].
С системой ЭГ взаимодействует несколько компонентов системы антикоагуляции, в том числе антитромбин III, который является ингибитором тромбина и активированных факторов IX и X. Антикоагулянтная активность антитромбина III усиливается за счет связывания с гепарансульфатом, который является структурным звеном ЭГ. Еще один антикоагулянт, тромбомодулин, вырабатывается эндотелиальными клетками и содержит хондроитинсульфат, который взаимодействует с тромбином, что приводит к активации протеина С. И, наконец, ингибитор пути тканевого фактора связывается через гепарансульфат для ингибирования факторов VIIa и Xa [33].
Повреждение эндотелия и эндотелиального гликокаликса при септическом шоке
При сепсисе и септическом шоке отмечается тяжелое повреждение эндотелиальной системы с деградацией ЭГ, которое приводит к нарушениям регуляции гомеостаза и проницаемости сосудистой стенки, вызывая повреждение микроциркуляторного русла [1, 2]. При сепсисе поврежденный слой ЭГ истончается, что ведет к выходу белков (альбумина) и жидкости через сосудистую стенку в интерстициальное пространство, а в дальнейшем — к гиповолемии, гипоальбуминемии и отеку тканей [37]. Таким образом, недостаточность системы эндотелия и ЭГ на фоне сепсиса запускает механизм полиорганной недостаточности (ПОН). Основными триггерами ПОН являются провоспалительные медиаторы, включая интерлейкин-1 (ИЛ-1), ИЛ-2, ИЛ-6, фактор некроза опухолей (TNF) и другие молекулы, высвобождающиеся при воспалении (брадикинин, тромбин, гистамин, фактор роста эндотелия сосудов), которые вызывают повреждение и активацию компонентов ЭГ при септическом шоке, а также стимулируют выброс межклеточных и сосудистых молекул клеточной адгезии. Эти медиаторы приводят к скоплению, адгезии и миграции лейкоцитов, что запускает воспалительные процессы в эндотелии и тканях и ведeт к дальнейшему повреждению ЭГ с прогрессированием капиллярной утечки в интерстициальное пространство [38].
Окислительный стресс при сепсисе также играет значимую роль в повреждении ЭГ. In vitro было показано, что выброс супероксидных радикалов и гидроксильных радикалов приводит к фрагментации гликозаминогликанов с последующей утратой части их компонентов [39, 40]. При деградации ЭГ клетки эндотелия подвергаются окислительному стрессу, который сопровождается увеличением пористости и проницаемости сосудов и интерстициальными потерями альбумина. Эти процессы наблюдаются не только у пациентов с септическим шоком, но и на фоне сахарного диабета, а также при артериальной гипертензии [6, 29]. Повреждение ЭГ приводит к высвобождению оксида азота (NO) и эндотелина, которые регулируют сокращение клеток гладкой мускулатуры и являются основными медиаторами, регулирующими сосудистый тонус [41], в том числе на фоне септического шока [42].
Системное воспаление и повреждение ЭГ при септическом шоке также вносят значимый вклад в развитие нарушений в коагуляционной системе и определяются как протромботическое и антифибринолитическое состояние, которое может привести к диссеминированному внутрисосудистому тромбозу с последующей ишемией органов и развитием ПОН. Клинически этот феномен может проявиться одним из следующих фенотипов: ДВС-синдром, тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром, тромбоцитопения, ассоциированная с ПОН. Деградация гепарансульфата ведет к возникновению прокоагулянтного состояния с последующим микротромбозом и потере антиоксидантных свойств эндотелия с его прогрессирующим окислительным повреждением [7–12].
В ходе ряда крупных многоцентровых исследований Johansson et al. продемонстрировали, что у пациентов с сепсисом отмечалась более высокая концентрация S1 в плазме в отличие от больных без воспалительного очага [15, 43, 44]. Steppan et al. в своей работе также показали более высокую концентрацию S1 в плазме у пациентов с септическим шоком по сравнению с группой пациентов, которым проводились обширные абдоминальные вмешательства [45]. В своей недавней работе Ostrowski et al. установили значимую положительную корреляцию между уровнем S1 и тяжестью ПОН, оцененной по шкале SOFA (Sequential Organ Failure Assessment), у пациентов на искусственной вентиляции легких с клиникой септического шока [46]. Также было установлено, что повышение концентрации в плазме крови S1 ассоциируется с дальнейшим повреждением эндотелия и коррелирует с активацией воспалительных цитокинов [47], коагулопатией и повышением частоты летальных исходов [44].
Необходимо отметить, что эндотелий представляет собой высокогетерогенную в морфологическом и функциональном плане систему, которая отличается не только в сосудах (т. е. в артериях, артериолах, капиллярах, венулах и венах), но и в тканях органов. Этими различиями будет определяться и гетерогенный ответ различных органов при септическом шоке [48]. В настоящее время обсуждается теория адекватного или нормального и патологического ответа организма на воспалительный процесс. Так, при появлении очага инфекции (например, пневмония или инфекция мягких тканей) вначале будут отмечаться адекватная или нормальная реакция организма в виде местной вазодилатации и увеличение проницаемости капилляров в пораженной области, что позволяет обеспечить адекватное скопление лейкоцитов в месте размножения микроорганизмов. Кроме того, активация системы свертывания и вазоконстрикция на границе очага помогают предупредить дальнейшее распространение инфекции. Однако на более поздних стадиях сепсиса изменения эндотелия и ЭГ будут способствовать снижению сосудистого тонуса, что приводит к нарушению микрососудистой перфузии, генерализации капиллярной утечки и ДВС-синдрому [49].
Следует отметить, что чрезмерная инфузионная терапия при сепсисе может приводить к деградации ЭГ.
В ходе ряда исследований было установлено, что гиперволемия приводит к растяжению стенок предсердия и высвобождению предсердными кардиомиоцитами предсердного натрийуретического пептида, который, в свою очередь, оказывает негативный эффект на ЭГ, вызывая его повреждение, что в последующем приводит к увеличению сосудистой проницаемости, воспалению и отеку тканей [60].
Потенциальные терапевтические подходы для подавления деградации гликокаликса при сепсисе
В настоящее время изучается ряд новых молекул, которые могут оказывать благоприятное протективное воздействие на ЭГ. Так, например, S1P (сфинголипид) может сохранять целостность ЭГ, предотвращая деградацию и сброс синдекана-1. S1P активирует рецептор S1P1, а активация рецептора S1P1 ослабляет активность матриксной металлопротеиназы (MMP), которая и вызывает повреждение и деградацию синдекана-1 [50]. В своем недавнем исследовании Coldewey et al. установили, что низкий уровень S1P в плазме у пациентов с сепсисом и септическим шоком ассоциирован с тяжестью течения воспалительного процесса и ПОН [51]. Известно, что гепарин защищает гликокаликс от деградации при сепсисе, выступая в качестве ингибитора гепараназы, которая выделяет гепарансульфат из ЭГ. Лабораторные исследования показали, что истончение ЭГ в микрососудах легких связано с деградацией гепарансульфата [52]. Поскольку активация гепараназы может повышать уровень экспрессии ММР, гепарин также может приводить к снижению уровня экспрессии ММР путем ингибирования активности гепараназы [53].
Сулодексид, высокоочищенный продукт экстракции из слизистой оболочки кишечника свиньи, как сообщалось, также ингибирует гепараназную активность [54]. В экспериментальном исследовании Song et al. [55] сообщили, что введение сулодексида мышам при сепсисе приводило к уменьшению сброса гепарансульфата и синдекана-4.
Фактор роста фибробластов (FGF) является медиатором физиологической репарации гликокаликса. Он быстро активируется циркулирующими фрагментами гепарансульфата, образующимися при деградации гликокаликса, и связывается с рецептором FGF, что служит сигналом для активации молекул, отвечающих за восстановление гликокаликса, таких как экзостозин-1, фермент, ответственный за синтез гепарансульфата. Однако при сепсисе этот процесс репарации значительно сокращается, поскольку передача сигналов от активированного рецептора FGF ингибируется [56]. Усиление этого сигнала, восстанавливающего структуру гликокаликса, ослабленного при сепсисе, является потенциальным терапевтическим подходом для восстановления слоя гликокаликса и улучшения его функции [57].
Важным аспектом терапии сепсиса служит контроль уровня гликемии, который может снижать степень повреждения и сброса гликокаликса при сепсисе и сохранять функцию эндотелия [58, 59]. В своей работе Nieuwdorp et al. показали, что гипергликемия, не корригированная в течение 6 ч, приводит к снижению системного объема гликокаликса примерно на 50 % от исходных значений. Кроме повреждения гликокаликса, гипергликемия ведет к увеличению в плазме фактора свертывания VIIa и тканевого тромбопластина. С системой гликокаликса связаны и ингибитор тромбина, и фактор Xa [33]. Таким образом, изменения системы ЭГ оказывают непосредственное влияние на коагуляцию и фибринолитический ответ [59]. Интересно, что повреждение гликокаликса, вызванное гипергликемией, можно уменьшить назначением N-ацетилцистеина [59].
Определенную роль в защите гликокаликса играет и альбумин. С помощью альбумина осуществляется перенос синдекана-1 от эритроцитов к эндотелию, где он способствует восстановлению гликокаликса, подавляя активность ММР [50, 61]. Jacob et al. в своих работах на животных показали, что альбумин предупреждает повреждение гликокаликса более эффективно, чем 6% гидроксиэтилкрахмал или 0,9% раствор натрия хлорида [62, 63]. Спорным остается вопрос о протективном воздействии свежезамороженной плазмы на ЭГ. Ряд авторов в ходе исследований на животных в модели геморрагического шока показал негативный эффект свежезамороженной плазмы на гликокаликс [64–66]. Тем не менее в клинической работе Straat et al. продемонстрировано, что после введения свежезамороженной плазмы пациентам с септическим шоком отмечалось значимое снижение концентрации синдекана-1 по сравнению с исходными значениями [67].
Кортикостероиды могут снижать воспалительное повреждение эндотелия и ЭГ [68]. Известно, что кортикостероиды ингибируют синтез цитокинов, в частности ТNF-α, который приводит к перестройке клеток эндотелия, и могут способствовать сохранению целостности эндотелия при сепсисе [69]. На функцию гликокаликса может влиять и целый ряд других препаратов — ингаляционные, местные и внутривенные анестетики, а также многочисленные лекарственные средства, применяемые для лечения сопутствующей патологии у больных с сепсисом, однако аспекты их применения находятся вне рамок данного обзора.
Таким образом, повреждение ЭГ является важным компонентом патогенеза сепсиса, требующим поиска новых терапевтических воздействий. Компоненты ЭГ могут служить маркерами повреждения эндотелия при сепсисе, отражая тяжесть системного воспаления.
Источники финансирования. Исследование выполнено при поддержке гранта Президента РФ для ведущих научных школ НШ-3927.2018.7.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Ильина Я.Ю. — работа с научной литературой, сбор информации, написание текста. Фот Е.В., Кузьков В.В. — редактирование статьи; Киров М.Ю. — редактирование, утверждение окончательного варианта статьи.
Читайте также:

