Оциллококцинум при энтеровирусной инфекции
Обновлено: 19.04.2024
В повседневной практике педиатру часто приходится сталкиваться с различными изменениями на коже пациентов. По статистике, различные поражения кожи являются причиной почти 30% всех обращений к педиатру. Иногда это только дерматологические проблемы, иногда высыпания являются проявлениями аллергической или соматической патологии, но в последнее время существенно вырос процент дерматологических проявлений инфекционных заболеваний. Иными словами, синдром инфекционной экзантемы прочно входит в нашу практику и требует определенной осведомленности, так как порой он является одним из главных диагностических признаков, позволяющих своевременно поставить диагноз и избежать тяжелых последствий.
Экзантемы являются одним из наиболее ярких и значимых в диагностическом и дифференциально-диагностическом отношении симптомов. Они встречаются при многих инфекционных заболеваниях, которые даже получили название экзантематозных (корь, краснуха, скарлатина, брюшной и сыпной тифы, ветряная оспа, герпетические инфекции). При них сыпь - обязательный компонент клинической картины заболевания, вокруг нее как бы разворачивается диагностический процесс, на нее опирается и дифференциальный диагноз. Существует также группа инфекций, при которых сыпь встречается, но она непостоянна и эфемерна. Такого рода экзантемы возможны при многих вирусных инфекциях (энтеро- и аденовирусных, ЦМВ, ЭБВ и др.). В этих случаях диагностическая ценность экзантем невелика.
Экзантема почти всегда сосуществует с энантемой, причем последняя обычно появляется за несколько часов или 1-2 дня до экзантемы. Например, обнаружение розеол или петехий на небе у больного с симптомами ОРВИ позволит доктору заподозрить герпетическую инфекцию, сыпной тиф или лептоспироз, а пятна Филатова - Коплика являются единственным по-настоящему патогномоничным симптомом кори. Это лишний раз доказывает чрезвычайную важность тщательного осмотра не только кожи, но и слизистых оболочек.
Единой классификации инфекционных экзантем в настоящее время не существует. Наиболее удобно их разделять на генерализованные и локализованные. Классическими называют экзантемы потому, что заболевания, относящиеся к данной группе, всегда протекают с синдромом экзантемы. Атипичные же заболевания сопровождаются высыпаниями часто, но не всегда (рис. 1, 2).
В статье речь пойдет о генерализованных вирусных атипичных экзантемах.
Рис. 1. Классификация экзантем
Рис. 2. Генерализованные экзантемы
Экзантема при парвовирусной инфекции постепенно исчезает в течение 5-9 дней, но при воздействии провоцирующих факторов, таких как солнечное облучение, горячая ванна, холод, физическая нагрузка и стресс, могут персистировать недели и даже месяцы. Исчезает сыпь бесследно.
У части больных на фоне сыпи или после ее исчезновения может отмечаться поражение суставов. Характерно симметричное поражение преимущественно коленных, голеностопных, межфаланговых, пястно-фаланговых суставов. Болевой синдром зависит от тяжести заболевания и может быть слабым или сильным, затрудняющим самостоятельное передвижение, суставы опухшие, болезненные, горячие на ощупь. Течение полиартритов доброкачественное.
В анализе крови в высыпной период выявляется легкая анемия, низкое содержание ретикулоцитов, в ряде случаев - нейтропения, тромбоцитопения, повышенная СОЭ [6]. Для более точной диагностики возможно использовать ПЦР (сыворотка, ликвор, пунктат костного мозга, биоптат кожи и т. д.) для определения ДНК парвовируса. Также применяется метод ИФА с определением в сыворотке крови уровня специфических антител: IgM в сыворотке крови пациента обнаруживаются одновременно с появлением симптомов заболевания (на 12-14-й день после заражения), их уровень достигает максимума на 30-й день, затем снижается в течение 2-3 месяцев. Через 5-7 дней от момента клинических проявлений парвовирусной инфекции появляются IgG, которые сохраняются в течение нескольких лет [7].
Специфической этиотропной терапии парвовирусной инфекции не существует. В зависимости от клинической формы проводится посиндромная терапия.
Внезапная экзантема
Внезапная экзантема (син.: розеола детская, шестая болезнь) - это острая детская инфекция, вызывающаяся вирусом герпеса 6-го типа, реже 7-го типа и сопровождающаяся пятнисто-папулезной экзантемой, возникающей после снижения температуры тела. Вирус герпеса типа 6 был впервые выделен и идентифицирован в 1986 году у больных с лимфопролиферативными заболеваниями, а в 1988 году было доказано, что данный тип вируса является этиологическим агентом внезапной экзантемы. Инфекция, вызванная вирусом герпеса человека типа 6, является актуальной проблемой современной педиатрии, что связано с ее широкой распространенностью: почти все дети инфицируются в возрасте до 3 лет и сохраняют иммунитет на всю жизнь [8, 9]. При данном заболевании четко выражена сезонность - чаще внезапная экзантема регистрируется весной и осенью.
После снижения температуры тела, реже за день до или через сутки после, появляется экзантема. Высыпания вначале появляются на туловище и затем уже распространяются на шею, верхние и нижние конечности, редко - лицо. Представлены округлыми пятнами и папулами до 2-5 мм в диаметре, розового цвета, окруженными белым венчиком, бледнеющими при надавливании. Элементы сыпи редко сливаются и не сопровождаются зудом. Продолжительность высыпаний - от нескольких часов до 3-5 дней, после чего они исчезают бесследно [10, 11]. Особенностью заболевания является то, что, несмотря на болезнь, самочувствие ребенка страдает не сильно, может сохраняться аппетит и активность. В клиническом анализе крови отмечаются лейкопения и нейтропения, лимфоцитоз, могут обнаруживаться атипичные мононуклеары и тромбоцитопения. Течение внезапной экзантемы доброкачественное, склонное к саморазрешению.
Заболевание склонно к саморазрешению и в подавляющем большинстве случаев не требует специфического лечения.
Инфекционный мононуклеоз
Инфекционный мононуклеоз - это острое инфекционное заболевание, вызываемое вирусами группы герпесов, наиболее часто ЭБВ, и характеризующееся лихорадочным состоянием, ангиной, увеличением лимфатических узлов, печени и селезенки, лимфоцитозом, появлением атипичных мононуклеаров в периферической крови [13].
ЭБВ повсеместно распространен среди человеческой популяции, им поражено 80-100% населения земного шара [14, 15]. Большинство детей инфицируется к 3 годам, а все население - к совершеннолетию. Максимальная заболеваемость отмечается в 4-6 лет и подростковом возрасте. Выражена сезонность -с весенним пиком и незначительным подъемом в октябре. Характерны подъемы заболеваемости каждые 6-7 лет.
Инкубационный период составляет от 2 недель до 2 месяцев. Основной симптомокомплекс включает следующие ведущие симптомы:
Заболевание в большинстве случаев начинается остро, с подъема температуры тела до высоких цифр. Обычно весь симптомокомплекс разворачивается к концу первой недели. Наиболее ранними клиническими проявлениями являются: повышение температуры тела; припухание шейных лимфатических узлов; наложения на миндалинах; затруднение носового дыхания. К концу первой недели от начала заболевания у большинства больных уже пальпируются увеличенная печень и селезенка, в крови появляются атипичные мононуклеары.
Помимо основного симптомокомплекса, при инфекционном мононуклеозе часто отмечаются различные изменения кожи и слизистых оболочек, появляющиеся в разгар заболевания и не связанные с приемом лекарственных препаратов. Практически постоянным симптомом является одутловатость лица и отечность век, что связано с лимфостазом, возникающем при поражении носоглотки и лимфатических узлов. Также нередко на слизистой оболочке полости рта появляются энантема и петехии. В разгар заболевания часто наблюдаются различные высыпания на коже. Сыпь может быть точечной (скарлатиноподобной), пятнисто-папулезной (кореподобной), уртикарной, геморрагической. Сыпь появляется на 3-14-й день заболевания, может держаться до 10 дней и разрешается бесследно. Отличительной чертой является ее большая интенсивность на акральных участках, где она обычно сливается и дольше держится. Экзантема не зудит и проходит бесследно.
Нельзя не упомянуть еще об одном очень характерном проявлении инфекционного мононуклеоза - появлении сыпи после назначения антибиотиков пенициллинового ряда [16]. Сыпь возникает, как правило, на 3-4-й день от начала приема антибиотиков, располагается преимущественно на туловище, представлена пятнисто-папулезной сливающейся экзантемой (кореподобный характер). Некоторые элементы сыпи могут быть более интенсивно окрашены в центре. Сыпь разрешается самостоятельно без шелушения и пигментации. Важным моментом является то, что данная экзантема не является проявлением аллергической реакции на лекарственный препарат: пациенты как до, так и после ЭБВ-инфекции могут хорошо переносить антибактериальные препараты пенициллинового ряда. Эта реакция до конца не изучена и на данный момент рассматривается как взаимодействие вируса и лекарственного препарата. Отличительными чертами такой сыпи являются следующие:
Инфекционный мононуклеоз в большинстве случаев протекает гладко, без осложнений. Заболевание заканчивается через 2-4 недели. В некоторых случаях по истечении этого срока сохраняются остаточные проявления болезни.
Этиотропнаятерапия инфекционногомононуклеоза окончательно не разработана. При среднетяжелой и тяжелой формах можно использовать препараты рекомбинантного интерферона (виферон), индукторы интерферона (циклоферон), иммуномодуляторы с противовирусным эффектом (изопринозин) [17, 18]. В основном применяется патогенетическая и симптоматическая терапия [19, 20].
Энтеровирусная экзантема может быть вызвана различными типами энтеровирусов, а в зависимости от этиологии различается и симптоматика. Выделяют три вида энтеровирусных экзантем:
Кореподабная экзантема возникает преимущественно у детей раннего возраста. Заболевание начинается остро, с подъема температуры тела, головной боли, мышечных болей. Практически сразу появляются гиперемия ротоглотки, инъекция склер, нередко в начале болезни бывают рвота, боли в животе, возможен жидкий стул. На 2-3-й день от начала лихорадочного периода одномоментно появляется обильная распространенная экзантема на неизмененном фоне кожи. Сыпь располагается всегда на лице и туловище, реже на руках и ногах, может быть пятнистой, пятнисто-папулезной, реже петехиальной, размеры элементов - до 3 мм. Сыпь сохраняется 1-2 дня и исчезает бесследно. Примерно в это же время снижается температура тела.
Розеолоформная экзантема (бостонская болезнь) начинается также остро, с повышения температуры до фебрильных цифр. Лихорадка сопровождается интоксикацией, першением и болью в горле, хотя при осмотре ротоглотки никаких существенных изменений, кроме усиления сосудистого рисунка, нет. В неосложненных случаях лихорадка держится 1-3 дня и резко падает до нормы. Одновременно с нормализацией температуры появляется экзантема. Она имеет вид округлых розовато-красных пятен размером от 0,5 до 1,5 см и может располагаться по всему телу, но наиболее обильной бывает на лице и груди. На конечностях, особенно на открытых участках, сыпь может отсутствовать. Сыпь сохраняется 1-5 дней и бесследно исчезает [22].
Генерализованная герпетиформная экзантема возникает при наличии иммунодефицита и характеризуется наличием мелкой везикулезной сыпи. Отличием от герпетической инфекции является отсутствие сгруппированности везикул и помутнения их содержимого.
Одним из локальных вариантов энтеровирусной экзантемы является заболевание, протекающее с поражением кожи рук и ног, слизистой оболочки полости рта - так называемая болезнь рук, ног и рта (син.: ящуроподобный синдром, вирусная пузырчатка конечностей и полости рта). Наиболее частыми возбудителями данного заболевания служат вирусы Коксаки А5, А10, А11, А16, В3 и энтеровирус типа 71 [23, 24].
Заболевание встречается повсеместно, болеют преимущественно дети до 10 лет, однако отмечаются случаи заболеваний и среди взрослых, особенно молодых мужчин. Так же как и при других энтеровирусных заболеваниях, встречается чаще летом и осенью.
Инкубационный период короткий, от 1 до 6 дней, продромальный - невыразительный или отсутствует вовсе. Заболевание начинается с незначительного повышения температуры тела, умеренной интоксикации. Возможны боли в животе и симптомы поражения респираторного тракта. Практически сразу на языке, слизистой щек, твердом небе и внутренней поверхности губ появляется энантема в виде немногочисленных болезненных красных пятен, которые быстро превращаются в везикулы с эритематозным венчиком. Везикулы быстро вскрываются с формированием эрозий желтого или серого цвета. Ротоглотка не поражается, что отличает заболевание от герпангины [25]. Вскоре после развития энантемы у 2/3 пациентов появляются аналогичные высыпания на коже ладоней, подошв, боковых поверхностей кистей и стоп, реже - ягодиц, гениталий и лице. Так же как и высыпания во рту, они начинаются как красные пятна, которые превращаются в пузырьки овальной, эллиптической или треугольной формы с венчиком гиперемии. Высыпания могут быть единичными или множественными [26].
Заболевание протекает легко и разрешается самостоятельно без осложнений в течение 7-10 дней. Однако необходимо помнить, что вирус выделяется до 6 недель после выздоровления [27, 28].
Диагностика энтеровирусных экзантем носит комплексный характер и предусматривает оценку клинических симптомов заболевания совместно с данными эпидемиологического анамнеза и обязательного лабораторного подтверждения (выделение энтеровируса из биологических материалов, нарастание титра антител) [29].
Лечение носит в большинстве симптоматический характер. Применение рекомбинантных интерферонов (виферон, реаферон), интерфероногенов (циклоферон, неовир), иммуноглобулинов с высоким титром антител может потребоваться только при лечении больных тяжелыми формами энтеровирусного энцефалита [30].
Таким образом, проблема инфекционных заболеваний, сопровождающихся экзантемами, остается актуальной по сей день. Высокая распространенность данной патологии среди населения требует повышенного внимания от врачей любой специальности.
Ключевые слова: энтеровирусная инфекция, энтеровирусы, вирусоносительство, бессимптомные формы, полиомиелитоподобные формы, серозный менингит, энерготропная терапия, L-карнитин, Элькар ®
Keywords: enterovirus infection, enteroviruses, carriage of viruses, asymptomatic forms, poliomyelitis-like forms, serous meningitis, energotropic therapy, L-carnitine, Elkar ®
Введение
Актуальность энтеровирусной инфекции (ЭВИ) связана с ее клиническим полиморфизмом, повсеместной распространенностью, широтой и массовостью поражения энтеровирусами (ЭВ) населения, склонностью к вспышечному характеру заболевания.
Особенностью ЭВИ является поражение центральной нервной системы (ЦНС) с развитием полиомиелитоподобных форм. Установлено, что от 18 до 31% случаев поражения ЦНС у детей раннего возраста связано с внутриутробным инфицированием ЭВ [1]. Способность ЭВ к персистенции с формированием аутоиммунного процесса может приводить к гибели плода, самопроизвольным выкидышам и заболеваниям новорожденных.
Для ЭВИ характерна высокая генетическая изменчивость с образованием новых высокопатогенных штаммов и отсутствием стойкого иммунитета. Не менее важным фактором считается способность ЭВ запускать аутоиммунные механизмы с поражением паренхиматозных органов, что зачастую приводит к хронизации процесса [2, 3].
Отсутствие этиотропной терапии ЭВИ и вакцинопрофилактики этой инфекции побуждает к поискам методов патогенетической терапии и ее обоснованию.
Эпидемиология
Энтеровирусы являются одними из самых распространенных патогенов человека. Во всем мире они ежегодно вызывают почти миллиард инфекций у людей [1]. В то же время продолжают появляться все новые серотипы ЭВ, некоторые из которых, как полагают ученые, получены людьми от других приматов [4]. Вследствие высокой генетической изменчивости ЭВ в последние годы обнаружены их новые высокопатогенные штаммы (А71 и D68) [4, 5], вызываемая ими инфекция протекает с респираторными и неврологическими симптомами и характеризуется тенденцией к вспышкам и высокой летальности [1, 4, 6].
По данным литературы, заболеваемость ЭВ типа A71 связана со вспышками hand, foot and mouth disease и редкими поражениями ЦНС в виде энцефалита с поражением ствола мозга. Данные вспышки регистрировались главным образом в Азиатско-Тихоокеанском регионе. В странах Азии также наблюдалась значительная распространенность ЭВ, а именно Коксаки А16 [7]. Выявление ЭВ серотипа D68 связано с развитием респираторных проявлений и дебютом острых вялых параличей в Северной Америке, Европе и Азии в последние 5 лет [8, 9]. В последние годы тяжелые формы заболеваний, вызванных ЭВ типов A71 и D68, регистрировались и в ряде европейских стран [10].
На рисунке представлены данные о заболеваемости детей ЭВИ в целом и заболеваемости серозным менингитом как одной из форм ЭВИ у детей в РФ. Согласно этим данным рост заболеваемости детей ЭВИ не имеет тенденции к снижению. Наоборот, за последние годы, а именно с 2015 по 2019 г., заболеваемость ЭВИ увеличилась почти в 2 раза. Заболеваемость серозным менингитом энтеровирусной этиологии также остается на стабильно высоком уровне.
По эпидемиологическим данным, ЭВИ имеет летне-осеннюю сезонность, хотя спорадические случаи в отдельных регионах России встречаются круглогодично, а максимальная заболеваемость данной инфекцией чаще регистрируется в августе-сентябре [2].

Показатели заболеваемости энтеровирусной (неполио) инфекцией за 2013-2019 гг. по РФ (на 100 тыс. населения)
Этиологическая характеристика энтеровирусов
ЭВ представляют собой род вирусов из семейства пикорнавирусов (Picornaviridae), порядок Picornavirales.
Согласно современной таксономии, основанной на геномных и биологических свойствах вирусов, ЭВ делятся на 15 видов, из которых ЭВ видов А-D и риновирусы видов A-C заражают человека [3, 5]. Это одна из самых многочисленных групп вирусов, включающая полиовирус, неполиомиелитные энтеровирусы, вирус гепатита А и риновирусы A, B, C.
Семейство характеризуется икосаэдрической симметрией капсида и одноцепочечной + РНК как носителя наследственной информации [1, 5]. Название ЭВ связано с их репродукцией в желудочно-кишечном тракте, однако энтерит они вызывают редко.
Клиническая картина
В классификации ЭВИ выделяют типичные и атипичные формы. Клиническая классификация представлена в таблице.
Клиническая классификация форм энтеровирусной инфекции
Клиническая картина ЭВИ характеризуется полиморфизмом симптомов – от 3- и 5-дневной лихорадки, респираторных поражений дыхательной системы, экзантемных форм до более грозных проявлений, паралитических полиомиелитоподобных форм. Инкубационный период длится от 2 до 35 дней, в среднем 7-10 дней.
ЭВИ может протекать в виде поражения дыхательной системы – герпангины, ринита, фарингита, бронхита, бронхиолита, пневмонии, вплоть до отека легких. Эти клинические формы составляют до 30% всех случаев ЭВИ у детей [4]. Экзантемные формы, варианты с формированием серозного менингита и паралитические полиомиелитоподобные формы ЭВИ встречаются значительно реже.
Тем не менее дети младше 5 лет подвержены тяжелым формам с развитием неврологических осложнений, таких как асептический мозжечковый менингит, мозжечковый энцефалит, острый вялый паралич. Развитие данных неврологических и респираторных форм чаще вызвано ЭВ типа A71 и D68.
Одна из форм ЭВИ – серозно-вирусный менингит. В большинстве случаев асептический серозный менингит протекает классически и характеризуется острым началом, выраженной головной болью, рвотой и симптомами интоксикации. Менингеальный синдром носит непостоянный характер и отличается диссоциацией менингеальных симптомов.
У новорожденных и детей грудного возраста асептический серозный менингит развивается как составляющая тяжелого системного поражения, включающего некроз печени, миокардит, некротизирующий энтероколит, внутрисосудистую коагуляцию. Менингеальные симптомы могут быть стертыми. Летальный исход у детей этого возраста является не следствием поражения ЦНС, а результатом острой печеночной недостаточности (вирусы ЕСНО) или миокардита (вирусы Коксаки).
После воспалительных форм ЦНС формируются резидуальные явления. Данные изменения наблюдаются в подростковом периоде и характеризуются проявлением таких форм, как цереброастенический синдром, неврозоподобные расстройства, гипертензионный синдром.
В отечественной литературе практически отсутствуют сведения о редких проявлениях ЭВИ, поражении ЭВ сердечно-сосудистой системы, желчного пузыря и почек.
В 50% случаев выявлена взаимосвязь с тропностью ЭВ к кардиомиоцитам и развитием дилатационной кардиомиопатии у детей [8]. Данная инфекция способствуют развитию кардиомиопатии двумя различными способами. При первом типе поражения ЭВ могут непосредственно инфицировать и индуцировать гибель клеток кардиомиоцитов. Во втором же случае ЭВ вызывают аутоиммунный ответ, при котором собственная иммунная система хозяина разрушает кардиомиоциты (стадия апоптоза) и приводит к формированию кардиомиопатии.
Изучая данные литературы, мы также обнаружили связь ЭВ Коксаки B4 с развитием сахарного диабета I типа. Вирус Коксаки В4 выступает триггером в развитии патологического процесса в поджелудочной железе [4, 8], вызывая апоптоз ^-клеток и гипогликемию в экспериментальных исследованиях. Таким образом, подтверждается тот факт, что ЭВ могут вызывать поражение поджелудочной железы с последующим развитием гипо- или гипергликемии.
Вопросы диагностики и терапии
Лабораторная диагностика ЭВИ осложняется большим количеством серотипов возбудителей, поэтому наряду с классическими вирусологическими методами в диагностике используют молекулярно-биологические методы, позволяющие секвенировать геном возбудителя и определить филогенетические связи между различными штаммами ЭВ [2]. Тип ЭВ может быть определен с использованием молекулярного типирования (генотипирования), которое основано на определении нуклеотидной последовательности области генома, кодирующей капсидный белок VP1. Полипептид VP1 содержит аминокислотные последовательности, определяющие серотип вируса, и является главным рецепторным локусом вириона. Определение типа ЭВ проводят путем секвенирования фрагментов области генома, кодирующей белки капсида VP3 и VP1. Молекулярное типирование ЭВ с использованием амплификации и секвенирования нуклеотидных последовательностей региона VP1 является прямым методом идентификации, обладает высокими показателями специфичности [11].
Диагноз ЭВИ и ее форм базируется в основном на клинической симптоматике и эпидемиологических данных.
Патогенетическая и симптоматическая терапия ЭВИ проводится с учетом клинической формы и основана на восстановлении метаболизма и энергетического потенциала поврежденных клеток. На этом фоне при развитии неврологической симптоматики в периоде реконвалесценции, особенно после серозно-вирусного менингита, может быть рекомендована метаболическая терапия [12], коррекция вегетативных расстройств, ассоциированных с синдромом вегетативной дистонии.
В основе патогенеза синдрома вегетативной дистонии лежит дезинтеграция высших вегетативных центров, нарушение равновесия между симпатическим и парасимпатическими отделами, расстройство взаимодействия различных органов и систем организма, метаболических процессов, что отражается на развитии адаптационно-компенсаторных реакций, формировании энергетического обмена [13].
В многочисленных исследованиях было показано, что нарушения энергетического обмена выявлены у детей с перинатальной патологией, урологическими и нефрологическими заболеваниями, острыми респираторными инфекциями [12, 14-17]. При всех отмеченных патологических состояниях целесообразно применение энерготропных препаратов.
В современной литературе имеются данные об использовании препаратов L-карнитина у детей и подростков при вегетативных расстройствах [13] и при всех указанных выше патологических состояниях и заболеваниях.
Карнитин улучшает белковый и жировой обмен, повышает секрецию и ферментативную активность желудочного и кишечного соков, способствует усвоению пищи, снижает избыточную массу тела. Участвует в транспорте ксенобиотиков и органических кислот из клетки, усиливает процесс детоксикации, позволяя устранить последствия интоксикации организма.
Элькар ® улучшает обмен веществ, непосредственно влияет на обеспечение клеток организма энергией, тем самым способствуя нормализации клеточного энергообмена, коррекции метаболических нарушений.
Важным направлением реабилитации детей после перенесенных вирусных инфекций является назначение препаратов на основе L-карнитина в связи с уникальностью его воздействия на клеточный метаболизм [18, 19]. Необходимость включения Элькара в патогенетическую терапию при инфекционных заболеваниях у детей отмечена в исследовании Т.А. Руженцовой [17]: вирусные агенты, в том числе и ЭВ [8], способны не только длительно персистировать в организме, находясь в латентном состоянии, и активизироваться на фоне ослабления иммунитета при присоединении интеркуррентной инфекции, но и вызывать поражение миокарда, что зачастую бывает сложно связать с первоначальным этиологическим фактором [17].
В работах О.В. Гончаровой показано, что включение в реабилитацию детей с острыми респираторными инфекциями препарата Элькар ® в возрастных дозах курсами длительностью 1-1,5 мес предупреждает развитие повторных эпизодов острых респираторных инфекций у детей и сокращает длительность их течения, восстанавливая активность иммунных клеток [14]. Кроме того, в литературе представлены данные об эффективности применения Элькара в дозе 30-50 мг/кг/сут в 2-3 приема курсами 1-1,5 мес при гипоксических состояниях у детей с перинатальной патологией [12]. Такая коррекция патологических процессов возможна и в периоде реконвалесценции серозных менингитов. Курсы необходимо повторять 2 раза в год в течение 3 лет.
Элькар ® незаменим для восстановления детей после болезни. Он улучшает энергообеспечение органов и тканей, повышает аппетит и усвоение белков, помогает организму работать на полную мощность, являясь естественным эндогенным метаболитом живого организма, принимая участие во всех видах обмена веществ, в регуляции энергетических и пластических процессов.
Элькар ® эффективно восполняет потребность организма в L-карнитине, когда организму необходима энергетическая поддержка.
Заключение
Значительный полиморфизм клинических проявлений ЭВИ с отсутствием четкой зависимости от серологического типа возбудителя, большая частота бессимптомных форм, длительное вирусоносительство, отсутствие специфических методов профилактики делают ЭВИ неуправляемой болезнью. Глубокое знание клинической симптоматики, своевременность постановки диагноза, а также принятые меры профилактики способствуют снижению частоты осложненных и тяжелых форм ЭВИ.
Энтеровирусы ассоциируются со многими заболеваниями, этиология которых ранее не связывалась с инфекционными факторами, – это кардиомиопатии, нефриты, сахарный диабет, васкулиты, бесплодие.
Таким образом, хотя большинство энтеровирусных инфекций и являются бессимптомными (90% случаев), эти энтеровирусы ответственны за различные инфекционные синдромы. Прогноз их развития зависит от инфекционной дозы, органа-мишени, возраста, пола, иммунного статуса пациента, проводимой патогенетической терапии и реабилитации.
Е.П.Селькова 1 , А.Л.Волчецкий 1 , А.С.Лапицкая 1 , Е.Ю.Радциг 2 , Н.В.Ермилова 2
1 ФГУН МНИИ эпидемиологии и микробилогии им. Г.Н.Габричевского Роспотребнадзора;
2 Кафедра оториноларингологии педиатрического факультета РГМУ;
Особенностью острых респираторных вирусных инфекций (ОРВИ) является высокая заболеваемость населения в любое время года. В период с октября по февраль-март эти инфекции приобретают массовый характер. Чаще всего ОРВИ болеют дети, особенно раннего возраста, которые, по данным Всемирной организации здравоохранения, ежегодно переносят по нескольку эпизодов этих инфекционных заболеваний [1]. У детей первых 3 лет жизни грипп особенно часто осложняется развитием бактериальных инфекций, таких как пневмонии, острый средний отит. Дети также служат основным источником распространения респираторных инфекций в обществе.
Ежегодно только в Москве регистрируется от 2,5 до 3 млн больных гриппом и ОРВИ. В течение последних лет эпидемические процессы этих инфекций в столице и в целом по России сходны. Однако уровни заболеваемости ОРВИ в Москве в 1,5-1,8 раза превышают российские показатели, что объясняется особенностями одного из самых крупных мегаполисов (высокая плотность населения, разветвленная транспортная сеть, интенсивные миграционные процессы и т.д.), оказывающих отрицательное воздействие на иммунные механизмы организма.
Многолетний анализ заболеваемости ОРВИ среди детей показал, что чаще всего в группе высокого риска по заболеваемости находятся дети живущие в крупных мегаполисах, что обусловлено определенными факторами. Во-первых, большинство детей посещают организованные коллективы - детские сады и школы, а также разнообразные развивающие курсы и спортивные секции. В связи с тем, что респираторные вирусы, особенно вирусы гриппа, обладают высокой вирулентностью и способны передаваться воздушно-капельным путем (при кашле, чихании и разговоре), в коллективах эти инфекционные возбудители распространяются очень быстро. Во-вторых, в современных условиях организм человека, особенно детский, подвергается воздействию множества неблагоприятных факторов внешней среды, что приводит к снижению защитных функций организма и возникновению вторичных иммунодефицитных состояний. Поэтому немаловажную роль в высокой заболеваемости ОРВИ детей больших городов играет снижение их иммунитета [2].
Человеческий организм обладает уникальной и мощной системой защиты от неблагоприятного воздействия внешней среды и инфекционных агентов различной этиологии (бактерии, вирусы, простейшие и т.д.). Системой данной ему природой (естественная) и сложившейся в течение длительного времени под влиянием различных факторов (приобретенная).
Вторичный иммунодефицит, возникающий при респираторных заболеваниях, чаще всего сопровождается нарушением синтеза интерферонов (ИФН), являющихся важным звеном в обеспечении устойчивости организма к вирусам. На внедрение инфекционного агента система ИФН реагирует значительно быстрее, чем другие звенья иммунитета. Для полной активации интерфероновой защиты требуется всего несколько часов. Как правило, любая острая инфекция прежде всего характеризуется значительным повышением уровня циркулирующего ИФН, затем происходит активация внутриклеточных антимикробных механизмов и иммунологических реакций. ИФН являются природной защитой клеток от микроорганизмов.
Во многих работах показано, что ИФН индуцируют развитие полноценного иммунного ответа, участвуя в регуляции активности естественных киллеров, фагоцитоза, цитотоксичности, экспрессии на поверхности клеток молекул главного комплекса гистосовместимости и т.д. ИФН выполняют одну из ключевых ролей при распознавании антигенов и выработке антител 3.
Немаловажная роль в системе противоинфекционной защиты принадлежит слизистой оболочке ротовой полости, в первую очередь подвергающейся вирусной атаке. При попадании вирусов в носоглотку включается целый комплекс иммунных реакций, необходимых в общей системе защиты внутренних органов и тканей, и собственный местный иммунитет. Специфический гуморальный иммунитет ротовой полости является одним из важнейших компонентов местного иммунитета и представлен иммуноглобулинами. Наиболее важную роль среди них играет секреторный иммуноглобулин А (SIgA). Его выделение способствует связыванию вирусов гриппа и их выходу из организма в активной форме, таким образом ограничивая циркуляцию вируса среди людей. Секреторные антитела избирательно адсорбируются на поверхности клеток мерцательного эпителия, эффективно защищая их от респираторных вирусов, и предупреждают или смягчают тяжесть заболевания во входных воротах гриппозной инфекции.
Несмотря на длительные и серьезные исследования по проблеме гриппа и ОРВИ, профилактика и лечение этих инфекций по-прежнему остается крайне сложной задачей. Успешно применяемая иммунизация населения против гриппа не может полностью решить проблему предупреждения инфекционных болезней, вызываемых респираторными вирусами.
Специфические и неспецифические средства профилактики и лечения гриппа и ОРВИ весьма обширны и представлены препаратами из химических и природных соединений с различными механизмами воздействия на возбудителя или направленными на усиление защитных функций организма. В последние годы популярными среди препаратов этой группы становятся натуропатические средства, обладающие положительными свойствами, особенно важными для лечения и профилактики ОРВИ у детей. Среди натуропатических препаратов особое место занимают гомеопатические, не имеющие побочных эффектов и не вызывающие привыкания. Они могут без ограничения применяться во всех возрастных группах в течение эпидемического периода [6, 7].
Эффективность Оциллококцинума в лечении гриппа известна на протяжении более 70 лет, что показали исследования, проведенные в разных странах на большом числе пациентов. Оценка эффективности проводилась авторами по определенным критериям. Препарат признавался эффективным, если число пациентов из принимавшей его группы, у которых исчезли все гриппоподобные симптомы в течение 2 первых суток, превышало число выздоровевших пациентов из группы, принимавшей плацебо, и/или если период полного выздоровления был менее продолжительным при использовании препарата, чем при приеме плацебо. У всех пациентов, участвовавших в эксперименте и принимавших Оциллококцинум, были проанализированы побочные эффекты, а также точность, с которой пациенты следовали необходимым предписаниям.
Эффективность лечения гриппа и гриппоподобных заболеваний была продемонстрирована:
- в многоцентровом рандомизированном исследовании во Франции [8] при участии 300 пациентов по 150 человек в опытной группе, получавшей Оциллококцинум, и контрольной группе, не принимавшей этот препарат;
- в слепом плацебо-контролируемом исследовании в Германии [9] в период с ноября 1990 до весны 1991 г. у 188 пациентов, получавших Оциллококцинум, и 184 человек, получавших плацебо. Через 2 сут после начала лечения значительное улучшение состояния здоровья отмечали 43,7% лиц, принимавших Оциллококцинум, и 33,5% из группы плацебо. К этому сроку в группе, принимавшей плацебо, у 5,4% человек отмечено ухудшение состояния здоровья, что потребовало дополнительных лечебных мероприятий;
- во Франции в двойном слепом плацебо-контролируемом исследовании приняли участие 149 врачей общей практики, большинство которых не являлись гомеопатами. Исследование проводилось с участием 478 пациентов в возрасте 12 лет и старше в период эпидемии гриппа, вызванного вирусом гриппа А. Критериями выздоровления являлись снижение ректальной температуры ниже 37,5°С и окончательное исчезновение 5 признаков, входящих в определение гриппозного синдрома. Допускалась персистенция кашля, насморка и слабости. Эффективность препарата оценивалась по основным критериям (уровень выздоровления через 48 ч, изменение этого уровня с течением времени и длительность заболевания) и вторичным (применение сопутствующих препаратов, наличие нежелательных явлений).
Таким образом, клинические испытания в этих исследованиях подтвердили положительные результаты включения в схемы лечения гриппа и ОРВИ с помощью Оциллококцинума, применение которого способствует более быстрому исчезновению симптомов и сокращает продолжительность заболевания.
Полученные данные позволяют сделать следующий вывод. Несмотря на то, что клинические испытания гомеопатических препаратов достаточно сложны, исследования зарубежных коллег, проведенные на высоком организационном уровне с соблюдением всех требований доказательной медицины, представляют надежные результаты.
Положительное влияние Оциллококцинума в профилактике и лечении гриппа было продемонстрировано и эпидемиологическими опытами отечественных исследователей 10.
Целью нашего контролируемого сравнительного эпидемиологического исследования являлось изучение эффективности в профилактике гриппа и ОРВИ и влияния гомеопатического препарата Оциллококцинум на систему защиты организма у часто болеющих детей, а также проведение скрининга респираторных вирусов, циркулирующих среди детей дошкольного возраста в биологических жидкостях (слюна, сыворотка крови).
Материалы и методы
В исследовании приняли участие 100 детей, имеющих ежегодно по нескольку эпизодов заболеваний ОРВИ, из 2 детских дошкольных учреждений Москвы. было сформировано 2 группы: опытная группа (ОГ) - 50 детей и контрольная группа (КГ) - 50 детей. В ОГ дети получали Оциллококцинум по 1 дозе в неделю (1,8, 15 и 23-й день); в КГ в качестве профилактического средства детям давали поливитамины в возрастной дозировке. Выбыл из исследования 1 ребенок из ОГ из-за перевода в другое дошкольное учреждение.
В соответствии с дизайном в исследование включались дети без вакцинации против гриппа в течение последних 12 мес, а также при наличии в анамнезе нескольких эпизодов заболеваний ОРВИ и гриппа и не получающие специфических (противовирусных) средств защиты.
Критериям исключения из исследования - индивидуальная непереносимость препаратов и любое заболевание в острой форме, в том числе ОРВИ и грипп.
В случае появления первых симптомов заболевания ОРВИ и гриппа или при контакте с заболевшими детям, включенным в исследование, в листе наблюдений ставилась дата контакта или начала заболевания.
Верификация диагноза у заболевших проводилась:
- при субъективных и объективных факторах, характерных для респираторной вирусной инфекции (головная боль, изменение поведения: вялость/возбудимость, повышенная температура тела, конъюнктивит, заложенность носа и/или насморк, гиперемия зева, кашель, увеличение лимфоузлов);
- на основании результатов серологического исследования методом иммунноферментного амнеза (ИФА) - определение специфических антител классов А, M и G к респираторным вирусам, циркулирующим в ОГ и КГ (в сыворотке крови и слюне).
Изучение профилактической эффективности препарата Оциллококцинум проводилось следующими методами
- методом наблюдений;
- у 30 человек ОГ и 30 КГ в крови определялись специфические антитела классов А (M и G) к респираторным вирусам гриппа А (H3N2) и А (H1N1), парагриппа 2-го типа, аденовирусов (до начала и после окончания приема препаратов);
- у 30 человек ОГ и 30 КГ в слюне определялись специфические антитела классов А (M и G) к респираторным вирусам гриппа А (H3N2) и А (H1N1), парагриппа 2-го типа, аденовирусов (до начала и после окончания приема препаратов);
[Определение антител к вирусам в сыворотке крови и слюне проводилось по результатам мониторинга за их циркуляцией среди населения Москвы в изучаемый период (поданным вирусологической лаборатории ФГУЗ Роспотребнадзора в г. Москве).]
- изучение интерферонового статуса у 30 человек ОГ и 30 КГ в динамике (до начала и по окончании приема препаратов).
Схема эпидемиологического наблюдения за испытуемыми, получающими Оциллококцинум, представлена на рис. 1.
За группами детей, участвующими в эпидемиологическом исследовании, было установлено медицинское наблюдение. Информация о состоянии здоровья пациентов, находящихся в ОГ и КГ, ежедневно собиралась ответственным врачом в течение всего времени приема препаратов и в течение недели после окончания профилактического курса. Данные регистрировались в картах наблюдения для детей ОГ и листе наблюдения для детей КГ. Средний возраст детей в изучаемых группах представлен в табл. 1.

В конце ноября 2019 года педиатр приехала на вызов в загородный посёлок. Родители вызвали врача, подозревая, что их четырёхлетний ребёнок повторно заболел ветряной оспой.
Жалобы
Родители отмечали у ребёнка повышение температуры до 38 °C , сыпь вокруг рта, ладонях и подошвах, мальчик жаловался на боль в стопах (отказывался наступать на ноги).
После приёма "Нурофена" отмечалось кратковременное снижение температуры, однако боль в стопах не уменьшалась.
Анамнез
Болезнь внезапно началась около суток назад с подъёма температуры и появления болей в ногах. Мальчик настойчиво показывал на подошвы, отказывался наступать на них, просил прикладывать прохладные салфетки. Ночью спал крайне беспокойно. Утром родители заметили мелкие высыпания вокруг рта, на ладонях и подошвах, напоминающие высыпания при ветряной оспе.
Около года назад ребёнок болел ветряной оспой. Тогда отмечались температура и обильная сыпь на теле, пациент был осмотрен педиатром, диагноз подтверждён.
В течение последнего месяца семья не выезжала за пределы своего посёлка. Дома все здоровы. Мальчик посещает частный детский сад. Неделю назад в группу вышел мальчик, недавно приехавший с отдыха из Турции, где легко переболел "неизвестной болезнью с сыпью", со слов его матери. Врача в отеле к нему не вызывали.
Обследование
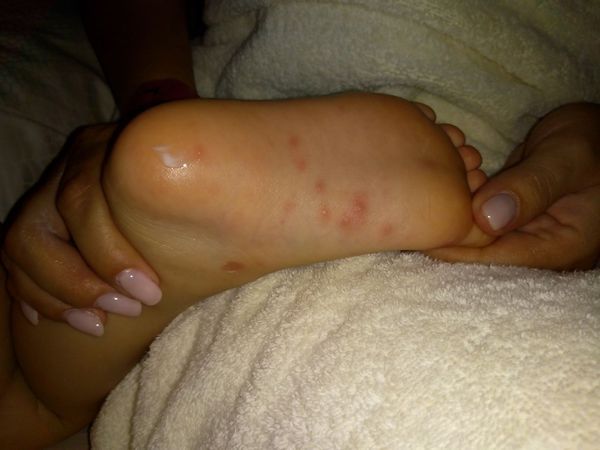
При осмотре: обильные папуловезикулёзные элементы на подошвах, скудные подобные элементы на ладонях. Вокруг рта около 10 розовых папулёзных элементов. На слизистой нёбных дужек, языка — мелкие пузырьки, вокруг них венчик покраснения. Сыпь во рту не доставляет ребёнку дискомфорта. Пьёт и ест без затруднений.
Со стороны других органов не отмечено никаких изменений. Температура 37,2 °C . К моменту осмотра мальчик уже уверенно наступает на ноги, ходит, не плачет.
Учитывая наличие классических для энтеровирусной инфекции высыпаний на коже кистей, стоп и слизистой рта, дополнительные обследования ребёнку не понадобились.
Диагноз
Лечение
Данное заболевание у детей не требует назначения противовирусных или антибактериальных препаратов. Мальчик получал симптоматическую терапию, направленную на облегчение симптомов:
- при жалобах на зуд и боль в месте высыпаний — смазывание элементов болтушкой "Циндол" 3-4 раза в день;
- орошение высыпаний на слизистой рта аэрозолем "Тантум верде" 3 раза в день;
- жаропонижающие средства при повышении температуры выше 38.5-39 °C .
- обильное питьё и диета с ограничением острых, кислых блюд, которые могут раздражать слизистую рта.
Прогулки разрешены, однако важно помнить, что ребёнок заразен для окружающих детей и взрослых. До полного разрешения сыпи мальчик должен быть изолирован. Купать ребёнка можно, но лучше под душем, а не в ванне.
Температура периодически повышалась в течение двух суток, свежие высыпания появлялись до третьего дня заболевания. Болевых ощущений после второго дня болезни больше не отмечалось. Полное разрешение высыпаний на коже и слизистых произошло к 12 дню от появления первых симптомов.
Через 2 недели от начала заболевания ребёнок был полностью здоров и начал вновь посещать детский сад.
Заключение
В нашем регионе случаи энтеровирусной инфекции преимущественно регистрируются с июля по сентябрь. Однако, учитывая широкие возможности для отдыха в тёплых странах в течение всего года, нельзя исключать встречу с этой инфекцией в холодное время года, как это и произошло в данном случае.
Кроме того, инфекция, вызванная вирусом Коксаки, действительно в некоторых случаях может напоминать ветряную оспу. Поэтому осмотр ребёнка педиатром крайне желателен.
Ежегодно, начиная с 2017 года, Роспотребназдор выпускает памятки для туристов, собирающихся провести летний отдых на море, в теплых странах, в которых рассказывается об опасностях вируса, а также о некоторых курортных местах, где вероятность заразиться особенно высока.

Симптомы вируса коксаки у детей
Симптомы в начальной стадии болезни:

- Интоксикация, о чем часто свидетельствует бурый или желтоватый налет на языке;
- Высокая температура до 39-40ºС, на этом фоне возможны судороги;
- Головная боль, слабость и сонливость, ломота во всем теле;
- Потеря аппетита, тошнота, рвота;
- Покраснение в горле, увеличиваются подчелюстные лимфоузлы.
- Через 1-2 дня на внутренней поверхности щек и губ, снаружи вокруг рта формируются водянистые пузырьки диаметром около 2 мм. Они сами вскрываются, что приводит к образованию язвочек.
- Одновременно с высыпаниями во рту такие же пузырьки появляются на коже ладоней и ступней. Сыпь может быть и на других частях тела.
Период выздоровления
Спустя 5 дней иммунная система начинает вырабатывать антитела. Спадает температура, общее состояние ребенка постепенно улучшается. Период выздоровления продолжается 5-7 дней: затягивается язвочки на слизистой, возвращается аппетит. В среднем заболевание продолжается 10 дней. Однако, если у ребенка ослаблен иммунитет, то вирус остается в нервной ткани и периодически вызывает рецидивы заболеваний: например, серозный менингит, герпетическая ангина, конъюнктивит, вирусное поражение сердца и так далее.
Какие противовирусные средства при вирусе Коксаки рекомендованы пациентам (на уровне МНН)
При любом заболевании необходимо комплексное лечение под наблюдением врача. И энтеровирусная инфекция – не исключение. Как правило, при обнаружении у маленького пациента характерных признаков болезни, назначается как противовирусное от Коксаки, так и симптоматическое лечение. Среди противовирусных препаратов применяют лекарственные средства, содержащие интерферон. К таким препаратам относится и Виферон Свечи.
Суппозитории, содержащие человеческий интерферон, не дают вирусу фору в несколько дней, пока организм сам начнет бороться с инфекцией, а начинает действовать незамедлительно, чем сокращает время выздоравливания. При симптоматическом лечении применяют следующее:
- Жаропонижающие сиропы или свечи, содержащие парацетамол или ибупрофен.
- Чтобы избежать обезвоживания и облегчения симптомов интоксикации следует пить большое количество воды (кипяченой или бутилированной), воды с лимоном;
- При поносах целесообразен прием абсорбирующие средства, например активированный уголь;
- Для облегчения боли во рту можно использовать гели, применяемые при прорезывании зубов у малышей.
- Для скорейшего заживления и профилактики инфицирования язвочек во рту применяются антибактериальные спреи;
- Хотя обычно сыпь не вызывает зуд у детей (отличие от ветрянки), но если она беспокоит малыша, то можно использовать антигистаминные средства.
Можно ли применять Виферон при коксаки?
Согласно инструкции препарат рекомендован для лечения энтеровирусных инфекций в комплексной терапии, в том числе и как противовирусное средство против вируса Коксаки.
Рекомендуемая доза для новорожденных детей, в том числе недоношенных с гестационным возрастом более 34 недель, – ВИФЕРОН 150 000 МЕ ежедневно по 1 суппозиторию 2 раза в сутки через 12 ч. Курс лечения — 5 суток.
Недоношенным новорожденным детям с гестационным возрастом менее 34 недель рекомендовано применение препарата ВИФЕРОН 150 000 МЕ ежедневно по 1 суппозиторию 3 раза в сутки через 8 ч. Курс лечения — 5 суток. Рекомендуемое количество курсов от одного до двух с перерывом в 5 дней.
Дети до 7 лет, ежедневно по 1 суппозиторию 150000 МЕ 2 раза в день с интервалом 12 часов в течение 5 дней (по показаниям лечение может быть продолжено с перерывом 5 дней). i
Какие противовирусные для профилактики коксаки можно принимать детям
Обычно перед поездками на курорты возникают вопросы о профилактике того или иного заболевания, который присутствует в жарком климате, и против которого у людей из других регионов отсутствует иммунитет. Конечно, было бы здорово дать какие-нибудь противовирусные препараты для детей от Коксаки своему ребенку и уже спокойно ехать отдыхать. Но, к сожалению, как и в ситуации с гриппом, таких препаратов, на 100 процентов защищающих от инфекции, не существует. И тут два пути, либо не посещать с маленькими детьми места потенциально опасные для них в инфекционном плане, либо соблюдать все возможные меры предосторожности, в первую очередь личную гигиену и гигиену ребенка. Следить, чтобы он не трогал лицо и рот грязными руками, не пользовался чужими вещами, в том числе и игрушками, и употреблял пищу только чистую воду, прошедшую термическую обработку, и только хорошо вымытые фрукты. Понятно, что в курортных условиях, не всегда можно вымыть руки с мылом, поэтому стоит запастись дезинфицирующими гелями, которым можно обработать руки. Так же в качестве меры профилактики могут применять такие противовирусные препараты при Коксаки, которые в виде спреев, гелей или мазей наносятся на слизистую носа, чтобы избежать заражения воздушно-капельным путем.
Выводы
Врач общей практики
Читайте также:

