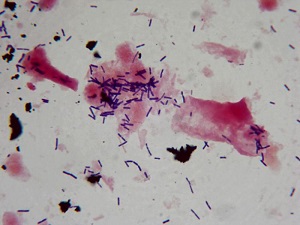
Окраска мазка метиленовым синим на гонококки
Обновлено: 18.04.2024
На мазки, высушенные на воздухе и фиксированные над пламенем спиртовки или метиловым спиртом, на 15-20 с наносится 1%-ный водный раствор метиленового синего, который затем осторожно смывается водой. После высушивания мазки микроскопируются.
Цитоплазма форменных элементов окрашивается в
бледно-голубой цвет, ядра - в синий, гонококки - в интенсивно-синий .
Аналогично окрашиваются и другие кокки. Если они находятся внутри клеток, то напоминают гонококки. По этому дифференциальное значение имеет только окраска по Граму.
Окраска по Граму
Этот метод, основан, на свойстве клеточной оболочки гонококка обесцвечиваться спиртом. Кокки, не относящиеся к роду нейссерий, остаются окрашенными. Используют
1%-ный водный раствор кристаллического
фиолетового (краску растворяют в горячей дистиллированной воде, раствор охлаждают и фильтруют через двойной бумажный фильтр);
раствор Люголя (1 г кристаллического йода, 2 г
калия йодида, 300 мл дистиллированной воды); 96%-ный этиловый спирт;1%-ный водный раствор нейтрального красного .
Окраска по Граму
На высушенный и фиксированный над пламенем спиртовки мазок кладут фильтровальную бумагу по размеру предметного стекла или несколько меньше, наливают на 1-2 мин раствор кристаллического фиолетового или же на мазок кладут фильтровальную бумагу, пропитанную 1% водным раствором кристаллического фиолетового. Затем мазок смывают водой и заливают раствором Люголя на 30-60с. Потом раствор Люголя сливают, и мазок погружают в ванночку с 96%-ным спиртом для обесцвечивания , которое производят под визуальным контролем, погружая и вынимая мазок из спирта до тех пор, пока с него перестанут стекать струйки краски. Препарат быстро промывают водой, наливают на 2мин раствор нейтрального красного, после чего мазок промывают водой и высушивают на воздухе. Препарат микроскопируют под иммерсионной системой при плоском зеркале и открытой диафрагме.
Гонококки окрашиваются в ярко-розовый цвет, протоплазма лейкоцитов - в слабо-розовый цвет. Ядра лейкоцитов и эпителиальных клеток, поскольку они удерживают частично кристаллвиолет, окрашиваются в слабо-синий цвет.
В переобесцвеченном мазке ядра лейкоцитов и эпителиальных клеток почти не имеют фиолетовой окраски.
В недообесцвеченном мазке гонококки окрашиваются в фиолетовый цвет и их можно принять за грам- положительные кокки .
ГОНОКОККИ окраска по ГРАМУ
ГОНОКОККИ окраска по ГРАМУ
Культуральное исследование.
При подозрении на гонорею, когда бактериоскопически гонококки не находят.
При наличии в мазке подозрительных на гонорею микроорганизмов.
При установлении излеченности.
При подтверждении гонорейного процесса у детей.
При обследовании больных трихомониазом после лечения.
У девочек и женщин старше 60лет с определением ферментативных своиств гонококков.
При исследовании материала из полости рта, при подозрении на гонорею глаз.
Методы провокации гонореи
Алиментарная провокация - заключается в назначении острой или соленой пищи и алкогольных напитков (пиво, шипучие вина).
Химическая провокация – заключается в раздражении слизистых оболочек мочеполовых органов химическими веществами.
Мужчинам производят инстилляцию в уретру 0,5%р-р ляписа.
Женщинам смазывание уретры на глубину 1-2см 1-2%-ным р-ром нитрата серебра, нижнего отдела прямой кишки на глубину 4см 1%-ным р-ром Люголя в глицерине и цервикального канала на глубину 1-1,5см 2-5%- ным р-ром нитрата серебра.
Девочкам влагалище люголевским р-ром, в уретру 2-3 капли 1%р-р ляписа.
Механическую провокацию производят путем растяжения уретры бужем или путем массажа на введенном буже.
Иммунобиологическая провокация – в/м вводят гоновакцину в дозе 500млн. микробных тел. Если гоновакацину применяли во время лечения, то для провокации назначают двойную терапевтическую дозу, но не более 2млрд. микробных тел. В условиях стационара можно вводить гоновакцину регионарно – в подслизистый слой шейки матки и уретры (100млн. микробных тел).
Термическая провокация - заключается в прогревании органов, в которых предполагается наличие гонококков. Проводят диатермию ежедневно в течении 3дней по 30-40-50мин., или индуктотермию 3 дня по 15мин. Мазки берут после каждого прогревания через 1час.
Физиологической провокацией является менструация. Мазки берут в дни наибольшего кровотечения.
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача. У любых препаратов есть противопоказания. Необходима консультация специалиста, а также подробное изучение инструкции!
Мазок на флору у женщин – лабораторное исследование, определяющее виды бактерий, которые присутствуют во влагалище. Это самый распространенный и простой метод выявления воспалений и ЗППП (заболеваний, передающихся половым путем).
Исследование абсолютно безболезненное. Оно производится во время обычного гинекологического осмотра. Врач берет материал одноразовым шпателем со стенок влагалища и шейки матки. Содержимое влагалища (влагалищный секрет) наносится на стекло. В лаборатории материал окрашивают, для того, чтобы бактерии стали четко различимы.
Цель исследования
- определить состояние микрофлоры влагалища;
- выявить половые инфекции и их возбудителя;
- определить степень воспалительного процесса;
- оценить степень чистоты влагалища, что обязательно перед дальнейшими диагностическими исследованиями и гинекологическими операциями – прижиганием эрозий, удалением полипов, выскабливанием;
- оценить состояние здоровья беременных женщин.
Когда гинеколог берет мазок на флору?
- жалобы на зуд или выделения из влагалища, другие симптомы воспаления;
- профилактические осмотры;
- контроль проведенного лечения;
- прием гормональных препаратов и иммуносупрессоров;
- контроль микрофлоры на фоне длительного приема антибиотиков;
- беременность. Проводится 3 раза за беременность (при постановке на учет, на 30-ой и 36-ой неделе).
Подпишитесь на Здоровьесберегающий видеоканал


Нормальная микрофлора влагалища
Влагалище здоровой женщины не стерильно. В нем присутствует множество видов микроорганизмов, их совокупность и называется микрофлорой. Бактерии постоянно конкурируют между собой за места обитания на стенках влагалища и за продукты питания.
Наиболее многочисленными являются лактобактерии и бифидобактерии, которые прикрепляются к эпителию влагалища. Они вырабатывают спирты, перекись, молочную и другие кислоты, обеспечивающие кислую реакцию влагалищного секрета. А также лизоцим и другие ферменты, сдерживающие размножение других видов бактерий.
Нарушение баланса микрофлоры влагалища
Микроорганизмы, входящие в состав микрофлоры здоровой женщины
| Микроорганизмы | Количество КОЕ/мл |
| Лактобактерии или палочки Додерлейна Lactobacillus spp | 10 7 -10 9 |
| Бифидобактерии Bifidobacterium spp. | 10 3 -10 7 |
| Клостридии Clostridium spp. | До 10 4 |
| Пропионибактерии Propionibacterium spp. | До 10 4 |
| Мобилункус Mobiluncus spp. | До 10 4 |
| Пептострептококки Peptostreptococcus spp | 10 3 -10 4 |
| Коринебактерии Corynebacterium spp. | 10 4 -10 5 |
| Стафилококки Staphylococcus spp. | 10 3 -10 4 |
| Стрептококки Streptococcus spp. | 10 4 -10 5 |
| Энтеробактерии Enterobacteriaceae | 10 3 -10 4 |
| Бактероиды Bacteroides spp. | 10 3 -10 4 |
| Превотеллы Prevotella spp. | До 10 4 |
| Порфиромонады Porphyromonas spp. | До 10 3 |
| Фузобактерии Fusobacterium spp. | До 10 3 |
| Вейлонеллы Veilonella spp. | До 10 3 |
| Микоплазмы M.hominis | До 10 3 |
| Уреаплазмы U.urealyticum | 10 3 |
| Кандиды - дрожжеподобные грибы | 10 4 |
Аббревиатура КОЕ/мл означает – колониеобразующих единиц в 1 мл питательной среды. Каждая колониеобразующая единица – это микроорганизм, из которого может образоваться колония.
Число бактерий выражают в десятичных логарифмах, для того, чтобы не писать числа с большим количеством нолей.
В описании влагалищной микрофлоры часто можно встретить названия грамположительные или грамотрицательные бактерии. Эти термины означают, что первые бактерии окрашиваются по методу, разработанному микробиологом Граммом, а другие при этом не изменяют свою окраску.
Грамположительные палочки в мазке, к которым относятся лактобактерии, являются хорошим признаком. В норме они преобладают у женщин репродуктивного возраста. В период менопаузы (климакса) и постменопаузы на первое место выходят грамотрицательные бактерии.
- аэробные – те, что развиваются при наличии кислорода;
- анаэробные – для жизнедеятельности которых не нужен кислород.
Как делают мазок на микрофлору влагалища?

Взятие мазка происходит в кабинете врача-гинеколога. Также женщина может пройти это исследование в частной лаборатории.
- Женщина размещается в гинекологическом кресле.
- Введение стерильных гинекологических зеркал для получения доступа к стенкам влагалища и шейке матки.
- Сбор материала с задней стенки влагалища. Эта процедура абсолютно безболезненна. Неприятные ощущения могут возникнуть льшь при прикосновении шпателя к воспаленному участку.
- Нанесение материала на предметное стекло. Влагалищный секрет распределяют штриховыми движениями по обезжиренному стеклу максимально тонким слоем, чтобы клетки располагались в один ряд и не закрывали друг друга.
- Фиксация мазка необходима, если его доставят в лабораторию более чем через 3 часа. Обработка позволяет избежать деформации клеток при высыхании и дает возможность сохранить препарат.
- Окраска мазка по методу Грама. В качестве красителя используется метиленовый синий. После окрашивания легче установить вид бактерий и определить состав микрофлоры.
- Оценка результата, которая состоит из 3-х частей: подсчет лейкоцитов, видовой состав микрофлоры, оценка чистоты влагалища.
- отверстия мочеиспускательного канала и парауретральных ходов (узких каналов, расположенных параллельно уретре);
- стенок влагалища;
- канала шейки матки.
Как подготовиться к этому мазку?
- за 14 дней прекратить прием антибиотиков и противогрибковых препаратов;
- за 2 дня прекратить введение любых влагалищных форм препаратов – растворов, свечей, таблеток, тампонов, мазей, кремов;
- за 2-3 суток воздержаться от половых актов;
- перед процедурой нельзя спринцеваться и мыть внутри влагалища.
Что показывает мазок на микрофлору влагалища?
4 степени чистоты влагалища
Какова норма мазка на микрофлору влагалища?
О чем говорят лейкоциты в мазке на флору влагалища?
Лейкоциты – это белые клетки крови, которые призваны бороться с инфекцией. Они могут выходить сквозь стенку сосудов и передвигаться самостоятельно. Лейкоциты обладают способностью к фагоцитозу – они поглощают бактерии и переваривают их. После того, как бактерия переварена, лейкоцит разрушается. При этом освобождаются вещества, которые вызывают воспаление, проявляющееся отеком и покраснением слизистой.
В норме количество лейкоцитов во влагалище не должно превышать 10. Большое количество лейкоцитов говорит о воспалении. Чем выше число лейкоцитов, тем сильнее выражен воспалительный процесс.
Зачем производят чувствительность к антибиотикам при исследовании мазка?
Чувствительность к антибиотикам или антибиотикограмма – выяснение чувствительности бактерий к антибиотикам. Исследование проводят одновременно с посевом мазка при обнаружении во влагалище болезнетворных бактерий, вызывающих воспаление или половые инфекции.
- полностью уничтожают бактерию - возбудителя болезни;
- останавливают рост возбудителя;
- не влияют на жизнедеятельность данной бактерии.
Как происходит исследование на чувствительность к антибиотикам?
После того, как были определены бактерии, вызвавшие болезнь, их распределяют в несколько пробирок с питательными средами. В каждую пробирку добавляют определенный антибиотик. Пробирки помещают в термостат, где созданы оптимальные условия для их размножения.
После культивации (около 7 дней) анализируют рост бактерий в пробирках. Там, где бактерии чувствительны к антибиотику, колоний не образуется. Этот препарат оптимальный для лечения пациентки. В пробирку, где добавлены препараты, к которым антибиотики нечувствительны, рост бактерий самый интенсивный. Такие лекарственные средства не могут быть использованы для лечения данного заболевания.
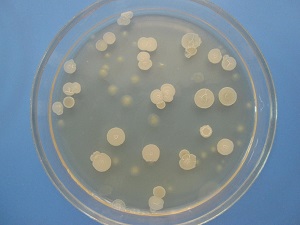
Что такое посев мазка?
Посев мазка или бактериологический посев (бакпосев) мазка – это лабораторное исследование, при котором содержимое влагалища помещают в питательную среду и создают оптимальные условия для роста бактерий.
- определить возбудителя инфекции половых органов;
- установить степень обсемененности – количество бактерий во влагалище;
- контролировать состояние микрофлоры после длительного лечения антибиотиками, цитостатическими препаратами. Проводится через 7-10 дней после отмены препарата.
- всем беременным женщинам при постановке на учет;
- при воспалительных процессах в половых органах;
- в мазке обнаружены грамотрицательные диплококки – для подтверждения гонококковой инфекции (гонореи);
- при вульвовагините рецидивирующем или хроническом.
Как проводится микробиологическое исследование?
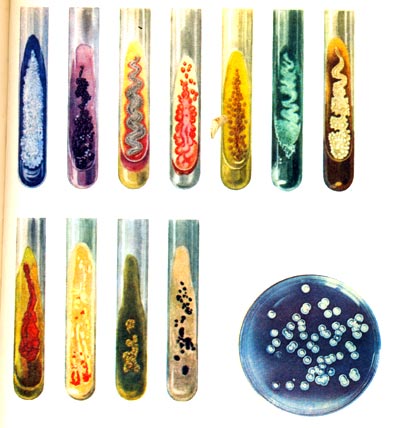
Отделяемое влагалища помещают в питательные среды – растворы или желеобразные массы, в которых имеются питательные вещества для бактерий. Пробирки и чашки Петри на 3-5 дней помещают в термостат, где постоянно поддерживается температура около 37 градусов, оптимальная для размножения микроорганизмов.
После культивации лаборант оценивает результаты. Из каждого микроорганизма в процессе деления вырастает целая колония бактерий. По ее внешнему виду лаборант определяет вид возбудителя. А по количеству колоний можно судить о концентрации данных микроорганизмов во влагалище. Далее концентрацию сравнивают с нормальными показателями.
Значимыми считаются те бактерии, концентрация которых превышает 10 4 КОЭ/мл. При данной концентрации микроорганизмы способны вызвать заболевание. При обнаружении такого количества бактерий результат анализа считается положительным.
Диагноз гонореи основывается на данных бактериологического и бактериоскопического исследования и идентификации возбудителя. Применяются также иммунологические методы для выявления антител (реакция Борде - Жангу) и антигенов (иммунофлюоресцентный и иммунохимический методы), а также постановка кожно-аллергических проб с гонококковым аллергеном. Материалом для исследования на гонорею обычно служит отделяемое из уретры, парауретральных протоков, большой железы преддверия, канала шейки матки, влагалища, секрет предстательной железы, семенных пузырьков, желез и лакун уретры, промывные воды прямой кишки, соскобы из уретры и прямой кишки, а также отделяемое глаз при гонобленорее и синовиальная жидкость при поражении суставов. Забор материала производит врач.
Отделяемое уретры у мужчин (предварительно отверстие очищают ватным тампоном, смоченным физиологическим раствором) захватывают краем предметного стекла, желобоватым зондом, ложечкой Фолькмана или берут петлей из глубины. У женщин материал для исследования из уретры, бартолиновых желез и парауретральных ходов после обтирания их ватным тампоном берут тупой ложечкой. Чтобы взять материал из шейки матки, во влагалище вводят зеркало Куска, протирают ватным тампоном и отделяемое берут влагалищным пинцетом или браншей корцанга. Из прямой кишки материал берут тупой ложечкой или с помощью промывных вод, в которых вылавливают подозрительные комочки, нити и готовят из них мазки.
Из материала, взятого из каждого пораженного органа и урогенитального тракта, готовят мазки на двух стеклах. Мазки должны быть равномерно размазанными, нетолстыми. Гонококки в тонких слоях окрашиваются грамотрицательно или переобесцвечиваются, в толстых - грамположительно. Высушенные на воздухе мазки фиксируют на пламени горелки и окрашивают (один мазок - 1%-ным раствором метиленового синего, второй - по Граму). При окраске по Граму лучше пользоваться водным раствором кристаллического фиолетового и 1%-ным водным раствором нейтрального красного. Мазок, окрашенный метиленовым синим, используется только для предварительного ориентировочного просмотра. Окончательное заключение по результатам микроскопии делается только на основании окраски препарата по Граму. Если не учесть это замечание, то можно допустить ошибку, так как другая флора, помимо гонококка, может располагаться внутриклеточно и иметь внешнее сходство с гонококком.
Окраска метиленовым синим. На мазки, высушенные на воздухе и фиксированные над пламенем спиртовки или метиловым спиртом, на 15-20 с наносится 1%-ный водный раствор метиленового синего, который затем осторожно смывается водой. После высушивания мазки микроскопируются. Цитоплазма форменных элементов окрашивается в бледно-голубой цвет, ядра - в синий, гонококки - в интенсивно-синий. Аналогично окрашиваются и другие кокки. Если они находятся внутри клеток, то напоминают гонококки.
Окраска по Граму. Используют 1%-ный водный раствор кристаллического фиолетового (краску растворяют в горячей дистиллированной воде, раствор охлаждают и фильтруют через двойной бумажный фильтр); раствор Люголя (1 г кристаллического йода, 2 г калия йодида, 300 мл дистиллированной воды); 96%-ный этиловый спирт; 1%-ный водный раствор нейтрального красного.
На высушенный и фиксированный над пламенем спиртовки мазок кладут фильтровальную бумагу по размеру предметного стекла или несколько меньше, наливают на 1-2 мин раствор кристаллического фиолетового или же на мазок кладут фильтровальную бумагу, пропитанную 1 %-ным водным раствором кристаллического фиолетового. Затем мазок смывают водой и заливают раствором Люголя на 30-60 с. Потом раствор Люголя сливают, и мазок погружают в ванночку с 96%-ным спиртом для обесцвечивания, которое производят под визуальным контролем, погружая и вынимая мазок из спирта до тех пор, пока с него перестанут стекать струйки краски. Препарат быстро промывают водой, наливают на 2 мин раствор нейтрального красного, после чего мазок промывают водой и высушивают на воздухе.
Препарат микроскопируют под иммерсионной системой при плоском зеркале и открытой диафрагме. Гонококки окрашиваются в ярко-розовый цвет, протоплазма лейкоцитов - в слабо-розовый цвет. Ядра лейкоцитов и эпителиальных клеток, поскольку они удерживают частично кристаллвиолет, окрашиваются в слабо-синий цвет. В переобесцвеченном мазке ядра лейкоцитов и эпителиальных клеток почти не имеют фиолетовой окраски. В недообесцвеченном мазке гонококки окрашиваются в фиолетовый цвет и их можно принять за грамположительные кокки. В случае неправильной окраски мазка по Граму берут препарат, окрашенный метиленовым синим, предварительно снимая с него иммерсионное масло спиртом или ксилолом, и окрашивают по Граму.
Посылая в лабораторию материал для исследования, необходимо приложить к нему направление, в котором следует указать, откуда взят материал, фамилию, инициалы больного, номер истории болезни и предполагаемый диагноз. В ответах из лаборатории нужно отмечать количество форменных элементов, эпителиальных клеток в мазке, присутствие или отсутствие других микроорганизмов ( и их отношение к окраске по Граму), вагинальных трихомонад, дрожжевых клеток.
Если при бактериоскопии не выявлены гонококки, прибегают к методу посева патологического материала из очагов поражения на искусственные питательные среды. Им пользуются в подозрительных на гонорею случаях, при торпидной, хронической гонорее, у заведомых источников заболевания гонореей, в случае воспалительных заболеваний урогенитального тракта у женщин, для подтверждения диагноза при установлении излеченности у детей, при исследовании материала из полости рта, при подозрении на гонорею глаз. Наилучшей средой для получения культуры гонококка является мясо- пептонный агар с добавлением асцитной или гидроцельной жидкости. В.Н. Беднова и М.Я. Яцуха предложили безасцитные среды.
При посеве загрязненного посторонней микробной флорой (из прямой кишки) материала в среду добавляют полимиксин М (12,4 ЕД/мл) и ристомицина сульфат (6,2 ЕЛ/мл). Оба антибиотика подавляют рост грамположительных и грамотрицательных микробов, не влияя на рост гонококков. Наилучший результат дает непосредственный посев материала на питательные среды. Если невозможно произвести бактериологические исследования на месте, пользуются транспортными средами. Гонококк на искусственных питательных средах дает рост обычно через 24 ч в виде мелких росовидных колоний. Если на следующий день рост гонококков не обнаружен, за посевами наблюдают 6-7 сут. Распознавать гонококковые колонии помогает оксидная реакция. На выросшие подозрительные колонии наносятся одна-две капли 1%-ного раствора парафенилендиамина или 0,5%-ного раствора тетраметилпарафенилендиамина гидрохлорида.. Гонококковые колонии при этом окрашиваются в пурпурно-коричневый (до черного) цвет.
При микроскопии мазков, приготовленных из суточной культуры, гонококки имеют вид кокков или диплококков одинаковой величины; приготовленные из трехсуточной культуры гонококки полиморфные, отдельные экземпляры окрашиваются очень бледно, количество гонококков с сохранившейся морфологией невелико. Дальнейшую идентификацию подозрительных на гонококк колоний производят на желточной среде ферменции. Использование ее позволяет, как правило, выделить гонококки в монокультуре.
Для отличия гонококков от сходных с ними микробов можно ограничиться исследованием ферментации глюкозы, мальтозы, левулезы. Гонококки ферментируют только глюкозу.
Для выявления гонококков в отделяемом применяют прямой метод иммунофлюоресценции. Для этого приготовленные мазки выдерживают в меченной изотиоционатом антигонококковой сыворотке в течение 1 ч при 35 градусов С во влажной камере, промывают фосфатным буфером и исследуют в люминесцентном микроскопе. Метод пригоден для дифференцирования гонококков в культурах и менее информативен при исследовании мазков, приготовленных из отделяемого очагов поражения.
В последние годы в диагностике гонореи используют иммуноферментный анализ, разработанный фирмой "АВВОТТ" в США. Тест обладает большой информативностью и сокращает сроки диагностики.
В качестве отборочного теста при обследовании на гонорею применяют постановку внутрикожной пробы с аллергеном гонококка, содержащим иммунологически активный белок, позволяющий выявить состояние сенсибилизации к возбудителю. Для выявления специфической сенсибилизации к гонококку аллерген в количестве 0,1 мл вводят в область средней трети внутренней поверхности предплечья строго внутрикожно. Оценку реакции производят через 24 ч после введения препарата (реакция гиперчувствительности замедленного типа). В зависимости от размера местной реакции ее оценивают на + (диаметр 6-10 мм), ++ (11-20 мм), +++ (свыше 20 мм). Результат считается положительным при наличии гиперемии с инфильтрацией диаметром свыше 5 мм. Лица с положительными результатами внутрикожной пробы подлежат углубленному клинико-лабораторному обследованию на гонорею. Противопоказания к постановке пробы: декомпенсированные заболевания печени, почек, сердечно-сосудистой системы, крови, туберкулез, ревматизм в стадии обострения, беременность, новообразования, аллергические заболевания и предшествующая гормонотерапия, острые интеркуррентные заболевания.
Трихомоноз характеризуется многоочаговостью поражения. Следовательно, материал для исследования необходимо брать из многих очагов инвазии.
Выделения, соскоб берут у мужчин из мочеиспускательного канала, у женщин — из боковой и задней частей свода влагалища, мочеиспускательного канала; у девочек — через отверстие девственной плевы желобоватым зондом или браншей вагинального пинцета. Перед взятием материала не рекомендуется туалет наружных половых органов, больного просят длительное время (не менее 3-4 ч) воздержаться от мочеиспускания.
Полученный материал помещают на предметное стекло и накрывают покровным стеклом. Если он густой, предварительно добавляют несколько капель теплого изотонического раствора натрия хлорида. Мочеполовые трихомонады необходимо рассматривать под микроскопом в свежем и окрашенном состоянии.
Нативные мазки желательно использовать немедленно. Исследуют при увеличении 10х40 обычным микроскопом или в темном поле зрения фазовоконтрастным. В свежеприготовленных неокрашенных препаратах мочеполовые трихомонады имеют грушевидную форму, величина их немного больше лейкоцита, движения — толчкообразные поступательные. При изучении препарата фазовоконтрастным микроскопом можно различить в расширенной части трихомонады жгутики.
Исследование трихомонад только в нативном мазке не исключают смешивания мочеполовых трихомонад с другими видами, встречающимися в организме человека (кишечная, ротовая). Поэтому, наряду с исследованием материала в нативном состоянии, необходимо всегда производить микроскопию окрашенных мазков. Мазки подсушивают на воздухе и фиксируют. Способ фиксации зависит от метода окраски. Для более детального исследования строения трихомонад (обнаружение ядра, ундилирующей мембраны и других органоидов) мазок окрашивают по Романовскому-Гимзе. В этих случаях препарат фиксируют спиртом и эфиром поровну.
Чаще всего мазки окрашивают 1% расвором метиленового синего или по Граму. Препарат фиксируют обычно над пламенем горелки. Окраска метиленовым синим и по Граму имеет преимущество перед другими методами, заключающееся в том, что в мазках можно одновременно исследовать гонококки и трихомонады.
Трихомонады, окрашенные по Граму, красноватого цвета, а метиленовым синим — синего. Величина их различная. Ядро овальной формы, расположено эксцентрически и окрашивается в более темный цвет по сравнению с протоплазмой. Жгутики не определяются. Часто в расширенной части трихомонады можно различить маленькую щель — цистому, а в цитоплазме — вакуоли, микроорганизмы, лейкоциты, эритроциты, сперматозооны и др. Для диагностики важным является обнаружение грамотрицательных диплококков (гонококков). При оценке препаратов, окрашенных метиленовым синим, необходимо дифференцировать трихомонады и эпителиальные клетки, которые больше по размеру, ядро расположено в центре.
Окраска гонококков метиленовым синим
Перед окраской мазки фиксируют 96-градусным этиловым спиртом в течение 3-х минут или над пламенем спиртовки. На высушенный мазок наносят 1% раствор метиленовой синьки и оставляют в течение 1 минуты. Остатки красителя смывают под струей холодной воды и высушивают в штативе. При исследовании под микроскопом ядра клеток окрашены в синий цвет, цитоплазма в голубой цвет различной интенсивности. Слизь голубого цвета. Бактериальная флора окрашивается в синий цвет различных оттенков. Гонококки темно-синего цвета, резко очерчены, бобовидной формы, парные, располагаются внутри полиморфноядерных лейкоцитов, в слизи и на эпителиальных клетках.
Окраска гонококков по Граму
Мазок фиксируют над пламенем горелки в течение 1-2 мин и окрашивают каким-либо красителем трифенилметановой группы (генцианвиолет, метилвиолет, кристаллвиолет), промывают водой 1-2 мин и заливают раствором Люголя (калия йодид — 2 г, йод кристаллический — 1 г, вода дистиллированная — 300 мл), а затем фиксируют 96% этиловым спиртом в течение 1 мин до появления серо-фиолетовых струек. После этого препарат промывают водой и дополнительно окрашивают какой-либо контрастной краской (нейтральрот). Гонококки грамотрицательны, то есть окрашиваются в красный либо розовый цвет. Грамположительные бактерии фиолетового цвета.
Читайте также:

