Окраска по граму при туберкулезе
Обновлено: 24.04.2024
Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
Для диагностики туберкулёза применяют бактериоскопические, бактериологические, биологические, серологические и аллергологические методы, входящие в обязательный диагностический минимум. Материалом для исследований служат мокрота, отделяемое свищей, моча, СМЖ, испражнения.
Микроскопия возбудителя туберкулеза в патологическом материале. В мазках, окрашенных по Цилю-Нильсену, обнаруживают кислотоустойчивые палочки возбудителя туберкулеза.
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности их обнаружения используют методы обогащения: центрифугирование и флотацию. В первом случае исследуемый материал обрабатывают смесью растворов NaCl и NaOH, центрифугируют и микроскопируют осадок. Второй метод включает обработку материала смесью NaOH, дистиллированной воды и ксилола (или бензола). Образец энергично встряхивают; образующаяся пена всплывает и захватывает микобактерии. Пену отсасывают и готовят мазки.
Наиболее результативна люминесцентная микросколия возбудителя туберкулеза. Материал обрабатывают аурамин-родамином и бактерии окрашиваются в бело-жёлтый цвет. Для выявления L-форм применяют AT, меченные флюорохромами.
Выделение возбудителя туберкулеза
Достоинство метода — возможность получения чистой культуры туберкулеза, позволяющая её идентифицировать, оценить вирулентные свойства и определить чувствительность к ЛС. Материал засевают, тщательно втирая, на твёрдые питательные среды.
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры применяют методы обогащения или обрабатывают материал 6-12% серной кислотой. Основной недостаток бактериологического метода — длительность получения результата (от 2 до 12 нед). В связи с этим разработаны ускоренные микрометоды выделения возбудителя туберкулеза.
Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в следующем. Материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду, дополненную цитратной лизированной кровью.
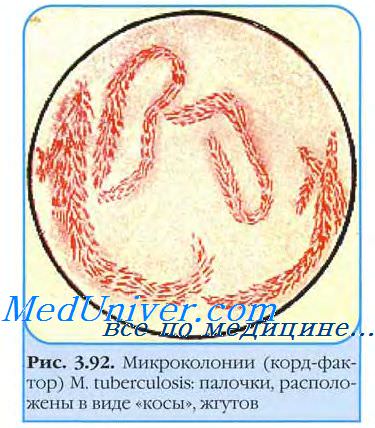
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные (рис. 22-2), а невирулентные — аморфные микроколонии. Культуры L-форм выделяют посевом в столбик полужидкой среды и инкубируют при 37 °С 1-2 мес.
Рост проявляется в виде облачка помутнения с мелкими вкраплениями. Вирулентность выделенной культуры возбудителя туберкулеза определяют заражением лабораторных животных и по наличию корд-фактора. Последний легко идентифицируют по способности микобактерии связывать нейтральный красный и нильский голубой и удерживать их после добавления щелочи. Вирулентные штаммы возбудителя туберкулеза удерживают красители, авирулентные — нет.
Лабораторная диагностика туберкулеза. Выявление бактерий туберкулеза.
В распознавании и дифференциальной диагностике туберкулеза, а также в определении эффективности проводимого лечения важную роль играют лабораторные методы исследования. Среди них большое значение имеют прежде всего способы обнаружения микобактерии туберкулеза в различных выделениях, воспалительных экссудатах, жидкостях и тканях организма больного.
При туберкулезе легких микобактерии находят прежде всего в мокроте. Частота, массивность и постоянство бацилловыделения зависят от формы процесса. Оно часто имеет место при инфильтративном и особенно деструктивном туберкулезе легких. Реже или периодически выделяют микобактерии больные очаговыми, диссеминированными и цирротическими формами туберкулеза без явного распада легочной ткани. Существенное значение имеет при этом состояние бронхов. При их специфическом поражении, но сохраненной дренажной функции микобактерии выявляются с мокротой сравнительно чаще и с большим постоянством, чем при нормальном состоянии бронхов или при их стенозе, вызывающем блокаду каверны.
Микобактерии туберкулеза находят в большом количестве в обильно выделяющейся мокроте, а в скудном отделяемом, наоборот, они встречаются реже и в виде единичных экземпляров. У больных, не выделяющих мокроту, лучшие результаты дает применение раздражающих аэрозольных ингаля пий 10—15% раствора поваренной соли в 1% растворе питьевой соды Н. М. Рудой и соавт. (1971) применяют с этой целью смесь, состоящую из 5 мл 10% раствора хлорида натрия, 1 мл химопсина, растворенного в физиологическом растворе, и 20 капель солутана.
Второе место по эффективности выявления бацилловыделения у больных, не выделяющих мокроту, занимает исследование промывных вод трахеи и бронхов, которое предложил Я. С. Зобин (1939). В настоящее время для анестезии гортани у взрослых применяют 0,25% раствор дикаина, разведенный в 10% растворе новокаина. Этот раствор наливают во время фонации на голосовые связки в количестве 0,5—1 мл. У больных с повышенным глоточным рефлексом этим раствором смазывают заднюю стенку глотки. Затем в трахею шприцем с напаянной канюлей вводят 10—20 мл физиологического раствора комнатной температуры.
При этом в результате раздражения слизистой оболочки бронхов возникает кашель, при котором из глубоких дыхательных путей вместе с введенной жидкостью выделяются слизь и мокрота. Это отделяемое исследуют на присутствие микобактерии туберкулеза или другой микробной флоры.
Исследование промывных вод бронхов редко сопровождается серьезными осложнениями. Только при сильном, длительном и приступообразном кашле иногда появляется кровохарканье, может аспирироваться инфекционный материал в здоровые участки легочной ткани, нарастает сердечная недостаточность. Такие явления отмечаются главным образом у больных с сопутствующей бронхиальной астмой, пороком сердца, гипертонией. В подобных случаях, очевидно, не следует прибегать к данному методу исследования. При отсутствии таких противопоказаний, особенно у больных с ограниченными формами процесса, у которых чаще всего и возникает необходимость в исследовании промывных вод бронхов, обычно не наблюдается каких-либо осложнений, и поэтому его можно производить не только в клинических, но и в амбулаторных условиях.
Менее эффективно производимое натощак исследование промывных вод желудка, в которых может содержаться бациллярная мокрота или бронхиальная слизь, чаще заглатываемая детьми, а иногда и взрослыми (Аrmand-Dellille, 1927). Кроме того, микобактерии могут проникать в желудок через его слизистую оболочку при гематогенном распространении инфекции в организме, а также при забрасывании бациоллосодержащей желчи (М. Д. Розанова, 1950). Пользоваться этим методом рекомендуется в тех случаях, когда не удается получить мокроту при раздражающих ингаляциях, при противопоказаниях к применению промывания бронхов или при невозможности их проведения по другим причинам.
Наименее информативно определение бацилловыделения с помощью исследований мазков слизи из гортани, а также промывания только верхних отделов дыхательных путей.
У части больных можно выделить микобактерии из крови. По наблюдениям 49 авторов, обобщенным в 1954 г. Dalencour, бациллемия отмечалась в среднем у 5,3% больных различными формами туберкулеза. П. И. Беневоленский (1945) установил ее у 3,7% больных туберкулезом легких (исключая страдающих гематогенным процессом). Чаще обнаруживают микобактерии в крови при туберкулезе кожи, обширных гематогенных диссеминациях в легких, при менингите. Однако, по сводным данным Kallos (1937). основанным на изучении гемокультур, выделенных от 14 502 больных, туберкулезная бациллемия имела место всего лишь у 1,13% из них.
Частота выявления микобактерии зависит не только от формы заболевания, метода получения материала, но и от способа его исследования (бактериоскопия, посев, заражение животных). Микобактерии туберкулеза обнаруживают при прямой бактериоскопии мазков мокроты, окрашенных по Цилю—Нельсену, при микроскопии с использованием метода обогащения — флотации и люминесцентного способа исследования. Методы обогащения повышают частоту обнаружения микобактерии туберкулеза в мокроте, промывных водах желудка и бронхов, в экссудате, спинномозговой жидкости, в каловых массах на 10—20% по сравнению с результатами прямой бактериоскопии.
Среди бактериоскопических методов выявления бацилловыделения наиболее чувствительным является люминесцентная микроскопия, повышающая возможность обнаружения в мокроте микобактерии на 15—20% по сравнению с обычной бактериоскопией, а при исследовании мазков из флотационных колец — на 8—10%. При этом облегчается изучение некоторых биологических свойств возбудителя — старения культур, аутолиза клеток и др.
Некоторые авторы утверждают, что при флюоресцентной (люминесцентной) микроскопии микобактерии туберкулеза можно выявить даже чаще, чем при посевах мокроты и других материалов на различные питательные среды. Kolbel (1955) обнаружил их при простой бактериоскопии у 39,7% больных, при бактериологическом методе — у 52,1%, а при люминесцентной микроскопии — у 73,6%. На преимущество последнего метода указывают Т. Н. Ященко и И. С. Мечева (1973), Н. С. Страхов и соавт. (1973).
Для суждения об эффективности проводимой антибактериальной терапии придают прогностическое значение уменьшению (или сохранению) в динамике массивности бацилловыделения. Поэтому целесообразно не только констатировать бацилловыделение, но и оценивать его количественный показатель. При этом при бактериоскопии бацилловыделение оценивается как обильное, если находят микобактерии в каждом поле зрения, умеренное — при наличии «единичных микробов в 40—50 полях зрения и скудное — при нахождении их единичных экземпляров в препарате.
Микобактерии. Микобактериозы. Свойства микобактерий. Классификация микобактерий.
В состав рода Mycobacterium семейства Mycobacteriaceae отдела Firmicutes включены неподвижные аэробные грамположительные палочковидные бактерии. Иногда они образуют нитевидные структуры, напоминающие мицелий грибов. Это и послужило основанием для их названия [греч. mykes, гриб и лат. bacterium, бактерия].
Для микобактерий характерно высокое содержание липидов, фосфатидов и восков в клеточных стенках (до 60%), что определяет их щёлоче-, спирто- и кисдотоустойчивость (признак особенно выражен у паразитических видов микобактерий).
Поэтому микобактерии плохо воспринимают анилиновые красители и обычные способы окрашивания. Для окраски применяют интенсивные методы, обычно Циля-Нильсена. Растут медленно или очень медленно; сапрофитические виды растут несколько быстрее. Некоторые виды образуют каротиноидные недиффундирующие в среду пигменты.
Микобактерии широко распространены в окружающей среде и вызывают поражения, известные как микобактериозы Заболевания регистрируют у различных холоднокровных и теплокровных животных; наиболее характерны поражения кожи, лёгких и лимфатических узлов.
Классификация микобактерий
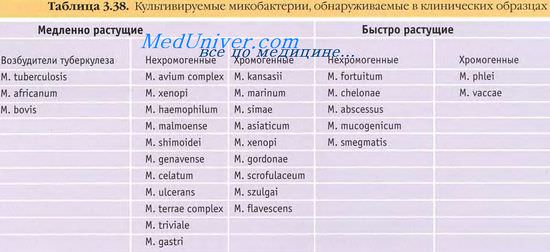
При классификации микобактерий учитывают патогенность для человека, способность к пигментообразованию, скорость роста и способность синтезировать никотиновую кислоту (ниацин).
• По патогенности выделяют собственно патогенные (вызывающие конкретные заболевания), потенциально патогенные и сапрофитические микобактерии. Патогенными для человека свойствами обладают М. tuberculosis, M. leprae, M. bovis. Прочие виды, вызывающие поражения у человека, известны как атипичные микобактерии.
• По скорости роста выделяют быстрорастущие (дают видимый рост на . 4-7-е сутки), медленнорастущие (рост наблюдают через 7-10 и более дней) и не растущие на искусственных средах (М. leprae) виды микобактерий.
• По способности образовывать пигменты выделяют фотохромогенные (образуют пигмент на свету), скотохромогенные (образуют пигмент в темноте) и нефотохромогенные (не образуют пигмента) виды микобактерий.
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Санкт-Петербургскогий государственный университет, Санкт-Петербург, Россия
Санкт-Петербургский НИИ фтизиопульмонологии
Информативность различных методов идентификации кислотоустойчивых микобактерий в зависимости от степени активности туберкулезного процесса
Журнал: Архив патологии. 2018;80(3): 40‑45
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Окраска карболовым фуксином по Цилю—Нильсену является основным используемым с конца XIX века методом выявления микобактерий туберкулеза в тканях. При этом количество микобактерий часто не соответствует активности инфекционного процесса как по клиническим, так и по морфологическим данным. Цель исследования — выявление морфологических особенностей микобактерий туберкулеза у пациентов с длительно протекающим туберкулезом. Материал и методы. Изучены 24 случая аутопсии верифицированного фиброзно-кавернозного туберкулеза. Парафиновые срезы окрашивали гематоксилином и эозином, карболовым фуксином по Цилю—Нильсену, аурамин-родамином (с последующим исследованием с помощью люминесцентного микроскопа), проводили иммуногистохимическое (ИГХ) исследование с сывороткой к РАВ (Protein antigen B). Результаты и обсуждение. Во всех наблюдениях выявлены характерные для прогрессирующего туберкулеза изменения. При окраске по Цилю—Нильсену обнаруживали единичные скопления кислотоустойчивых бактерий (менее чем в 10 полях зрения, общее число не более 1000). При окраске аурамин-родамином число обнаруженных микобактерий оказалось достоверно выше (в 10—50 полях зрения, общее число от 1000 до 10 000), а наибольшим оно было при ИГХ-исследовании (более чем в 50 полях зрения , общиее число более 10 000). При этом локализация микобактерий при всех видах исследования была исключительно внеклеточной. Доля типичных палочек при окраске по Цилю—Нильсену (85—95%, в среднем 88,13±2,14%) значительно больше таковой, выявленной при окраске аурамин-родамином (50—85%, в среднем 64,38±4,24%) , и еще значимо больше, чем при проведении ИГХ-исследования (50—70%, в среднем 57,29±2,78%). Столь же сильно разнятся показатели для атипичных морфологических форм микобактерий, выявляемых при окраске по Цилю—Нильсену в минимальном количестве и обнаруживаемых в большом количестве при флюоресцентном и ИГХ-исследовании. Заключение. Доказана способность микобактерий к морфологическому полиморфизму, а также необходимость уточнения патогенеза туберкулеза.
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Санкт-Петербургскогий государственный университет, Санкт-Петербург, Россия
Санкт-Петербургский НИИ фтизиопульмонологии
Морфологические методы выявления микобактерий туберкулеза (МБТ) незаменимы в рутинной практике фтизиатрических, инфекционных и многопрофильных стационаров, дополняя клинические, радиологические, микробиологические и иммунологические подходы. При этом число микобактерий, обычно оцениваемое по количеству кислотоустойчивых палочек при окраске по Цилю—Нильсену (Ziehl—Neelsen), часто не соответствует активности инфекционного процесса как по клиническим, так и морфологическим данным, что, однако, не послужило пока предметом масштабных исследований [1, 2].
Основным, используемым с конца XIX века, методом окрашивания микобактерий является метод Циля—Нильсена с использованием карболового фуксина. Состав красителя и протокол окрашивания варьируют в модификациях разных авторов, но суть метода неизменна: карболовый фуксин задерживается в клеточной стенке микобактерий и сохраняется в ней даже после обработки кислотой, обесцвечивающей все остальные структуры и микроорганизмы.
Альтернативным методом селективного окрашивания МБТ является использование раствора аурамина О и родамина В, предполагающее исследование ткани с применением люминесцентной микроскопии, что ограничивает его широкое использование. Как и карболовый фуксин, аурамин образует комплекс с миколовыми кислотами в составе микобактерий, но, по-видимому, обладает к ним большим сродством, поэтому правильно окрашенные препараты с полноценно обесцвеченным фоном обеспечивают высокую контрастность микобактерий и позволяют обнаруживать их в большем количестве по сравнению с окраской по Цилю—Нильсену [3, 4].
Обсуждается возможность выявления МБТ в тканях при использовании иммуногистохимии (ИГХ) и метода полимеразной цепной реакции (ПЦР). Применительно к ИГХ проблемой является перекрестная чувствительность антител как к микобактериям туберкулезного комплекса, так и к нетуберкулезным микобактериям. Применение метода ПЦР существенно ограничивают значительные технические трудности, связанные с его проведением, а также отсутствие возможности достоверного определения количества возбудителей и их локализации [5—8].
В качестве сыворотки для ИГХ-исследования используются моноклональные антитела к антигену РАВ (Protein antigen B)—гликопротеину с молекулярной массой 38 кДа, обнаруживаемому вне зависимости от состояния клеточной стенки микобактерий [9].
Неоднородность результатов даже при правильно выполненной классической окраске по Цилю—Нильсену может рассматриваться как повод для изучения свойств возбудителя.
Одним из важных факторов, влияющих на взаимодействие МБТ с макроорганизмом, является иммуносупрессия прежде всего при ВИЧ-инфекции, в результате чего морфологическая картина туберкулеза в большинстве случаев становится нетипичной за счет меньшей выраженности гранулематозной реакции и большей альтерации, при этом число обнаруживаемых кислотоустойчивых палочек, как правило, больше [10]. Тем не менее и у пациентов без иммуносупрессии регулярно встречается ситуация, при которой ожидаемая с учетом клинических данных морфологическая картина далека от классических представлений о строении туберкулезной гранулемы, локализации и форме кислотоустойчивых микобактерий [11—14].
Слабое окрашивание карболовым фуксином или полное отсутствие такового, зачастую безосновательно трактуемое как технологический дефект, в действительности может быть связано с изменением самого возбудителя, предполагающим полную или частичную утрату микобактериями клеточной стенки (возможно, по типу образования L-форм), чей химический состав и пространственная структура определяют их тинкториальные свойства. Трансформация в L-формы является универсальным свойством многих видов бактерий, обеспечивающих адаптацию в неблагоприятных условиях [15]. В случае с МБТ в качестве неблагоприятных условий можно рассматривать как иммунный ответ, так и специфическую терапию. Показано, что потеря клеточной стенки может быть одним из факторов формирования лекарственной устойчивости к противотуберкулезным препаратам [16, 17].
Кроме непостоянства тинкториальных свойств микобактерий, также требует изучения феномен, при котором обнаруживаются атипичные формы возбудителя: кокковидные, булавовидные, ветвящиеся и прочие, отличные от классических палочек Коха [18].
Образование подобных форм может происходить как в процессе изменения структуры клеточной стенки, так и в результате изменения жизненного цикла причем и при ускорении размножения, и при его угнетении с преобладанием старых форм. В любом случае атипичная морфология микобактерий требует сопоставления с клиническими проявлениями заболевания и эффективностью терапии [19—22].
Материал и методы

Изучены 24 случая аутопсии клинически, рентгенологически и микробиологически верифицированного фиброзно-кавернозного туберкулеза легких. Большинство пациентов мужчины, средний возраст 49,67±5,77 года. У большей части пациентов зафиксирована широкая лекарственная устойчивость (ШЛУ) МБТ — 14 случаев либо множественная лекарственная устойчивость (МЛУ) МБТ — 5 случаев (невосприимчивость заболевания соответственно к четырем или двум противотуберкулезным препаратам первой линии), при этом ни в одном случае не выявлено сочетания туберкулеза с ВИЧ. Во всех наблюдениях имело место длительное течение заболевания и продолжительное лечение в профильных стационарах (см. таблицу). Характеристика исследованных умерших Примечание. М — мужчины, Ж — женщины.
Непосредственной причиной смерти большинства пациентов стала интоксикация вследствие прогрессирования инфекционного процесса, также были зафиксированы случаи смерти от легочного кровотечения, тромбоэмболии легочной артерии и сердечно-легочной недостаточности. На вскрытии диагноз фиброзно-кавернозного туберкулеза во всех случаях подтвержден.
Кусочки легких для гистологического исследования фиксировали в 10% нейтральном формалине с последующей проводкой в спиртах и заливкой в парафин по общепринятым методикам. Срезы окрашивали гематоксилином и эозином, карболовым фуксином по Цилю—Нильсену, аурамин-родамином (с последующим исследованием с помощью люминесцентного микроскопа), также проводили ИГХ-исследование с использованием моноклональных антител к антигену РАВ.
Исследование включало оценку выраженности морфологических изменений в области каверн и активности туберкулезного процесса по классификации Б.М. Ариэля [23], подсчет количества микобактерий при увеличении в 400 раз и количества полей зрения, в которых они визуализируются, определение соотношения между различными морфологическими формами возбудителя (палочковидными, кокковидными и прочими), а также их локализация (внутриклеточно, внеклеточно либо в виде адгезированных на поверхности фагоцитов).
После оценки процентного соотношения различных морфологических форм микобактерий подсчитывали среднее значение для каждой формы, затем вычисляли абсолютную погрешность с доверительной вероятностью p=0,95. Значимость различий между методами исследования оценивали путем вычисления t-критерия Стьюдента и сравнения с критическими значениями.
Результаты
При окраске гематоксилином и эозином во всех наблюдениях выявлены характерные для туберкулеза изменения, соответствующие прогрессированию инфекционного процесса (активность IV—V степени по классификации Б.М. Ариэля): крупные каверны с широкой фиброзной капсулой в стенках каверн и в окружающей легочной ткани, определялись гранулемы и более крупные очаги отсева, представленные округлыми эозинофильными фокусами казеозного некроза с мелкими фрагментами клеточного детрита различного размера, окруженными клеточным валом, представленным лимфоцитами, плазмоцитами и в большей степени макрофагами с эпителиоидно-клеточной трансформацией и тенденцией к слиянию с формированием единичных гигантских многоядерных клеток Лангерганса типичного строения с примесью единичных нейтрофильных гранулоцитов. В других полях зрения отмечали утолщение межальвеолярных перегородок за счет фиброза, дистелектазы, очаговый антракоз, умеренный интерстициальный и альвеолярный отек, паретическое полнокровие сосудов, очаговые диапедезные кровоизлияния. Бронхи малого и среднего размера характеризовались лимфоцитарной инфильтрацией, склерозом, гипертрофией мышечного слоя, очаговой атрофией мерцательного эпителия (рис. 1, 2). Рис. 2. Стенка каверны у пациента с фиброзно-кавернозным туберкулезом. Окраска гематоксилином и эозином, ×100. Рис. 1. Типичная картина туберкулезного воспаления. Окраска гематоксилином и эозином, ×100.
При окраске карболовым фуксином по Цилю—Нильсену в патологических очагах обнаруживали единичные скопления внеклеточно расположенных кислотоустойчивых бактерий в среднем менее чем в 10 полях зрения общим числом не более 1000 (рис. 3, 4). Рис. 3. Типичные кислотоустойчивые внеклеточно расположенные палочки. Окраска по Цилю—Нильсену, ×400. Рис. 4. Очаговая тенденция к формированию одиночных скоплений палочек. Окраска по Цилю—Нильсену, ×1000. Подавляющее большинство (85—95%, в среднем 88,13±2,14%) возбудителей имело палочковидную форму, также встречались кокковидные формы (5—13%, в среднем 9,33±1,17%), на прочие морфологические формы вместе взятые приходилось менее 3% наблюдаемых микобактерий .
При окраске аурамин-родамином и последующем исследовании в люминесцентном микроскопе обнаруживали очаговые скопления внеклеточно расположенных микобактерий в 10—50 полях зрения общим числом от 1000 до 10 000, преимущественно палочковидных (50—85%, в среднем 64,38±4,24%), а также кокковидных (10—45%, в среднем 27,29±3,84%), гранул (2—10%, в среднем 6±1,09%), булавовидных (1—5%, в среднем 1,96±0,6%) и ветвящихся (до 1%) форм микобактерий (рис. 5, 6). Рис. 6. Палочковидные и атипичные формы микобактерий. Окраска аурамин-родамином. Люминесцентная микроскопия, ×1000. Рис. 5. Внеклеточно расположенные одиночные микобактерии и их скопления. Окраска аурамин-родамином. Люминесцентная микроскопия, ×400.
При ИГХ-исследовании (рис. 7, 8) Рис. 7. Множественные внеклеточные скопления микобактерий. ИГХ-исследование, ×400. Рис. 8. Атипичные морфологические формы микобактерий. ИГХ-исследование, ×1000. обнаруживали множественные скопления внеклеточно расположенных микобактерий более чем в 50 полях зрения общим числом более 10 000, характеризовавшихся большим разнообразием форм: на палочки приходилось 50—70% (в среднем 57,29±2,78%), на кокковидные — 20—39% (в среднем 28,71±2,31%), на гранулы — 5—13% (в среднем 9,04±1,04%), на булавовидные — 1—7% (в среднем 3,71±0,64%) и на ветвящиеся — 1—3% (в среднем 1,25±0,47%).
Обобщая полученные данные, можно сказать, что доля типичных палочек, выявленных посредством классической окраски по Цилю—Нильсену, значимо больше таковой (t=10,4; p≤0,05), выявленной при окраске аурамин-родамином, и еще более значимо (t=18,2; p≤0,05), чем при проведении ИГХ-исследования. Столь же сильно разнятся показатели для атипичных морфологических форм микобактерий, выявленных при окраске по Цилю—Нильсену в минимальном количестве и обнаруженных в большом количестве при флюоресцентном и ИГХ-исследовании.
Несмотря на типичную картину активного туберкулезного поражения с большим объемом казеозных масс, окраска по Цилю—Нильсену не выявила многочисленных кислотоустойчивых бактерий, подтвердив встречаемый в практике феномен. Принципиально важным при этом является выбор для исследования именно пациентов с фиброзно-кавернозным туберкулезом, чей анамнез предполагал длительное волнообразное течение заболевания и продолжительную терапию, корректировавшуюся в ходе лечения, с учетом ее неэффективности вследствие устойчивости микобактерий к противотуберкулезным препаратам.
Такие случаи можно считать самыми сложными для классического бактериоскопического выявления МБТ ввиду предшествовавшего длительного процесса адаптации возбудителя, что сопровождалось периодами активации и угнетения размножения, а также изменением структуры клеточной стенки с сохранением вирулентности. Именно особенности жизненного цикла могут объяснить присутствие в большом количестве атипичных форм микобактерий, наиболее убедительно выявленных при ИГХ-исследовании.
Важно отметить отсутствие во всех наблюдениях (как при окраске по Цилю—Нильсену, так и при флюоресцентном исследовании) внутриклеточной локализации возбудителя. Микобактерии отсутствовали как в эпителиоидных клетках, макрофагах и в гигантских клетках Лангерганса, так и в нейтрофильных гранулоцитах. Наиболее информативным следует считать ИГХ-исследование, так как, если следовать теории, что явление дормантности возбудителя сопровождается полной или частичной потерей им клеточной стенки для последующей внутриклеточной персистенции, то отсутствие окрашивания внутриклеточно расположенных микобактерий карболовым фуксином по Цилю—Нильсену можно объяснить именно структурными изменениями клеточной стенки. Однако ИГХ-исследование не зависит от состояния и компонентов клеточной стенки, следовательно, обеспечивает выявление микобактерий, находящихся на любом этапе жизненного цикла, в том числе с изменением своих тинкториальных свойств.
В ходе ИГХ-исследования, как и в случае с окраской по Цилю—Нильсену и аурамин-родамином, не выявлено достоверных признаков присутствия возбудителя внутри фагоцитов, что идет вразрез с традиционными взглядами на локализацию микобактерий в туберкулезном очаге, сформированными на основе экспериментальных моделей заболевания у грызунов [24, 25]. В ряде наблюдений зафиксирована адгезия единичных микобактерий на поверхности макрофагов и нейтрофильных гранулоцитов. Не исключено, что подобное расположение способно симулировать внутриклеточную локализацию.
Необходимо отметить, что в обследованной группе у пациентов имелась определенная гетерогенность, связанная с возрастом, варьировавшим в пределах от 31 года до 84 лет, и длительностью заболевания (от 2 до 33 лет), однако морфологическая картина туберкулеза и характеристика микобактерий практически идентичны у всех пациентов вне зависимости от возраста и давности заболевания.
Принципиальным моментом также явилось расположение в ряде случаев скоплений МБТ по периферии очагов казеозного некроза на границе с прилегающим к зоне некроза валом эпителиоидных клеток и фиброзной стенкой каверны. Данная локализация микобактерий может натолкнуть на мысль о формировании ими биопленок, что может быть одним из объяснений возникновения лекарственной устойчивости, хотя этот вопрос и требует специального изучения.
Выводы
1. Проведенное исследование подтвердило, что микобактерии туберкулеза могут выявляться в тканях с помощью различных методов и иметь разную морфологию, при этом наличие даже небольшого числа кислотоустойчивых бактерий при окраске по Цилю—Нильсену является важным диагностическим признаком, но их отсутствие не свидетельствует об отсутствии туберкулеза.
2. При использовании всех бактериоскопических методов на светооптическом уровне на нашем материале внутриклеточных форм возбудителя не обнаружено.
3. Наибольшая доля атипичных морфологических форм микобактерий обнаруживается при флюоресцентном (35,62%) и ИГХ- исследованиях (42,71%), что демонстрирует их более высокую чувствительность, в то время как при окраске по Цилю—Нильсену атипичные микобактерии выявляются в сравнительно небольшом количестве (11,87%).
4. Микробиологическая сущность и клиническое значение морфологического полиморфизма микобактерий требуют дальнейшего изучения. Более того, можно утверждать, что в уточнении нуждается и патогенез туберкулеза.
Концепция и дизайн исследования — В.А.Ц., М.М.А.
Сбор и обработка материала — А.Н.О., М.М.А.
Статистическая обработка — М.М.А.
Написание текста — В.А.Ц., М.М.А.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Читайте также:

