Операция на глазе при токсоплазмозе
Обновлено: 19.04.2024
Лечение токсоплазмоза глаз. Профилактика
В остром периоде первичного заболевания и в период рецидива лечение направлено прежде всего на уничтожение паразитов, находящихся в крови и внутриклеточно; одновременно проводят противовоспалительную терапию. Если рецидив не сопровождается повышением исходного уровня антител, то можно предположить, что обострение воспалительного Процесса возникает или вследствие активации инфекции в условиях снижения иммунитета, или в результате вторичных дистрофических изменений в тканях глаза. В этих условиях вопрос о применении противопаразитарной терапии решают индивидуально. Противоинфекционные препараты показаны при появлении новых очагов или активации старого очага. Наоборот, при наличии только вторичных дистрофических изменений или развитии осложнений (отслойка сетчатки, катаракта, вторичная глаукома, кератопатия) показана патогенетическая и симптоматическая терапия. Оба вида терапии применяют при активации инфекции и наличии вторичных дистрофических изменений.
При лечении острого токсоплазмоза синергидное специфическое антипаразитарное действие оказала комбинация пириметамина и сульфаниламидного препарата [О'Conner П. R.]. В Институте глазных болезней им. Гельмгольиа применяют следующую схему лечения [Кацнельсон Л. А.]. Хлоридин (син.: тиндурин, Darkelar, Malocide, Pyrimethamine и др.) назначают тремя циклами по 7 дней с перерывами в 5—10 дней или непрерывным курсом в течение месяца в дозе 0,025 г 3 раза в день вместе с сульфаниламидными препаратами по 0,5 г 4 раза в день. Можно также применять 10% раствор этазола внутривенно или электрофорез 1 % раствора норсульфазола.
Аминохинол (Aminochinolum) также назначают в сочетании с сульфаниламидными препаратами, проводят 2—3 цикла лечения по 5 дней с перерывами в 5—7 дней, доза препарата 0,1—0,15 г 2—3 раза в день после еды.
Специфическую терапию при острых экссудативных и рецидивирующих формах нередко сочетают с местным применением кортикостероидов. Наиболее эффективно ретробульбарное введение дексаметазона. В период проведения кортикостероидной терапии дополнительно назначают антибиотики. Следует обратить внимание, что, по мнению G. R. O'Conner, при субтеноновом введении кортикостероидов отмечается немедленное улучшение клинического состояния, но через несколько недель или месяцев происходит значительное ухудшение.
Экспериментальные исследования, проведенные К. F. Tabbara и соавт., показали высокую, по мнению авторов, специфическую активность антибиотика клиндамицина при остром глазном хориоретините. В процессе последующих клинических наблюдений с применением клиндамицина получены противоречивые результаты [Lakhanpal V. et al.]. Так, G. E. Murphy, наблюдавший рецидив после лечения токсоплазмозного ретинохориоидита клиндамицином и подчеркивавший токсичность антибиотика, обращает внимание на необходимость более контролируемых клинических испытаний для определения места клиндамицина в лечении глазного токсоплазмоза. Наоборот, Н. Gildslein, применив клиндамицин в сочетании с сульфаниламидными препаратами при лечении 8 больных активным токсоплазмозным ретинохориоидитом, уже в первые 2 нед добился клинического улучшения с повышением остроты зрения.
Побочное действие было отмечено у 2 больных. Больным, у которых поражение захватывало зрительный нерв или желтое пятно, дополнительно назначали преднизолон внутрь.
Неспецифическая гипосенсибилизация, а также общая и местная противовоспалительная терапия занимают важное место в лечении различных форм глазного токсоплазмоза. При хронических рецидивирующих процессах и положительной очаговой реакции на ВКП проводят специфическую десенсибилизацию [Шпак Н. И.]. M. Bonnet и соавт. для профилактики рецидивов токсоплазмозных хориоретинитов использовали иммунотерапевтическое воздействие БЦЖ.
Успехи иммунофармакологии открывают новые возможности повышения неспецифической резистентности, например с помощью левамизола [Майчук Ю. Ф., Микули С. Г.]. Можно предположить, что иммунокорреляция активными пептидами вилочковой железы займет важное место в лечении рецидивирующего глазного токсоплазмоза. Один из препаратов этой группы — Т-активин зарекомендовал себя как мощный регулятор антигенспецифической чувствительности Т-лимфоцитов при рецидивирующем офтальмогерпесе [Майчук Ю. Ф. и др.].
При составлении плана комплексной терапии следует учитывать, что в основе патогенеза глазного токсоплазмоза лежат инфекционно-токсический и инфекцион-но-аллергический процессы, при которых наряду с инфильтрацией ткани сетчатки и сосудистой оболочки происходят нарушение микроциркуляции, артериовенозная окклюзия, высвобождение фармакологически активных веществ, оказывающих повреждающее действие на ткани глаза с последующим рубцеванием, пролиферацией, новообразованием сосудов, дистрофией сетчатки. Направленность терапии необходимо определять в соответствии с ведущим фактором патогенеза.
В последние годы в лечении токсоплазмозных хориоретинитов определенное значение приобретают крио-, фото- и лазеркоагуляция. К. N. Chartey и R. J. Brockhurst применили фотокоагуляцию у 5 больных, безуспешно леченных химиотерапевтическими средствами, и дали положительную оценку этому методу. А. Ф. Калибердина и Л. Е. Теплинская использовали лазеркоагуляцию для лечения 6 больных в сочетании со специфической химиотерапией и отметили положительный результат, но подчеркивают необходимость проведения предварительной ангиографии, позволяющей точно определить границы очага, точки фильтрации и новообразованные сосуды.
В профилактике токсоплазмоза важное значение имеет тщательный контроль за осуществлением мер по ве-терииарно-санитарному надзору за животными и мясными продуктами, а также санитарно-просветительпая работа среди населения в местах природно-очаговой распространенности заболевания. С целью профилактики врожденного токсоплазмоза необходимо выявлять больных токсоплазмозом женщин и своевременно проводить их лечение. Как показали С. В. Wilson и соавт., раннее выявление и лечение врожденного токсоплазмоза глаз позволяет предупредить тяжелые последствия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Общие сведения

Причины токсоплазмозного увеита
Возбудителем токсоплазмозного увеита является Toxoplasma gondii, которая относится к типу простейших, классу споровиков. Жизненный цикл состоит из двух фаз развития – половой и бесполой. Процесс размножения токсоплазм происходит только в эпителиоцитах кишечника кошачьих. Фаза бесполого развития реализуется в клетках большинства органов и тканей человека, включая глазное яблоко. Данный этап жизненного цикла характеризуется склонностью к инвазии, что обуславливает не только функциональные, но и органические изменения органа зрения при токсоплазмозном увеите.
Врожденная форма заболевания наблюдается при вертикальном (трансплацентарном) пути передачи возбудителя от матери к ребенку. Причина приобретённого токсоплазмозного увеита – инфицирование от плотоядных, сельскохозяйственных животных или птиц. Чаще переносчиками выступают кошки, голуби. Возбудители проникают в системный кровоток через небольшие повреждения кожи или интактную слизистую оболочку. Менее распространённым путём заражения является алиментарный, который реализуется при употреблении мяса больных животных, а также овощей и фруктов, не прошедших полноценную обработку. Развитие токсоплазмозного увеита может быть связано с переливанием крови или трансплантацией инфицированных органов.
Проникновение возбудителей в лимфатические узлы приводит к регионарному лимфадениту. Очаги инфекции формируются при диссеминации токсоплазмы в кровеносном русле. Возникновение токсоплазмозного увеита возможно только при проникновении инфекционного агента через гематоофтальмический барьер. Реже зрительная дисфункция наблюдается при нарушении проницаемости гематоэнцефалического барьера и поражении зрительной коры головного мозга.
Симптомы токсоплазмозного увеита
С клинической точки зрения специалисты в сфере офтальмологии различают врожденную и приобретённую формы заболевания. В большинстве случаев в патологический процесс вовлечена сосудистая оболочка, поэтому токсоплазмозный увеит проявляется симптоматикой хориоретинита. Реже развивается генерализованный увеит. При этом интактными остаются передние отделы глазного яблока. Орган зрения чаще поражается в хроническом периоде болезни. Приобретенная форма заболевания при отсутствии нарушений со стороны иммунной системы протекает латентно. При хроническом течении возбудитель может длительное время находиться в стадии персистенции и провоцировать периодическое развитие рецидивов.
Клинические проявления врожденной формы токсоплазмозного увеита зависят от того, в каком триместре беременности произошло инфицирование. Заражение в I триместре несовместимо с жизнью, при инфицировании во II и III триместрах отмечается подострое или хроническое течение токсоплазмозной инфекции. Очень редко токсоплазмозный увеит протекает латентно и является только причиной развития вторичного страбизма. Данный вариант патологии часто сочетается с олигофренией, гидроцефалией, микрофтальмом, злокачественным течением миопии.
При генерализованном увеите поражение передних отделов глазного яблока протекает в форме токсико-аллергической реакции, спровоцированной специфическим воспалением увеальной сосудистой оболочки глаза. Наиболее распространёнными сопутствующими патологиями, наблюдающимися при токсоплазмозном увеите, являются миопия, катаракта и колобома хориоидеи, птоз век. Об осложненном течении заболевания свидетельствует хориоидальная неоваскуляризация.
Диагностика токсоплазмозного увеита
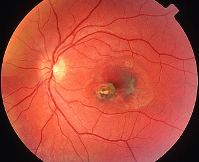
Диагностика токсоплазмозного увеита основывается на проведении офтальмологом наружного осмотра, офтальмоскопии, биомикроскопии, визометрии, биопсии, гониоскопии, цитологического исследования, иммуноферментного анализа (ИФА). При наружном осмотре пациентов с врожденным токсоплазмозным увеитом выявляется гиперемия бульбарной конъюнктивы, птоз века, нистагм. Офтальмоскопически визуализируется поражение центральных отделов глазного дна. Очаг воспаления или хориоретинальная гранулема с бело-желтым или коричневым оттенком чаще всего имеют диаметр около ⅓ от диаметра диска зрительного нерва. Реже образуются крупные очаги, диаметр которых больше диаметра ДЗН.
Длительное течение токсоплазмозного увеита приводит к дегенерации зоны поражения с последующим развитием коагуляционного некроза. При проведении офтальмоскопии определяется округлый очаг белого цвета с четко очерченными фестончатыми краями. По периферии очага атрофии наблюдается скопление пигмента, интра- и субретинальное кровоизлияние. Для генерализованной формы токсоплазмозного увеита с вовлечением переднего отдела глазного яблока характерно появление преципитатов на роговой оболочке. При гониоскопии в передней камере выявляется клеточная взвесь.
При проведении биомикроскопии со щелевой лампой при остром течении токсоплазмозного увеита определяются участки кровоизлияния, скопления экссудата, помутнение стекловидного тела. Эндозоиты можно обнаружить в экссудате или внутри клеток структур увеального тракта в процессе цитологического исследования биоптата. В цистах располагаются цистозоиты. Подтвердить наличие токсоплазм можно при биопсии неповрежденных тканей по периферии зоны специфического воспаления или некроза. Биомикроскопия при приобретённом токсоплазмозном увеите позволяет выявить большое количество преципитатов в задних отделах глазного яблока, множественные задние синехии в сочетании с помутнением стекловидного тела. При проведении ИФА в острой фазе заболевания повышается титр антитоксических антител класса IgM. Изолированное выявление IgG указывает на хроническое течение токсоплазмозного увеита или фазу реактивации.
Лечение токсоплазмозного увеита
Тактика лечения токсоплазмозного увеита определяется формой и особенностями течения заболевания. Используются иммуномодуляторы, общеукрепляющие средства. Специфическая терапия показана только пациентам с риском снижения остроты зрения. Препаратами выбора являются лекарственные средства из группы синтетических антибактериальных препаратов в комплексе с сульфаниламидами. Курс лечения длится от 2 до 4 недель. В течение всего курса показано применение фолиевой кислоты и проведение общего анализа крови в динамике. Это обусловлено тем, что препараты указанных групп могут приводить к снижению уровня лейкоцитов и тромбоцитов. При изолированном развитии токсоплазмозного увеита рекомендовано парабульбарное введение глюкокортикоидов. В случае развития системных проявлений токсоплазмоза показана пульс-терапия глюкокортикоидами.
При необходимости хирургического вмешательства антитоксоплазмозную терапию необходимо проводить в пред- и послеоперационном периоде. Лазерная коагуляция выполняется с целью отграничения зоны воспаления, но не используется для удаления токсоплазмозных очагов, что связано с их глубоким расположением и высоким риском развития послеоперационных осложнений. При выявлении атрофического очага большого размера у пациента с врожденной формой токсоплазмозного увеита специфическое лечение рекомендовано только при возникновении рецидива заболевания.
Прогноз и профилактика токсоплазмозного увеита
Специфические превентивные меры не разработаны. Неспецифическая профилактика токсоплазмозного увеита направлена на укрепление иммунитета. При необходимости назначаются иммуномодуляторы. Также пациентам необходимо нормализовать режим сна и отдыха, избегать возникновения стрессовых ситуаций. Риск инфицирования снижается при соблюдении правил личной гигиены, уходе за домашними животными, правильной термической обработке продуктов питания.
Прогноз зависит от степени тяжести заболевания. При легких формах специальная терапия не требуется, поскольку для токсоплазмозного увеита характерно благоприятное течение. При увеите средней степени тяжести применение иммуномодуляторов и стимуляция защитных сил организма способствуют достижению длительной ремиссии. Инфицирование женщины в І триместре беременности ассоциировано с неблагоприятным прогнозом для плода.
Врожденный токсоплазмоз – это паразитарная патология, которая возникает при трансплацентарном инфицировании ребенка Toxoplasma gondii. У большинства детей протекает бессимптомно. Возможные проявления заболевания: интоксикационный синдром, пятнисто-папулезная сыпь, лимфаденопатия, желтуха, гепатоспленомегалия, отеки нижних конечностей. Часто провоцирует развитие патологий органа зрения, слуха, ЦНС; реже – миокарда, легких и печени. Антенатальная диагностика базируется на проведении биопсии, постнатальная – на совокупности анамнестических и клинико-лабораторных данных (ИФА, ПЦР). Этиотропное лечение врожденного токсоплазмоза проводится при помощи схем на основе препаратов пириметамина и сульфадимезина или спирамицина.
МКБ-10
Общие сведения
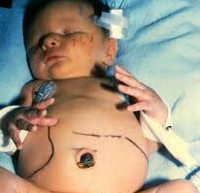
Врожденный токсоплазмоз – заболевание в педиатрии и неонатологии, возникающее в результате трансплацентарного заражения плода на фоне острой формы токсоплазменной инфекции у матери. Впервые Toxoplasma gondii была описана французами К. Николь и Л. Монсо в 1908 году. В 1939 г. американцы Э. Вольф, Д. Кауэн и Б. Пэйдж подтвердили трансплацентарный механизм передачи возбудителя. Промежуточными хозяевами могут выступать более 400 видов животных. Согласно статистическим данным ВОЗ, число инфицированных токсоплазмой людей в мире составляет порядка 1,5 млрд. человек, в России – около 30% всего населения. Частота врожденной формы 1,5:1000 новорожденных. Даже на фоне лечения средний показатель смертности у детей до 5 лет составляет 12%, осложнения возникают почти у 90%.

Причины врожденного токсоплазмоза
Врожденный токсоплазмоз развивается только при инфицировании матери Toxoplasma gondii во время вынашивания ребенка. Механизм заражения беременной женщины – фекально-оральный. Наиболее распространенные причины: контакт с животными из семейства кошачьих и употребление термически необработанной пищи. Инвазивная форма возбудителя – ооциста – формируется в кишечнике животных и выделяется с калом, после чего может на протяжении 12 и больше месяцев сохранять контагиозность в условиях внешней среды. В крайне редких случаях этиологическим фактором может стать трансплантация контаминированных органов или переливание крови. Заражение плода T. gondii происходит трансплацентарным путем. После рождения ребенка развивается интенсивный гемолиз, возникают геморрагии на слизистых оболочках, расширение камер сердца, пневмония или интерстициальный отек легких, некроз печени и селезенки, увеличение лимфоузлов, воспаление и отек тканей головного мозга, некробиоз сетчатки. При гистологическом исследовании непосредственно пораженных тканей определяется некроз, гранулематозная или диффузная пролиферация ретикулоцитов, инфильтрация плазмоцитами и лимфоцитами, перифокально – множество токсоплазм. Впоследствии на месте некротизированных участков формируется фиброз, переходящий в кальциноз.
Классификация врожденного токсоплазмоза
В зависимости от периода инфицирования плода врожденный токсоплазмоз может протекать в трех формах:
- Хроническая форма. Заражение происходит в I-II триместрах беременности. Риск передачи возбудителя – 13-18%. При такой форме могут развиваться атрофия головного мозга, гидроцефалия, деформация желудочков мозга, анофтальмия, колобома, атрофия сетчатки, врожденные пороки сердца и других органов и систем.
- Подострая форма. Инфицирование – III триместр. Риск заражения ребенка – 75-85%. Проявления могут включать в себя энцефалит, менингоэнцефалит, очаговый некроз сетчатки, увеит.
- Острая форма. Токсоплазма попадает в организм ребенка непосредственно перед родами. Возможные симптомы: гипертермия, пятнисто-папулезная сыпь, интенсивная желтуха, гепатоспленомегалия, анемия, миокардит, пневмония.
Симптомы врожденного токсоплазмоза
Врожденный токсоплазмоз может проявляться в различные периоды жизни ребенка – от первых дней до нескольких месяцев. Специфических симптомов данное заболевание не имеет. Зачастую присутствующая клиника нечеткая и имитирует другие врожденные патологии. Наиболее вероятные проявления врожденного токсоплазмоза: ухудшение общего состояния, пятнисто-папулезная сыпь различной локализации, генерализованная лимфаденопатия, увеличение печени и селезенки, желтуха, отеки нижних конечностей, субфебрильное повышение температуры тела. Тяжесть симптомов зависит от степени инфицирования токсоплазмами, триместра беременности, в котором произошло инфицирование, и иммунных сил матери. Примерно 70-90% детей не имеют каких-либо проявлений в ранние периоды жизни, но почти у всех спустя некоторое время возникают осложнения. Классический врожденный токсоплазмоз проявляется триадой Сэбина – обструктивная гидроцефалия, хориоретинит и массивное внутричерепное обызвествление. Наблюдается данный комплекс не более чем у 3% детей. Помимо триады, часто возникают миокардит, миозит, гепатит и пневмония. Клинические проявления напрямую зависят от присутствующих патологических изменений. Вероятность развития поздних осложнений на фоне латентного врожденного токсоплазмоза составляет порядка 90%. Период возникновения может быть разным – от нескольких месяцев до нескольких лет. Наиболее часто наблюдается поражение глаз, органа слуха и ЦНС. Самое распространенное осложнение – ретинит (примерно 85% случаев). К другим последствиям перенесенного врожденного токсоплазмоза относят олигофрению, гидроцефалию, повышение внутричерепного давления, острый и хронический энцефалит, эпилепсию, полную глухоту и/или слепоту, микрофтальм, увеит, хроническую гипертермию, редко – шизофрению.
Диагностика врожденного токсоплазмоза
Диагностика врожденного токсоплазмоза может проводиться в антенатальном и постнатальном периоде. Антенатальное исследование подразумевает использование инвазивных методов с дальнейшими лабораторными анализами. Абсолютное показание к их проведению – острый токсоплазмоз матери в сумме с нарушениями развития плода по результатам акушерского УЗИ. Выбор методики исследования зависит от срока беременности. При гестации от 10 недель проводится биопсия хориона, от 16 недель – амниоцентез, от 18 – кордоцентез. Для верификации инфекции полученный материал исследуют при помощи ПЦР. Постнатальная диагностика включает в себя сбор анамнестических данных и проведение клинического и лабораторного исследования. Данная мера является обязательной для всех детей, входящих в группу риска внутриутробного инфицирования. Неспецифическая диагностика и ее результаты зависят от присутствующих симптомов и синдромов. Список исследований может включать в себя ОАК (анемия, тромбоцитопения, лейкоцитоз); рентгенографию ОГК (признаки инфильтрации легких); нейросонографию и КТ головного мозга; биохимическое исследование крови с измерением АЛТ и АСТ, определением СРБ, уровня билирубина и его фракций (все показатели выше нормы); офтальмоскопию (некроз сетчатки); спинномозговую пункцию (признаки воспаления). Специфические методы подразумевают серодиагностику биологических жидкостей методом ИФА, при котором наблюдается возрастание титра антител IgG в 4 и больше раз и высокий уровень IgM на протяжении 10-14 суток. При необходимости проводится ПЦР с целью идентификации ДНК токсоплазмы.
Лечение врожденного токсоплазмоза
Лечение новорожденного с выраженной клинической картиной врожденного токсоплазмоза проводится только в условиях стационара, в отделении патологии новорожденных. Соблюдение специфического режима и рациона не требуется, их коррекция проводится в соответствии с состоянием ребенка. При наличии отягощенного анамнеза матери этиотропную терапию начинают с момента постановки предварительного диагноза. В других случаях перед началом лечения требуется проведения лабораторных методов исследования. Используемые схемы: пириметамин и сульфадимезин на 1-1,5 месяца; спирамицин или другие макролиды на 4-6 недель. В некоторых случаях применяют системные глюкокортикостероиды – преднизолон. Симптоматическое лечение зависит от присутствующих симптомов и синдромов, выявленных педиатром или неонатологом. При стойком повышении внутричерепного давления или развитии гидроцефалии показано хирургическое лечение. При необходимости дальнейшее лечение может проводиться амбулаторно под контролем педиатра, инфекциониста и других специалистов. В таких же условиях проводится терапия субклинической и латентной формы врожденного токсоплазмоза. Решение об отказе от приема препаратов принимается на основе клинико-лабораторных показателей, находящихся в пределах возрастной нормы, и заключения всех лечащих врачей.
Прогноз и профилактика врожденного токсоплазмоза
Прогноз при врожденном токсоплазмозе зависит от триместра, в котором произошло инфицирование плода и тяжести клинических проявлений. При развитии патологии в I триместре может наблюдаться самопроизвольное прерывание беременности и выкидыш или дальнейшее развитие тяжелых форм заболевания, однако аномалии органов при этом не возникают. При адекватной и своевременной терапии прогноз для жизни благоприятный, для выздоровления – сомнительный. Неспецифическая профилактика врожденного токсоплазмоза включает в себя ограничение контакта домашних животных с беременной женщиной, соблюдение гигиенических норм, прием в пищу только термически обработанных продуктов, тщательное мытье овощей и фруктов. При наличии факторов, указывающих на возможное инфицирование матери, проводится специфическая диагностика, направленная на идентификацию T. gondii. При подтверждении диагноза показано немедленное проведение этиотропной терапии. Специфической профилактики врожденного токсоплазмоза не разработано.
Врожденный и приобретенный токсоплазмоз глаз. Клиника
Данные литературы о частоте врожденного и приобретенного токсоплазмоза крайне противоречивы. Большинство исследователей считают, что повреждение глаз чаще наблюдается при врожденном токсоплазмозе [Кацнельсон Л. А.]. Известный специалист в области токсоплазмоза G. R. O'Connor указывает, что большинство случаев глазного токсоплазмоза, с точки зрения времени возникновения, относится к врожденным, а трансплацентарное инфицирование плода является единственным путем передачи инфекции. При обследовании детей с врожденными заболеваниями глаз токсоплазмозная этиология установлена у 38,4% [Шпак Н. И.].
Если острый токсоплазмоз плода развивается до 7-го месяца беременности, то глазные поражения носят особенно тяжелый характер. Помимо двустороннего хориоретинита, обнаруживали и другие последствия инфекции: микро- и анизоорбиту, анофтальм, микрофтальм, гидрофтальм, помутнение роговицы, катаракту, ирит, задний увеит, атрофию зрительного нерва, нистагм, косоглазие, слепоту.
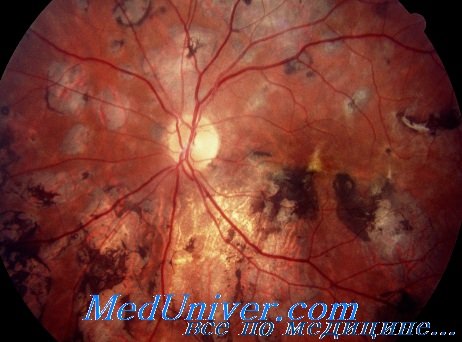
Для врожденного токсоплазмоза наиболее характерны грубые хориоретинальные очаги, чаще располагающиеся в макулярной или парамакулярной зоне. Обычно очаг неправильной формы с четкими границами и отложением пигмента по краю. Неизмененные сосуды сетчатки проходят над очагом. Величина атрофического очага может достигать нескольких диаметров диска. Поскольку такой очаг предстанляет собой конечную фазу перенесенного внутриутробного токсоплазмоза, в литературе его нередко описывают как псевдоколобому [Кацнельсон Л. А.].
При центральной локализации очага отмечается потеря зрения. В некоторых случаях преобладают хориоретинальные рубцы по периферии сетчатки [Корре J. G., Kloosterman G. J.]. Авторы наблюдали детей с врожденным токсоплазмозом, у которых рубцевание хориоретинальных очагов произошло в возрасте 16 лет. Рецидивы отмечались как у леченых, так и у нелеченых детей.
С. В. Wilson и соавт., наблюдавшие за 24 детьми с врожденным токсоплазмозом от рождения до 8 лет, подчеркивают, что в большинстве случаев врожденная токсоилазмозная инфекция бессимптомна и не распознается при рождении. Тяжелые хориоретиниты и в отдельных случаях слепота возникали уже после рождения.
Врожденный токсоплазмоз глаза может сопровождаться гидро- и микроцефалией, расстройствами психики, образованием интракраниальных кальцификатов.
Рецидивы при врожденном токсоплазмозе возникают у 13—30% больных [Гонова Л. П., Шпак Н. И., Калибердина А. Ф., Тенлинская Л. Е.], протекают в виде хориоретинитов с появлением свежих фокусов рядом со старыми атрофическими очагами.
Приобретенный токсоплазмоз глаз
Заболевание характеризуется большим многообразием клинических проявлений. При этом глазные поражения могут быть единственными симптомами или сочетаться с другими клиническими проявлениями токсоплазмозной хронической инфекции.
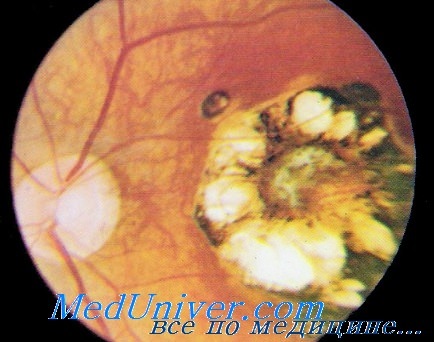
К нечасто встречающимся токсоплазмозным поражениям глаз относят конъюнктивиты, эписклериты, стромальные кератиты с поздней васкуляризацией роговицы, кератосклероувеиты, ириты, пластические иридоциклиты, увеиты, ретинальные кровоизлияния, экссудативные и пролиферативные хориоретиниты.
Наиболее характерны для токсоплазмоза поражения в виде центрального хориоретинита и нейрохориоретинита [Пастухова Л. П., Шпак Н. И., Калибердина А. Ф., Тенлинская Л. Е., Кацнельсон Л. А.]. В центральной зоне глазного дна обнаруживают очаговый хориоретинит в виде свежего рыхлого очага округлой формы с перифокальными отеками, иногда геморрагиями и помутнением в задних слоях стекловидного тела; в других случаях развиваются диффузный хориоретинит, нейрохориоретинит, юкстапапиллярный хориоретинит.
Анализируя 60 случаев глазного токсоплазмоза, Т. F. Schlaegel и J. С. Weber в 12% отметили активные ретинальные очаги вблизи желтого пятна (5° от ямки) и в 12% — легкий отек в области желтого пятна. В 62% случаев макулярная область не была поражена.
Обратное развитие хориоретинальных поражений протекает очень медленно и заканчивается грубым рубцеванием через 6—12 мес. При рецидивах вблизи старых атрофических пигментированных очагов появляются свежие фокусы, характеризующиеся усилением помутнения стекловидного тела, отеком, экссудатом и геморрагиями на глазном дне.
К более редко встречающимся клиническим формам поражения глазного дна следует отнести диссеминированный хориоретинит, экссудативную отслойку сетчатки, пигментный эпителиит, генерализованный увеит.
F. Kayazawa наблюдал субретииальную неоваскуляризацию у одного больного токсоплазмозом, a I. Skorska и соавт. обнаружили ее у 7 из 36 больных токсоплазмозным хориоретинитом. Идентификация новых субретинальных сосудов легко выявлялась в ранней фазе ангиографии. Кровоизлияние из этих сосудов может привести к внезапному ухудшению зрения без видимого нарастания воспалительной реакции.
J. С. Folk и L. A. Lobes наблюдали 6 больных, у которых единственными проявлениями токсоплазмоза были выраженный папиллит и воспалительная реакция в заднем отделе стекловидного тела без видимых изменений сетчатки.
К поздним осрожнениям хориоретинального токсоплазмоза, приводящим к внезапной потере зрения, относят образование неоваскулярной мембраны в хориоидее с последующей макулярной отслойкой [Fine S. L. et al.]. Ни у одного из 3 больных, у которых образовалась такая мембрана, не отмечены свежие воспалительные явления.
L. Т. Reese и соавт. описали случай острого некротизирующего ретинита с последующим эндофтальмитом. После смерти больного, наступившей вследствие поражения центральной нервной системы, при гистологическом исследовании токсоплазмы обнаружены в головном мозге.
Редким осложнением токсоплазмоза является также ретинальная неоваскуляризация, приводящая к геморрагиям. Три таких случая наблюдали М. W. Graynon и coавт.. Отсутствие активности хориоретинальных очагов связывали с окклюзией ретинальных артериол и венул, проходящих через очаги, ретинальной неоваскуляризацией и ретинальными геморрагиями. Фотокоагуляния привела к прекращению геморрагии и исчезновению неоваскуляризации.
Редкую форму позднего токсоплазмозного хориоретинита наблюдали Л. Leblanc и соавт.. Токсоплазмозная инфекция была выявлена с помощью серологических тестов у женщины на 5-м месяце беременности и подтверждена выделением паразита из плаценты. Однако клинические проявления хориоретинита возникли только спустя 6 лет.
В последнее время предпринимаются попытки проанализировать взаимосвязь токсоплазмозной инфекции и синдрома приобретенного иммунодефицита (СПИД), вызываемого вирусом HTLV3 [Velimirovic В., Diallo J. S.]. Осуществить это пока трудно, так как хориоретинальные поражения при токсоплазмозе и СПИД имеют много общего [Freeman W. R. et al., 1984].
Пример нераспознанной при жизни токсоплазмозной инфекции приводят J. H. Yeo и соавт.. У больной, которой проводили общую химиотерапию по поводу диссеминированной узелковой лимфомы, появился большой очаг в макулярной области, расцененный как лимфоматозный инфильтрат. Больная умерла вследствие развития тяжелого иммуподефицитного состояния. При гистологическом исследовании в сетчатке пораженного глаза и головном мозге были обнаружены токсоплазмы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

