Описторхоз аскаридоз фасциолез что это
Обновлено: 18.04.2024
Категории МКБ: Амебиаз (A06), Анкилостомоз (B76.0), Аскаридоз (B77), Дикроцелиоз (B66.2), Дифиллоботриоз (B70.0), Другие инвазии, вызванные цестодами (B71), Инвазия, вызванная taenia saginata (B68.1), Инвазия, вызванная taenia solium (B68.0), Некатороз (B76.1), Описторхоз (B66.0), Стронгилоидоз неуточненный (B78.9), Токсоплазмоз (B58), Трихинеллез (B75), Трихуроз (B79), Фасциолез (B66.3), Цистицеркоз (B69), Энтеробиоз (B80)
Общая информация
Краткое описание
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ КЫРГЫЗСКОЙ РЕСПУБЛИКИ
ДЕПАРТАМЕНТ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ И ГОСУДАРСТВЕННОГО САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОГО НАДЗОРА
КЫРГЫЗСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ ПЕРЕПОДГОТОВКИ И ПОВЫШЕНИЯ КВАЛИФИКАЦИИ
КЫРГЫЗСКО-РОССИЙСКИЙ СЛАВЯНСКИЙ УНИВЕРСИТЕТ им. Б.Н.ЕЛЬЦИНА
ДИАГНОСТИКА, ЛЕЧЕНИЕ И ПРОФИЛАКТИКА ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ
Клинические протоколы
Клинические протоколы (КП) по диагностике, профилактике и лечению паразитарных заболеваний приняты Экспертным советом по оценке качества клинических руководств/протоколов от 15.12.2017 г. и утверждены приказом Министерства здравоохранения Кыргызской Республики (МЗ КР) № 42 от 18 января 2017 г.
Клиническая проблема
Кишечные гельминтозы, протозоозы и тканевые паразитозы
Название документа
Диагностика, профилактика и лечение паразитарных заболеваний
Этапы оказания помощи
1-3 уровни медицинской помощи
Клинические протоколы применимы
к пациентам с кишечными гельминтозами, протозоозами и тканевыми паразитозами.
Целевые группы
Врачи-инфекционисты, семейные врачи, педиатры, аллергологи, окулисты, пульмонологи, эпидемиологи, паразитологи, лабораторные специалисты, организаторы здравоохранения, специалисты Фонда обязательного медицинского страхования (ФОМС), ординаторы, аспиранты, студенты и др.
Планируемая дата обновления
Проведение следующего пересмотра КП планируется в 2020 г., либо раньше, по мере появления новых ключевых доказательств по лабораторной, клинической диагностике и/или лечению паразитарных болезней.
В связи с тем, что новая стратегия по противорецидивной, консервативной терапии эхинококкоза и альвеококкоза находится на стадии разработки, клинические протоколы лечения данных личиночных гельминтозов исключены из данного сборника протоколов. После рассмотрения экспертным советом и утверждения МЗ КР, они будут изданы как дополнение к данному сборнику. В процессе апробации и рецензирования клинического протокола были получены комментарии и рекомендации, которые были учтены при его доработке.
Ожидаемый результат от внедрения данного клинического протокола
Внедрение в практическое здравоохранение профилактического лечения круглых червей – нематодов у всех членов семьи, включая беременных женщин с 3 триместра в эпидемиологически неблагополучных регионах (область, район, село), обеспечит оздоровление от нематодозов всей семьи и предупреждению риска постоянного перекрестного инвазирования членов семьи друг от друга, а также от других членов сообщества (в детских садах, школах, коллективах и тд). Лечение женщин во время беременности приведет к оздоровлению будущей мамы и снижению риска передачи инвазии детям грудного и раннего возраста.
Введение
Гельминтные инвазии в основном бывают двух типов: передаваемые через воду и передаваемые через почву ‒ геогельминты. Последние принадлежат к двум группам: нематодам (круглые черви) и платигельминтам (плоские черви) и живут в кишечнике человека, ежедневно выделяя тысячи яиц, которые попадают в почву с фекалиями инфицированных людей. При этом, яйца проглатываются детьми, которые берут грязные пальцы в рот после игр на земле (контакт с почвой); вместе с овощами, если овощи, не моются, не очищаются и не готовятся надлежащим образом; с водой из загрязненных источников и т. д. 1 .
После развития зрелых гельминтов в организме человека, они могут вызвать нарушение переваривания жиров, снижение абсорбции витаминов (особенно витамина А), временную непереносимость лактозы, снижение гемоглобина и железа, подавление аппетита и иммунной реакции, оказывают воздействие на рост, вес и познавательные функции инфицированных детей. Некоторые нематоды, в частности Trichuris trichiura, присасываются в слизистую оболочку кишечника и питаются кровью. Они выделяют антикоагулянты, вследствие чего повреждения кровоточат, что в итоге вызывает железодефицитную анемию.
Таким образом, паразиты могут быть опасными как для здоровья каждого человека, так и для всего сообщества в целом, в связи с чем большинство стран мира осуществляют различные программы, рекомендованные ВОЗ по профилактике и лечению паразитозов среди населения, особенно среди групп риска 1
Стратегия ВОЗ по борьбе с геогельминтами 1
ВОЗ рекомендует проводить ПЛ раз в год в случае, если распространенность гельминтозов, передаваемых через почву превышает 20% и дважды в год в случае, если этот показатель в сообществе превышает 50%.
Данная стратегия преследует глобальную цель – профилактическое лечение (ПЛ), по меньшей мере, 75% всех детей школьного возраста, подвергающихся риску заболевания геогельминтами. Направлена на профилактику и установление контроля над заболеваемостью геогельминтами путем проведения периодического ПЛ населения без предварительного индивидуального диагностического исследования всех людей из групп риска (дети дошкольного возраста, дети школьного возраста, включая подростков, а также беременные женщины со 2-го триместра) в эндемичных районах. Освобождение организма от гельминтов, путем ПЛ приводит к улучшению аппетита, что может способствовать увеличению роста и прибавки веса, также снижает заболеваемость и бремя болезни, вызванное наличием паразитов.
Важно отметить, что прием препаратов, используемых для ПЛ, детьми в возрасте до 12-месячного возраста не рекомендуется, так как безопасность и эффективность этих препаратов у детей данной возрастной группы не были подтверждены.
Профилактическое лечение однократной дозой альбендазола (400 мг) или мебендазола (500 мг) рекомендуется для беременных женщин после первого триместра, проживающих в районах, где распространенность нематодозов и/или трихоцефалеза составляет 20% или более (40% и более среди беременных женщин) и где анемия является серьезной проблемой общественного здравоохранения (условная рекомендация, среднее качество доказательств) 2 или в качестве лечения инфицированных беременных женщин в неэндемичных районах 3 .
Рекомендуемые ВОЗ лекарственные средства: альбендазол (400 мг) и мебендазол (500 мг) — эффективны, недороги и просты для распространения немедицинским персоналом (например, учителями). Они прошли экстенсивное тестирование на безопасность и использовались среди миллионов людей, при этом наблюдалось лишь незначительное количество умеренных побочных эффектов.
Фасциолез – это паразитарная инвазия, вызываемая печеночной или гигантской двуусткой и характеризующаяся преимущественным поражением гепатобилиарной системы. Течение фасциолеза сопровождается недомоганием, лихорадкой, крапивницей, тошнотой, болями в правом подреберье, увеличением размеров печени, желтухой. В диагностике фасциолеза информативны серологические методы (ИФА, РИФ, РИГА), исследование дуоденального содержимого и фекалий на яйца гельминтов, УЗИ печени и желчевыводящих путей. В комплексную терапию фасциолеза включают диету, прием антигельминтных средств (триклабендазол, празиквантел), желчегонных, антигистаминных препаратов.
МКБ-10
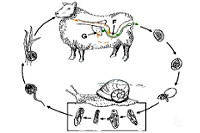
Общие сведения
Фасциолез - внекишечный гельминтоз, обусловленный паразитированием в паренхиме печени и желчных путях печеночной или гигантской фасциолы (сосальщика). Наряду с описторхозом, клонорхозом, парагонимозом, шистосомозами фасциолез относится к наиболее распространенным трематодозам человека. Фасциолез, вызываемый печеночным сосальщиком, распространен в Австралии, странах Европы и Южной Америки. Фасциолез, связанный с гигантским сосальщиком, встречается в Африке, Восточной Азии, районах Средней Азии и Закавказья. Описаны, как спорадические, так и массовые вспышки заболевания, охватывавшие сотни человек. Согласно имеющимся данным, фасциолезом поражено от 2,5 до 17 млн. населения планеты.

Причины фасциолеза
Характеристика возбудителя
Механизм передачи
Окончательными хозяевами сосальщиков служат травоядные сельскохозяйственные животные, реже – человек. Паразитируя в желчевыводящей системе, гельминты откладывают яйца, которые с испражнениями попадают в окружающую среду и свое дальнейшее развитие проходят в пресной воде. Там вышедшие из яиц личиночные стадии (мирацидии) внедряются в тело брюхоногих моллюсков, являющихся промежуточными хозяевами возбудителя фасциолеза.
Во внутренних органах моллюсков мирацидии превращаются сначала в спороцисты, а затем в хвостатые церкарии. Через 1-2 месяца церкарии снова выходят в воду, инцистируются, превращаясь в адолескарий, и прикрепляются к поверхности водных растений или водной пленке. В этой стадии личинки становятся инвазионными, т. е способными вызывать фасциолез у животных и человека.
Заражение животных фасциолезом происходит при поедании травы на выпасе, загрязненной личинками двуустки; инфицирование человека возможно при употреблении в пищу дикорастущих или огородных растений, полив которых осуществлялся водой из пресных водоемов; питье некипяченой воды; во время купания и т. д. В желудочно-кишечном тракте личинки фасциолы высвобождаются из оболочек, через стенку кишечника выходят в брюшную полость, где через капсулу внедряются в паренхиму печени и таким образом попадают в желчные протоки. Возможен гематогенный путь миграции – через кишечные и воротную вены в печеночные протоки.
Через 3-4 месяца паразитирования в организме окончательного хозяина фасциолы достигают половозрелой стадии и начинают откладывать яйца. В гепатобилиарной системе человека возбудители фасциолеза способны паразитировать 5-10 и более лет.
Патогенез
Развивающиеся в миграционную фазу инвазии токсико-аллергические реакции связаны с сенсибилизацией организма антигенами личинок, а также механическим травмированием тканей на пути их продвижения. В хронической стадии фасциолеза патологические эффекты обусловлены паразитированием гельминтов в желчных протоках. Половозрелые гельминты вызывают повреждение печеночной паренхимы с развитием микроабсцессов и фиброзных изменений печени.
Скапливаясь в желчных ходах, фасциолы могут способствовать их обструкции и нарушению оттока желчи, развитию пролиферативного (а в случае присоединения вторичной инфекции – гнойного) холангита. Общетоксическое воздействие на организм при фасциолезе обусловлено поступлением в кровь продуктов жизнедеятельности гельминтов и распада печеночной ткани. В исходе длительного течения фасциолеза может развиваться цирроз печени и портальная гипертензия.
Симптомы фасциолеза
В развитии фасциолеза выделяют инкубационный период, острую (миграционную) и хроническую (связанную с паразитированием взрослых гельминтов) стадии. В зависимости от инвазирующей дозы, инкубационный период может длиться от 1 до 8 недель.
В миграционную фазу главным образом выражены общетоксические и аллергические симптомы. Больные фасциолезом жалуются на подъемы температуры, слабость, недомогание, головную боль. Лихорадка может быть субфебрильной или высокой (до 39-40°С), носить ремитирующий или волнообразный характер. На этом фоне появляется крапивница и кожный зуд, отек Квинке, высокая (до 80-85%) эозинофилия в крови. Развиваются диспепсические расстройства: тошнота, рвота, боли в эпигастрии и правом подреберье; происходит увеличение размеров печени, сопровождающееся желтухой. В раннем периоде часто развивается аллергический миокардит, характеризующийся загрудинными болями, артериальной гипертензией, тахикардией. Через несколько недель клинические проявления острого фасциолеза значительно или полностью стихают.
Спустя 3-6 месяцев заболевание вступает в хроническую стадию, симптомы которой обусловлены непосредственным поражением печени и желчных путей. Течение хронического фасциолеза сопровождается гепатомегалией, приступообразными болями в правом боку; в периоды обострения – желтухой. Длительная инвазия приводит к развитию диспепсического синдрома, анемии, гепатита, цирроза печени.
Вторичное инфицирование чревато возникновением гнойного холецистита и холангита, абсцессов печени, стриктуры желчных путей. В литературе описаны казуистические случаи фасциолеза с нетипичной локализацией сосальщиков в головном мозге, легких, молочных железах, евстахиевых трубах, гортани, подкожных абсцессах.
Диагностика
Чаще всего фасциолез диагностируется уже в хронической стадии, когда с беспокоящими жалобами больные обращаются к терапевту или гастроэнтерологу. Предположительный диагноз основывается на совокупности эпидемиологических данных и клинических данных. В пользу фасциолеза свидетельствует наличие ранее зафиксированных случаев инвазии на данной территории, групповая заболеваемость, употребление в пищу салатных растений, питье воды из открытых источников или использование ее для мытья посуды, фруктов, овощей и пр.
- Методы выявления возбудителя. В раннем периоде фасциолеза диагноз подтверждается серологическими методами (РИФ, ИФА, РИГА, РСК). В хронической стадии информативно обнаружение яиц фасциол в фекалиях или дуоденальном содержимом. Паразиты могут быть обнаружены с помощью ультразвукового исследования печени и желчного пузыря, КТ печени.
- Биохимия крови. В биохимических пробах печени отмечается повышение активности трансаминаз и щелочной фосфатазы, гипопротеинемия, гипоальбуминемия.
Фасциолез необходимо отличать от описторхоза, клонорхоза, вирусных гепатитов, панкреатита, холангита, холецистита другой этиологии.
Лечение фасциолеза
Лечение фасциолеза проводится стационарно. В острую фазу назначается щадящая диета, десенсибилизирующие препараты; при развитии миокардита и гепатита показаны глюкокортикостероиды. К противопаразитарной терапии переходят только после стихания острых явлений. В качестве этиотропных препаратов при фасциолезе используются триклабендазол, гексахлорпараксилол, празиквантел. С целью изгнания погибших фасциол из желчных протоков назначаются желчегонные средства.
Контрольное паразитологическое обследование (анализ кала на яйца гельминтов, дуоденальное зондирование с исследованием порций желчи) проводится спустя 3 и 6 месяцев. В случае развития гнойных осложнений требуется назначение антибиотиков и проведение хирургического вмешательства (дренирования абсцесса печени, дренирования желчных протоков и др.).
Прогноз и профилактика
Ранняя диагностика фасциолеза позволяет провести своевременную терапию и добиться выздоровления. При высокоинтенсивной инвазии или вторичной бактериальной инфекции прогноз может быть серьезным, вплоть до летального исхода. Индивидуальная профилактика фасциолеза заключается в недопущении употребления сырой воды из водоемов, плохо промытой огородной зелени. Меры общественного контроля включают очистку водоемов, их защиту от фекального загрязнения, ликвидацию промежуточных хозяев фасциолеза – моллюсков, ветеринарное обследование и дегельминтизацию скота, санитарно-просветительскую работу.
Описторхоз – гельминтное заболевание, вызываемое плоскими паразитическими червями класса сосальщиков и протекающее с поражением гепатопанкреатобилиарной системы. Течение описторхоза характеризуется лихорадкой, болями в животе, нарушением аппетита, кожными высыпаниями, желтухой, гепатоспленомегалией, диспепсией, астматическим бронхитом, астеновегетативным синдромом. Диагностика описторхоза основывается на обнаружении яиц описторхисов в дуоденальном содержимом и в кале, результатах серологических реакций, данных биохимического анализа крови, инструментальных исследований (УЗИ, холецистохолангиографии, КТ). Для терапии описторхоза используются противогельминтные (празиквантел, азинокс), желчегонные и ферментные препараты.
МКБ-10
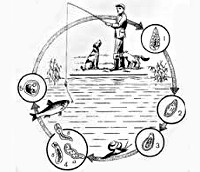
Общие сведения
Описторхоз – внекишечный гельминтоз из группы трематодозов, возбудители которого паразитируют в желчных протоках печени и поджелудочной железе, вызывая полиморфные клинические проявления. Наиболее напряженный очаг описторхоза расположен на территории Западной Сибири, в низовьях р. Иртыш и среднем течении Оби, где инвазированность местного населения приближается к 80-90%. Кроме этого, эндемичными по описторхозу районами служат бассейны рек Волга, Кама, Днепр, Дон, Енисей и др., главным образом, связанные с рыбным промыслом и рыбопереработкой. Наибольшая заболеваемость регистрируется среди лиц в возрасте от 15 до 50 лет, преимущественно мужчин. Опасность описторхоза заключается в том, что при длительном течении он повышает риск развития рака печени и рака поджелудочной железы.

Причины описторхоза
Описторхоз вызывают два вида гельминтов-сосальщиков: Opisthorchis felineus и Opisthorchis viverrini. На территории России распространен возбудитель О. felineus – сибирская или кошачья двуустка. Это плоский гельминт длиной 4–20 мм, шириной 1–4 мм, имеющий ланцетовидное тело, снабженное ротовой и брюшной присосками. Описторхоз, вызываемый O. viverrini встречается в странах Юго-Восточной Азии.
Развитие описторхисов происходит с трехкратной сменой хозяев: первым промежуточным хозяином выступают моллюски, вторым промежуточным - пресноводные рыбы семейства карповых (лещ, сазан, линь, елец, язь, плотва и др.) и окончательным - млекопитающие (кошка, собака, лисица, выдра, песец, соболь, человек), питающиеся рыбой. Окончательные хозяева выделяют яйца с личинками во внешнюю среду вместе с фекалиями. Попав в водоем, яйца заглатываются пресноводными моллюсками рода Codiella, в организме которых претерпевают изменения: сначала из яйца выходит мирацидий, который последовательно превращается в спороцисту, редию и церкария. Хвостатая личинка (церкарий) выходит из тела моллюска и в водоеме прикрепляется к телу карповых рыб, внедряется в соединительную и мышечную ткань, где инцистируется, превращаясь в метацеркарий. Находясь в теле рыб, через 6 недель личинки становятся инвазионными, т. е. приобретают способность вызывать описторхоз у окончательных хозяев.
Заражение человека и животных происходит при употреблении инвазированной, плохо обработанной (сырой, малосольной) рыбы. В ЖКТ окончательного хозяина под действием дуоденального сока капсула и оболочки личинок растворяются, в результате чего метацеркарии мигрируют в общий желчный проток, внутрипеченочные желчные протоки, а также в протоки поджелудочной железы. В гепатопанкреатобилиарной системе через 3–4 недели метацеркарий превращается в зрелого описторхиса, способного продуцировать яйца. Полный цикл развития гельминта от стадии яйца до половозрелой особи длится 4–4,5 месяца. Инвазированность человека описторхисами может варьировать от нескольких единиц до десятков тысяч. В организме окончательного хозяина кошачья двуустка может паразитировать 20-25 лет.
Патогенез описторхоза
Характер и выраженность патологических процессов, характеризующих течение описторхоза, зависят от массивности и длительности инвазии, состояния иммунной системы. В зависимости от этих факторов течение описторхоза может быть стертым или манифестным; легким, среднетяжелым и тяжелым. В патогенезе описторхоза выделяют раннюю (острую) и позднюю (хроническую) стадии.
В острой стадии гельминтоза доминируют токсико-аллергические реакции, развивающиеся в ответ на действие метаболитов паразитов на организм хозяина. Они сопровождаются повышением проницаемости сосудистой стенки, периваскулярным отеком и эозинофильной инфильтрацией стромы различных органов, образованием некротических очагов в паренхиме печени. Повреждение сосальщиками эпителия желчных протоков вызывает гиперплазию бокаловидных клеток, кистозное расширение мелких желчных ходов. При хроническом описторхозе в стенках желчных протоков развивается вялотекущее воспаление, выявляется разрастание соединительной ткани, нередко возникает закупорка гельминтами мелких желчных протоков. Данные процессы приводят к развитию вторичного бактериального холангита, дискинезии желчевыводящих путей, образованию желчных камней, в тяжелых случаях – к циррозу печени и портальной гипертензии. Поражения поджелудочной железы при описторхозе определяются, главным образом, отеком железы и нарушением оттока панкреатического секрета, что сопровождается кистевидным расширением канальцев, пролиферативным каналикулитом и фиброзом органа.
Симптомы описторхоза
Острая фаза описторхоза манифестирует через 2-4 недели после заражения. Легкая форма гельминтоза начинается с внезапного скачка температуры тела до 38°С и последующего сохранения субфебрилитета в течение в течение 1-2-х недель. В это время пациенты испытывают слабость, боли в животе, отмечают неустойчивый характер стула. В периферической крови при легком течении описторхоза выявляется умеренный лейкоцитоз и эозинофилия до 15 - 20%.
Среднетяжелая форма описторхоза протекает с лихорадкой (до 39°С и выше), которая длится около 3-х недель. Характерны миалгии и артралгии, уртикарные кожные высыпания, катар верхних дыхательных путей, увеличение печени и селезенки, рвота, диарея, астматический бронхит. Нарастают лейкоцитоз, эозинофилия до 25 - 60%, повышается СОЭ.
Тяжелые формы острого описторхоза развиваются у 10 - 20% больных и могут протекать по тифоподобному, гастроэнтероколитическому, гепатохолангитическому и респираторному вариантам. Симптоматика тифоподобного варианта описторхоза включает высокую лихорадку, озноб, лимфаденит, полиморфную кожную сыпь, диспепсию. В клинике преобладают явления интоксикации и аллергизации; возможно токсико-аллергическое поражение ЦНС или миокарда. При гастроэнтероколитической форме описторхоза развивается клиническая и патоморфологическая картина гастрита (катарального, эрозивного), гастродуоденита, язвы желудка и двенадцатиперстной кишки, энтероколита. Данные состояния сопровождаются снижением аппетита, тошнотой, болями в эпигастрии и правом подреберье, диареей. В течении гепатохолангитического варианта острого описторхоза превалируют желтуха, гепатоспленомегалия, абдоминальный синдром по типу печеночной колики или опоясывающего характера. Патологические синдромы могут включать в себя гепатит, холангит, холецистит, панкреатит. При вовлечении органов дыхания (респираторном варианте описторхоза) развивается трахеит, астмоидный бронхит, пневмония, плеврит, лихорадка.
Хронический описторхоз чаще всего протекает по типу дискинезии желчных путей, холангиогепатита, холангиохолецистита, желчнокаменной болезни, хронического панкреатита, гастрита, дуоденита. Имеют место признаки астеновегетативного синдрома: слабость, утомляемость, раздражительность, эмоциональная неустойчивость, головная боль, нарушение сна, повышенное потоотделение. Могут развиваться дистрофические изменения миокарда, проявляющиеся болями за грудиной, тахикардией, артериальной гипотонией. Длительное течение хронического описторхоза может осложниться циррозом печени, гнойным холангитом, флегмоной желчного пузыря, желчным перитонитом, первичным раком печени и поджелудочной железы.
Диагностика описторхоза
При проведении диагностики описторхоза учитываются эпидемиологические сведения, указывающие на пребывание пациента в эндемичных очагах, употребление в пищу свежезамороженной, малосоленой, недостаточно термически обработанной рыбы. Характерно изменение биохимических проб печени и ферментов поджелудочной железы - повышение билирубина, трансаминаз, амилазы и липазы. Данные инструментальных исследований (ФГДС, УЗИ гепатодуоденальной зоны и поджелудочной железы, холецистография, КТ, МРТ печени и желчевыводящих путей) обнаруживают признаки гастродуоденита, дискинезии желчевыводящих путей, холецистита, холангита, гепатита, панкреатита.
В целях паразитологического подтверждения описторхоза проводится микроскопическое исследование дуоденального содержимого и кала, в которых обнаруживаются яйца кошачьей двуустки. Для повышения вероятности обнаружения яиц гельминта перед проведением дуоденального зондирования и копроовоскопии целесообразно назначать пациенту тюбажи по Демьянову и желчегонные препараты. Выявить противоописторхозные антитела в сыворотке крови позволяет иммуноферментный анализ. Ввиду полиморфизма клинических симптомов течение острого описторхоза может напоминать вирусный гепатит, пищевую токсикоинфекцию, заболевания тифопаратифозной группы, миграционную фазу аскаридоза и анкилостомидоза.
Лечение описторхоза
Лечение описторхоза осуществляется поэтапно. На первом этапе назначается подготовительная терапия, включающая желчегонные и спазмолитические препараты, блокаторы Н1-гистаминовых рецепторов; по показаниям – короткие курсы антибиотиков. Кроме медикаментозной терапии, проводится физиотерапевтическое лечение (электрофорез сернокислой магнезии, магнитотерапия, микроволновая терапия). Целью подготовительного этапа служит нормализация желчевыделения и оттока желчи, купирование воспалительного процесса в ЖКТ и желчевыводящих путях.
В рамках основного этапа лечения описторхоза назначается противогельминтная химиотерапия. Наибольшую эффективность в уничтожении паразитов доказали празиквантел и его аналоги. После проведения дегельминтизации для эвакуации описторхисов с желчью проводится слепое зондирование, импульсная магнитотерапия, электростимуляция диафрагмального нерва. В случае выраженного токсико-аллергического синдрома требуется назначение антигистаминных препаратов, глюкокортикоидов, инфузионной терапии. Контроль эффективности противопаразитарного лечения предполагает проведение трехкратного исследования фекалий и дуоденального содержимого.
Заключительный этап курса лечения описторхоза направлен на выведение продуктов распада паразитов и восстановления биоценоза кишечника. С этой целью проводятся тюбажи с ксилитом, сорбитом, минеральной водой; назначаются желчегонные и ферментные препараты, гепатопротекторы, сорбенты, пре- и пробиотики.
Прогноз и профилактика описторхоза
При легких и среднетяжелых формах описторхоза прогноз обычно благоприятный, хотя возможны случаи повторной гельминтной инвазии. При возникновении гнойного холецистита и перитонита исход зависит от полноты и скорости оказания хирургической помощи. Прогностически неблагоприятно развитие острой печеночной недостаточности, рака печени, поджелудочной железы или холангиокарциномы.
Действия по предотвращению заражения описторхозом включают лечебно-профилактическую работу (выявление и дегельминтизацию инвазированных), эпидемиологические мероприятия (защиту водоемов от загрязнения фекалиями человека и животных, соблюдение технологии обработки и приготовления рыбы, уничтожение моллюсков), санитарно-просветительную работу (информирование населения).
Рассмотрены факторы риска паразитозов у детей, действие паразитов на организм ребенка, подходы к диагностике паразитарной инвазии и принципы комплексного лечения паразитозов с тем чтобы предотвратить дальнейшее развитие функциональных нарушений с формиров
Risk factors of parasitosis in children was considered, as well as the influence of parasites on a child's body, approaches to the diagnostics of parasitic invasions and principles of integrated treatment of parasitic diseases in order to prevent the further development of functional disorders of the formation of organic pathology.
.jpg)
Паразитарное заболевание — развитие болезненных симптомов в результате жизнедеятельности гельминта или простейших в организме человека [1]. Основной фактор выживания и распространения паразитов — их необычайно высокая репродуктивная способность, а также постоянно совершенствующиеся механизмы приспособления к обитанию в теле человека. К сожалению, настороженность медицинских работников в отношении паразитарных заболеваний у населения в настоящее время чрезвычайно низка, а профилактика гельминтозов сведена к лечению выявленных инвазированных пациентов [12, 13]. Вместе с тем многие исследователи отмечают связь широкой распространенности паразитозов у детского населения с развитием функциональной патологии органов пищеварения на фоне нарушений регуляции и высокий риск формирования хронических заболеваний даже при условии естественной санации ребенка с течением времени.
Самые распространенные и изученные заболевания — аскаридоз, энтеробиоз (рис. 1) и лямблиоз — регистрируются повсеместно. В России ежегодно выявляется более 2 млн больных нематодозами. При оценке территориального распределения лямблиоза по России установлено, что самый высокий средний уровень показателей заболеваемости в течение многих лет отмечен в Санкт-Петербурге, причем пораженность детей, посещающих детские учреждения, составляет 35% [2].
Каждый человек в течение жизни неоднократно переносит различные паразитарные заболевания [9]. В детском возрасте паразитозы встречаются чаще. У детей раннего возраста (до 5 лет) этому способствует широкая распространенность репродуктивного материала паразитов (цисты, яйца, личинки (рис. 2)) в окружающей среде и недостаточное развитие гигиенических навыков.
.jpg)
Значимость определенных факторов риска меняется в соответствии с возрастом ребенка. Доказано, что для детей младшего возраста более значимы санитарно-гигиенические условия проживания, а для подростков при сборе анамнеза необходимо уделить внимание социально-экономическим и географическим факторам (пребывание в лагере, туристическая поездка, наличие младшего брата или сестры) (рис. 3).
.jpg)
Транзиторное снижение противоинфекционного иммунитета как фактор риска возникновения паразитоза у детей регистрируется также в период реконвалесценции после вирусных заболеваний, вызываемых вирусами герпетической группы (цитомегаловирус, вирус простого герпеса I и II, вирус Эпштейна–Барр), может возникать в результате ятрогении (применение иммуносупрессивной терапии при аллергических и аутоиммунных заболеваниях). В настоящее время значимая доля детей находится в состоянии дезадаптации, которое также сопровождается снижением иммунной защиты.
Иммунную защиту желудочно-кишечного тракта (ЖКТ) ребенка можно условно разделить на специфическую и неспецифическую. К неспецифической защите относят комплекс условий нормального пищеварения: зрелость ферментативных систем, обеспечение кислотно-щелочного градиента в различных отделах ЖКТ, деятельность нормальной микрофлоры, адекватную моторику.
Отдельно необходимо отметить, что для такого заболевания, как лямблиоз, предрасполагающим фактором инвазии является нерегулярное и недостаточное отделение желчи в кишечник при аномалиях развития желчного пузыря (перетяжки, перегибы). Лямблиоз, выявленный у пациентов педиатрического отделения МОНИКИ, в 100% случаев сопровождался дисфункцией билиарного тракта.
.jpg)
У детей в восстановительном периоде после острых кишечных инфекций, после массивной антибиотикотерапии, а также у пациентов с хронической патологией органов пищеварения сопутствующие нарушения ферментного обеспечения, нормофлоры и моторики кишечника также делают ЖКТ более уязвимым для паразитов (рис. 4).
Специфическая защита слизистой оболочки органов пищеварения зависит от возраста ребенка и его зрелости. Механизм специфической иммунной защиты является одной из наиболее древних систем организма, так как гельминтозы сопровождают человечество в течение многих тысячелетий. Этот механизм представлен прежде всего эозинофилами крови и иммуноглобулином Е.
Классический развернутый антипаразитарный ответ может быть сформирован у ребенка не ранее достижения им 4 лет и тесно связан с качеством и количеством IgE, созревающего к этому возрасту. При контакте организма с паразитом в первую очередь выделяются медиаторы воспаления: интерлейкин, лейкотриен С4, D4, простагландины, тромбоксаны. Увеличивается количество лимфоцитов, продуцирующих IgM и IgG. В клиническом анализе крови отмечается рост уровня эозинофилов и базофилов, связанный с увеличением содержания этих клеток в тканях инвазированного органа. Встречаясь с личинками паразита, тканевые базофилы выделяют гепарин и гистамин, которые в сочетании с лейкотриенами и другими медиаторами воспаления вызывают общие проявления: зуд, реактивный отек, гиперемию, а также могут спровоцировать общие проявления: бронхоспазм, проявления крапивницы или диарею. Аллергическое воспаление при паразитозах развивается по классическому пути и призвано создать условия, приводящие к гибели и/или элиминации паразита [5].
Вместе с тем эозинофилы обладают выраженным цитотоксическим потенциалом, превышающим возможности других клеток крови, что объясняет первостепенное значение эозинофилов в антипаразитарных реакциях и их повреждающую роль при аллергии. Основное действие эозинофилы оказывают в барьерных тканях. В очаге инвазии они дегранулируют, оказывая гельминтотоксическое и цитотоксическое действие. Белки эозинофильных гранул (большой основной протеин, эозинофильная пероксидаза, эозинофильный катионный протеин, эозинофил-производный нейротоксин) токсичны не только для паразита, но и для клеток организма ребенка. Еще одной из важных причин системных и органных поражений, сопутствующих паразитозам, является образование иммунных комплексов [9, 10].
Действие паразитов на организм ребенка осуществляется с вовлечением многих систем. Практически все их виды могут вызывать сдвиг соотношения Th1/Th2 клеток в направлении, благоприятном для их выживания. Описаны случаи, когда продукты выделения паразита оказывали гормоноподобное действие на организм хозяина [5].
Местное влияние паразиты осуществляют, вызывая контактное воспаление слизистой оболочки и стимулируя вегетативные реакции. При этом нарушаются процессы кишечного всасывания, адекватная моторика ЖКТ и его микробиоценоз.
Системное влияние оказывается за счет использования паразитом энергетического и пластического потенциала пищи в ущерб организму ребенка, индукции аллергии и аутоиммунных процессов, целенаправленной иммуносупрессии и эндогенной интоксикации. Проведенными исследованиями показано, что аллергический синдром сопутствует аскаридозу и энтеробиозу в 71,3% случаев. Среди детей с атопическим дерматитом паразитозы выявляются у 69,1%, при этом лямблиоз из числа всех инвазий составляет 78,5% [4].
Особенно узнаваемую клиническую картину формирует токсокароз (рис. 5). Клиническими маркерами этой инвазии являются лейкемоидная реакция эозинофилов (от 20% и выше эозинофилов в формуле крови), сопровождающая ярко и упорно протекающий аллергический синдром в виде атопического дерматита с выраженным зудом и резистентностью к традиционной терапии или тяжелую бронхиальную астму с частыми приступами.
В 75,3% случаев паразитозы сопровождаются разнообразными функциональными нарушениями со стороны ЖКТ. Рядом работ доказано, что паразитарная инвазия способна вызывать нарушения углеводного обмена, а также дисахаридазную недостаточность за счет снижения уровня лактазы [7, 9].
У большинства детей нарушения адаптации являются одним из важных звеньев патогенетического процесса при паразитозе. Следует отметить, что состояние дезадаптации затрагивает в первую очередь лимфоцитарное звено иммуногенеза, что не может не сказываться на созревании и дифференцировке специфического иммунитета.
Диагностика паразитозов
До настоящего времени ведется поиск простого, доступного и надежного метода диагностики паразитозов. Разработанные методики прямого визуального обнаружения требуют минимальной экспозиции диагностического материала, многократных повторных исследований. Известные способы диагностики глистных инвазий и протозоозов, такие как метод толстого мазка фекалий по Като, метод формалин-эфирного осаждения, перианальный соскоб, микроскопия пузырной и печеночной желчи, имеют ряд недостатков, связанных как с особенностями развития паразита, так и с состоянием макроорганизма и его реактивностью.
Непрямые методы исследования (определение специфических антител) обладают недостаточной специфичностью и достоверностью. Известно, например, что, проходя сложный цикл развития от яйца до взрослого состояния, гельминты меняют свой антигенный состав. Антитела в организме хозяина вырабатываются в основном в ответ на поступление экскретов и секретов гельминта, тогда как в иммунодиагностических реакциях используются соматические антитела. Возникающая неспецифическая сенсибилизация организма, общность некоторых антигенов трематод, простейших и человека создают высокий удельный вес ложноположительных серологических реакций в титрах ниже достоверно диагностических. Таким образом, исследование методом иммуноферментного анализа (ИФА) на гельминты является высокочувствительным, но низкоспецифичным методом. Определение паразитов методом полимеразной цепной реакции (ПЦР) является высокоспецифичным и высокочувствительным методом, но из-за дороговизны и сложности не может быть скрининговым, когда, например, нужно обследовать группу детей из детского учреждения.
Не теряет своей актуальности клинический осмотр ребенка и внимательный учет косвенных признаков паразитоза. Важно отметить возможность течения паразитоза при аллергическом и астеническом синдроме, полилимфаденопатии неясного генеза, при нарушениях кишечного всасывания, углеводного обмена, при затяжном и хроническом течении болезней пищеварительного тракта, гепатоспленомегалии неясного генеза. Течение паразитарной инвазии имеет клинические особенности: обычно признаки поражения минимизированы, заболевание носит стертый характер, обострения полиморфны и неярки. Особенностью обострений заболеваний данной группы является их цикличность с периодом в 11–15 дней.
Косвенными лабораторными признаками паразитоза могут быть анемия, базофилия, эозинофилия, увеличение уровня аспартатаминотранферазы (АСТ).
Кроме того, признаки возможной паразитарной инвазии следует учитывать при оценке результатов инструментального исследования. При ультразвуковом исследовании органов брюшной полости у ребенка старше 3 лет косвенными признаками паразитоза являются гепатоспленомегалия, неравномерность паренхимы печени и селезенки за счет мелких гиперэхогенных сигналов, увеличенные лимфатические узлы в воротах селезенки.
Лечение гельминтозов
Лечение гельминтозов должно начинаться с применения специфических антигельминтных препаратов. Современный арсенал лекарственных средств, используемых для лечения кишечных паразитозов, включает значительное количество препаратов различных химических классов [11]. Они применяются как в клинической практике для лечения выявленных больных, так и с целью массовой профилактики.
Определяя препарат для специфической противопаразитарной терапии, следует понимать, что спектр действия этих препаратов не особенно широк. Практически все препараты этой группы применяются многие десятки лет и целесообразно предположить, что паразиты выработали системы приспособления и заболевание может быть резистентным к проводимой терапии. По данным Г. В. Кадочниковой (2004), эффективность такого традиционного препарата, как Декарис, в современных условиях не достигает 57%. Кроме того, эта группа противопаразитарных средств, к сожалению, имеет ряд побочных эффектов: тошноту, рвоту, абдоминальный синдром.
Таким образом, в современных условиях следует отдавать предпочтение более современным препаратам, которые, во-первых, являются универсальными для лечения как нематодозов, так и смешанных глистных инвазий и активны в отношении такого распространенного паразита, как лямблия. Во-вторых, использование одного противопаразитарного препарата, а не их комбинации, ощутимо снижает риск неприятных побочных эффектов. На сегодняшний день единственный представитель этой группы в нашей стране — альбендазол (Немозол).
Для лечения аскаридоза у детей старшего возраста или при рецидивировании заболевания в настоящее время под наблюдением врача может быть применен комбинированный прием антигельминтных средств (например, альбендазол в течение трех дней, затем — Вермокс в течение трех дней). Непременным условием успешной дегельминтизации больных энтеробиозом являются одновременное лечение всех членов семьи (коллектива) и строгое соблюдение гигиенического режима для исключения реинвазии. Следует отметить, что важное значение имеет ежедневная влажная уборка, так как были описаны казуистические случаи распространения репродуктивного материала остриц на частичках пыли на высоту до 1,5 метра.
В педиатрической клинике МОНИКИ разработаны принципы терапии паразитозов, учитывающие особенности патогенеза инвазии и позволяющие качественно и надежно вылечить данную группу заболеваний. Благодаря применению разработанной схемы терапии удается эффективно предотвратить реинвазию и развитие функциональных нарушений органов пищеварения у детей.
Принципы терапии больных паразитозами
1. Прием антипаразитарных препаратов проводится с учетом вида возбудителя инвазии.
Препараты, применяемые в лечениии аскаридоза:
- Вермокс (мебендазол) (для детей с 2 лет) — по 100 мг 2 раза в сутки в течение 3 дней;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении энтеробиоза:
- Вермокс (мебендазол) (для детей с 2 лет) — 100 мг однократно;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении лямблиоза:
- орнидазол 25–30 мг/кг (если масса тела больше 35 кг — 1000 мг) в два приема в течение 5 дней, 1 день — 1/2 дозы, повторный курс через 7 дней;
- Макмирор (нифурател) — по 15 мг/кг 2 раза в сутки в течение 7 дней;
- Немозол (альбендазол) — по 15 мг/кг однократно в течение 5–7 дней.
2. Лечение паразитоза предусматривает измененные в результате жизнедеятельности паразитов свойства пищеварительного тракта ребенка (функциональные нарушения органов пищеварения, ферментопатия, изменение микробиоценоза) и их коррекцию курсами ферментных препаратов и синбиотиков (табл. 1).
3. Обязательное применение энтеросорбентов и комплекса поливитаминов с микроэлементами (табл. 2 и 3).
Таким образом, разработанные в клинике педиатрии МОНИКИ принципы комплексной терапии паразитозов у детей предусматривают поэтапное восстановление функционального состояния ЖКТ, нарушенного в результате местного и системного влияния паразитов. Применение комплексной терапии позволяет предотвратить дальнейшее развитие функциональных нарушений с формированием органической патологии, а также избежать реинвазии.
Литература
Л. И. Васечкина 1 , кандидат медицинских наук
Т. К. Тюрина, кандидат медицинских наук
Л. П. Пелепец, кандидат биологических наук
А. В. Акинфиев, кандидат медицинских наук
Читайте также:

