Описторхоз статьи в журналах
Обновлено: 19.04.2024
Описторхоз широко известен в мире как природно-очаговое паразитарное заболевание человека и животных. В настоящее время описано 70 видов трематод семейства Opisthorchidae Luhe,1911. Из них у человека паразитируют - в Европе, Западной Сибири, Казахстане Opisthorchis felineus (Rivolta,1884), на Дальнем Востоке и в Китае - Clonorchis viverrini (Poirier, 1886), на Аляске и в Канаде- Metorchis conjunсtus (Cobbold,1960) (Скрябин К.И., Петров А.М.,1950, Филимонова Л.В.,1998).
В последние годы в Западной Сибири выявлен еще один опасный для человека вид трематод сем Opisthorchidae Luhe,1911 - Metorchis bilis (Кузнецова В.Г., ФедоровК.П., 1997). Этот вид вызывает заболевание под названием меторхоз и уже под этим именем включен в СанПиН 2002г. В практической жизни под названием описторхоз часто понимают фактически возбудителей двух разных видов- O.felineus и M. bilis, относящихся к одному семейству. Трематоды имеют трех хозяев - двух промежуточных (моллюск и рыба) и окончательного -(человек и млекопитающие), а также две свободноживущие стадии - яйцо и личинка.
Внедрение возбудителей в организм человека приводит к тяжелому поражению печени, желчного пузыря и поджелудочной железы, сопровождается аллергическими проявлениями и дисбактериозом (Пальцев А.И.,1987,1998). У больных описторхозом отмечено снижение иммунитета в отношении простудных заболеваний. Кроме того, заболевание может маскироваться под другие и выявляется не сразу. Помимо непосредственного вреда здоровью, описторхоз вынуждает больного проходить длительное обследование, проводить лечение, зачастую повторное, восстанавливать микроценоз кишечника после дегильминтации (Литвина Л.А., Стрижак В.М., 2003). Все это связано с большими материальными затратами. Даже в благополучные восьмидесятые годы экономический ущерб от лечения одного работающего больного был значительным и составлял 234руб. при среднемесячной зарплате в стране 175 руб.
Из сказанного очевидно, что проблема описторхоза заслуживает внимания, тем более что количество больных в последние годы не только не уменьшилось, но и возросло. В девяностые годы, по данным Областной СЭС, больные описторхозом встречались во вех 30 районах Новосибирской области. Данные о больных на 1000 жителей показывают, что особенно заражены люди в районах, расположенных на реках Омь, Таре, Тартасе (10-104 чел. На 1000 жителей), в районе Новосибирского водохранилища (32-109 чел.), в районах рек Каргат, Чулым, Чулыменок - бассейне оз. М.Чаны (30-101 чел.), на р. Оби и её притоках - р.Уень, р.Иня (17-75чел.), на озерах бассейна реки Карасук (16-46 чел.). В Новосибирске за последние три года количество вновь выявленных больных описторхозом колеблется за год от 2300 до 2500 человек. Увеличение количества случаев описторхоза в 90-ые годы по сравнению с предыдущими годами составило 48,6%.
Единственным источником заражения человека паразитами служит рыба семейства карповых. В течение многих лет (1965-1990г.г.) нами в Карасукском районе Новосибирской области проводилось исследование показателей зараженности различных видов рыб и моллюсков, обитающих в озере Кротовая Ляга, личиночными стадиями трематод сем.Оpisthorchidae. У озерного гольяна выявлена тенденция к повышению показателей экстенсивности инвазии при увеличении акватории озера с большими глубинами. Пищевые взаимоотношения гольяна и моллюсков также сказывались на величине зараженности рыб описторхидами - с увеличением в пище гольяна моллюсков-битиниид зараженность его увеличивалась (Соусь С.М., Малышев Ю.Ф.,1976).
Определена корреляционная связь между годовыми (от 6 до19 лет) изменениями показателей факторов среды и зараженностью карася меторхисами (M.bilis) К достоверным связям относятся следующие: положительная между средней температурой воды июля и обилием личинок меторхов в карасе (N=19, r=0,48, p=0,05) отрицательная между показателями рН среды и экстенсивностью инвазии рыб (N=6,r=-0,91, p=0,01); (то есть при увеличении щелочности воды число зараженных рыб уменьшается); обилием личинок меторхов в карасе (N=6, r=-0,95, p=0,01) и численностью карася (N=16, r=-0,55, p=0,05). Установлена также связь, близкая к достоверной, между величиной экстенсивности инвазии карася и показателями среднелетних температур воды (N=19,r=-0,44, p=0,05 N=20).
Итак, на увеличение зараженности карася меторхами достоверно оказывают влияние повышение температуры воды, изменение рН среды от щелочной к нейтральной, уменьшение численности карася промысловых размеров на площади озера со средними глубинами.
Корреляционным анализом установлено, что в Карасукском районе число вновь выявленных больных описторхозом людей по годам (1965-1998) достоверно и положительно коррелировало с показателями частоты зараженности карася меторхиями (N=33, r=0,57, p=0,001) и обилием паразитов в рыбе (N=33,r=0,45, p<0,01).Это вполне естественно, так как карась является основной пресноводной рыбой в питании населения данного района.
Природный очаг описторхоза в Европейской части России поддерживается в основном дикими животными, обитающими в воде- это норка, выдра, речной бобер и др. В Западной Сибири кроме подобных животных очаг поддерживают лисица обыкновенная, корсак, хорь, песец, соболь. Это объясняется гидрологическими особенностями местных водоемов, имеющих неустойчивый водный режим. При обмелении озер они промерзают в зимний период, рыба гибнет от недостатка кислорода, а весной становится доступной для диких зверей. Экспериментально установлено, что личинки паразитов в такой рыбе остаются живыми (Соусь С.М., 1988).
Вместе с тем, человек, вклиниваясь в природный очаг, сам способствует его распространению. Это очевидно, например, потому, что вокруг деревень на р. Оби зараженность моллюсков больше, чем в отдалении от них, так как люди усиливают зараженность животных описторхозом, скармливая сырую рыбу кошкам, собакам, свиньям. Яйца меторхов и описторхов, рассеиваемые окончательными хозяевами ‘ паразитов (человек, домашние и дикие животные), попадают в воду, где их заглатывают промежуточные хозяева -моллюски Bithynia tentaculata и Opisthorchophora inflatа. В них происходит бесполое размножение меторхов и описторхов, их личинки -церкарии, выходят в воду и проникают через кожные покровы в дополнительных хозяев - карповых рыб и локализуются в поверхностных слоях их мышц. К рыбам, представляющим потенциальную опасность для человека и животных в Западной Сибири, относятся следующие виды: язь, линь, сеголетки сазана, лещ, верховка, елец и озерный гольян. В перечисленных видах рыб паразитируют меторхи и описторхи, за исключением карася, у которого обнаруживаются только меторхи, и пескаря, у которого встречаются только описторхи.
Акклиматизация животных может усиливать значимость природных очагов описторхоза, создавать новые очаги или служить лимитирующим фактором величины популяции возбудителя описторхоза. Так, появление в Западной Сибири еще одного дефинитивного хозяина - акклиматизированной ондатры, увеличило стабильность парaзитарной системы O.filineus. Вселение дополнительных хозяев - рыб (лещ, верховка - случайный акклиматизант), не только усилило значимость природных очагов описторхоза, но и создало новые очаги.
Из сказанного очевидно, что решение проблемы описторхоза возможно лишь при комплексном подходе к ней со стороны специалистов различных профилей- экологов, рыбоводов, санитарных врачей. Важная роль в снижении заболеваемости принадлежит пропаганде знаний среди населения. В последние годы в силу ряда объективных причин такая пропаганда снизилась, и резко возросло количество заболевших. Ослаблено внимание и к контролю за поступающей в продажу рыбой, которой изобилуют рынки г.Новосибирска, и которая зачастую выловлена из неизвестных водоемов.
Учитывая, что проблема описторхоза еще долгое время будет существовать и оставаться актуальной, считаем необходимым внесение сведений об описторхозе в региональные учебники биологии, начиная с младших классов. В этот период идет формирование мировоззрения ребенка, и он правильно воспринимает непосредственную связь между собой и природой. Начатое с детства воспитание в человеке культуры общения с природой должно привести к снижению заболеваемости меторхозом и описторхозом.
Цель исследований: провести анализ литературных источников на установление роли описторхоза в здравоохранении, оценке актуальности гистологических и гистохимических методов при определении эффективности препаратов против гельминтов – возбудителей описторхоза.
Материалы и методы. Проведён анализ источников литературы по изучению описторхоза, распространению его возбудителя и значению для здравоохранения. Изучена официальная документация годовых отчетов, представленных на официальных сайтах.
Ключевые слова
Об авторе
Оксана Ивановна Бибик
650029, г. Кемерово, ул. Ворошилова 22а
Список литературы
1. Бабаева Е. Ю., Чернышёва Е. С., Николаева С. А. Комплексное использование синтетических антигельминтиков и растительных препаратов при глистных инвазиях // Вестник РУДН, серия Медицина. 2015. № 2. С. 93–99.
3. Базин И. С., Гарин А. М. Лечение холангиоцеллюлярного рака желчных протоков, рака желчного пузыря и рака Фатерова сосочка // Русский медицинский журнал. 2002. № 24. С. 1103–1108.
4. Балашева И. И., Миронова З. Г. Особенности течения и терапии описторхоза у детей. Томск. 1990. 152 с.
7. Бибик О. И. Патоморфология и гистохимическая реактивность органов и тканей трематод после действия антигельминтиков: автореф. дис… канд. биол. наук. М., 1997. 13 с.
8. Бибик О. И. Морфофункциональная характеристика органов и тканей паразита и хозяина при трематодозах после химиотерапии антигельминтиками // Российский паразитологический журнал. 2008. № 1. С. 99–106.
10. Бибик О. И., Начева Л. В. Паразитарные болезни, распространённые на территории Кузбасса (распространённость, меры борьбы и профилактики). Методические рекомендации (для врачей практического здравоохранения и ветеринарной медицины, студентов, ординаторов и аспирантов соответствующего профиля). Кемерово, 2010. 63 с.
14. Богданов А. О., Прокудина Д. В., Байков А. Н., Салтыкова И. В. Молекулярные механизмы, опосредующие развитие холангиокарциномы в ходе хронической инвазии печёночными сосальщиками // Сибирский онкологический журнал. 2015. № 6. С. 83–90.
15. Беэр С. А. Биология возбудителя описторхоза. М., 2005. 336 с.
16. Бычков В. Г. Описторхоз и рак печени у населения гиперэндемичного очага. Новосибирск, 1992. 175 с.
17. Гузеева Т. М. Состояние заболеваемости паразитарными болезнями в Российской Федерации и задачи в условиях реорганизации службы // Медицинская паразитология и паразитарные болезни. 2008. № 1. С. 3–10.
19. Летюшев А. Н. Критерии оценки активности эпидемического процесса описторхоза в крупном промышленном центре Западной Сибири и оптимизация системы эпидемиологического надзора: дис. … д-ра мед. наук. Тюмень, 2017. 205 с.
20. Либерман Е. Л., Медведева И. Н. Показатели инвазии массовых видов карповых рыб Нижнего Иртыша метацеркариями сем. Opisthorchiidae // Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство. 2017. № 4. С. 37–42.
22. Начева Л. В., Бибик О. И. Микроморфологические исследования органов и тканей разных видов трематод до и после воздействия антигельминтиками // Труды Всероссийского института гельминтологии им. К.И. Скрябина. 2006. Т. 44. С. 162–169.
28. Плотникова Е. Ю., Баранова Е. Н. Описторхоз: осложнения и проблемы лечения // Гастроэнтерология Санкт-Петербурга. 2018. С. 14–18.
29. Сергиев В. П. Регистрируемая и истинная распространенность паразитарных болезней // Медицинская паразитология и паразитарные болезни. 1991. № 2. С. 3–5.
30. Щекина Е. Г. Гельминтозы: современный взгляд на проблему // Провизор. 2007. № 12. С. 30–34.
31. Andrews R. H., Sithithaworn P., Petney T. N. Opisthorchis viverrini: an underestimated parasite in world health. Trends in Parasitology. 2008. 24 (11): 497–501.
32. Chiu A., Neff M., Garcia G. Late complications of infection with Opisthorchis viverrini. Western Journal of Medicine. 1996; 164 (2): 174–176.
33. Dechakhamphu S., Pinlaor S., Sitthithaworn P., Nair J., Bartsch H., Yongvanit P. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiol Biomarkers Prev. 2010; 19 (1): 310–318. doi: 10.1158/1055-9965.EPI-09-0849.
34. Elkins D. B., Mairiang E., Sithithaworn P., Mairiang P., Chaiyakum J., Chamadol N., Loapaiboon V., Haswell-Elkins M. R. Cross-sectional patterns of hepatobiliary abnormalities and possible precursor conditions of cholangiocarcinoma associated with Opisthorchis viverrini infection in humans. American Journal of Tropical Medicine and Hugiene. 1996; 55 (3): 295–301. DOI: 10.4269/ajtmh.1996.55.295
35. Fukase K., Ohtsuka H., Onogawa T., Oshio H., Ii T., Mutoh M., Katayose Y., Rikiyama T., Oikawa M., Motoi F., Egawa S., Abe T., Unno M. Bile acids repress E-cadherin through the induction of Snail and increase cancer invasiveness in human hepatobiliary carcinoma. Cancer Science. 2008; 99 (9): 1785–1792. doi: 10.1111/j.13497006.2008.00898.x.
36. Jing H., Lee S. NF-κB in cellular senescence and cancer treatment. Molecules and Cells. 2014; 37 (3): 189–195. doi: 10.14348/molcells.2014.2353.
37. Jusakul A., Loilome W., Namwat N., Haigh W. G., Kuver R., Dechakhamphu S., Sukontawarin P., Pinlaor S., Lee S. P., Yongvanit P. Liver flukeinduced hepatic oxysterols stimulate DNA damage and apoptosis in cultured human cholangiocytes. Mutation Research. 2012; 731 (12): 48–57. doi: 10.1016/j.mrfmmm.2011.10.009.
38. Kaewpitoon N., Kaewpitoon S. J., Pengsaa P., Sripa B. Opisthorchis viverrini: the carcinogenic human liver fluke. World Journal of Gastroenterology. 2008; 14 (5): 666–674.
39. Kim S. S., Kim S. J., Rim H. J. Electronmicroscopic studies on the effect of praziquantel to Clonorchis sinensis. Korea University Medical Journal. 1982; 19: 91–105.
40. Laha T., Sripa J., Sripa B., Pearson M., Tribolet L., Kaewkes S., Sithithaworn P., Brindley P. J., Loukas A. Asparaginyl endopeptidase from the carcinogenic liver fluke, Opisthorchis viverrini, and its potential for serodiagnosis. International Journal of Infectious Diseases. 2009; 12: 49–59. doi: 10.1016/j.ijid.2008.03.033
41. Lovis L., Mak T. K., Phongluxa K., Ayé Soukhathammavong P., Vonghachack Y., Keiser J., Vounatsou P., Tanner M., Hatz C., Utzinger J., Odermatt P., Akkhavong K. Efficacy of praziquantel against Schistosoma mekongi and Opisthorchis viverrini: a randomized, single-blinded dosecomparison trial. PLoS One. 2012; 6:e 1726.
42. Maksimova G. A., Zhukova N. A., Kashina E. V., Lvova M. N., Katokhin A. V., Tolstikova T. G., Mordvinov V. A. Role of opisthorchis felineus on induction of bile duct cancer. Parazitologiia. 2015; 49 (1): 3–11.
43. Marcos L. A., Terashima A., Gotuzzo E. Update on hepatobiliary flukes: fascioliasis, opisthorchiasis and clonorchiasis. Current Opinion in Infectious Diseases. 2008; 21(5): 523–30.
44. Mathema V. B., Na-Bangchang K. Current insights on cholangiocarcinoma research: a brief review. Asian Pacific Journal of Cancer Prevention. 2015; 16 (4): 1307–1313.
45. Pal S., Bhattacharjee A., Ali A., Mandal N. C., Mandal S. C., Pal M. Chronic inflammation and cancer: potential chemoprevention through nuclear factor kappa B and p53 mutual antagonism. Journal of Inflammation (London). 2014; 11: 1–28. doi: 10.1186/1476-9255-11-23. eCollection 2014.
46. Patel T. Cholangiocarcinoma. Nature Clinical Practice Gastroenterology & Hepatology. 2006; 3 (1): 33–42.
47. Pinlaor S., Hiraku Y., Ma N., Yongvanit P., Semba R., Oikawa S., Murata M., Sripa B., Sithithaworn P., Kawanishi S. Mechanism of NOmediated oxidative and nitrative DNA damage in hamsters infected with Opisthorchis viverrini: a model of inflammation-mediated carcinogenesis. Nitric Oxide. 2004; 11 (2): 175–183.
48. Pinlaor S., Hiraku Y., Yongvanit P., TadaOikawa S., Ma N., Pinlaor P., Sithithaworn P., Sripa B., Murata M., Oikawa S., Kawanishi S. iNOSdependent DNA damage via NFkappaB expression in hamsters infected with Opisthorchis viverrini and its suppression by the antihelminthic drug praziquantel. International Journal of Cancer. 2006; 119 (5): 1067–1072.
49. Saijuntha W., Sithithaworn P., Wongkham S., Laha T., Pipitgool V., Tesana S., Chilton N. B., Petney T. N., Andrews R. H. Evidence of a species complex within the food-borne trematode Opisthorchis viverrini and possible co-evolution with their first intermediate hosts // International Journal for Parasitology. 2009; 37: 695–703. DOI: 10.1016/j.ijpara.2006.12.008
50. Sriamporn S. Epidemiologic study of liver cancer using a population-based cancer registry as a guide in Khon Kaen, Thailand. Public Health Reports. 1993; 5 (1): 51–58.
51. Sripa B., Brindley P. J., Mulvenna J., Laha T., Smout M. J., Mairiang E., Bethony J. M., Loukas A. The tumorigenic liver fluke Opisthorchis viverrini – multiple pathways to cancer. Trends in Parasitology. 2012; 28 (10): 395–407. doi: 10.1016/j.pt.2012.07.006.
52. Sripa B., Kaewkes S., Sithithaworn P., Mairiang E., Laha T., Smout M., Pairojkul C., Bhudhisawasdi V., Tesana S., Thinkamrop B., Bethony J. M., Loukas A., Brindley P. J. Liver Fluke Induces Cholangiocarcinoma. PLoS Medicine. 2007; 4 (7): 1148–1155.
53. Tielens A. G., van den Heuvel J. M., van den Bergh S. G. The energy metabolism of Fasciola hepatica during its development in the final host. Molecular and Biochemical Parasitology. 1984; 13 (3): 301–307.
54. Watanapa P., Watanapa W. B. Liver flukeassociated cholangiocarcinoma. British Journal of Surgery. 2009; 962–970.

В статье авторы приводят статистику по случаям заболевания описторхозом среди населения России и Республики Башкортостан, выявляют причины роста и падений данных показателей. Представлены современные данные об описторхозе человека Представлены примеры заболевания описторхоза в мире, в России и в отдельном регионе с целью демонстрации процентного соотношения заболевших.
Цель исследования: Изучение описторхоза человека, с целью выявления причин повышения или понижения динамики заболевших в
Актуальность: Описторхоз является одной из главных обсуждаемых проблем паразитического заболевания в сфере здравоохранения и занимает главные строчки по паразитическим заболеваниям в России, находясь на 4–5 месте. Поэтому разбор данной проблемы является актуальным на настоящий момент времени, что даст нам понять причины такой высокой заболеваемости среди населения.
Введение: Высокая заболеваемость населения связана с одной из основных проблем данного паразитического заболевания — длительный промежуток времени начала заболевания, который может длиться от 5 до 42 дней [2].
В большинстве случаев заболевание протекает в острой форме, продолжительность может составлять две недели. [2]
Возбудитель описторхоза передаётся через зараженную рыбу, из этого следует, что очаги заболевания распространены среди населения в местах близлежащих рек, где имеются благоприятные условия для существования и размножения моллюсков, которые являются промежуточными хозяевами для кошачьего сосальщика, и карповых рыб, вода которых подвергается значительному фекальному загрязнению, а население употребляет в пищу зараженную личинками рыбу.
Данная ситуация сохраняется как по миру, так и по всей России из-за огромного числа рыбоперерабатывающих предприятий, которые не соблюдают технологии обеззараживания рыбы, вследствие чего не спадает рост больных описторхозом.
Количество заражений описторхозом в мире
Известно, что он вызывает значительное бремя для здоровья в регионе описторхоза в Таиланде и, возможно, на всем юго-востоке материка. Для снижения заболеваемости Оpisthorchiidae нужна необходимая комплексная программа профилактики и борьбы с описторхозом.
В этом обзоре наша цель состоит в том, чтобы представить краткую информацию о текущей ситуации в отношении естественной истории описторхоза и его опасности для здоровья в Юго-Восточной Азии.
Это подтверждается международными эпидемиологическими исследованиями, по данным которых в Северных регионах Тайланда, являющихся эндемичными очагами инвазии Opisthorchis viverrini, заболеваемость холангиокарциномы достигает 96 случаев на 100 тыс.
Холангиокарцинома считается фатальной опухолью и распространена в эндемичных районах присутствия возбудителя описторхоза. Возникновение первичного рака печени коррелирует с длительностью и интенсивностью описторхозной инвазии [4].
Употребление в пищу сырой, ферментированной или недоваренной карповой рыбы, зараженной печеночной двуусткой Opisthorchis viverrini, приводит к хроническому воспалению желчевыводящих путей, фиброзу перидуктала и повышенному риску рака.
Описторхоз в России
Описторхоз, который вызван трематодой Opisthorchis felineus, распространён на территории России, Украины, Казахстана.
В настоящее время в странах СНГ описторхоз распространен преимущественно в местностях, прилегающих к бассейну рек Оби и Иртыша (Западно-Сибирский и Казахстанский очаги), а также в бассейнах Печоры, Камы, Волги, Дона, Немана и других рек России.
Наибольший индекс заболеваемости в России отмечается среди коренного прибрежного населения. Заболеваемость отмечается среди детей в возрасте 1–3 лет, возрастает к 14–15 годам и на этом уровне держится до 50–60 лет. В профессиональном отношении чаще поражаются рыбаки и моряки.
Высокий показатель заболеваемости приходиться на центральную Россию. Очень высокая заболеваемость регистрируется в Томской и Тюменской областях [3].
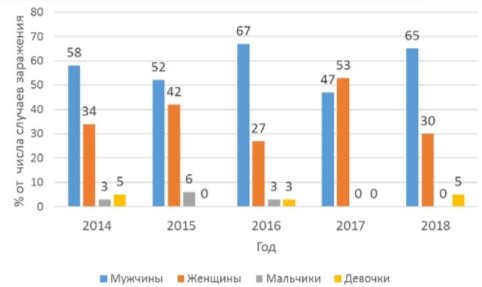
На данном графике показано процентное соотношение людей, больных описторхозом за период 2014–2018 гг.
Видно, что почти за все время преобладало количество мужчин. Это связано с мужской работой, которую они выполняют (рыбак, моряк и т. д.)
Высокие показатели заболеваемости населения описторхозом ухудшаются социальными факторами: увеличением в рационе питания населения прибрежных городов и поселков рыбы и рыбопродуктов домашнего приготовления. Так же идет увеличение числа рыбаков-любителей, которые отлавливают зараженную рыбу в водоемах с дальнейшей целью поедания [4].
Статистика описторхоза по республике Башкортостан

По статистике с 2010 по 2020 год видно резкое снижение заболеваемости населения описторхозом. Видно, что на период 2017 года приходиться резкое повышение данной заболеваемости. Можно предположить, что это связанно с увеличением рыбной ловли и работой вахтовым методом в регионах Западной Сибири.
За 5 месяцев (май — сентябрь) 2017 года было диагностировано 30 случаев острого описторхоза. Чаще болели мужчины (70 %) [1].
Вывод: Основываясь на данные результаты, которые были приведены выше, можно сказать, что эпидемиологическая ситуация населения по описторхозу является напряжённой и данное паразитическое заболевание остаётся серьёзной проблемой здравоохранения не только в России, но и в мире. Представители Оpisthorchiidae, паразитируя в желчном пузыре, желчных протоках и печени хозяина, продуцируя токсичные и иммуногенные продукты жизнедеятельности, нарушая метаболизм клеток, являются одним из факторов, способствующих развитию рака желчных протоков.
Основные термины (генерируются автоматически): Россия, описторхоз, паразитическое заболевание, Башкортостан, высокая заболеваемость, зараженная рыба, Таиланд.
Ключевые слова

Актуальность. В 2010 году около 2 миллионов новых случаев рака (16 %) во всем мире были связаны с возбудителями других заболеваний [15]. Если бы эти заболевания можно было предотвратить или лечить, то, по оценкам, в менее развитых регионах мира было бы на 23 % меньше раковых заболеваний и на 7 % меньше онкологических заболеваний в более развитых регионах.
Представители семейства Оpisthorchiidae Opisthorchis viverrini и O. felineus давно признаны причиной серьёзных проблем со здоровьем человека: по всему миру около 40 млн. заражённых и более 600 млн. находятся в риске заражения [16]. Заболевания, вызванные O. viverrini и O. felineus являются серьезной проблемой общественного здравоохранения в таких странах как Таиланд, Лаос, Камбоджа, Вьетнам, где более 10 миллионов человек инвазированы в результате потребления рыбы, содержащей метацеркарии — возбудителей описторхоза [13]. Opisthorchis viverrini — эндемичный гельминтоз для территории долины реки Меконг. При этом возможен завоз возбудителя на территорию России при развивающейся торговле и туристических поездок.
Цель исследования— провести анализ на возможность возбудителей описторхоза как факторов риска для развития стадий канцерогенеза.
Материалы иметоды.: анализ обзора литературы и научных статей российских и зарубежных учёных за последние 10 лет.
Результаты иих обсуждение. Описторхоз — биогельминтоз, поражающий преимущественно гепатобилиарную систему и поджелудочную железу, отличающийся длительным течением, протекающий с частыми обострениями, способствующий возникновению первичного рака печени и поджелудочной железы. Возбудителями описторхоза являются: O. felineus, который приурочен к речным системам, занимающим пространство от бассейна реки Ангары до западной оконечности Европы; его подвид Opisthorchis felineus arvicola, распространенный в бассейне реки Шидерты в Казахстане; О. viverrini, охватывающий страны Южной и Юго-Восточной Азии (в Таиланде данным гельминтом поражено 80 % населения). Обь-Иртышский бассейн считается крупным, напряжённым и неблагоприятным очагом описторхоза. Около 600 случаев на 100 тыс. населения в Ханты-Мансийском автономном округе, 200 случаев на 100 тысяч населения в Тюменской области [5]. Инвазирование населения в Западной Сибири Opisthorchis felineus достигает 51,82 %, в отдельных районах свыше 95 % (). В Кемеровской области описторхоз занимает третье место по распространённости заболеваний гельминтозами среди населения со среднегодовой заболеваемостью 2138 человек (12 %) [1, 4, 8–10]. Причина такого распространения заключается в наличии чрезвычайно развитой речной поймы, обеспечивающей условия для циркуляции возбудителя болезни.
Первичный рак печени может быть представлен в двух вариантах — это гепатоцеллюлярная карцинома и холангиокарцинома [12]. Чаще первый вариант связан с инфекцией гепатита В и С. Холангиокарцинома считается фатальной опухолью и распространена в эндемичных районах присутствия возбудителя описторхоза. Рак может развиваться через 30–40 лет после заражения, а смерть наступает через 3–6 месяцев после постановки диагноза [11, 17].
Находясь вблизи эпителия желчных протоков и продуцируя продукты своего метаболизма, являющиеся токсичными и иммуногенными для организма человека, описторхи вызывают гиперплазию эпителия желчного протока. А механическое повреждение во время процессов присасывания описторхов, отрыве эпителия и миграции паразита приводит к изъязвлению ткани. Яйца гельминтов проникая в ткани вызывают гранулематозное воспаление. Инфильтрация воспалительными клетками связана с присутствием антигенов гельминта. Гиперплазию и воспалительный процесс относят к предопухолевым состояниям. Немалую роль играют активные вещества, такие как NO, а также кислородные радикалы, такие как супероксид (O2–), вырабатывающиеся в хронически воспаленных тканях в качестве иммунного ответа. NO увеличивает возможность канцерогенеза через ингибирование репарации ДНК [18]. Продукты окисления липидов могут реагировать с основаниями ДНК с образованием аддуктов. Эти поражения могут инициировать канцерогенез посредством специфических замен пар оснований. Факторы риска, связанные с образом жизни (алкоголь, курение), могут взаимодействовать с эффектами инвазии и усиливать потенциальные канцерогенные эффекты.
В 2009 году O. viverrini признан Международным агентством по исследованию рака как биологический канцероген 1-й группы в 2009 [17]. Канцерогенная роль O. felineus еще недостаточно изучена [19]. Однако жизненные циклы, морфология, локализация в организме человека O. viverrini и O. felineus схожи.
Празиквантел (Билтрицид) считается эффективным препаратом при химиотерапии описторхоза [14]. Микроморфологические и гистохимические исследования подтверждают действие празиквантела на организм описторхов и их яйцепродукцию [2, 7].
Выводы. Описторхоз — серьёзная проблема здравоохранения, т. к. описторхи кроме основного заболевания — гельминтоза, паразитируя в гепатобилиарном тракте, продуцируя токсичные и иммуногенные продукты жизнедеятельности, нарушая метаболизм клеток, способствуют развитию канцерогенеза, являясь факторами развития его стадий.
Основные термины (генерируются автоматически): возбудитель описторхоза, заболевание, население, организм человека, первичный рак печени, поджелудочная железа, Таиланд.
Читайте также:

