Определение одного антигена одного инфекционного агента
Обновлено: 18.04.2024
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
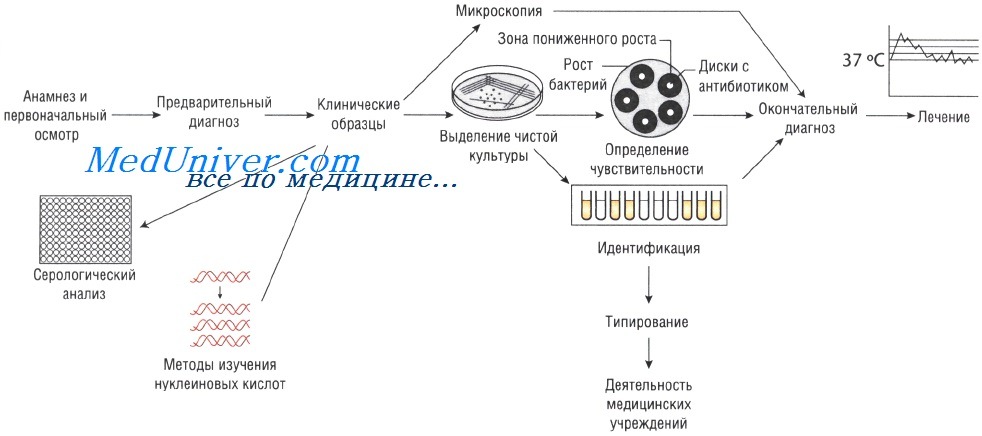
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Антигены и антитела. Серологические реакции между антигенами и антителами.
Антигены – генетически чужеродные вещества, которые при введении в организм животного или человека вызывают специфический иммунный ответ — синтез антител, формирование сенсибилизированных Т-лимфоцитов, иммунологической памяти или толерантности. Под чужеродными веществами понимаются химические структуры, которых нет в организме. Инородными для организма человека являются вирусы, микроорганизмы, а также клетки, ткани, органы животных и других людей. Антигены имеют несколько рецепторов для связи с антителами и способны вступать в реакцию с ними как в организме животного или человека (in vivo), так и вне организма – в пробирке (in vitro).
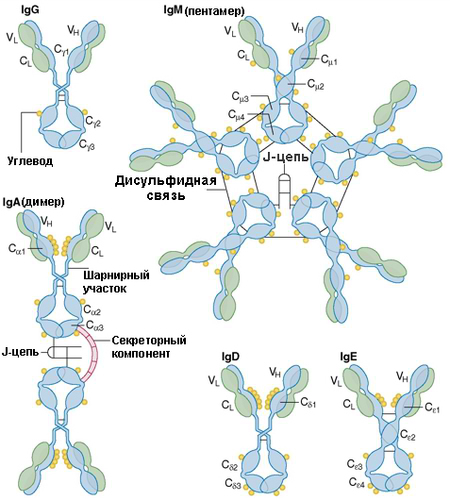
Антитела - высокомолекулярные белки глобулиновой фракции сыворотки крови. Антитела синтезируются под влиянием антигена и способны специфично реагировать (соединяться) с соответствующим антигеном. Все антитела имеют характерную структуру иммуноглобулинов; отличаются по иммунологическим, биологическим и физическим свойствам; и делятся на 5 классов – ІgG , ІgА, ІgМ, ІgD и ІgЕ.
Серологические реакции
В лабораторной практике используют серологические реакции — лабораторные реакции между антигенами и антителами, которые приводят к регистрируемым изменениям в исследуемой системе. Эти реакции получили название серологических, так как для их постановки используют сыворотку (serum), содержащую антитела.
Серологические исследования, выполняемые для обнаружения специфических антител и антигена возбудителя при инфекционных заболеваниях, — более доступные методы лабораторной диагностики, чем бактериологическое выявление возбудителя. В ряде случаев серологические исследования остаются единственным методом диагностики инфекционных заболеваний.
Некоторые методы определения антител, используемые в лабораторной практике
1. Реакция связывания комплемента
Комплемент - это система белков плазмы крови, которая включает в себя 9 компонентов указанных буквой С (С1, С2, С3. С9), фактор В, фактор D и ряд регуляторных белков. Некоторые из этих компонентов состоят из 2 - 3 белков, например С1 - это комплекс из трех белков. Эти белки циркулируют в кровеносном русле и присутствуют на мембранах клеток. Комплемент является важнейшей системой как врождённого, так и приобретённого иммунитета. Эта система предназначена для защиты организма от действия чужеродных агентов и участвует в реализации иммунного ответа организма. Комплемент был открыт в конце 19-го столетия бельгийским ученым Ж. Борде.
Реакция связывания комплемента (РСК) – серологическая реакция, используемая для количественного определения комплементсвязывающих антител и антигенов. Впервые описана Борде и Жангу (Bordet - Gengou) в 1901 году. РСК основана на том, что комплекс "антиген - антитело" способен поглощать комплемент, который добавляют в реакционную смесь. При соответствии друг другу антигенов и антител они образуют иммунный комплекс, к которому присоединяется комплемент. Специфический иммунный комплекс адсорбирует комплемент, добавленный в систему, т.е. происходит связывание комплемента комплексом антиген - антитело. Чем больше антител, тем больше фиксируется комплемента. Если же комплекс "антиген - антитело" не образуется, то комплемент остается свободным.
Сложность РСК состоит в том, что реакция образования комплекса "антиген - антитело – комплемент" невидимая. Для выявления компонентов реакции используют дополнительную индикаторную гемолитическую систему. С помощью реакции гемолиза проводится количественное определение остатка комплемента после окончания реакции антигена с антисывороткой.
Реакцию связывания комплемента (РСК) используют для выявления антител на определенный антиген или определяют тип антигена по известному антителу. В этой сложной серологической реакции участвуют две системы и комплемент. Первая система - бактериологическая (основная), состоит из антигена и антитела. Вторая система - гемолитическая (индикаторная). В нее входят эритроциты барана (антиген) и соответствующая им гемолитическая сыворотка (антитело).
РСК ставят в два приема: вначале соединяют антиген с испытуемой сывороткой крови, в которой отыскивают антитела, а затем добавляют комплемент. Если антиген и антитело соответствуют друг другу, то образуется иммунный комплекс, который связывает комплемент. При отсутствии в сыворотке антител иммунный комплекс не образуется и комплемент остается свободным. Поскольку процесс адсорбции комплемента комплексом визуально невидимый, то для выявления этого процесса добавляют гемсистему.
В связи с высокой чувствительностью реакция связывания комплемента (РСК) применяется как для серологической диагностики бактериальных и вирусных инфекций, аллергических состояний, так и для идентификации антигенов (выделенной бактериальной культуры).
2. Реакция преципитации
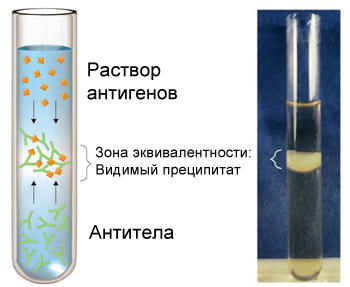
Реакция преципитации (РП) (от лат. praecipitatio – выпадение осадка, падение вниз) основана на выпадении в осадок специфического иммунного комплекса, состоящего из растворимого антигена и специфического антитела в присутствии электролита. В результате реакции образуется мутное кольцо или рыхлый осадок – преципитат. Реакция преципитации происходит между водорастворимым антигеном и антителом, получаются крупные комплексы, которые выпадают в осадок
3. Реакция флоккуляции
Реакция флоккуляции (по Рамону) (от лат floccus - хлопья шерсти, flocculi – клочья, хлопья; flocculation – образование рыхлых хлопьевидных агрегатов (флокул) из мелких частиц дисперсной фазы) - появление опалесценции или хлопьевидной массы (иммунопреципитации) в пробирке при реакции токсин - антитоксин или анатоксин – антитоксин. Ее применяют для определения активности антитоксической сыворотки или анатоксина.
4. Реакция агглютинации
Агглютинация (от лат. agglutinatio — склеивание) – это реакция взаимодействия антигена со специфическим антителом, которая проявляется в виде склеивания. При этом антигены в виде частиц-корпускул (микробные клетки, эритроциты и др.) склеиваются антителами и выпадают в осадок (агглютинат) в виде хлопьев. Агглютинаты обычно видны невооруженным глазом. Для появления реакции необходимо присутствие электролитов (например, изотонического раствора хлорида натрия), ускоряющих процесс агглютинации.
С помощью реакции агглютинации (РА), reactio agglutinationis (англ. agglutination test) выявляют антитела или корпускулярные антигены. В зависимости от вида используемого иммунодиагностикума различают реакцию микробной агглютинации, гемагглютинации, латексагглютинации, коаглютинации и т.д.
5. Название антител, участвующих в осадочных реакциях
Антитела, участвующие в осадочные реакциях, получили традиционное название по своему взаимодействию с антигеном:
агглютинины – вызывают склеивание корпускулярного антигена – агглютиногена и осаждение комплекса антиген - антитела (агглютината);
В лизирующих реакциях участвуют бактериолизины (вызывают лизис бактерий) и гемолизины (вызывают лизис эритроцитов).
Взаимодействие антител с антигеном. Взаимодействие АТ и Аг. Классы иммуноглобулинов ( Ig ). Классификация иммуноглобулинов ( Ig ). Ig M. Иммуноглобулин M.
Взаимодействие антител с антигеном включает специфическую и неспецифическую фазы.
• Специфическая фаза протекает быстро и представляет специфическое взаимодействие активного центра с Аг.
• Неспецифическая фаза протекает медленнее, зависит от присутствия электролитов и свойств Аг. Корпускулярные Аг агрегируются в крупнодисперсные конгломераты и выпадают в осадок (феномен агглютинации).
Растворимые Аг образуют мелкодисперсные конгломераты (феномен преципитации), проявляющиеся помутнением раствора или образованием колец преципитации либо зон преципитации в гелях.
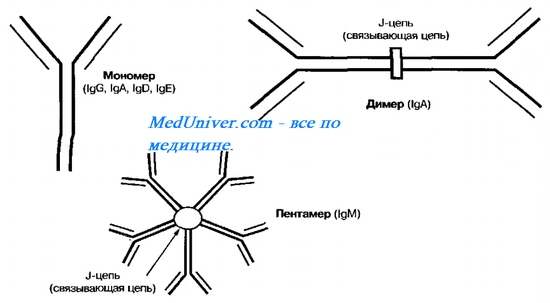
Рис. 10-9. Организация молекул иммуноглобулинов ( Ig ) различных классов. IgD, IgE, IgG представлены в форме мономеров, IgA — моно- и димеров, IgM — пентамеров.
Классы иммуноглобулинов ( Ig ). Классификация иммуноглобулинов ( Ig ).
Константные участки лёгких цепей бывают двух типов — каппа (к) и ламбда; константные участи тяжёлых цепей представлены пятью основными формами — мю (р), гамма (у), дельта (8), альфа (а) и эпсилон (е). Каждая из них ассоциирована с отдельным классом Ig. Выделяют 5 классов AT: IgA, IgD, IgE, IgG и IgM (рис. 10-9, табл. 10-8).
Молекулы lgG, IgD и IgE представлены мономерами, IgM — пентамерами; молекулы IgA в сыворотке крови — мономеры, а в экск-ретируемых жидкостях (слёзная жидкость, слюна, секреты слизистых оболочек) — димеры.
IgM синтезируются при первичном попадании Аг в организм. Пик образования приходится на 4-5-е сутки с последующим снижением титра. Образование IgM к некоторым А г (например, жгутиковым Аг бактерий) осуществляется постоянно. К IgM относят значительную часть AT, вырабатывающихся к Аг грамотрицательных бактерий.
Наличие IgM к Аг конкретного возбудителя указывает на острый инфекционный процесс.
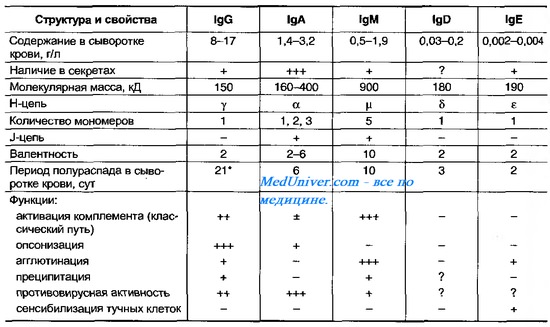
Таблица 10-8. Основные свойства иммуноглобулинов ( Ig )
Молекула IgM — пентамер; пять субъединиц соединены J-цепью [от англ. joining, связывающий], в результате чего молекула IgM приобретает 10 Аг-связывающих участков.
Молекулы IgM опсонизируют, агглютинируют, преципитируют и лизируют содержащие Аг структуры, а также активируют систему комплемента по классическому пути (для комплементзависимого лизиса бактерии достаточно одной молекулы IgM).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Антиген ( Аг ) представляющие клетки. Иммунные реакции. Классификация имунных реакций. Антигены. Свойства антигенов. Структура антигенов ( Аг ). Валентность Аг.
Иммунные реакции. Классификация имунных реакций
Большинство иммунных реакций требует взаимодействия Аг-распознающих, Аг-представляющих, эффекторных и регуляторных клеток. Иммунные реакции традиционно разделяют на гуморальные (реализуются циркулирующими в средах организма AT) и клеточные (реализуются при непосредственном контакте иммунокомпетентных клеток). Вместе с тем все иммунокомпетен-тные клетки — компоненты единой иммунной системы. Поэтому такое разделение носит условный характер, тем более, что AT синтезируются клетками (плазмоцитами), а Т-лимфоциты проявляют свою активность через различные растворимые факторы (цитокины и хемокины).
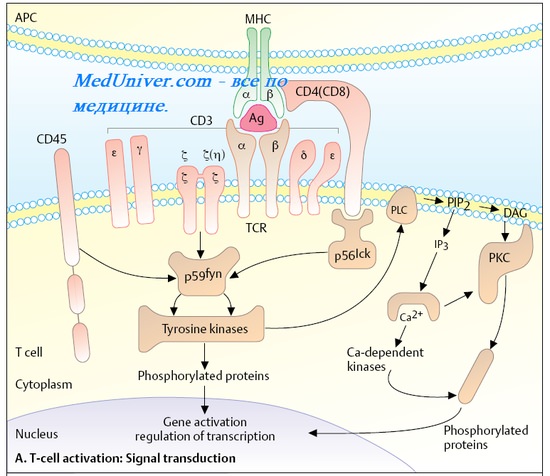
Антигены. Свойства антигенов. Структура антигенов ( Аг )
Антигены — вещества различного происхождения, несущие признаки генетической чужеродное™ и вызывающие развитие иммунных реакций (гуморальных, клеточных, состояние иммунной толерантности, индуцирование иммунной памяти). Свойства Аг определяются комплексом признаков: иммуногенность, антигенность, специфичность, чужеродность.
Способностью вызывать развитие иммунного ответа и определять его специфичность обладает фрагмент молекулы Аг — антигенная детерминанта (эпитоп), избирательно реагирующая с Аг-распознающими рецепторами и AT. Антигенные детерминанты располагаются в областях Аг, обращенных к его микроокружению.
Эпитоп — наименьшая распознаваемая единица Аг; молекула Аг может иметь несколько эпитопов, то есть быть поливалентной. Чем сложнее молекула Аг и чем больше у неё эпитопов, тем больше вероятность развития иммунного ответа. Структура многих антигенных детерминант известна. Например, в полипептидной последовательности эпитопом может быть фрагмент из 7-8 аминокислотных остатков; свойства антигенности и специфичности определяются также пространственной конфигурацией фрагмента.
Моноклональные AT специфически распознают только одну Аг-детерминанту и связываются с ней. Поликлональные AT, как правило, распознают несколько антигенных детерминант в составе Аг.
Валентность Аг
Белки содержат несколько Аг-детерминант. Количество молекул AT, связывающих все эпитопы, определяет валентность Аг (возрастает пропорционально увеличению молекулярной массы белковой молекулы).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:
- У каких червей впервые появилась кровеносная система у кольчатых червей или у круглых червей
- Освобождаются ли люди зараженные токсокарозом от работы
- Инфекция в околоплодных водах у беременных
- Как избавиться от лихорадки на губе за 1 день в домашних условиях
- Унифицированный клинический протокол инфекционный эндокардит

