Определение токсигенности возбудителя дифтерии проводят в
Обновлено: 24.04.2024
Для данного исследования лаборатория принимает следующий биоматериал:
- Мазок/отделяемое ротоглотки
- Мазок/отделяемое носоглотки
- Мазок/отделяемое носовых ходов
Возможны ограничения в приеме биоматериала. Уточняйте информацию в расписании нужного Вам офиса.
Подготовка к исследованию
Внимание! Для хранения и транспортировки биологического материала лаборатория CMD предоставляет специальные расходные материалы: коллектор без транспортной среды и коллектор транспортный с жидкой средой Эймса (зонд-тампон для отбора из узких полостей или зонд-тампон стандартный). Перед обращением к врачу их необходимо получить в ближайшем офисе.
Условия подготовки определяются лечащим врачом.
Взятие материала рекомендуется проводить:
- до начала антибактериальной терапии или не ранее чем через две недели после ее окончания;
- для ротоглотки. Натощак или через 4 часа после еды (не полоскать рот и не пить);
- для носовых ходов. если полость носа заполнена слизью, перед процедурой рекомендуется провести высмаркивание.
Внимание! При взятии биоматериала обязательно используются оба коллектора для каждой локализации. Предварительно на коллекторе указать локализацию.
Доставка в лабораторию в день взятия биоматериала при Т=+2+25 °С в коллекторе. Замораживание образцов недопустимо!
Метод исследования
Corynebacterium diphtheriae (палочки Леффлера) – возбудители дифтерии, характеризующейся фибринозным воспалением в месте входных ворот инфекции и токсическим поражением преимущественно сердечно-сосудистой и нервной систем. Наиболее частая форма – дифтерия ротоглотки (дифтерийная ангина), а при локализации воспаления на гортани или трахее может развиться дифтерийный круп. Основной путь передачи воздушно-капельный. Заражение происходит от больных или бактерионосителей.
Культуральные исследования выполняются с применением высококачественных транспортных и питательных сред ведущих мировых производителей. Идентификацию выделенных микроорганизмов проводят классическим бактериологическим методом с использованием современных тест-систем и определением токсигенности возбудителя.
Показания к исследованию:
- Обследование лиц с подозрением на дифтерию;
- Обследование контактных лиц;
- Оценка эффективности антибактериальной терапии.
Результат бактериологического исследования, в случае обнаружения возбудителя дифтерии (Corynebacterium diphtheriae) предоставляется в качественном формате.
Интерпретация проводится врачом с учетом клинических проявлений.
При единовременном заказе нескольких услуг, услуга по сбору биоматериала оплачивается только один раз.
Группа коринебактерий включает представителей родов Corynebacterium представленные неподвижными палочковидными бактериями, способными к ветвлению.
Коринебактерии. Corynebacterium diphtheriae
Род Corynebacterium семейства Corynebacteriaceae отдела Firmicutes образуют неподвижные прямые или слегка изогнутые палочки, окружённые микрокапсулой. Большинство видов коринебактерий — облигатные паразиты слизистых оболочек — патогенные и условно-патогенные для животных и человека виды.

Возбудитель дифтерии. Дифтерийная палочка ( палочка Клебса-Лёффлера ). Дифтерия. Гаротильо
Дифтерия — острое инфекционное заболевание, вызываемое Corynebacterium diphtheriae и её токсином. Дифтерийные палочки вызывают воспаление воздухоносных путей, реже кожных покровов. Токсин палочки Клебса-Лёффлера приводит к дегенерации периферических нервов, сердечной мышцы и других тканей.
Возбудитель дифтерии — Corynebacterium diphtheriae; впервые его выделил Э. Клебс (1883), а чистую культуру возбудителя получил Ф. Лёффлер (1884).
Эпидемиология дифтерии. Распространенность палочки дифтерии
Резервуар дифтерии — человек (больной, реконвалесцент, бактерионоситель); наибольшую эпидемическую опасность представляют больные лица. Реконвалесценты выделяют дифтерийную палочку в течение 15-20 сут. Основной путь передачи дифтерийной палочки — воздушно-капельный; также возможно заражение через предметы, используемые больным, и инфицированные пищевые продукты (обычно молоко).
При комнатной температуре во влажной атмосфере палочка Клебса-Лёффлера сохраняется долго. При 60 °С дифтерийная палочка отмирает в течение 10 мин; в высушенных плёнках выдерживает температуру 98 "С в течение 1 ч, а при комнатной температуре может сохраняться до 7 мес.
На игрушках дифтерийная палочка сохраняется до 2 нед, в пыли — до 5 нед, в воде и молоке — до 6-20 сут, на рассеянном свету остаётся жизнеспособным до 8 ч. Дезинфектанты и антисептики инактивирутют возбудителя дифтерии в течение 5-10 мин.
Пик заболеваемости дифтерией приходится на осенне-зимние месяцы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Выявление дифтерийной палочки. Принципы микробиологической диагностики дифтерии. Диагностика дифтерии. Культивирование дифтерии. Определение токсигенности дифтерийной палочки.
С целью раннего выявления дифтерии и определения носителей дифтерийной палочки необходимы выделение и идентификация возбудителя, а также определение его способности к токсинообразованию. Материалом для исследования служат дифтеритические плёнки, слизь из носоглотки или отделяемое из подозрительных поражений кожных покровов.
Забор материала на дифтерию проводят двумя стерильными тампонами: один используют для посева, с другого делают мазки и окрашивают их по Граму и Найссеру. Взятый материал следует доставлять в лабораторию не позднее чем через 3 ч.
Бактериоскопия дифтерийной палочки
Окраска по Граму не является специфичной, так как дифтерийные палочки сравнительно плохо воспринимают красители, но позволяет косвенно идентифицировать непатогенные коринебактерии, располагающиеся в виде палисада (параллельно) или в виде китайских иероглифов. Окраска по Найссеру позволяет выявить характерные зёрна Бабеша-Эрнста и отличить дифтерийную палочку от ложнодифтерийной палочки С. pseudodiphtheriticum (С. hofmannii), часто обитающей в носоглотке.

Культивирование дифтерийной палочки
Бактерии дифтерии выделяют посевом на элективные среды с теллуритом (например, Клауберга II или Маклёода), ложнодифтерийная палочка (палочка Хофманна) теллур не восстанавливает (см. рис. 8 на вклейке). Для выделения чистой культуры дифтерии часть подозрительной колонии засевают на скошенный агар (или среду Ру), вторую часть — на твёрдую питательную среду для определения токсигенности и (не обжигая петли) проводят определение цистиназной активности (проба Пизу). При положительном результате наблюдают образование коричневого облачка вокруг линии укола. Чистую культуру идентифицируют на средах Хйсса, пользуясь укороченным пёстрым рядом (глюкоза, мальтоза, сахароза, мочевина), что позволяет отличить С. diphtheriae от непатоген пых коринебактерии (рис. 14-3).
Определение токсигенности дифтерийной палочки
Определение токсигенности дифтерийной палочки in vivo. Проводят подкожным или внутрикожным заражением 0,5-1,0 мл бактериальной культуры морских свинок массой 250 г. За 24 ч до заражения одно животное иммунизируют дифтерийным антитоксином. При положительном результате неиммунизированные животные погибают в течение 3-5 сут.
Фаготипирование дифтерийной палочки
Для дифференциальной диагностики возбудителей используют набор из 9 кори нефагов. С его помощью можно типировать большинство токсигенных и нетоксигенных штаммов биовара gravis.
Антигенная структура дифтерийной палочки
У Corynebacterium diphtheriae выделяют О- и К- антигены ( Аг ). Липидные и полисахаридные термолабильные фракции О-антигена ( Аг ) коринебактерий преимущественно представлены межвидовыми антигенами ( Аг ).
Поверхностные термолабильные К-антигены ( Аг ) (нуклеопротеиды, белки) обеспечивают видовую специфичность и проявляют выраженную иммуногенность. С помощью анти-К-сывороток дифтерийные бактерии разделяют на серологические варианты (около 58). Биовар mitis включает 40 сероваров, gravis — 14, intermedius — 4. В отечественной практике используют диагностические агглютинирующие, неадсорбированные сыворотки; в том числе полигрупповые и к сероварам для РА на стекле и в пробирках.
Патогенез поражений дифтерии
Ферменты дифтерии (гиалуронидаза, нейраминидаза, фибринолизин) обеспечивают проникновение возбудителя в различные ткани, включая кровоток. Однако (в отличие от токсинемии) бактериемия клинически не проявляется.
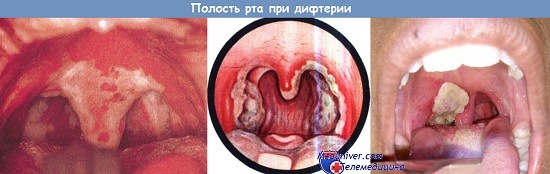
Дифтерия. Нёбные миндалины, нёбные дужки и нёбный язычок покрыты беловато-грязными пленками.
Отмечается изъязвление тканей. Форсированное оттеснение языка позволяет увидеть надгортанник (пленки на нем отсутствуют).
Клинические проявления дифтерии. Клиника дифтерии. Признаки дифтерии
Продолжительность инкубационного периода дифтерии 2-12 сут. В клинической картине дифтерии выделяют сменяющие друг друга период манифестных проявлений фибринозного процесса и ранних токсических осложнений (первые 5-10 сут), период поздних токсических осложнений (не обязательный, с 10-12 сут до 6 нед), период реконвалесценции (2-3 мес после исчезновения проявлений).
В зависимости от локализации дифтерии выделяют поражения ротоглотки (наиболее часто), дыхательных путей, носа и редкой локализации (глаза, наружные половые органы, кожа, раневые поверхности).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Дифтерию вызывают токсигенные штаммы Corynebacterium diphtheriae или палочки Леффлера, не токсигенные штаммы заболевания не вызывают. Дифтерийный токсин по своим свойствам относится к сильнодействующим ядам, уступая лишь ботулитическому и столбнячному. Под воздействием токсина нарушается синтез белков во внутренних органах больного, что приводит к структурным и функциональным нарушениям, демиелинизация нервных волокон – к параличам и парезам. Способность к токсинообразованию проявляют лишь лизогенные штаммы C.diphtheriae, инфицированные бактериофагом (р-фаг), несущим ген tox, кодирующий структуру токсина дифтерии. Передача бактериофагом гена tox нетоксигенным штаммам C.diphtheriae, обитающим в носоглотке и накопление их в популяции, может сопровождаться развитием вспышки дифтерии.
Наиболее таксономически близкими к виду C.diphtheriae являются C.ulcerans и C.рseudotuberculosis, природные патогены крупного и мелкого рогатого скота, лошадей. Кроме того, на слизистой ротоглотки и носа часто встречается палочка Гофмана (C.pseudodiphtheriticum), не обладающая патогенностью и токсигенностью для человека. Поэтому основной задачей лабораторной диагностики дифтерии является выявление токсигенных штаммов дифтерии и дифференцировка возбудителя дифтерии от других коринебактерий, нормальных обитателей носо- и ротоглотки. Все микроорганизмы рода Corynebacterium – грамположительные полиморфные палочки, не образующие спор, хорошо растущие в аэробных условиях при 37°С. При окраске метиленовым синим в клетках C.diphtheriae отмечается внутриклеточная исчерченность, что объясняется наличием зерен волютина. Окраска по Граму не используется из-за вариабельности окрашивания клеток. По форме колоний и некоторым биохимическим свойствам C.diphtheriae подразделяются на культурально-биохимические варианты – gravis, mitis, intermedius, однако все они обладают способностью вырабатывать дифтерийный токсин. Тяжесть течения заболевания не связана с биохимическим вариантом C.diphtheriae. Токсигенные штаммы дифтерии более чувствительны к антибиотикам, чем не токсигенные.
Показания к обследованию
- Профилактическое обследование – выявление источников инфекции, группы населения с повышенным риском заболевания; наблюдение за циркуляцией токсигенных штаммов в популяции; лица, поступающие в детские дома, школы интернаты, специализированные учреждения для детей и взрослых;
- обследования по эпидемическим показаниям – лица с подтвержденным контактом с больным дифтерией или при эпидемии дифтерии в данной местности;
- диагностические исследования – при подозрении на заболевание дифтерией (тонзиллит, назофарингит или ларингит который протекает с налетами псевдомембранозного характера).
Дифференциальная диагностика. Заболевания, сопровождающиеся тонзиллитом (инфекционный мононуклеоз, ангины стрептококковой, стафилококковой этиологии и др.).
При культуральных исследованиях возбудитель C.diphtheriae дифференцируется от других коринебактерий, в первую очередь C.pseudodiphtheriticum, C.ulcerans, C.pseudotuberculosis.
Материал для исследований
- Мазок из ротоглотки и носа, при подозрении на дифтерию редких локализаций (глаз, рана, ухо и т.д.) – материал с пораженных участков, а также с миндалин и носа – культуральные исследования, обнаружение специфического фрагмента гена tox;
- сыворотка крови – выявление АТ.
Этиологическая лабораторная диагностика включает посев клинического материала с изучением токсигенных свойств на среде для определения токсигенности и биохимической идентификацией возбудителя, обнаружение АГ (дифтерийного токсина), выявление специфических АТ к дифтерийному токсину, обнаружение специфического фрагмента гена tox.
Сравнительная характеристика методов лабораторной диагностики и особенности интерпретации их результатов. Микроскопические исследования выполняют только для идентификации выделенной культуры. Микроскопия биологического материала не проводится.
Для посева используют материал соответствующих локализаций. Изучение токсигенных свойств на среде для определения токсигенности выполняют при использовании метода встречной иммунодиффузии токсина и антитоксических АТ в плотной питательной среде. При отсутствии линий преципитации на среде для определения токсигенности через 48 ч инкубации культура признается не токсигенной. Для биохимической идентификации используется тест с цистиназой (среда Пизу), определение уреазной и сахаролитической (сахароза, глюкоза, крахмал) активности.
Выдача ответа:
- при обнаружении специфических линий преципитации на среде для определения токсигенности через 24–48 ч, положительной пробе на цистиназу, отрицательной пробе на уреазу, характерных культуральных и биохимических свойств дается заключение о выделении токсигенного штамма C.diphtheriae принадлежащего к культурально-биохимическому варианту gravis, mitis;
- при отсутствии специфических линий преципитации на среде для определения токсигенности через 48 ч, положительной пробе на цистиназу, отрицательной пробе на уреазу, характерных культуральных и биохимических свойств дается заключение о выделении не токсигенного штамма C.diphtheriae принадлежащего к соответствующему культурально-биохимическому варианту;
- при наличии линий преципитации на среде для определения токсигенности, идентичных линиям контрольного штамма дифтерии, положительных проб на цистиназу, уреазу, ферментации глюкозы и крахмала, отсутствие ферментации сахарозы, отсутствие редукции нитратов в нитриты, культуру относят к виду C.ulcerans, токсигенный вариант;
- при выделении дифтероидов ответ выдается отрицательный.
При посеве возбудитель C.diphtheriae дифференцируется от других коринебактерий, в первую очередь C.pseudodiphtheriticum, C.ulcerans, C.pseudotuberculosis. Для выявления дифтерийного токсина используют методы РНГА или ИФА. Это исследование не является обязательным в практических бактериологических лабораториях, однако может использоваться как дополнительное для выдачи предварительного ответа. Метод также позволяет определить относительное (условное) количественное содержание токсина в исследуемой пробе.
Для выявления специфических АТ используют методы РПГА и РНГА. Метод РПГА используется для изучения напряженности противодифтерийного иммунитета. Условно-защитным титром АТ принят титр 1:20.
У больных определение титра АТ к АГ дифтерийной палочки в сыворотке крови методом РНГА проводится в двух пробах крови, собранных в начале заболевания и через 7–10 дней. Нарастание титра АТ в 3–4 раза во второй сыворотке относительно первой свидетельствует о перенесенной инфекции. Исследование используется преимущественно для ретроспективной диагностики дифтерии.
Обнаружение гена токсигенности (tox) методом ПЦР – наиболее быстрый и надежный метод лабораторной диагностики, однако он не дает информацию о способности микроорганизма к экспрессии дифтерийного токсина. Описаны случаи нетоксигенных штаммов дифтерии, несущих в себе
Читайте также:

