Основной метод диагностики протозойных инфекций
Обновлено: 23.04.2024
Микроскопический метод направлен на выявление паразитов в нативных и окрашенных препаратах. Материалом для исследования служат кровь, пунктаты грудины или лимфатических узлов, спинномозговая жидкость, соскоб с кожных элементов, фекалии, дуоденальное содержимое, отделяемое слизистой оболочки наружных половых органов или мочеиспускательного канала. Простейшие можно обнаружить как в мазках, так и в гистологических препаратах, изготовленных из пораженных тканей. Разработано значительное число методов окраски простейших, среди которых наиболее часто применяется метод Романовского-Гимза.
Серологический метод при протозойных инфекциях имеет вспомогательное значение. Применяется РА (американский трипаносомоз), РП (американский трипаносомоз, амебиаз), РСК (американский трипаносомоз, токсоплазмоз, висцеральный лейшманиоз, амебиаз), РИФ (американский трипаносомоз, малярия, токсоплазмоз, висцеральный лейшманиоз, амебиаз), РНГА (токсоплазмоз), ИФА (токсоплазмоз, тропическая малярия, амебиаз, кожный и висцеральный лейшманиозы, американский трипаносомоз).
Аллергический метод – кожные аллергические пробы применяются редко, обычно для подтверждения диагноза кожного лейшманиоза (проба с лейшманином, реакция Монтенегро) и токсоплазмоза (проба с токсоплазмином).
Биологический метод (биопроба) применяется для подтверждения диагноза ряда протозоозов, а также в научных целях. Чувствительными животными для дизентерийных амеб и балантидий являются 2-3-недельные крысята, морские свинки, котята, щенки, золотистые хомячки; для лямблий — мыши; для лейшманий белые мыши и хомяки; для американских трипаносом - морские свинки; для африканских трипаносом – мартышки; для токсоплазм - белые мыши. Заражение животных осуществляют парентерально, в слепую кишку при лапаротомии, через длинный пластмассовый зонд или путем скармливания животным исследуемого материала.
В течение 30 дней после заражения микроскопическому исследованию подвергают кровь животных, мазки-отпечатки из органов или гистологические препараты из пораженных тканей.
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ПРОТОЗОЙНЫХ ИНФЕКЦИЙ
Малярия
Возбудителями тропической малярии является Plasmodium falciparum, трехдневной малярии - Plasmodium vivax, четырехдневной малярии - Plasmodium malariae и трехдневной или овале-малярии - Plasmodium ovale. Малярийные плазмодии претерпевают половой цикл развития в организме комара рода Anopheles и бесполый цикл (шизогония – рис.41) — в организме человека, поражая сначала клетки печени (тканевая шизогония), а затем эритроциты (эритроцитарная шизогония).
Микроскопический метод. Кровь на наличие плазмодиев малярии исследуют на стадии эритроцитарной шизогонии путем микроскопии обычных мазков и толстой капли, окрашенных по Романовскому-Гимзе. Плазмодии, цитоплазма которых окрашена в голубой цвет, а ядро в вишнево-красный, находят в эритроцитах.
Бесполые (эритроцитарные) формы паразитов имеют некоторые морфологические особенности. В частности, мерозоит представляет собой круглую или овальную форму с небольшим участком цитоплазмы около ядра; кольцевидный трофозоит - одноядерную форма с узким ободком цитоплазмы, окружающим небольшую вакуоль; амебовидный трофозоит - одноядерную форму с различным количеством и величиной псевдоподий; шизонт содержит два или несколько ядер; морула характеризуется полным разделением ядра и цитоплазмы на мерозоиты.
Половые формы плазмодиев (гаметоциты или гамонты) не содержат вакуолей и псевдоподий. Мужские (микрогаметоциты) и женские (макрогаметоциты) формы отличаются по величине и структуре ядра, интенсивности окраски цитоплазмы и размерам.
При микроскопии тонкого мазка при малярии находят обычно кольцевидные трофозоиты. У P. vivax, P. malariae, P. оvale они имеют размеры от 2 до 4 мкм, занимают около 1/3 диаметра эритроцита. Ядра у трофозоитов P. vivax и P. malariae круглые, у P. ovale — неправильной формы, крупные; ободок цитоплазмы ровный, неширокий, суживается к ядру. Молодые кольцевидные трофозоиты P. falclparum мелкие (1,25-1,50 мкм), занимают примерно 1/6 часть диаметра эритроцита, имеют маленькое круглое ядро с тонким ободком цитоплазмы. Взрослые кольцевидные трофозоиты более крупные, занимают 1/3 диаметра эритроцита, ободок цитоплазмы толстый, резко суживающийся к ядру.
Амебовидные трофозоиты P. vivax отличаются разнообразием форм, размеров, наличием одной или нескольких псевдоподий, вакуолей, круглого или овального ядра, пигмента в виде темно-коричневых цитоплазматических зерен различной величины и формы. Амебовидные трофозоиты P. malariae округлые и овальные (нередко в виде ленты поперек эритроцита с продолговатым или вытянутым ядром), с короткими и широкими псевдоподиями, более темной цитоплазмой и пигментом, ядром неправильной формы.. Амебовидные трофозоиты P.falciparum в виде круглых или

Рис. 41. Основные стадии эритроцитарной шизогонии малярийных плазмодиев
овальных форм лишены вакуоли, имеют ядро круглой или неправильной формы, пигмент черного цвета, расположенный компактно, однако они, как правило, в периферической крови не обнаруживаются. Молодые трофозоиты P. ovale имеют кольцевидную форму, более взрослые сходны с P. malariae.
Размеры шизонтов у возбудителей малярии увеличиваются по нарастающей в ряду P.vivax, P. ovale, P.falciparum.
Эритроциты, пораженные P. vivax и P. ovale, увеличиваются в диаметре до 10-12 мкм, хуже окрашиваются по Романовскому —Гимзе; эритроциты, пораженные P. ovale, могут приобретать неправильную форму, иметь бахромчатый край. Морфология эритроцитов, содержащих P. malariae и P. falciparum, не меняется.
В эритроцитах, содержащих P. vivax на различных стадиях развития, выявляются множественные мелкие азурофильные зерна (зернистость Шюффнера), при наличии в эритроцитах P. ovale зерна редкие и крупные (зернистость Джеймса), при обнаружении в эритроцитах кольцевидных трофозоитов P.falciparum можно выявить небольшое количество крупных азурофильных зерен (зернистость Маурера), а в тех случаях, когда возбудителем является P. malariae, в эритроцитах выявляют мелкую зернистость Циманна.
Морфология возбудителей малярии в толстой капле. Кольцевидные трофозоиты P. vivax, P. ovale, P. malariae обычно имеют одинаковую величину, однако в толстой капле они часто дефор-
мируются, превращаясь в форму запятой или восклицательного знака; цитоплазма при этом концентрируется около ядра в виде округлого или треугольного комочка. Наряду с кольцевидными трофозоитами можно найти другие формы плазмодиев и определить вид возбудителя.
Для амебовидных трофозоитов P. vivax в толстой капле характерна деформация их цитоплазмы в виде двух или нескольких комочков, располагающихся около ядра.
Трофозоиты P. malariae в мазке выглядят как компактные овальные или округлые образования с большим количеством пигмента.
Женские гаметоциты (гамонты) P. vivax и P. malariae в толстой капле не удается отличить от взрослых трофозоитов. Мужские гаметоциты имеют крупное ядро, окруженное узким ободком бледно-голубой цитоплазмы с рассеянными по ней зернами пигмента. Гаметоциты P. falciparum имеют характерную полулунную форму.
Серологический метод - определение антител к плазмодиям малярии с помощью РИА или ИФА с диагностическими целями проводится редко.

Протозойные заболевания или протозоозы - это заболевания, вызванные простейшими микроорганизмами. Такие инфекции могут быть системными (поражать весь организм) и кишечными (поражают желудочно-кишечный тракт).
К системным протозоозам относятся малярия, бабезиоз, лейшманиоз, токсоплазмоз, трипаносомоз.
В этой статье мы поговорим о простейших, которые поражают желудочно-кишечный тракт и вызывают кишечные инфекции.
Кишечные простейшие передаются фекально-оральным путем. Встречаются простейшие, а соответственно и инфекции, вызванные ими, по всеми миру, но наиболее широко распространены в областях с плохими санитарно-гигиеническими условиями и контролем за состоянием воды. Токсоплазмоз, кстати, тоже передается орально-фекальным путем, но при этом не поражает ЖКТ (подробнее по ссылке). Некоторые простейшие могут распространяться половым путем, например при орально-анальных контактах. Несколько разновидностей простейших вызывают тяжелые инфекции у пациентов с ВИЧ-инфекцией в продвинутой стадии.
Наиболее важными кишечными протозойными патогенами являются лямблии и амебы, криптоспоридии, бластоцисты и др.
Многие патогенные и непатогенные микроорганизмы могут находиться в кишечнике в одно и то же время. При этом инфекции, вызванные кишечными простейшими, в большинстве случаев характеризуются либо бессимптомным течением, либо стертой клинической симптоматикой. Настороженность по поводу паразитарных заболеваний имеет место при хронических диареях, кожных высыпаниях неясной этиологии, в некоторых случаях при длительно сохраняющейся эозинофилии в крови.
Постановка диагноза основывается на сборе эпидемиологического анамнеза, на выявлении симптомов и физикального обследования, а также на результатах лабораторного исследования кала на простейшие, а при наличии возможностей - на антигены возбудителей (криптопроридии, амебы, лямблии) или выявление генетического материала простейших с помощью молекулярно-генетических методов.
Микроскопический анализ кала является скрининговым методом диагностики, но может потребовать повторных исследований, методов концентрации и специальных окрашиваний. Наиболее информативным в этом плане может быть анализ трехдневного кала с применением специальных методов обогащения, с интервалом в две недели при первом отрицательном результате. Два последовательных отрицательных результата исследования кала на я/гельминтов и простейшие с интервалом в 14 дней позволяют исключить паразитарную (и глистную) инвазию, и дообследоваться в другом направлении.
Entamoeba histolytica/E. dispar .
Кишечный амебиаз распространен повсеместно, преимущественно в Центральной Америке, западной Южной Америке, Западной и Южной Африке и на индийском субконтиненте. В развитых странах большинство случаев происходит среди недавних иммигрантов и туристов, вернувшихся из эндемичных областей. Амебиаз является третьей по распространенности причиной смерти от паразитозов после малярии и шистосомоза.
Разновидностей амеб множество, но наиболее часто выявляются E.histolytica и E. dispar. Принято считать, что E.dispar непатогенна, но при ее выявлении в совокупности с клинической картиной заболевания, необходимость лечения рассматривается индивидуально.
Человек инфицируется при заглатывании цист с пищей или водой, или при оральных сексуальных контактах. После попадания в организм человека из цисты выходит трофозоит, который по мере продвижения по кишечнику может либо проникать в ткани кишечника, либо выводиться с калом (как в виде цист, так и в виде трофозоитов). Для заражения опасны только цисты.
В 90% случаев течение болезни бессимптомное. Если все же есть клиническая картина, то она может варьировать от легкой диареи до тяжелой дизентерии (боль в животе, диарея с кровью и слизью, снижение веса, повышение Т тела) и даже вызывать опасные осложнения: перфорацию кишечника, кишечные кровотечения и др. К факторам риска тяжелого течения относятся молодой возраст, беременность, лечение кортикостероидами, злокачественные новообразования, недоедание и алкоголизм, а также ВИЧ-инфекция.
Амебная инфекция может стать хронической и проявляться в виде диареи с болью в животе, слизью, метеоризмом, потерей веса. Могут обнаруживаться безболезненные, пальпируемые скопления - амебомы - по ходу толстого кишечника.
При внекишечном амебиазе наиболее часто поражается печень (абсцесс печени). Симптомы включают боль или дискомфорт в области печени, иррадиирующие в правое плечо, неустойчивую лихорадку, потливость, озноб, тошноту, рвоту, слабость и потерю веса. Абсцесс может перфорировать в поддиафрагмальное пространство, правую плевральную полость, правое легкое, перикард.
Основным методом диагностики, помимо общеклинических исследований (при которых можно обнаружить лейкоцитоз, эозинофилию, повышение СОЭ, повышение уровня трансаминаз печени и др.) является микроскопия кала. При этом 3х-кратное исследование повышает чувствительность до 95%. Чувствительностью до 100% обладают иммунохроматографические методы, основанные на выявлении антигена амеб в кале, кроме того они позволяют дифференцировать E.dispar и E.Histolytica. Так же могут использоваться молекулярно-генетические методы - ПЦР, и серологические методы - определение наличия антител к амебам, но серологические данные нельзя интерпретировать отдельно от других.
Из инструментального обследования информативным может быть колоноскопия, при которой выявляются характерные изъязвления стенки кишечника, а дальше проводится биопсия и гистологическое исследование материала, где могут быть выявлены трофозоиты амеб.
При подозрении на внекишечный амебиаз используют Р-графию органов грудной клетки, УЗИ органов брюшной полости, КТ с контрастированием или МРТ.
Лечение проводится только после лабораторного подтверждения диагноза. И оно включает в себя несколько схем последовательно применяемых противомикробных препаратов (действующих как на ткани кишечника, так и в просвете кишечника), в зависимости от тяжести заболевания, формы (кишечная или внекишечная), индивидуальной непереносимости препаратов и другого-другого-другого.
Лямблиоз не менее широко распространен - лямблии наиболее часто обнаруживаются при исследовании кала. Пути передачи те же, инфицирование происходит при проглатывании цист. После попадания в организм из цист выходит трофозоит, который паразитирует в тканях тонкой кишки, дозревает, а затем выводится в окружающую среду с калом в виде цист.
Характер клинических проявлений у человека, вероятно, зависит от ряда факторов, включая вирулентность изолята, паразитарную нагрузку и иммунный ответ хозяина. Половина переносит без симптомов, 15 процентов выделяют цисты без симптомов (бессимптомная инфекция встречается как у детей, так и у взрослых, а бессимптомное выделение кист может длиться шесть месяцев и более), 35-45% отмечают клинические симптомы острой или хронической инфекции.
Острый лямблиоз: диарея, недомогание, стеаторея, спазмы в животе и вздутие, метеоризм, тошнота, снижение веса, рвота, лихорадка, запор, крапивница. Симптомы обычно развиваются после инкубационного периода от 7 до 14 дней. Возникновение острых желудочно-кишечных симптомов в течение одной недели после контакта вряд ли может быть связано с инфекцией Giardia . Симптомы могут длиться от двух до четырех недель.
Симптомы хронического лямблиоза могут включать: жидкий стул, но обычно не диарея, стеаторея, потеря веса (от 10 до 20 процентов веса тела), мальабсорбция, задержка роста, недомогание, усталость, депрессия, спазмы в животе, метеоризм, отрыжка. Проявления могут усиливаться и уменьшаться в течение многих месяцев.
Нарушение всасывания может быть причиной значительной потери веса, которая может возникнуть при лямблиозе. Даже в случаях бессимптомной инфекции может возникнуть нарушение всасывания жиров, сахаров, углеводов и витаминов. Это может привести к гипоальбуминемии и дефициту витаминов A, B12 и фолиевой кислоты. Приобретенная непереносимость лактозы встречается примерно у 40 процентов пациентов - клинически это проявляется обострением кишечных симптомов после употребления молочных продуктов. Восстановление может занять много недель даже после избавления от паразита.
Осложнения: мальабсорбция, потеря веса, у путешественников длительная диарея, у детей может привести к задержке роста. Редко - сыпь, крапивница, афтозные язвы и реактивный артрит или синовит, холецистит, холангит или гранулематозный гепатит. При этом лямблиоз не ассоциирован со смертностью даже у иммунокомпрометированных лиц.
Диагностика основана на обнаружении простейших (трофозоитов или цист) при микроскопии кала, на выявлении антигена лямблий в кале иммунохроматографическими методами, обнаружении генетического материала методом ПЦР. При подозрении на лямблиоз и получении 5 негативных результата исследования кала необходимо рассмотреть возможность исследования дуоденального содержимого. Стоит помнить, что на обнаружение паразита могут влиять прием антибактериальных, антацидных препаратов, а также обследования с использованием контрастных веществ.
Лечение проводится только при лабораторном подтверждении диагноза и при наличии клинических проявлений заболевания, лечение бессимптомных носителей осуществляется в случае, если они контактируют с беременными, с больными муковисцидозом, если это дети, посещающие ДДО или работники пищевой промышленности.
Спорообразующие простейшие (Cryptosporidium parvum, Isospora belli, Cyclospora cayetanensis, Mycrosporidia)
Жизненный цикл для всех спорообразующих простейших одинаков и начинается после проглатывания спор, из которых в тонком кишечнике высвобождаются спорозоиты и начинают активно размножаться в энтероцитах, а затем способствуют развитию новых спор, выделяющихся с калом после гибели энтероцитов. При паразитировании данных микроорганизмов значительно страдает архитектоника ворсинок, что нарушает всасывание.
Из всех спорообразующих наиболее изучены криптоспоридии - о них и пойдет речь.
Путь передачи - фекально-оральный, инфицирование при проглатывании цист с водой, пищей, от человека к человеку, от животных к человеку. Факторами риска тяжелого течения могут быть ВИЧ-инфекция, трансплантация органов, дефицит IgA, гипогаммаглобулинемия и прием иммунодепрессантов.
В 30% случаев встречается бессимптомное течение. У пациентов, у которых развиваются симптомы, инкубационный период обычно составляет от 7 до 10 дней (от 2 до 28 дней). Диарея, связанная с криптоспоридиозом, может быть острой или хронической, кратковременной, прерывистой или непрерывной, скудной или обильной, с водянистым стулом до 25 л/день. Часто пациенты отмечают недомогание, тошноту и анорексию, спастические боли в животе и субфебрильную температуру. У иммунокомпетентных людей болезнь обычно проходит без лечения в течение 10–14 дней, хотя может сохраняться дольше или рецидивировать после первоначального улучшения. У людей с ослабленным иммунитетом криптоспоридиоз может стать хроническим изнурительным заболеванием с постоянной диареей и значительным истощением. Наиболее подвержены риску люди, живущие с ВИЧ, не принимающие антиретровирусную терапию и имеющие низкий уровень СД4+ менее 100-50кл/мкл.
Диагностика основана на выявлении микроорганизмов при микроскопии кала, выявлении их генетического материала методом ПЦР, обнаружение антигенов криптоспоридий в фекалиях, гистологическом исследовании биоптатов слизистой оболочки кишечника.
Если пациент с иммунодефицитом, то лечение может вызвать некоторые трудности - чаще это длительная, комбинированная терапия, которая может не дать желаемых результатов. При наличии ВИЧ-инфекции у пациента следует незамедлительно начать антиретровирусную терапию, в некоторых случаев этого бывает достаточно, но все же иногда необходимо добавить и противопаразитарные препараты.
У иммунокомпетентных лиц лечение криптоспоридиоза не требуется, если только клинические проявления не длятся более двух недель.
Распространен повсеместно. Фекально-оральный путь передачи. У людей паразитирует в толстом кишечнике, чаще встречается у пациентов с ВИЧ-инфекцией. Патогенез развития заболевания изучен не до конца. Вопрос о том, действительно ли этот паразит является патогеном для человека, остается спорным. Выделение этого паразита с диареей у пациентов с трансплантацией почек и другими иммунодефицитами коррелирует, но практически не связано со смертностью. У людей с ВИЧ-инфекцией и бластоцистозом симптомы исчезают самопроизвольно или подтверждается другая их этиология.
Клинические проявления при бластоцистозе могут включать: диарею, тошноту, анорексию, спазмы в животе, вздутие живота, метеоризм, крапивницу и усталость. Обычно описывается водянистая диарея (может быть острой или хронической). Лихорадка обычно отсутствует.
Диагностика - микроскопия и ПЦР-исследование кала, а также культуральные методы.
Пациенты с обнаруженными бластоцистами в кале и без клинических проявлений не нуждаются в лечении. Если все же есть клинические проявления, то необходимо исключить другую их этиологию, и только в случае исключения другой этиологии рассматривается вопрос о лечение.
Балантидиаз человека наиболее распространен в тропических и субтропических регионах и развивающихся странах. Путь передачи фекально-оральный, при заглатывании цист при употреблении зараженной пищи или воды. Источником инфекции являются свиньи. Эксцистация происходит в тонкой кишке, паразит колонизирует подвздошную и толстую кишки, могут проникать в ткани, цисты формируются в просвете кишечника и выделяются с калом.
Большинство случаев протекает бессимптомно. Риск развития симптомов увеличивается при сопутствующей инфекционной патологии. Симптомы могут включать тошноту, рвоту, потерю веса, боль в животе и заметную диарею с примесью крови. Фульминантное течение заболевания с перфорацией кишечника возникает редко.
Диагноз инфекции B. coli устанавливается путем обнаружения трофозоитов или цист при исследовании кала или соскобах слизистой оболочки, полученных при колоноскопии или ректороманоскопии.
Оптимальный подход к лечению балантидиаза неясен. В целом, лечение целесообразно при симптоматическом течении инфекции. Если симптомы не исчезают после проведенной терапии, необходимо повторить исследование кала для исключения другой этиологии.
Ранее считалась комменсалом. Путь передачи фекально-оральный, инфекция ассоциирована с энтеробиозом.
Инфекция может быть симптоматической или бессимптомной. Общие симптомы включают боль в животе, острую и рецидивирующую диарею, тошноту, рвоту, метеоризм. D. fragilis может проявляться периферической эозинофилией и/или эозинофильным колитом. Диарея обычно длится 1-2 недели, тогда как боль в животе может сохраняться в течение 1-2 месяцев. Из-за очень высокой связи с острицами у некоторых пациентов также может проявляться анальный зуд, инфекции нижних мочевыводящих путей.
Диагноз ставится путем обнаружения трофозоитов при микроскопии образцов стула или с помощью молекулярно-генетических методов.
У бессимптомного человека обычно не требует лечения, но инфекции, вызванные D. fragilis, следует лечить, если организм обнаруживается как единственный патоген в образцах стула пациентов с абдоминальной болью или диареей более 1 недели.
Несколько непатогенных простейших обитают в кишечном тракте и могут быть идентифицированы в образцах стула, отправленных в клиническую лабораторию для исследования яиц и паразитов. Поскольку диагностическая лаборатория может сообщить об этих непатогенных паразитах, важно уметь различать организмы, требующие лечения, и организмы, которые этого не требуют.
Непатогенные простейшие можно разделить на две группы: амебы и жгутиковые.

Трипаносомоз - еще одно заболевание, вызываемое простейшими, а в частности простейшими рода Trypanosome.
Патогенными для человека являются T.brucei и T.cruzi, которые занимают различные территории и передаются разными насекомыми.
Трипаносомоз, вызываемый T.brucei, также называется африканским или сонной болезнью , из названия понятно, какой район для него эндемичен.
Различают две формы африканского трипанососмоза - гамбийскую (вызываемую T.b.gambiense, распространенную в Западной и Центральной Африке) и родезийскую (вызываемую T.b.rhodesiense, эндемичной для Восточной Африки).
Данные формы имеют свои особенности:
При гамбийском трипаносомозе основным хозяином является человек, а второстепенным свинья. Переносчиком возбудителя является муха цеце (обитает в зарослях растительности по берегам рек и ручьев, проявляет наибольшую активность в светлое время суток).
При родезийской форме основными хозяевами и источником инфекции являются животные (антилопы, крупный рогатый скот, овцы) и реже человек. Возбудителя родезийского трипаносомоза также переносят мухи цеце, но обитающие в саваннах и саванных лесах, более светолюбивые и менее требовательны к влаге.
Человек заражается при укусе мухи цеце, у которой в слюнных железах содержатся инвазионные формы трипаносом (это значит, что трипаносомоз - это трансмиссивное заболевание, но также существует вертикальная передача инфекции - от матери к плоду).
После укуса мухи трипаносомы размножаются в подкожно-жировой клетчатке (на месте входных ворот инфекции формируются шанкр), далее через несколько дней распространяются по лимфатическим и кровеносным сосудам и в дальнейшем продолжают паразитировать в органах и тканях, основные это лимфатическая система, центральная нервная система и сердце. Антитела, выработанные в ответ на внедрение паразита, подавляют его размножение, но в результате изменения комбинации гликопротеинов на своей поверхности трипаносомы могут ускользнуть от иммунного ответа хозяина и запустить новый цикл размножения, с чем связано чередование обострений и ремиссий заболевания.
Больной заразен, начиная с 10 дня после укуса и в течение всего времени клинических проявлений.
Клинические проявления имеют три стадии: кожная, гемолимфатическая и стадия поражения ЦНС. Клиническая картина родезийского трипаносомоза отличается более острым и тяжелым течением и ранним поражением центральной нервной системы, прогноз более тяжелый.
При кожной стадии папула может развиться на месте укуса мухи цеце в течение нескольких дней до 2 недель. Она развивается в темновато-красный, болезненный, плотный узелок, который может изъязвляться (трипаносомный шанкр). Шанкр чаще встречается при инфицировании T. b. rhodesiense, и у туристов, нежели коренного населения.
Гемолимфатическая стадия развивается в течение нескольких месяцев при инфицировании T. b. gambiense и нескольких недель - при заражении T. b. rhodesiense. Характерны перемежающаяся лихорадка, головные боли, озноб, мышечные и суставные боли, гиперестезия, лимфаденопатия и отек лица. У светлокожих пациентов может наблюдаться эритематозная сыпь в виде кольцевых эритем до 7-10 см в диаметре. Для гамбийской формы характерен симптом Уинтерботтома (увеличение лимфоузлов в заднем шейном треугольнике).
Стадия поражения ЦНС при гамбийской форме длится от нескольких месяцев до нескольких лет после начала острой болезни. При родезийской форме болезнь более быстрая, и поражение нервной системы часто происходит в течение нескольких недель. Поражение ЦНС вызывает постоянную головную боль, неспособность сконцентрироваться, поведенческие изменения (например, прогрессирующая усталость и безразличие), дневную сонливость, тремор, атаксию и в итоге кому. Без лечения смерть наступает в течение нескольких месяцев от начала заболевания в случае T. b. rhodesiense и в течение 2-3 лет в случае T. b. gambiense. Пациенты без лечения умирают в коме от истощения или вторичных инфекций.
Для диагностики трипаносомоза используется световая микроскопия крови (тонкий или толстый мазок) или пунктата лимфоузла. Концентрация трипаносом в крови часто низкая, поэтому различные концентрационные методики увеличивают чувствительность диагностических методов. Серологической обследование часто неинформативно.
Всем пациентам с африканским трипаносомозом должна быть выполнена люмбальная пункция и исследование спинномозговой жидкости для определения стадии заболевания. При вовлечении СМЖ в патологический процесс наблюдается повышение уровней лимфоцитов (≥ 6 клеток/мкл), общего белка и неспецифического IgM.
Лечение африканского трипаносомоза зависит от вида возбудителя и стадии заболевания.
Для предотвращения африканского трипаносомоза необходимо избегать эндемичных районов и предохраняться от укусов мух цеце. Следует носить закрытую одежду, использовать репелленты.
Американский трипаносомоз (или болезнь Шагаса) вызывается T.cruzi. Болезнь характеризуется хроническим течением с преимущественным поражением сердца, желудочно-кишечного тракта и нервной системы.
Трипаносома крузи передается клопами подсемейства Triatominae (поцелуйные клопы) и эндемична в Южной и Центральной Америке, Мексике, редко в США. К носителям, помимо людей, относятся домашние собаки, опоссумы, броненосцы, крысы, еноты и многие другие животные. Значительно реже происходит передача при употреблении в пищу зараженных инфицированными клопами или их испражнениями тростникового сока или пищи, трансплацентарно от инфицированной матери плоду либо при переливании крови или трансплантации органов от инфицированного донора.
Патогенез заболевания сходен с таковым для африканского трипаносомоза.
Клинически болезнь Шагаса протекает в трех стадиях: острая, латентная и хроническая.
Острая болезнь Чагаса в эндемичных районах обычно развивается у детей и может быть бессимптомной. Симптомы могут появляться через 1–2 недели после заражения. на месте внедрения паразита появляется эритематозное поражение кожи. Если место инвазии – конъюнктива, развивается односторонний периокулярный отек с конъюнктивитом и увеличением расположенных перед ушной раковиной лимфатических узлов (симптом Романьи).
Острая болезнь Чагаса смертельна у небольшого процента пациентов. К смерти приводят острый миокардит с сердечной недостаточностью или менингоэнцефалит. У остальных симптомы утихают без лечения.
Первичная острая болезнь Чагаса у пациентов ВИЧ-инфекцией в продвинутой стадии может протекать в тяжелой и нетипичной форме – не только с поражениями кожи, но и с развитием абсцесса головного мозга.
Латентная стадия не имеет никаких клинических проявлений и может быть выявлена только при скрининговом серологическом обследовании.
Хроническая болезнь Шагаса развивается у 20–30% пациентов после латентной фазы, которая может тянуться годы или десятилетия. Вероятнее всего этому способствует аутоиммунная реакция организма с преимущественным поражением сердца и желудочно-кишечного тракта.
Сердечные нарушения обычно манифестируют нарушениями проводимости, в том числе блокадой правой ножки пучка Гиса или блокадой передней ветви левой ножки пучка Гиса. Хроническая кардиомиопатия часто приводит к слабому расширению всех полостей сердца, апикальным аневризмам и прогрессированию поражения проводящей системы сердца. У пациентов наблюдается сердечная недостаточность, обмороки, внезапная смерть из-за блокады сердца, желудочковой аритмии или тромбоэмболии.
Поражение желудочно-кишечного тракта проявляется как мегаэзофагус - дисфагия, которая может привести к легочным инфекциям или к серьезной гипотрофии. Или мегаколон, который приводит к кишечной непроходимости.
Для диагностики во время острой фазы болезни информативен анализ тонкого и толстого мазков крови, микроскопия окрашенных препаратов пунктата лимфоузлов. Напротив, для латентной инфекции или хронической болезни характерно небольшое количество паразитов в крови, в связи с чем могут быть использованы методы концентрации. Серологические исследования могут использоваться как скрининговые, положительный результат требует дообследования.
Антипаразитарное лечение показано для всех случаев болезни в острой стадии, пациентам с врождённой формой болезни либо с реактивированной инфекцией, а также детям до 18 лет в латентной стадии заболевания. Чем моложе пациент и чем раньше начато лечение, тем с большей вероятностью оно приведёт к паразитологическому выздоровлению.
Эффективность лечения снижается по мере увеличения продолжительности инфекции, а побочные эффекты более вероятны у взрослых. Лечение рекомендуется проводить лицам в возрасте до 50 лет, если нет признаков прогрессирующего повреждения сердца или желудочно-кишечного тракта. В случае пациентов старше 50 лет лечение подбирают индивидуально, с учетом возможных рисков и пользы.
При появлении выраженных симптомов хронической болезни Шагаса со стороны сердечно-сосудистой или пищеварительной системы противопаразитарные препараты не рекомендуются.
Патогенетическая терапия включает лечение сердечной недостаточности, применение кардиостимуляторов при блокаде сердца, антиаритмических препаратов, трансплантацию сердца, расширение пищевода, инъекции ботулотоксина в нижний сфинктер пищевода и оперативные вмешательства при мегаколон.
Профилактика болезни Шагаса включает мероприятия, направленные на снижение численности клопов а также меры индивидуальной защиты, например сетки на кровать при необходимости ночевать в глиняном жилье.
Будьте здоровы, путешествуйте, но не забывайте о мерах индивидуальной защиты. И если все же не удалось избежать укусов мухи цеце или поцелуйного клопа - будьте внимательны к себе, ведь даже в течение нескольких месяцев и лет могут появиться признаки паразитарного заболевания. И Вы уже знаете, куда обратиться за помощью!
Услуги, упомянутые в статье*:
Микроскопическое исследование венозной крови методом концентрации на возбудителей филяриатозов и трипаносомозов (А26.05.010.s01)
Микроскопическое исследование крови методом толстой капли на возбудителей филяриатозов, трипаносомозов (А26.05.010.s02)
*Назначение и интерпретация результатов анализов должны проводиться только лечащим врачом

По данным Европейского регионального бюро ВОЗ, ежегодно во всем мире происходит более 340 миллионов новых случаев бактериальных и протозойных (вызываемых паразитами) инфекций, передающихся половым путем. В 2016 году организация зафиксировала 127 миллионов случаев хламидиоза, 87 миллионов случаев гонореи, 6,3 млн заболеваний сифилисом и 156 млн заболеваний трихомониазом. Как сегодня проходить диагностику ИППП?
Более 30 бактерий, вирусов и паразитов передаются половым путем. Чаще всего передаются восемь инфекций. Четыре из них вызывают излечимые заболевания: сифилис, гонорею, хламидиоз и трихомониаз, еще четыре — вирусы, которые вызывают неизлечимые вирусные инфекции: гепатит В, вирус простого герпеса, вирус иммунодефицита человека (ВИЧ) и вирус папилломы человека (ВПЧ). Часть из них поддается терапии: мы успешно лечим ВИЧ-инфекцию, вирус гепатита В, вирус простого герпеса, а против вируса папилломы человека эффективной терапии нет.
ИППП называют так, поскольку они передаются преимущественно через секс: вагинальный, анальный или оральный. Однако некоторые ИППП также могут передаваться контактным путем, через кровь или продукты крови, а также от матери к ребенку (сифилис, гепатит B, ВИЧ, хламидиоз, гонорея, герпес и ВПЧ). Например, по данным Центра по контролю и профилактике заболеваний (CDC) в США, в 2020 году зафиксировано почти 2100 случаев заболевания сифилисом у новорожденных младенцев.
Информация о том, что терапия ВИЧ-инфекции предотвращает передачу вируса ВИЧ-отрицательному партнеру повлияла на заболеваемость излечимыми инфекциями. В отношении ВИЧ-инфекции существует принцип Н=Н (Undetectable = Untransmittable или неопределяемый = не передающий). Если ВИЧ-позитивный человек принимает терапию и добился стабильного снижения вирусной нагрузки в крови, то он не может передать вирус своему половому партнеру. Кроме того, появилась доступная до- и постконтактная профилактика ВИЧ (ДКП/ ПКП) — это комбинации антиретровирусных препаратов, прием которых до или после потенциально рискованного полового акта значительно снижает вероятность инфицирования.
Имея эффективную профилактику заражения ВИЧ, люди перестали этого бояться и начали чаще практиковать незащищенный секс, что привело к увеличению риска передачи других ИППП, надежной защитой, против которой являлся презерватив.
Чем опасны излечимые инфекции, передающиеся половым путем
Излечимые ИППП в наше время крайне редко приводят к смерти человека, но они способны значительно снизить уровень качества его жизни. Отсутствие лечения гонококковых и хламидийных инфекций у женщин в 40% случаев приводит к воспалительным заболеваниям органов малого таза, что, в свою очередь, может привести к бесплодию.
Нелеченные ИППП у матерей ежегодно являются причиной глазных инфекций, ведущих к слепоте у 4000 новорожденных. Передача ИППП от матери ребенку во время беременности и родов может привести к мертворождению, недоношенности, сепсису, пневмонии, неонатальному конъюнктивиту и другим заболеваниям.
Герпес и сифилис могут увеличивать риск заражения ВИЧ в три и более раз, в случае если ВИЧ-позитивный партнер не знает о своем статусе или не принимает АРТ. Инфекция ВПЧ ежегодно вызывает 570 000 случаев рака шейки матки, из которых более 300 000 заканчиваются смертью пациентки.
Кому нужно проверяться на ИППП
Безусловно, проверку на ИППП необходимо проводить при появлении симптомов: выделений из половых органов и уретры, жжения при мочеиспускании или сексе и других проявлениях.
Однако нужно помнить, что многие инфекции, в том числе неизлечимые, нередко протекают бессимптомно. Чем раньше вы начнете терапию, тем меньше шансов остается у болезни нанести вред вашему организму, меньше шансов, что вы передадите инфекцию партнеру.
Регулярное обследование на ИППП необходимо проходить всем. Например, CDC рекомендует пройти анализ на ВИЧ людям в возрасте от 13 до 64 лет в рамках обычных медицинских обследований.
Людям, относящимся к уязвимым группам, рекомендуется проходить тестирование не реже одного раза в год.
Традиционно уязвимыми группами для ИППП, включая ВИЧ, считаются:
- Люди, употребляющие психоактивные вещества;
- Мужчины, практикующие секс с мужчинами (МСМ);
- Коммерческие секс-работники;
- Трансгендеры.
Кроме того, анализы на ИППП необходимо сдавать беременным женщинам и парам, планирующим беременность. Необходимо помнить, о том, что в группе риска также люди, подвергшиеся сексуальному насилию.
О регулярной проверке на ИППП не стоит забывать мужчинам и женщинам, у которых появился новый половой партнер или несколько партнеров.
Проверяться на ИППП необходимо всем, кто занимается сексом. Секс-презерватив=ИППП.
Как часто нужно проверяться на ИППП
ВОЗ допускает использование экспресс-тестов. Например, для тестирования на ВИЧ доступны высокоэффективные тесты по околодесенной жидкости. Однако положительные результаты подобных тестов необходимо проверять стандартными методами.
При тестировании на ВИЧ в лаборатории проводится анализ крови методом ИФА (иммуноферментный анализ), который необходим для выявления не самого вируса, а антител к нему. Однако даже после положительного результата его необходимо несколько раз перепроверить, в том числе используя метод иммунного блота и ПЦР (полимеразная цепная реакция).
Вирусный гепатит В (ВГВ) в хронической форме может протекать бессимптомно на протяжении многих лет. Обследование на наличие вирусного гепатита В необходимо проходить регулярно, но правильнее провести эффективную и безопасную прививку, что защитит вас от заражения в будущем. Также диагностика ВГВ очень важна для беременных женщин: вирус гепатита В может передаваться от матери ребенку.
Для выявления ВГВ необходимы лабораторные исследования, позволяющие выявить антигены и антитела, которые определяются на разных стадиях заболевания. Выбор оптимального исследования, соответствующего форме и стадии заболевания, определяет опытный специалист.

Препаратов для лечения ВПЧ пока не существует, но есть эффективная вакцина, которая защищает от рака, вызванного этим вирусом. Для обследования на ВПЧ ВОЗ рекомендует тестирование на наличие ДНК вируса методом ПЦР — это объективный и современный метод диагностики. При получении положительного результата врач определяет показания по дальнейшему обследованию для исключения последствий инфекции. С рекомендациями по частоте скрининга вы можете ознакомиться в нашем материале .
Вирус простого герпеса может передаваться не только половым, но и контактным путем, а также от матери ребенку. Для диагностики используются методы ИФА и ПЦР. В качестве диагностических материалов может использоваться кровь (ИФА), мазки со слизистой и содержимое герпетических пузырьков (ПЦР). Выбор оптимального метода диагностики, соответствующий стадии и форме болезни, осуществляет опытный врач.
Для диагностики сифилиса приоритетными являются серологические методы исследования крови, нетрепонемные и трепонемные тесты, которые выявляют в том числе скрытые формы болезни. Следует подчеркнуть, что в диагностике сифилиса возможны ложноположительный и ложноотрицательные тесты. В частности, ложноположительную реакцию может вызвать бактерия-спирохета Borrelia и другие бактерии, антитела к возбудителям которых близки по строению к антителам возбудителя сифилиса.
Гонорея и хламидиоз выявляются при помощи исследовании мочи, урологического соскоба или мазка из шейки матки у женщин. Скрининг важен, даже если у вас нет явных симптомов заболевания.
Верификация диагноза трихомониаз происходит на основании лабораторного исследования отделяемого уретры и влагалищного отделяемого микроскопическим методом, а также соскоба со слизистых оболочек уретры и влагалища методом ПЦР, либо путем бактериологического посева отделяемого уретры и влагалища.
Врач-дерматовенеролог, косметолог, к.м.н. Анна Викторовна Шаропина
Медицинский редактор:
Руководитель Университетской клиники, к.м.н., врач-инфекционист
Коннов Данила Сергеевич.
Микроскопический метод направлен на выявление паразитов в нативных и окрашенных препаратах. Материалом для исследования служат кровь, пунктаты грудины или лимфатических узлов, спинномозговая жидкость, соскоб с кожных элементов, фекалии, дуоденальное содержимое, отделяемое слизистой оболочки наружных половых органов или мочеиспускательного канала. Простейшие можно обнаружить как в мазках, так и в гистологических препаратах, изготовленных из пораженных тканей. Разработано значительное число методов окраски простейших, среди которых наиболее часто применяется метод Романовского-Гимза.
Серологический метод при протозойных инфекциях имеет вспомогательное значение. Применяется РА (американский трипаносомоз), РП (американский трипаносомоз, амебиаз), РСК (американский трипаносомоз, токсоплазмоз, висцеральный лейшманиоз, амебиаз), РИФ (американский трипаносомоз, малярия, токсоплазмоз, висцеральный лейшманиоз, амебиаз), РНГА (токсоплазмоз), ИФА (токсоплазмоз, тропическая малярия, амебиаз, кожный и висцеральный лейшманиозы, американский трипаносомоз).
Аллергический метод – кожные аллергические пробы применяются редко, обычно для подтверждения диагноза кожного лейшманиоза (проба с лейшманином, реакция Монтенегро) и токсоплазмоза (проба с токсоплазмином).
Биологический метод (биопроба) применяется для подтверждения диагноза ряда протозоозов, а также в научных целях. Чувствительными животными для дизентерийных амеб и балантидий являются 2-3-недельные крысята, морские свинки, котята, щенки, золотистые хомячки; для лямблий — мыши; для лейшманий белые мыши и хомяки; для американских трипаносом - морские свинки; для африканских трипаносом – мартышки; для токсоплазм - белые мыши. Заражение животных осуществляют парентерально, в слепую кишку при лапаротомии, через длинный пластмассовый зонд или путем скармливания животным исследуемого материала.
В течение 30 дней после заражения микроскопическому исследованию подвергают кровь животных, мазки-отпечатки из органов или гистологические препараты из пораженных тканей.
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ПРОТОЗОЙНЫХ ИНФЕКЦИЙ
Малярия
Возбудителями тропической малярии является Plasmodium falciparum, трехдневной малярии - Plasmodium vivax, четырехдневной малярии - Plasmodium malariae и трехдневной или овале-малярии - Plasmodium ovale. Малярийные плазмодии претерпевают половой цикл развития в организме комара рода Anopheles и бесполый цикл (шизогония – рис.41) — в организме человека, поражая сначала клетки печени (тканевая шизогония), а затем эритроциты (эритроцитарная шизогония).
Микроскопический метод. Кровь на наличие плазмодиев малярии исследуют на стадии эритроцитарной шизогонии путем микроскопии обычных мазков и толстой капли, окрашенных по Романовскому-Гимзе. Плазмодии, цитоплазма которых окрашена в голубой цвет, а ядро в вишнево-красный, находят в эритроцитах.
Бесполые (эритроцитарные) формы паразитов имеют некоторые морфологические особенности. В частности, мерозоит представляет собой круглую или овальную форму с небольшим участком цитоплазмы около ядра; кольцевидный трофозоит - одноядерную форма с узким ободком цитоплазмы, окружающим небольшую вакуоль; амебовидный трофозоит - одноядерную форму с различным количеством и величиной псевдоподий; шизонт содержит два или несколько ядер; морула характеризуется полным разделением ядра и цитоплазмы на мерозоиты.
Половые формы плазмодиев (гаметоциты или гамонты) не содержат вакуолей и псевдоподий. Мужские (микрогаметоциты) и женские (макрогаметоциты) формы отличаются по величине и структуре ядра, интенсивности окраски цитоплазмы и размерам.
При микроскопии тонкого мазка при малярии находят обычно кольцевидные трофозоиты. У P. vivax, P. malariae, P. оvale они имеют размеры от 2 до 4 мкм, занимают около 1/3 диаметра эритроцита. Ядра у трофозоитов P. vivax и P. malariae круглые, у P. ovale — неправильной формы, крупные; ободок цитоплазмы ровный, неширокий, суживается к ядру. Молодые кольцевидные трофозоиты P. falclparum мелкие (1,25-1,50 мкм), занимают примерно 1/6 часть диаметра эритроцита, имеют маленькое круглое ядро с тонким ободком цитоплазмы. Взрослые кольцевидные трофозоиты более крупные, занимают 1/3 диаметра эритроцита, ободок цитоплазмы толстый, резко суживающийся к ядру.
Амебовидные трофозоиты P. vivax отличаются разнообразием форм, размеров, наличием одной или нескольких псевдоподий, вакуолей, круглого или овального ядра, пигмента в виде темно-коричневых цитоплазматических зерен различной величины и формы. Амебовидные трофозоиты P. malariae округлые и овальные (нередко в виде ленты поперек эритроцита с продолговатым или вытянутым ядром), с короткими и широкими псевдоподиями, более темной цитоплазмой и пигментом, ядром неправильной формы.. Амебовидные трофозоиты P.falciparum в виде круглых или
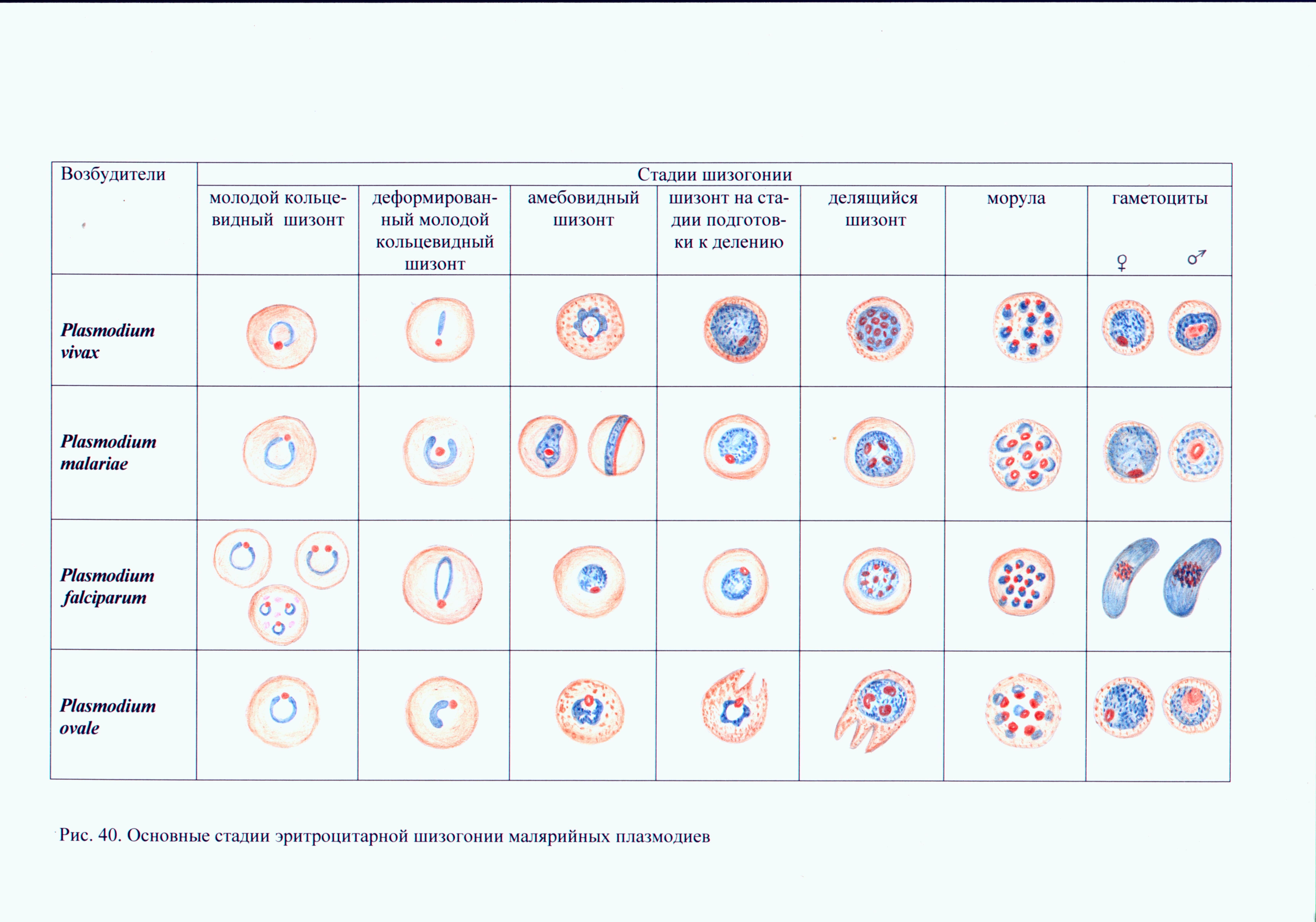
Рис. 41. Основные стадии эритроцитарной шизогонии малярийных плазмодиев
овальных форм лишены вакуоли, имеют ядро круглой или неправильной формы, пигмент черного цвета, расположенный компактно, однако они, как правило, в периферической крови не обнаруживаются. Молодые трофозоиты P. ovale имеют кольцевидную форму, более взрослые сходны с P. malariae.
Размеры шизонтов у возбудителей малярии увеличиваются по нарастающей в ряду P.vivax, P. ovale, P.falciparum.
Эритроциты, пораженные P. vivax и P. ovale, увеличиваются в диаметре до 10-12 мкм, хуже окрашиваются по Романовскому —Гимзе; эритроциты, пораженные P. ovale, могут приобретать неправильную форму, иметь бахромчатый край. Морфология эритроцитов, содержащих P. malariae и P. falciparum, не меняется.
В эритроцитах, содержащих P. vivax на различных стадиях развития, выявляются множественные мелкие азурофильные зерна (зернистость Шюффнера), при наличии в эритроцитах P. ovale зерна редкие и крупные (зернистость Джеймса), при обнаружении в эритроцитах кольцевидных трофозоитов P.falciparum можно выявить небольшое количество крупных азурофильных зерен (зернистость Маурера), а в тех случаях, когда возбудителем является P. malariae, в эритроцитах выявляют мелкую зернистость Циманна.
Морфология возбудителей малярии в толстой капле. Кольцевидные трофозоиты P. vivax, P. ovale, P. malariae обычно имеют одинаковую величину, однако в толстой капле они часто дефор-
мируются, превращаясь в форму запятой или восклицательного знака; цитоплазма при этом концентрируется около ядра в виде округлого или треугольного комочка. Наряду с кольцевидными трофозоитами можно найти другие формы плазмодиев и определить вид возбудителя.
Для амебовидных трофозоитов P. vivax в толстой капле характерна деформация их цитоплазмы в виде двух или нескольких комочков, располагающихся около ядра.
Трофозоиты P. malariae в мазке выглядят как компактные овальные или округлые образования с большим количеством пигмента.
Женские гаметоциты (гамонты) P. vivax и P. malariae в толстой капле не удается отличить от взрослых трофозоитов. Мужские гаметоциты имеют крупное ядро, окруженное узким ободком бледно-голубой цитоплазмы с рассеянными по ней зернами пигмента. Гаметоциты P. falciparum имеют характерную полулунную форму.
Серологический метод - определение антител к плазмодиям малярии с помощью РИА или ИФА с диагностическими целями проводится редко.
Читайте также:

