Основные принципы местного лечения ран и раневой инфекции
Обновлено: 24.04.2024
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов. Ведущим ограничением в выборе антибактериальных препаратов в настоящее время является широкое распространение полирезистентных микроорганизмов. Это значительно сужает выбор как системных, так и местных препаратов эмпирической антибактериальной терапии ран. В настоящее время в целях профилактики прогрессирования раневой инфекции находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов.
К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран, можно отнести сульфаниламид (Ранавексим), сульфатидин серебра, неомицин с бацитрацином. Местная терапия инфицированных ран должна базироваться на этиологических и анамнестических характеристиках раны, фазе раневого процесса и объеме поражения. Местное применение антибактериальных препаратов (например, сульфаниламида) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги).
Ключевые слова: раны, антибактериальная терапия, полирезистентность, местное применение антибиотиков, сульфаниламид.
Для цитирования: Левчук И.П., Костюченко М.В. Антибактериальные препараты для местной терапии ранений различной этиологии. РМЖ. Медицинское обозрение. 2018;2(2(II)):64-68.
Levchuk I.P., Kostyuchenko M.V.
Pirogov Russian National Research Medical University, Moscow
The article deals with modern problems of antibiotic therapy of the wounds of various etiologies, possibilities and limitations of the use of topical antibiotics. Currently, the main limitation in the choice of antibacterial drugs is the widespread use
of multiresistant microorganisms. This fact significantly reduces the choice of both systemic and topical drugs for empirical antibiotic therapy of wounds. At present, topical antibiotics are often used to prevent the progression of wound infection, which often allows to avoid systemic side effects. Topical antibacterial preparations most actively used for outpatient management of wounds can be attributed to a sulfanilamide (Ranavexim), sulfatides silver, neomycin with bacitracin. Topical therapy
of wounds should be based on etiological and anamnestic characteristics of the wound, phase of the wound process and the extent of the lesion. Topical use of antibacterial drugs (e. g. sulfanilamide) is possible with small lesions without an active infectious process in the wound (such as abrasions, scratches, small cuts and burns).
Key words: wounds, antibacterial therapy, multidrug resistance, topical application of antibiotics, sulfanilamide.
For citation: Levchuk I.P., Kostyuchenko M.V. Antibacterial drugs for topical therapy of the wounds of various etiologies // RMJ. Medical Review. 2018. № 2(II). P. 64–69.
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов
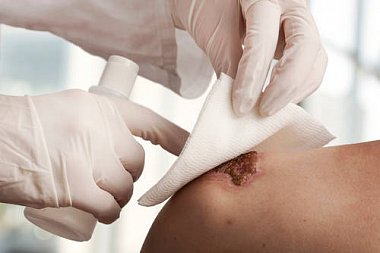
Все раны, полученные в нестерильных условиях, являются инфицированными, рост бактериальной флоры в ране провоцирует развитие воспалительного процесса, сопровождающегося повышением местной температуры, гиперемией, болью и нарушением функции части тела, на которой находится рана. Частота развития инфекционных осложнений остается весьма значительной и достигает в целом 45%. Наиболее подвержены развитию инфекционных осложнений раны, загрязненные землей, с нарушением кровоснабжения в области непосредственно самого повреждения или всей части тела, огнестрельные и минно-взрывные раны, укусы животных и человека. В зависимости от вида повреждения и условий окружающей среды в раны могут попадать различные микроорганизмы: резидентные — постоянно живущие и размножающиеся на коже (преимущественно коагулазонегативные кокки, например Staphylococcus epidermidis, S. aureus, и дифтeроиды, например Corinebacterium spp., реже — грамотрицательные бактерии), и транзиторные — в норме отсутствующие и попадающие на кожу после контакта с контаминированными объектами окружающей среды и больными людьми. В зависимости от области тела (голова, конечности, перианальная область и т. д.) спектр резидентной микрофлоры может быть различным. Транзиторная флора
также неодинакова по составу, который зависит от характера раны, этиологии, окружающей среды и может быть представлен различными инфекционно-опасными микроорганизмами (Escherichia coli, Klebsiella spp., Pseudomonas spp., Salmonella spp. и другими грамотрицательными бактериями, S. aureus, вирусами и грибами, Candida albicans, ротавирусами и др.). При повреждении кожи транзиторные микроорганизмы способны длительно колонизировать и инфицировать кожу, формируя при этом новую, гораздо более опасную резидентную (но не нормальную) флору. В большинстве случаев инфицирование обусловливается микробными ассоциациями. Так, укусы собак сопровождаются инфекционным осложнением примерно в 20% случаев, кошек — до 30–50%, человека — 70–80% [1–3].

Из-за изменения гистохимических параметров тканей в результате повреждения и разрушения защитной барьерной функции кожи даже непатогенные микроорганизмы могут стать причиной выраженных воспалительных, гнойных процессов. Для выбора оптимальной антибактериальной терапии необходимо учитывать возможный микробный спектр раны (табл.1).
Антибактериальная терапия
В настоящее время внебольничные штаммы остаются чувствительными к большому числу антибиотиков, в т. ч. β-лактамам. До конца 1990-х годов метициллин-резистентные микроорганизмы (MRSA) были исключительно внутрибольничной проблемой с преимущественным распространением в Европе. Однако в настоящее время имеются сведения и о внебольничных резервуарах полирезистентного стафилококка зоонозного происхождения, который составляет в общей массе до 50% и более на юге Европы и 10–25% в Центральной Европе и Великобритании [14]. В России в амбулаторных условиях частота встречаемости MRSA не превышает 3,8%, однако в условиях стационара частота встречаемости этих микроорганизмов, а также устойчивых к цефалоспоринам грамотрицательных E. coli и Klebsiella spp. достигает 60,4–84,9%. При выявлении высокого риска инфицированности MRSA-штаммами необходимо включить анти-MRSA-препарат в схему лечения [6–7].
В целях профилактики прогрессирования раневой инфекции в настоящее время находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов. Системной антибактериальной терапии не требуется при очагах менее 5 см после адекватной хирургической обработки [6].
В случае обширных раневых дефектов, клинических проявлений инфекции, включая системные признаки воспаления (повышение температуры тела >38° С или снижение 12×10 9 /л или лейкопения 90 уд./мин; одышка >24 дыханий/мин), иммунодефицитного состояния необходимо системное применение антибиотиков [7]. Местные лекарственные формы с антибактериальным компонентом при этом также находят место в протоколах лечения.
Активно применяющиеся в настоящее время антибактериальные препараты, при кажущемся на первый взгляд многообразии, с учетом современной концепции лечения инфицированных ран и требований, предъявляемых к подобным препаратам, имеют существенные ограничения. Спектр действия большей части широко известных препаратов значительно сузился для стационарного применения в связи с полирезистентностью микроорганизмов (табл. 2) и ограничением из-за побочных эффектов при больших раневых поверхностях (табл. 3).
Многие местно применяемые антибактериальные препараты имеют достаточно жесткие ограничения для стационарного применения в связи с резистентностью микрофлоры, а также по площади раневой поверхности из-за активного всасывания и токсичности при попадании в системный кровоток [20]. К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран с целью профилактики развития раневой инфекции, можно отнести сульфаниламид, сульфатидин серебра, неомицин с бацитрацином, при риске негоспитальных устойчивых штаммов — мупироцин и фузидовую кислоту. Сульфаниламид не потерял актуальности и характеризуется противомикробным действием по отношению к негоспитальным штаммам грамположительных и грамотрицательных кокков, E. coli, Shigella spp., Vibrio cholerae, Haemophilus influenzae, Clostridium spp., Bacillus anthracis, Corynebacterium diphtheriae, Yersinia pestis, а также Chlamydia spp., Actinomyces spp., Toxoplasma gondii и некоторым другим бактериям при ранах и ожогах, полученных в результате несчастных случаев и в чрезвычайных ситуациях [15–16, 21].
Применяя местные антибактериальные препараты, которые непосредственно контактируют с раной, необходимо учитывать их форму выпуска и состав вспомогательных веществ, соотнося их с фазами раневого процесса.
В первой фазе раневого процесса рекомендуются для местного применения препараты на водорастворимой основе с сульфаниламидом [6]. Сульфаниламид в виде порошка для местного применения (Ранавексим в банке с дозатором) поглощает раневой экссудат, не травмирует ткани раневой поверхности, препятствует развитию микрофлоры в ране и вторичному инфицированию [21, 22]. При использовании лекарственной формы в упаковке с дозатором легко контролируются дозировка лекарственного вещества и равномерность нанесения порошка без контакта с раневой поверхностью, что уменьшает риск побочных эффектов. При глубоких ранениях в полость раны вносят 5–15 г порошка для наружного применения (Ранавексим), при этом максимальная суточная доза для взрослых составляет 15 г, для детей старше 3-х лет — 300 мг, при местном применении в виде порошка (непосредственном нанесении на раневую поверхность) препарат не обладает раздражающим ткани действием [15, 21, 23].
Во второй фазе раневого процесса следует отдавать преимущество формам, не наносящим ущерба грануляциям.
Учитывая мультирезистентность микроорганизмов, в настоящее время эмпирические схемы антибактериальной терапии претерпевают значительные изменения. Давно известные и широко используемые антибиотики остаются, как правило, препаратами выбора лишь для ведения небольших ран в амбулаторных условиях у пациентов с низким риском инфицирования MRSA и другими устойчивыми штаммами. Раны, требующие хирургического лечения в условиях стационара, автоматически переводят пациентов в группу риска, и выбор препарата меняется. При этом антибактериальный спектр применяемого препарата должен включать возможных возбудителей с учетом этиологических и анамнестических характеристик раны.
Заключение
Таким образом, при назначении антибактериальной терапии ран необходимо учитывать этиологию и обстоятельства, при которых было получено повреждение, возможный спектр возбудителей, лечение амбулаторное или стационарное, риск инфицирования резистентной микрофлорой, особенности хирургического лечения раны и фазу раневого процесса. При этом, несмотря на широкое использование местных форм антибактериальных препаратов, в настоящее время отсутствуют четкие стандартизированные подходы относительно фаз раневого процесса. Только местное применение антибактериальных препаратов (например, сульфаниламида в форме порошка для наружного применения — Ранавексима) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги). При глубоких и обширных раневых дефектах после хирургической обработки применяется системная антибактериальная терапия, дополняемая при необходимости местными лекарственными формами.
Для цитирования: Чадаев А.П., Климиашвили А.Д. Современные методики местного медикаментозного лечения инфицированных ран. РМЖ. 2002;26:1211.
Российский государственный медицинский университет
ГКБ № 4, Москва
Н аложение лекарственных средств на раневую поверхность применялось испокон веков для лечения ран. Но время, разумеется, вносило свои коррективы: менялись взгляды на течение раневого процесса, появлялись новые лекарственные препараты, совершенствовались методы лечения.
Основные принципы деления процесса заживления ран на фазы или стадии течения были разработаны И.Г. Руфановым (1954), С.С. Гирголавом (1956), R. Ross (1968), В.И. Стручковым (1975) и М.И. Кузиным (1990). По современным представлениям, определяющим патогенетическую направленность лечебных мероприятий, раневой процесс разделяют на 3 фазы: воспаления, регенерации и реорганизации рубца с эпителизацией. В фазе воспаления вначале преобладают сосудистые реакции, характеризующие механизм воспаления, а затем происходит очищение раны от погибших тканей. Вторая фаза связана с образованием грануляционной ткани. Реорганизация рубца и эпителизация являются основными компонентами, завершающими течение раневого процесса.
Принцип подбора лекарственных средств и применения методов лечения, эффективных в той или иной фазе раневого процесса, практически отработан и традиционно не пересматривается в течение длительного времени. Медикаментозные средства используют в зависимости от конкретной фазы течения раневого процесса. Лекарственные средства, применяемые в фазе воспаления, должны оказывать антимикробный, дегидратирующий и некролитический эффекты. Препараты, используемые в фазах регенерации и реорганизации рубца с эпителизацией, должны обладать иными свойствами: стимулировать регенеративные процессы, способствуя росту грануляций и ускорению эпителизации, защищать грануляционную ткань от вторичной инфекции и подавлять рост вегетирующей в ране микрофлоры.
Совершенствование местного лечения направлено в основном на применение самых современных эффективных препаратов, и сложность подбора этих препаратов заключается в динамичном и многогранном течении процесса в зависимости от индивидуальных особенностей конкретного пациента.
В последнее время получило развитие новое направление в совершенствовании местного лечения – разработка носителей лекарственных средств. Положительное значение носителей лекарств было обнаружено еще в отношении иммобилизованных на них протеиназ (П.И. Толстых и др., 1985; В.К. Гостищев и др., 1986). На первых этапах внедрения в практику раневых покрытий использовались марлевые салфетки. Впоследствии при лечении различных по своей патогенетической природе ран применялись покрытия с самыми разнообразными фиксирующими материалами: от фильтровальной бумаги до различных многослойных многофункциональных материалов и перевязочных средств (И.А. Ерюхин, 1995; L. Flint, 1996).
Материал и методы
Левомеколь – мазь на водорастворимой основе полиэтиленоксида, содержащая левомицетин и метилурацил. Мазь обладает выраженной осмотической активностью и оказывает антимикробное и противовоспалительное действие. Метилурацил – пиримидиновое производное, стимулирует рост и размножение клеток за счет активации обменных процессов и, в частности, нуклеинового обмена. Изготовленный в виде 10% мази на жировой основе, препарат оказывает противовоспалительное действие, ускоряет заживление ран, не повреждая грануляций, но не обладает прямой противомикробной активностью. В фазе воспаления раневого процесса мы применяли левомеколь, а по мере формирования грануляций, то есть в фазе регенерации, заменяли ее 10% метилурациловой мазью.
Лечение проведено больным при открытом течении гнойных ран после вскрытия и хирургической обработки разнообразных заболеваний мягких тканей или вялотекущих гнойных процессов, так как главной задачей исследования являлось выяснение воздействия препаратов на раневой процесс независимо от причин их возникновения (табл. 2).
Результаты и обсуждение
Результаты лечения ран оценивали по клинической эффективности местного применения препаратов. В комплекс клинической оценки эффективности лечения были включены следующие параметры:
- сроки очищения ран;
- время появления грануляций;
- время появления эпителизации;
- индекс Поповой (СЗР) в процентном выражении.
Планиметрию раны для оценки скорости ее заживления проводили с помощью нанесения контуров раны на миллиметровую бумагу до начала лечения, а далее на 5, 7, 9, 11 и 15 дни в зависимости от объективных и субъективных факторов. Скорость заживления раны (СЗР) или индекс Поповой, выраженный в процентах, рассчитывали следующим образом:
ИП = (S – Sn) x 100/S x t
При этом S – величина площади раны при предшествующем измерении, Sn – величина площади раны в настоящий момент, t – число дней между первым и последующим измерением.
Результаты сравнительной оценки эффективности местного лечения гнойных ран при вторичном их заживлении в основной и контрольной группах представлены в табл. 3.
Что такое открытая рана? Причины возникновения, диагностику и методы лечения разберем в статье доктора Николенко Виталия Александровича, травматолога со стажем в 12 лет.
Над статьей доктора Николенко Виталия Александровича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Раной называют повреждение кожных покровов или слизистых оболочек, вызванное внешним воздействием механических сил.
Исходя из приведённого определения, причиной раны, как нозологической формы, может являться исключительно травмирующий агент.

Природа раны всегда экзогенная (возникает под воздействием внешних факторов). Даже если речь идёт о травматизации мягких тканей изнутри костями или разрыве кожи от перенапряжения — всё же изначальной причиной поврежения является приложенная извне сила, которая превысила предел прочности тканей и привела к ране косвенным путём. [1]
В большинстве случаев рана — результат прямого нарушения целостности покровной ткани тем или иным ранящим объектом. Характер раны, тактика лечения, вероятные осложнения и её клинический исход напрямую зависят от изначального воздействия и свойств ранящего объекта (преимущественно его геометрии и силе соударения). [2]
Как отдельные варианты ранения рассматриваются размозжение тканей и травматические отслойки тканей в результате тупой травмы тела. Последний вариант отличается обширной зоной деструкции и дополнительными факторами, отягощающими раневой процесс в отсроченном периоде. [3]
Огнестрельные раны также рассматриваются обособленно в силу особого подхода в лечении. Ранящий источник в этом случае, обладая значительной кинетической энергией, образует вокруг раны область контузии тканей. [4]
Тяжесть раневого процесса определяется способом воздействия. В настоящее время достаточно изучен профиль осложнений, характерный для каждого вида раны. Наглядным примером комплексного раневого процесса, приводящего к общему заболеванию, служит глубокая колотая рана, осложнившаяся клостридиальной инфекцией. [5]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы открытой раны
Первым и патогномоничным симптомом, характерным для раны, является нарушение целостности кожных покровов или слизистой оболочки. Другими неотъемлемыми клиническими признаками являются:
- диастаз краёв повреждённых тканей;
- кровотечение из зоны повреждения;
- боль и функциональные расстройства.
Перечисленная тетрада, четко и академично характеризует рану. [6]
Под диастазом понимают расхождение краёв раны, неизменно возникающее при любом ранении в той или иной степени выраженности. Даже резаная рана с гладкими краями имеет диастаз, в том числе при макроскопически адаптированных краях раны.
Кровотечение из раны присутствует всегда, за исключением редких случаев коагулопатии (нарушений свёртываемости крови). [7] Собственно кровотечение может нести раннюю и непосредственную угрозу жизни. Оно явным образом даёт понять, что человек имеет дело именно с раной. Капиллярное, венозное, артериальное или смешанное кровотечение — компонент, присущий любой ране.
Боль — специфичный вариабельный признак раны. Его вариабельность обусловлена не только характером и локализацией раны, но и общим состоянием организма, индивидуальной лабильностью и уровнем болевого порога.
Диагноз можно установить при одновременном сочетании всех перечисленных выше симптомов, однако это не ограничивает спектр всех проявлений раны. Диагностирование раны не представляет особой сложности ввиду внешних очевидных признаков травмы. Кроме того, при осмотре обращает на себя внимание выраженное нарушение функции, которое следует рассматривать как симптомокомплекс. [8]
Нарушение функции проявляет себя неспецифически, то есть может быть присуще не только последствиям ранения, но и сочетанных повреждений.
Функциональные расстройства, связанные с раной, стоит разделить на локальные и системные — это упрощает диагностику и поясняет природу симптоматики раны.
- К локальным нарушениям функции относят последствия острой воспалительной и посттравматической реакций, которые характерны для отёка. [9]
- К системным функциональным расстройствам относят общие реакции организма (например, лихорадку).
Под нарушением функции в симптоматике раны, как правило, понимают не дисфункцию на тканевом уровне с патогенетическими сдвигами, а глобальные проявления анатомического характера: нарушение подвижности в сегменте, вплоть до утери опороспособности и объёма движений. [10]
Патогенез открытой раны
Патогенез ранений детально изучен. На его основе строится лечение ран. Неизменность патогенетических звеньев при ранении позволяет говорить о раневом процессе и его течении как об общем комплексе типичных проявлений, характерных для любой раны, независимо от её морфологии.
Существуют различные класификации терминологий и длительности фаз, однако классификация Росса заслужила признание повсеместно. Согласно ей, выделяют три фазы раневого процесса:
- воспалительная фаза;
- пролиферативная фаза;
- реорганизационная фаза. [11]
Воспалительная фаза
В первой фазе происходит острая сосудистая реакция, характеризующаяся:
- вазоспазмом (сужением артерий и капилляров) с целью локального гемостаза (остановки кровотечения);
- выбросом гуморальных факторов свёртывания, катализаторов местных иммунных реакций.
Задача воспалительной фазы — мобилизовать силы организма с целью локализации процесса и подготовки к успешной репарации (восстановлению) в дальнейшем. [12]
Второй этап этой фазы состоит в элиминации (устранении) организмом поврежденных структур. Длительность перечисленных процессов — от трёх до пяти суток. После чего наступает следующая стадия раневого процесса.
Пролиферативная фаза
Как видно из названия, в этот период начинается восстановление повреждённых и замещение утраченных тканей.
Как правило, эта фаза протекает от нескольких суток до нескольких недель. Существует прямая зависимость от количества утраченной ткани при ранении. В основе пролиферативной фазы лежит преобладание процессов синтеза за счёт клеток-предшественников. [14]
Реорганизационная фаза
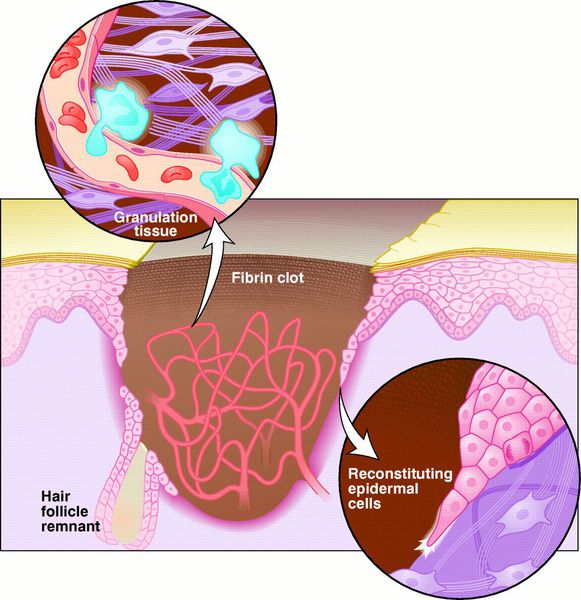
Заживление ран проходит по одному из трёх путей: первичным или вторичным натяжением, или под струпом. [19]
Первичное натяжение — самый благоприятный способ заживления. Для него, однако, требуются изначальные благоприятные условия: рана с минимальной микробной контаминацией, плотно соприкасающиеся края раны, отсутствие некротических тканей.
Вторичное натяжение — вариант заживления раны, противоположный описанного выше натяжения. Этот тип заживления характерен для инфицированных ран. [20]
Заживление под струпом — заживление, характерное для ран с большой площадью, но малой глубиной. При этом, протекает процесс, аналогичный заживлению первичным натяжением, но ориентированный в продольной плоскости. Кроме того, раневая поверхность покрывается струпом — слоем высохшей крови, тканевой жидкости и детрита. [21] Струп выполняет функцию биологической повязки до заживления и эпителизации раны.
Классификация и стадии развития открытой раны
Классификация ран обширна, в основном, за счёт обилия классифицируемых признаков.
В основную класификацию ран, радикально влияющую на способ их ведения, включают инфицированные и неинфицированные повреждения или, как их называют врачи, гнойные и чистые раны.
По способу и обстановке нанесения раны делятся на хирургические, случайные, умышленные и раны военного времени.
По характеру раневых ворот, что зависит от механизма нанесения раны:
- огнестрельные;
- размозженные;
- укушенные;
- резаные;
- ушибленные;
- колотые;
- рубленные;
- рваные;
- скальпированные;
- раздавленные. [16]
В классификациях по данному признаку встречаются раны смешанного характера (например, укушено-рваные или размозжено-рваные).
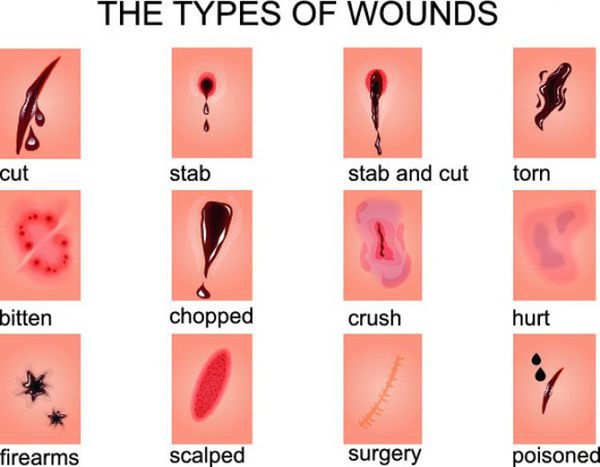
По обширности выделяют рану с малой зоной повреждения и обширную рану.
По количеству ран: одиночная и множественные раны. Эта классификация включает дополнительный критерий: множественные раны разделяются на сочетанные и комбинированные. [17]
По характеру раневого канала раны разделяются на слепые, сквозные, касательные, проникающие и непроникающие.
По наличию осложнений раны могут быть осложненными и неосложненными. Осложниться раны могут общими и местными процессами.
Независимо от характера раны, ей присуща клиническая стадийность, которая отражает аналогичную последовательность патогенеза.
Непосредственно после нанесения раны, возникает первичный рефлекторный спазм сосудов микроциркуляторного русла, как нейровегетативный ответ на травму. [18] Это короткий период, с характерным отсутствием кровотечения, несмотря на масштаб повреждения. После чего, развивается кровотечение.
Независимо от характера и интенсивности кровотечения, организм стремится к гемостазу сосудистым и гуморальным звеном. Если гемостаз наступил, и состояние после кровопотери стабилизировано — начинается репаративная фаза.
Осложнения открытой раны
Осложнения ран делятся на местные и общие. И те, и другие могут быть ранними и поздними, в зависимости от сроков развития.
Местные осложнения ран могут носить инфекционный и неинфекционный характер. Инфекционные местные осложнения — присоединение активного микробного заражения раны с клиническим проявлением воспалительной реакции. [22]
Инфицирование раны — бесспорное осложнение, замедляющее заживление раны, снижающее вероятность первичного заживления, приносящее риск генерализованных осложнений и ухудшающее отдалённый прогноз. [23]
Некроз — гибель тканей в зоне раны. Это вторичный процесс, развивающийся уже в отделённом времени после получения раны.
Как отдельный вид местных осложнений, рассматривают вторичное кровотечение, возникшее после изначально выполненного гемостаза раны. В случае выполненного хирургического лечения возможны осложнения раны другого характера — несостоятельность швов.
К неинфекционным местным осложнениям относят повреждение крупных нервов, магистральных сосудов, сухожилий. Это приводит к необходимости расширения объёмов оперативного пособия (и даёт абсолютные показания к нему), резко уменьшая шансы на восстановление функции сегмента. [25]
Общие или генерализованные осложнения раны опасны нарушениями жизненных функций организма. Общие осложнения ран могут стать фатальными для пациента.
Выделяют следующие неинфекционные осложнения общего характера:
- Геморрагический шок — декомпенсация витальных показателей организма, на фоне массивной кровопотери. Это раннее общее осложнение, которое встречается наиболее часто.
- Травматический шок — преобладание болевой импульсации, как ключевого компонента в нарушении гемостаза. Травматический шок включает в себя понятие массивной кровопотери, но связан с отягощением раны другой травмой либо множественными ранами. [26]
Общие осложнения инфекционной причины: сепсис, клостридиальная инфекция.
Осложнения местные и общие тесно связаны. Генерализация осложнений напрямую указывает на вероятную ошибку в подходах к лечению. Любой раневой процесс может генерализоваться даже при правильных тактических решениях врача. [16]
Диагностика открытой раны
Диагностика раны в своем большинстве — визуальна. Результатов осмотра достаточно, чтобы установить предварительный и, в большинстве случаев, полный диагноз. Нарушение целостности тканей, зияние краёв раны, кровотечение — критерии диагноза. [3]
Не стоит пренебрегать сбором жалоб пациента, уточнением деталей об обстоятельствах получения раны с целью моделирования механизма нанесения раны. Общеклинический план опроса пациента позволит дополнить диагноз сопутствующей патологией, важной для лечения раны.
В ряде случаев, определить повреждение подлежащих анатомических структур позволят клинические тесты. Оценка объёмов движений сегмента при ранении в проекции сухожилий, нагрузочные тесты выявляют полные или частичные повреждения, которые могут быть не визуализированы во время ревизии. [10]
Инструментальные методы диагностики раны направлены на исключение сопутствующего повреждения сосудов, нервов, внутренних органов. Рентген-визуализация выявляет рентгеноконтрастные инородные тела, что станет ценной информацией для хирурга перед операцией.
Лабораторный минимум — общий анализ крови, коагулограмма. Они позволят в кратчайшие сроки оценить объём кровопотери и проблемы с гемостазом.
Одним из немногих специфичных для раны лабораторных тестов является посев раневого содержимого на рост бактериальной флоры с определением чувствительности к антибиотикам.
Лечение открытой раны
Лечение ран бывает общим и местным, консервативным и оперативным.
Монотерапия (только общее или местное) раны не применятся, за редким исключением.
Показания к консервативному лечению — поверхностные и осаднённые раны, раны с адаптированными краями, отказ пациента от оперативного лечения, терминальное состояние пациента либо абсолютные противопоказания к выполнению наркоза или анестезии. [28] Условным показанием к консервативному лечению, является первичное инфицирование раны. В этом случае применимы отсроченные швы либо консервативное ведение.
Технически, лечение раны консервативным способом заключается в регулярных перевязках раны до заживления с целью минимизации риска инфекционных осложнений. Вопрос о хирургическом лечении в таком случае, может быть поставлен в ходе динамического наблюдения. [12]
Вакуум-терапия
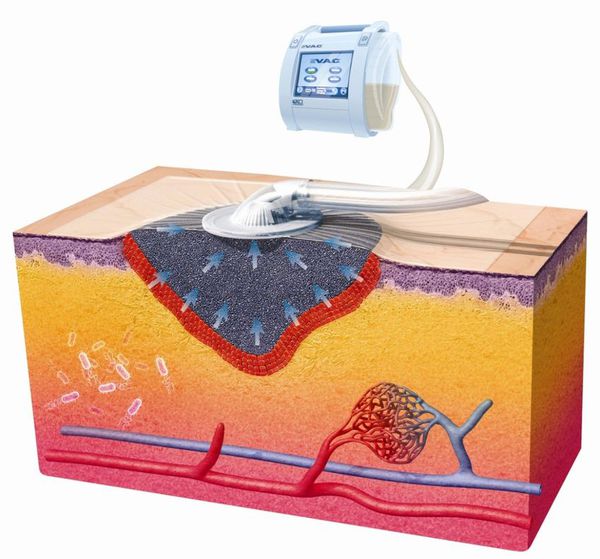
Эффективный и современный способ консервативного лечения ран — вакуум терапия, проводимая с использованием окклюзионных повязок. Отрицательное давление, импульсный и переменный режимы приводят к положительным эффектам: адекватному дренированию раны, щадящей стимуляции репаративных процессов, устранению затёков и отслойки кожи. [29]
Этот способ лечения подходит как для чистых, так и для инфицированных ран, не ограничивая способность пациента к передвижению.
Физиолечение
Как вспомогательный метод местной терапии, применяется физиолечение — ультрафиолетовое облучение раны, гипербарическая оксигенация, воздействие холодным плазменным потоком. [27]
Хирургические способы лечения
Раневой процесс может протекать таким образом, что показания к хирургической активности появляются в отдаленном периоде. [8]
Лечение раны оперативным путём заключается в хирургической обработке: ревизии, гемостазе, иссечении нежизнеспособных тканей, анатомическом (послойном) восстановлении целостности тканей путём ушивания либо сопоставления и удержания скобами.
При ранах с дефектами тканей применима первичная пластика раны с целью реконструкции сегмента и профилактики неминуемых некротических и инфекционных осложнений.
Общая терапия
Общее лечение раны выполняется с соблюдением комплексных принципов: антибиотикотерапия, анальгетики, инфузионно-трансфузионная терапия (при показаниях), введение противостолбнячной, противогангренозной сыворотки, применение анаболических препаратов, поливитаминных комплексов, лечение сопутствующей патологии организма с целью повышения его компенсаторных возможностей. [27]
Отсутствие хирургического, местного лечения раны или его несостоятельность не компенсируется общим лечением и, в том числе, мощной антибиотикотерапией. Санация (лечение) локального очага — приоритетная. Заживление раны без адекватной хирургической обработки затягивается на недели и месяцы.
Прогноз. Профилактика
Прогноз раны определяется её характером — очевидно, что рваная рана заживает длительнее и хуже, чем резаная. [11] Обширность повреждения, сопутствующая и сочетанная патология значительно повлияют на сроки заживления.
Во многом, течение раневого процесса подвластно осложнениям. Осложнения, возникшие в отдалённом периоде, могут замедлить хорошо протекавшее ранее заживление.
Опыт врача хирурга, радикальность обработки раны, способ хирургического пособия и ошибки в его выполнении, техническая и материальная база лечебного учреждения — всё это переменные факторы, объясняющие условность прогноза. [19]
Неблагоприятный прогноз несут раны с дефектами мягких тканей, с нарушением целостности сосудов, нервов, мышц и сухожилий, а также раны, сопровождающиеся переломами.
Отдельного внимания заслуживает прогноз ран инфицированных неспецифичной и специфичной флорой. [11] Первая группа характеризуется вариабельным течением раневого процесса со сроками, превышающими время заживления неинфицированных ран. Вторая группа ран может нести инвалидизирующее влияние: анаэробная агрессивная флора вынуждает хирургов выполнять ампутации и экзартикуляции с целью спасения жизни. [16]
Получение случайных ран не подвержено контролю. Это объясняет трудность их профилактики. Производственный травматизм — единственное звено, подвластное влиянию профилактики. Соблюдение техники безопасности на рабочих местах значительно снижает риск ранений. В остальном, профилактика направлена на раннее и корректное лечение раны с целью минимизации раневых осложнений. [4]
Для цитирования: Чадаев А.П., Климиашвили А.Д. Современные методики местного медикаментозного лечения инфицированных ран. РМЖ. 2002;26:1211.
Российский государственный медицинский университет
ГКБ № 4, Москва
Н аложение лекарственных средств на раневую поверхность применялось испокон веков для лечения ран. Но время, разумеется, вносило свои коррективы: менялись взгляды на течение раневого процесса, появлялись новые лекарственные препараты, совершенствовались методы лечения.
Основные принципы деления процесса заживления ран на фазы или стадии течения были разработаны И.Г. Руфановым (1954), С.С. Гирголавом (1956), R. Ross (1968), В.И. Стручковым (1975) и М.И. Кузиным (1990). По современным представлениям, определяющим патогенетическую направленность лечебных мероприятий, раневой процесс разделяют на 3 фазы: воспаления, регенерации и реорганизации рубца с эпителизацией. В фазе воспаления вначале преобладают сосудистые реакции, характеризующие механизм воспаления, а затем происходит очищение раны от погибших тканей. Вторая фаза связана с образованием грануляционной ткани. Реорганизация рубца и эпителизация являются основными компонентами, завершающими течение раневого процесса.
Принцип подбора лекарственных средств и применения методов лечения, эффективных в той или иной фазе раневого процесса, практически отработан и традиционно не пересматривается в течение длительного времени. Медикаментозные средства используют в зависимости от конкретной фазы течения раневого процесса. Лекарственные средства, применяемые в фазе воспаления, должны оказывать антимикробный, дегидратирующий и некролитический эффекты. Препараты, используемые в фазах регенерации и реорганизации рубца с эпителизацией, должны обладать иными свойствами: стимулировать регенеративные процессы, способствуя росту грануляций и ускорению эпителизации, защищать грануляционную ткань от вторичной инфекции и подавлять рост вегетирующей в ране микрофлоры.
Совершенствование местного лечения направлено в основном на применение самых современных эффективных препаратов, и сложность подбора этих препаратов заключается в динамичном и многогранном течении процесса в зависимости от индивидуальных особенностей конкретного пациента.
В последнее время получило развитие новое направление в совершенствовании местного лечения – разработка носителей лекарственных средств. Положительное значение носителей лекарств было обнаружено еще в отношении иммобилизованных на них протеиназ (П.И. Толстых и др., 1985; В.К. Гостищев и др., 1986). На первых этапах внедрения в практику раневых покрытий использовались марлевые салфетки. Впоследствии при лечении различных по своей патогенетической природе ран применялись покрытия с самыми разнообразными фиксирующими материалами: от фильтровальной бумаги до различных многослойных многофункциональных материалов и перевязочных средств (И.А. Ерюхин, 1995; L. Flint, 1996).
Материал и методы
Левомеколь – мазь на водорастворимой основе полиэтиленоксида, содержащая левомицетин и метилурацил. Мазь обладает выраженной осмотической активностью и оказывает антимикробное и противовоспалительное действие. Метилурацил – пиримидиновое производное, стимулирует рост и размножение клеток за счет активации обменных процессов и, в частности, нуклеинового обмена. Изготовленный в виде 10% мази на жировой основе, препарат оказывает противовоспалительное действие, ускоряет заживление ран, не повреждая грануляций, но не обладает прямой противомикробной активностью. В фазе воспаления раневого процесса мы применяли левомеколь, а по мере формирования грануляций, то есть в фазе регенерации, заменяли ее 10% метилурациловой мазью.
Лечение проведено больным при открытом течении гнойных ран после вскрытия и хирургической обработки разнообразных заболеваний мягких тканей или вялотекущих гнойных процессов, так как главной задачей исследования являлось выяснение воздействия препаратов на раневой процесс независимо от причин их возникновения (табл. 2).
Результаты и обсуждение
Результаты лечения ран оценивали по клинической эффективности местного применения препаратов. В комплекс клинической оценки эффективности лечения были включены следующие параметры:
- сроки очищения ран;
- время появления грануляций;
- время появления эпителизации;
- индекс Поповой (СЗР) в процентном выражении.
Планиметрию раны для оценки скорости ее заживления проводили с помощью нанесения контуров раны на миллиметровую бумагу до начала лечения, а далее на 5, 7, 9, 11 и 15 дни в зависимости от объективных и субъективных факторов. Скорость заживления раны (СЗР) или индекс Поповой, выраженный в процентах, рассчитывали следующим образом:
ИП = (S – Sn) x 100/S x t
При этом S – величина площади раны при предшествующем измерении, Sn – величина площади раны в настоящий момент, t – число дней между первым и последующим измерением.
Результаты сравнительной оценки эффективности местного лечения гнойных ран при вторичном их заживлении в основной и контрольной группах представлены в табл. 3.
Читайте также:

