Особенности бактериологического метода при диагностике туберкулеза
Обновлено: 19.04.2024
Для цитирования: Черноусова Л.Н. Современные тенденции и возможности микробиологической диагностики туберкулеза. РМЖ. 2002;16:697.
ЦНИИ туберкулеза РАМН, Москва
В настоящее время лабораторная диагностика занимает ведущее место в выявлении многих инфекционных заболеваний. Подтверждение диагноза туберкулеза основывается на результатах микробиологических анализов при выделении из биологического материала возбудителя – микобактерий туберкулеза. Современная микробиологическая диагностика туберкулеза состоит из нескольких основных групп анализов, направленных на выявление возбудителя, определение лекарственной чувствительности и типирование микобактерий.
Обнаружение возбудителя
Обнаружение возбудителя начинается с наиболее простых и быстрых бактериоскопических методов с использованием светового микроскопа с окраской по Циль–Нильсену и люминесцентного с окраской флюорохромами. Преимущество бактериоскопии – в быстроте получения результата. Однако возможности ее ограничены из–за низкой чувствительности. Этот метод является наиболее экономичным и рекомендован ВОЗ в качестве основного для выявления заразных больных (табл. 1).
При антибактериальной терапии обнаружение микобактерий туберкулеза имеет прогностическое значение. Поэтому бактериовыделение оценивается количественно. Золотым стандартом выявления микобактерий признаны культуральные исследования. Для посева патологического материала используют яичные среды: Левенштейна–Йенсена, среду Финна II, Мордовского и др. Количество микобактерий (или колоний в пробирке при культуральном методе исследования) в процессе химиотерапии является ориентировочным показателем ее эффективности или косвенным свидетельством развития устойчивости микобактерий к противотуберкулезным препаратам.
Для повышения процента выделения микобактерий посевы патологического материала проводят на несколько сред, в том числе и на жидкие в автоматизированных системах учета роста типа BACTEC, что позволяет удовлетворить все культуральные потребности возбудителя. Посевы инкубируют до двух с половиной месяцев. При отсутствии роста к этому времени посев считается отрицательным. Наиболее чувствительным способом обнаружения микобактерий туберкулеза считается метод биологической пробы – заражение диагностическим материалом высокочувствительных к туберкулезу морских свинок.
Развитие молекулярной биологии позволило значительно повысить эффективность обнаружения микобактерий. Базовым методом молекулярно–генетических исследований является полимеразная цепная реакция (ПЦР), направленная на выявление ДНК микобактерий в диагностическом материале. ПЦР дает экспоненциальное увеличение специфического участка ДНК возбудителя: 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле.
Роль молекулярной диагностики в клинической практике повышается, поскольку увеличивается число больных со скудным бактериовыделением. Однако при постановке диагноза результаты ПЦР являются дополнительными и должны сопоставляться с данными клинического обследования, рентгенографии, микроскопии мазка, посева и даже ответа на специфическое лечение.
Интереснейшая область исследования, которая открывается благодаря ПЦР–диагностике, – изучение латентной инфекции M. tuberculosis. По современной концепции туберкулезной инфекции, из 100 человек, контактирующих с M. tuberculosis, 90 могут быть инфицированы, но только у 10 развивается активная болезнь. У остальных 90% инфекция будет оставаться латентной из–за противотуберкулезного иммунитета. Положительные ответы ПЦР при отрицательных результатах посевов патологического материала отмечаются у 55% лиц, подвергавшихся бытовым контактам с M. tuberculosis, и у 80% лиц, у которых туберкулез протекал без рентгенографических проявлений. Проведение ПЦР–исследований у пациентов из групп риска выявляло больных с отрицательными результатами микроскопии и посевов, но с субклинической инфекцией M. tuberculosis [11]. Подобные результаты были получены и в наших исследованиях [6].
Определение лекарственной устойчивости микобактерий
Для определения лекарственной устойчивости микобактерий используется несколько групп методов (табл. 2). По приказу № 558 МЗ РФ от 1978 г. в бактериологических лабораториях России используется метод абсолютных концентраций. В лаборатории ЦНИИТ РАМН внедрен ускоренный метод по тестированию нитратредуктазной активности микобактерий с помощью реактива Грисса.
В крупных противотуберкулезных центрах используются методы определения лекарственной устойчивости в жидких средах с автоматизированной радиометрической и флюоресцентной системой учета роста микобактерий типа ВАСТЕК, позволяющие сокращать срок анализа до 14 дней.
В последнее время разрабатываются новые методы оценки лекарственной устойчивости на уровне генотипа [10]. Работа по изучению молекулярных механизмов резистентности показала наличие у микобактерий генов, связанных с устойчивостью к различным препаратам: к изониазиду – гены katG, inhA, kasA, к рифампицину – rpoB, к стрептомицину – rpsL и 16SрРНК, к этамбутолу – emb1, к фторхинолонам – gyrA и т.д. [7].
Широкомасштабные исследования по изучению спектра мутаций в геноме устойчивых микобактерий показали, что наиболее распространенными были мутации в 531, 526 и 516 кодонах rpoB гена, устойчивость к изониазиду характеризовалась мутациями в 315 кодоне katG гена. В целом спектр мутаций не отличался от выявленных исследователями в разных регионах мира [2].
Доступность данных по молекулярной основе лекарственной устойчивости к противотуберкулезным препаратам дала возможность разработки новых, основанных на ПЦР, методов, представленных в табл. 2. Наши работы, проведенные совместно с Институтом физико–химической медицины МЗ РФ и Институтом молекулярной биологии РАН, продемонстрировали перспективность использования молекулярно–генетических методов для быстрого определения лекарственной устойчивости [1, 3, 4].
Наибольшие надежды по совершенствованию методов для определения лекарственной устойчивости микобактерий связаны с развитием микрочиповой технологии, позволяющей определять устойчивость одновременно к нескольким противотуберкулезным препаратам микобактерий непосредственно из диагностического материала в течение 2 дней [9].
Типирование микобактерий
Комплекс методов имеется и для типирования микобактерий, когда используются традиционные культуральные и биохимические методы, биологические, а также молекулярно–генетические (табл. 3). На основе молекулярно–генетического типирования микобактерий интенсивно развивается область молекулярно–эпидемиологических исследований, в которой по генотипу микобактерии выявляются очаги и прослеживаются пути распространения туберкулезной инфекции [5, 8].
2. Генерозов Э.В. и др. Молекулярная характеристика полирезистентных клинических штаммов Mycobacterium tuberculosis из России. // Молекулярная генетика, микробиология и вирусология, 2000; 1: 11–7.
3. Генерозов Э.В.и др. Детекция и характеристика мутаций в rроВ гене резистентных к рифампицину клинических штаммов Mycobacterium tuberculosis. // Проблемы туберкулеза, 1999; 2: 39–42.
4. В.М. Михайлович и др. Использование методов гибридизации и ПЦР на специализированном ТБ–микрочипе для обнаружения рифампицин–резистентных штаммов Mycobacterium tuberculosis // БЭБ и М, 2001, 1: 112–7.
5. Черноусова Л.Н.и др. Молекулярная эпидемиология туберкулеза в тюрьмах. // Актуальные проблемы пенитенциарной медицины. Мат–лы международной научно–практич. конференции, Минск, 2001: 48–50.
6. Черноусова Л.Н., Ларионова Е.Е., Севастьянова Э.В., Голышевская В.И. Роль ПЦР–анализа в комплексных бактериологических анализах во фтизиатрии. // Проблемы туберкулеза, 2001; 3: 58–60.
Бактериологический метод диагностики туберкулеза. Влияние химиотерапии на диагностику туберкулеза.
Наилучшие результаты получают при одновременном использовании двух различных плотных сред. При этом не следует ограничиваться однократным или даже повторным исследованием, а необходимо последовательно, через известные интервалы производить посевы мокроты или промывных вод бронхов. Целесообразность такой диагностической тактики подтверждается повседневным опытом и, в частности, наблюдениями, проведенными в Институте туберкулеза в Будапеште. При троекратном исследовании методом посева мокроты у значительной группы больных туберкулезом легких микобактерии были обнаружены у 70,3% из них, после 5 анализов — у 80,7%, а после 10 — у 97,9%.
При бактериологическом способе исследования удается не только выявить и подсчитать количество выросших колоний микобактерии туберкулеза, но и изучить их различные свойства, дифференцировать от кислотоупорных сапрофитов и атипичных штаммов, определить типовую принадлежность, ферментативную активность, лекарственную чувствительность и др.
Успехи различных способов культивирования микобактерии, естественно, ограничили сферу применения биологического метода исследования, т. е. заражения животных исследуемым материалом. Но они ни в какой мере пе исключают его. Путем заражения высокочувствительных к туберкулезу лабораторных животных, главным образом морских свинок, можно обнаружить микобактерий, даже если они содержатся в исследуемом материале в небольшом количестве. Это обстоятельство приобретает, конечно, весьма важное диагностическое значение. Тем же способом удается лучше дифференцировать вирулентные и атипичные штаммы от сапрофитов, определить тип микробов, к которым одни виды животных чувствительны, а другие устойчивы, а также установить патогенность и вирулентность микобактерий туберкулеза.
Следует подчеркнуть, что при специфической химиотерапии затрудняется обнаружение микобактерий в различных выделениях, жидкостях и тканях организма больного. Это явление связано с тем, что под влиянием антибактериальных препаратов, особенно при длительной терапии, понижается жизнеспособность микобактерий и изменяются их морфологические свойства и химический состав, что отражается на тинкториальной способности, так как может вести к снижению или утрате присущей микобактериям кислотоустойчивости. Мертвые микобактерий по Цилю—Нельсену окрашиваются так же, как и живые. Для их дифференциации применяют специальные методы окраски. Так, живые микобактерий, в которых содержится нативная дезоксирибонуклеиновая кислота, окрашиваются метиловым зеленым. Погибшие микробы лучше окрашиваются пиронином в розовый цвет, а сафранином — в красный. При докраске карболовым фуксином живые микобактерий окрашиваются в зеленый цвет, а погибшие — в красный.
Распознавание таких биологически и морфологически измененных форм возбудителя туберкулеза, особенно в условиях повседневной практики, естественно, встречает затруднения. Этим отчасти можно объяснить, что у некоторых больных даже деструктивным туберкулезом легких не находят микобактерий туберкулеза в мокроте уже вскоре после начатой химиотерапии. Нет сомнения, что только у части из них произошло стойкое и полное морфологическое и биологическое оздоровление стенок туберкулезных каверн. У остальных имеет место мнимая абациллярность, что подтверждается возможностью обострения процесса при динамическом наблюдении, а также обнаружением микобактерий в полости или стенках каверны при специальном исследовании. В этом можно убедиться, если произвести пункцию, казалось бы, излеченной каверны и исследовать ее содержимое после промывания физиологическим раствором. Пользуясь таким методом, Neef (1966) из 49 больных с остаточными, большей частью небольшими (до 0,5 см в диаметре), посттуберкулезными полостями в легких у 11 больных, т. е. почти в 1/4 случаев, обнаружил микобактерий, которые не удавалось найти в мокроте или в промывных водах бронхов всеми доступными способами.
Таким образом, в условиях современной химиотерапии возникает необходимость дальнейшего усовершенствования методов обнаружения микобактерий туберкулеза. В то же время обязательным условием является одновременное динамическое комплексное применение различных лабораторных способов исследования патологического материала: бактериоскопии, посева, по возможности заражения лабораторных животных. Необходимо, кроме того, использование ряда специальных методов для выявления не только классических, но и других вариантов возбудителя.
Так, применяя новые питательные среды, а также пенициллин и дигидрострептомицин, можно выделить из мокроты, спинномозговой жидкости, мочи и тканей больных туберкулезом L-формы микобактерий в виде мелких зерен и шаровидных тел.
При дифференциации типичных и атипичных микобактерий используют комплекс многих методов исследования: определяют кислотно- и спиртоустойчивость микобактерий; изучают особенности их роста при различной температуре, на отдельных питательных средах, при наличии и отсутствии солнечного света; исследуют морфологию культур и способность образовывать пигмент; устанавливают степень чувствительности к туберкулостатическим препаратам. Существенное диагностическое значение имеют некоторые биохимические тесты: амидазный и ниациновый, определение каталазной, дегидрогеназной, пероксидазной, уреазной и липазной активности и реакция восстановления нитратов. О вирулентности тех или иных штаммов микробов судят по результатам определения корд-фактора и цитохимическим тестам. Их патогенность устанавливают при заражении морских свинок, белых мышей, кроликов, кур. Эти исследования дополняются изучением антигенных структур, а также аллергическими пробами с туберкулином и сенситинами, серологическими реакциями у больных.
Определенную роль в клинике туберкулеза органов дыхания играет вторичная — смешанная — инфекция, что связано прежде всего с тем что при нем нередко отмечаются хронический бронхит и пневмония, пневмосклероз, бронхоэктазы. Эти изменения могут сопутствовать туберкулезу или становятся его осложнением, особенно при длительном течении. В том и другом случае, отмечают Н. В. Татарский и А. Я. Цигельник (1968), создаются условия для проявления активности вторичной флоры и развития ряда клинических симптомов: повышения температуры, увеличения количества мокроты, нарастания катаральных явлений в легких, амилоидоза и т. д. При бактериологическом исследовании при этом обнаруживают различного вида стрептококки и стафилококки, грамположительные и грамотрицательные кокки, кишечную палочку и т. д. Все они имеют различную степень чувствительности к отдельным антибиотикам. При этом обязательным является выделение чистых культур и определение их патогенности.
При дифференциальной диагностике туберкулеза и глубоких микозов— аспергиллеза, гистоплазмоза, актиномикоза, кокцидиомикоза, нокаридиоза, кандидомикоза и т. д. — важно не только тщательно исследовать нативные и окрашенные препараты мокроты на присутствие дрожжеподобных грибов рода Candida, Coccidoides immitis, Histoplasma capsulatum, Aspergillus fumigatus и т. д., но и производить посевы на специальные питательные среды, главным образом на среду Сабуро с агаром или без него. Положительные результаты приобретают большее диагностическое значение, если одновременно у больных выявляются кожные реакции на кокцидиоидин, гистоплазмин, аспергиллин, бластомицин и др., а также серологические реакции с соответствующими антигенами (реакция преципитации, связывания комплемента).
Лабораторная диагностика туберкулеза. Выявление бактерий туберкулеза.
В распознавании и дифференциальной диагностике туберкулеза, а также в определении эффективности проводимого лечения важную роль играют лабораторные методы исследования. Среди них большое значение имеют прежде всего способы обнаружения микобактерии туберкулеза в различных выделениях, воспалительных экссудатах, жидкостях и тканях организма больного.
При туберкулезе легких микобактерии находят прежде всего в мокроте. Частота, массивность и постоянство бацилловыделения зависят от формы процесса. Оно часто имеет место при инфильтративном и особенно деструктивном туберкулезе легких. Реже или периодически выделяют микобактерии больные очаговыми, диссеминированными и цирротическими формами туберкулеза без явного распада легочной ткани. Существенное значение имеет при этом состояние бронхов. При их специфическом поражении, но сохраненной дренажной функции микобактерии выявляются с мокротой сравнительно чаще и с большим постоянством, чем при нормальном состоянии бронхов или при их стенозе, вызывающем блокаду каверны.
Микобактерии туберкулеза находят в большом количестве в обильно выделяющейся мокроте, а в скудном отделяемом, наоборот, они встречаются реже и в виде единичных экземпляров. У больных, не выделяющих мокроту, лучшие результаты дает применение раздражающих аэрозольных ингаля пий 10—15% раствора поваренной соли в 1% растворе питьевой соды Н. М. Рудой и соавт. (1971) применяют с этой целью смесь, состоящую из 5 мл 10% раствора хлорида натрия, 1 мл химопсина, растворенного в физиологическом растворе, и 20 капель солутана.
Второе место по эффективности выявления бацилловыделения у больных, не выделяющих мокроту, занимает исследование промывных вод трахеи и бронхов, которое предложил Я. С. Зобин (1939). В настоящее время для анестезии гортани у взрослых применяют 0,25% раствор дикаина, разведенный в 10% растворе новокаина. Этот раствор наливают во время фонации на голосовые связки в количестве 0,5—1 мл. У больных с повышенным глоточным рефлексом этим раствором смазывают заднюю стенку глотки. Затем в трахею шприцем с напаянной канюлей вводят 10—20 мл физиологического раствора комнатной температуры.
При этом в результате раздражения слизистой оболочки бронхов возникает кашель, при котором из глубоких дыхательных путей вместе с введенной жидкостью выделяются слизь и мокрота. Это отделяемое исследуют на присутствие микобактерии туберкулеза или другой микробной флоры.
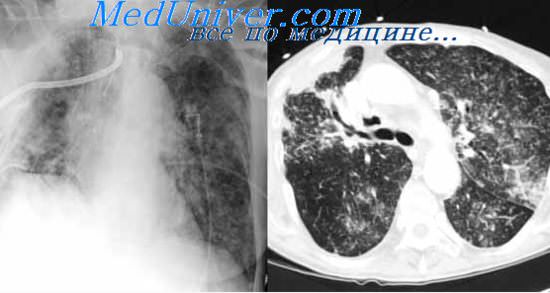
Исследование промывных вод бронхов редко сопровождается серьезными осложнениями. Только при сильном, длительном и приступообразном кашле иногда появляется кровохарканье, может аспирироваться инфекционный материал в здоровые участки легочной ткани, нарастает сердечная недостаточность. Такие явления отмечаются главным образом у больных с сопутствующей бронхиальной астмой, пороком сердца, гипертонией. В подобных случаях, очевидно, не следует прибегать к данному методу исследования. При отсутствии таких противопоказаний, особенно у больных с ограниченными формами процесса, у которых чаще всего и возникает необходимость в исследовании промывных вод бронхов, обычно не наблюдается каких-либо осложнений, и поэтому его можно производить не только в клинических, но и в амбулаторных условиях.
Менее эффективно производимое натощак исследование промывных вод желудка, в которых может содержаться бациллярная мокрота или бронхиальная слизь, чаще заглатываемая детьми, а иногда и взрослыми (Аrmand-Dellille, 1927). Кроме того, микобактерии могут проникать в желудок через его слизистую оболочку при гематогенном распространении инфекции в организме, а также при забрасывании бациоллосодержащей желчи (М. Д. Розанова, 1950). Пользоваться этим методом рекомендуется в тех случаях, когда не удается получить мокроту при раздражающих ингаляциях, при противопоказаниях к применению промывания бронхов или при невозможности их проведения по другим причинам.
Наименее информативно определение бацилловыделения с помощью исследований мазков слизи из гортани, а также промывания только верхних отделов дыхательных путей.
У части больных можно выделить микобактерии из крови. По наблюдениям 49 авторов, обобщенным в 1954 г. Dalencour, бациллемия отмечалась в среднем у 5,3% больных различными формами туберкулеза. П. И. Беневоленский (1945) установил ее у 3,7% больных туберкулезом легких (исключая страдающих гематогенным процессом). Чаще обнаруживают микобактерии в крови при туберкулезе кожи, обширных гематогенных диссеминациях в легких, при менингите. Однако, по сводным данным Kallos (1937). основанным на изучении гемокультур, выделенных от 14 502 больных, туберкулезная бациллемия имела место всего лишь у 1,13% из них.
Частота выявления микобактерии зависит не только от формы заболевания, метода получения материала, но и от способа его исследования (бактериоскопия, посев, заражение животных). Микобактерии туберкулеза обнаруживают при прямой бактериоскопии мазков мокроты, окрашенных по Цилю—Нельсену, при микроскопии с использованием метода обогащения — флотации и люминесцентного способа исследования. Методы обогащения повышают частоту обнаружения микобактерии туберкулеза в мокроте, промывных водах желудка и бронхов, в экссудате, спинномозговой жидкости, в каловых массах на 10—20% по сравнению с результатами прямой бактериоскопии.
Среди бактериоскопических методов выявления бацилловыделения наиболее чувствительным является люминесцентная микроскопия, повышающая возможность обнаружения в мокроте микобактерии на 15—20% по сравнению с обычной бактериоскопией, а при исследовании мазков из флотационных колец — на 8—10%. При этом облегчается изучение некоторых биологических свойств возбудителя — старения культур, аутолиза клеток и др.
Некоторые авторы утверждают, что при флюоресцентной (люминесцентной) микроскопии микобактерии туберкулеза можно выявить даже чаще, чем при посевах мокроты и других материалов на различные питательные среды. Kolbel (1955) обнаружил их при простой бактериоскопии у 39,7% больных, при бактериологическом методе — у 52,1%, а при люминесцентной микроскопии — у 73,6%. На преимущество последнего метода указывают Т. Н. Ященко и И. С. Мечева (1973), Н. С. Страхов и соавт. (1973).
Для суждения об эффективности проводимой антибактериальной терапии придают прогностическое значение уменьшению (или сохранению) в динамике массивности бацилловыделения. Поэтому целесообразно не только констатировать бацилловыделение, но и оценивать его количественный показатель. При этом при бактериоскопии бацилловыделение оценивается как обильное, если находят микобактерии в каждом поле зрения, умеренное — при наличии «единичных микробов в 40—50 полях зрения и скудное — при нахождении их единичных экземпляров в препарате.
Внелегочный туберкулез (ВЛТ) — актуальная проблема фтизиатрии. Из-за сложности диагностики и лечения привлекает все большее внимание врачей различных специальностей (хирургов, педиатров, ортопедов, урологов, офтальмологов, онкологов и др.).

В зависимости от уровня деятельности диагностических служб удельный вес ВЛТ среди всех форм туберкулеза составляет 4–16% в СНГ (в Беларуси — 8–10%). Показатель в высокоразвитых странах Европы и Америки — от 1/4 (Австрия, Швейцария, Германия) до 1/3 (США) и даже — 1/2 (Канада) от всех выявленных случаев туберкулеза.
Частично эти различия объясняются тем, что в указанных странах внелегочными формами туберкулеза считаются процессы, локализующиеся вне легочной паренхимы, в т. ч. плевриты, внутригрудные лимфадениты и др. Относительное благополучие эпидемиологических показателей по ВЛТ не отражает истинной картины заболеваемости: по литературным данным, количество неучтенных больных с ВЛТ в мире достигает 36%.
Значительный рост заболеваемости туберкулезом легких предопределяет увеличение заболеваемости ВЛТ в 2–3 раза через 5–10 лет, а в отдельных случаях — через 25–30 лет, когда ситуация с туберкулезом легких улучшится.
В России на 1 месте по частоте из внелегочных форм — туберкулез периферических лимфатических узлов (ЛУ), на 2 — мочеполовой, на 3 — костносуставной.
Можно уверенно утверждать, что в организме человека нет органов и тканей, которые не поражаются туберкулезом. Разница лишь в частоте поражения органа и в выявляемости.
Возрастнополовой состав больных ВЛТ интересен фактом преобладания женщин (59–63%), в то время как среди больных туберкулезом органов дыхания превалируют мужчины (до 70%). Эта тенденция наиболее выражена при туберкулезе мочеполовой системы у больных 5–39 лет (>75% — женщины). Дети среди заболевших ВЛТ составляют 7–10%.
Удельный вес костносуставного туберкулеза чаще наиболее высок у детей 0–4 лет, что частично обусловлено высокой частотой БЦЖ — оститов в этом возрасте. Среди взрослых больных частота костносуставного туберкулеза выше у лиц старше 50 лет. Туберкулез органа зрения, наоборот, чаще диагностируется в возрасте 20–40 лет (около 50% случаев), а в старших возрастных группах — значительно реже (10%). Туберкулез периферических ЛУ встречается одинаково часто в возрасте 4–60 лет. Значительную часть среди пациентов составляют люди 25–45 лет, имеющие достаточно благоприятные бытовые условия.
Наиболее опасно заражение микобактериями туберкулеза (МБТ) в раннем детском возрасте, когда могут развиваться генерализованные формы; в 7–14 лет дети более устойчивы к инфекции, и заражение реже приводит к заболеванию. В 14–16 лет наступает снижение сопротивляемости организма, на фоне которого у инфицированных ранее детей происходит реактивация первичной инфекции, а само заболевание протекает более тяжело.
Вегетация МБТ в очагах внелегочной локализации происходит в условиях повышенного ацидоза и анаэробиоза, поэтому имеются некоторые биологические особенности возбудителя туберкулеза, выделенного из внелегочных очагов: жизнеспособность и ферментативная активность МБТ значительно снижена, по сравнению с возбудителем легочного процесса. Лекарственная устойчивость МБТ из очагов ВЛТ наблюдается реже, однако в последние годы отмечается неблагоприятная тенденция к увеличению частоты лекарственной устойчивости МБТ к 2, 3 и более противотуберкулезным препаратам. При ВЛТ, как и при легочном, МБТ чаще всего устойчивы к стрептомицину, изониазиду, рифампицину, мультирезистентность МБТ из внелегочных очагов составляет в последние годы до 27%.
Диагностика
Имеются трудности и значительное количество ошибок в диагностике ВЛТ, поскольку туберкулез традиционно ассоциируется с поражением легких, и невольно игнорируется реальность внелегочной локализации (по материалам аутопсий нефтизиатрических стационаров даже в странах с высокой медтехнологией более половины случаев ВЛТ прижизненно не распознается).
Большая часть больных, подвергающихся оперативному лечению по поводу ВЛТ, уже были оперированы в учреждениях общелечебной сети, и у 40% из них возникли осложнения (абсцессы, свищи, парезы и др.), вызванные неадекватным объемом проведенных оперативных вмешательств.
Верификация диагноза при ВЛТ, особенно на ранних стадиях развития, относится к числу наиболее сложных задач клинической фтизиатрии, поскольку результативность бактериологического и морфологического исследований при большинстве локализаций невысока. Так, при туберкулезном менингите МБТ обнаруживаются в спинномозговой жидкости в 11–52% случаев, при туберкулезе женских половых органов бактериологическая и/или гистологическая верификация составляет 8–30%, при туберкулезе периферических лимфатических узлов МБТ обнаруживаются в 15–55% случаев, а диагностика туберкулезного поражения органа зрения и вовсе исключает возможность использования вышеуказанных методов. В целом, среди больных ВЛТ бактериологическое подтверждение имеется не более чем у 40% от общего числа (что вообще характерно для ВЛТ).
Одной из причин диагностических ошибок в распознавании туберкулеза внелегочной локализации может быть наличие у части больных неспецифических проявлений, связанных не с развитием специфического воспаления, а с реакцией иммунокомпетентной системы в ответ на туберкулезную инфекцию. Развитие таких реакций наблюдается преимущественно при первичном туберкулезе и при гематогенной диссеминации.
Спектр параспецифических реакций может включать клиниколабораторные синдромы:
• кожные проявления в виде узловатой эритемы;
• суставной параспецифический синдром (артралгии);
• полисерозиты (плевриты, перикардиты, асциты);
• поражение миокарда (неспецифический миокардит);
Эти симптомы не являются проявлением ВЛТ, они обусловлены токсическим поражением капилляров у больных туберкулезом. Один из важнейших общих принципов своевременной диагностики ВЛТ — обязательное изучение анамнеза с особым вниманием к факторам риска.
Факторы риска ВЛТ:
• период виража туберкулиновой чувствительности и гиперергическая проба Манту с 2 ТЕ у ребенка и подростка;
• контакт с больным туберкулезом человеком или животным (проживание в очаге туберкулезной инфекции или очаге смерти);
• наличие активного или неактивного туберкулеза органов дыхания и других органов.
В диагностике поможет подробная информация о наблюдавшихся ранее симптомах туберкулезной интоксикации, плеврите, периферическом лимфадените, пневмониях, частых простудных заболеваниях. В комплекс диагностических мероприятий при подозрении на туберкулез органа зрения и женских половых органов обязательно включаются провокационные туберкулиновые пробы.
Из лабораторных методов диагностики определенное значение имеет ПЦР, обладающая при ВЛТ достаточно высокой чувствительностью и специфичностью (особенно при туберкулезе периферических лимфатических узлов и женских половых органов). Единственный метод верификации диагноза туберкулеза периферических ЛУ — гистологическое исследование (и/или бактериологическое).
Традиционно диагностика ВЛТ, особенно костносуставного и мочеполового, базируется на рентгенологическом исследовании, сохраняющем и в настоящее время свое основное, базовое значение. С конца 90х г.г. прошлого века в клиническую практику вошли прогрессивные методы визуализации патологии, значительно расширяющие возможности лучевой диагностики: ультрасонография (УЗИ), радионуклидные исследования, рентгеновская компьютерная томография, магнитнорезонансная томография. Каждый из методов имеет свои возможности и ограничения, для их использования существуют конкретные показания и диагностические алгоритмы. В этом ряду МРТ заняла особое положение в диагностике заболеваний костносуставной системы и считается многими авторами методом выбора в диагностике воспалительных заболеваний позвоночника.
Если весь комплекс обязательных и дополнительных методов исследования не позволил обосновать диагноз, возможно назначение тесттерапии.
Диагностика внелегочных форм туберкулеза зависит от многих факторов, но она невозможна без тесного сотрудничества рентгенологов и фтизиатров.
Сергей МАРУТКО, зав. отделением для лечения больных костносуставным туберкулезом 1го городского противотубдиспансера Минска;
Наталья МОРОЗКИНА, доцент кафедры фтизиопульмонологии БГМУ
Медицинский вестник, 13 ноября 2008
Читайте также:

