Ост для исследования на нематодозы
Обновлено: 19.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Амилоидоз: причины появления, симптомы, диагностика и способы лечения.
Амилоидоз – это системное заболевание, характеризующееся накоплением в клетках различных органов патологически нерастворимого белка-амилоида (фибриллярного гликопротеида), которое приводит к склерозу тканей, их последующей атрофии и некрозу, развитию полиорганной недостаточности.
Причины появления амилоидоза
Точная причина амилоидоза до сих пор не установлена. Многие ученые ставят во главу угла генетическую предрасположенность и некоторые системные заболевания, среди которых особо отмечают ревматоидный артрит, спондилоартропатии, аутовоспалительные наследственные периодические лихорадки, а также туберкулез.
Заболевание может манифестировать и без видимой причины, а также проявиться в старческом возрасте.
Классификация заболевания
Существуют две основные формы амилоидоза:
- системный (поражает ткани большинства органов);
- локальный (поражает ткани отдельного органа: почек, сердца, кожи и др.).
- Первичный (идиопатический) амилоидоз, , или AL-амилоидоз характеризуется появлением в плазме крови и отложением в тканях различных органов аномальных легких цепей иммуноглобулинов.
- Вторичный (общий) амилоидоз развивается на фоне таких хронических заболеваний, как бронхит, туберкулез, остеомиелит, сифилис и др., поэтому долгое время может не диагностироваться.
- Наследственный амилоидоз вызван мутациями генов иммунной системы, что приводит к образованию клеток, продуцирующих амилоид. К наследственному амилоидозу можно отнести лихорадку, семейный нейропатический, нефропатический и кардиопатический амилоидоз.
- Старческий церебральный амилоидоз считается наиболее опасным, поскольку поражает сердце, поджелудочную железу, легкие и головной мозг.
- Опухолевый амилоидоз проявляется отложением амилоида в тканях пораженного опухолью органа, в результате чего злокачественный процесс быстро прогрессирует.
Проявления заболевания разнообразны и обусловлены локализацией, выраженностью, продолжительностью амилоидоза и степенью вовлечения в процесс внутренних органов. Если на ранней стадии характерных симптомов амилоидоза может почти не быть, то по мере развития болезни клинические проявления постепенно нарастают.
Общие признаки амилоидоза:
- отсутствие аппетита и потеря веса;
- усталость и слабость;
- отеки;
- симптомы сердечной недостаточности;
- раздражительность и перепады настроения;
- миалгия (боль в мышцах);
- трофические язвы;
- рвота;
- диарея;
- кожный зуд;
- сонливость;
- частые головокружения;
- бледность кожных покровов из-за развития анемии.
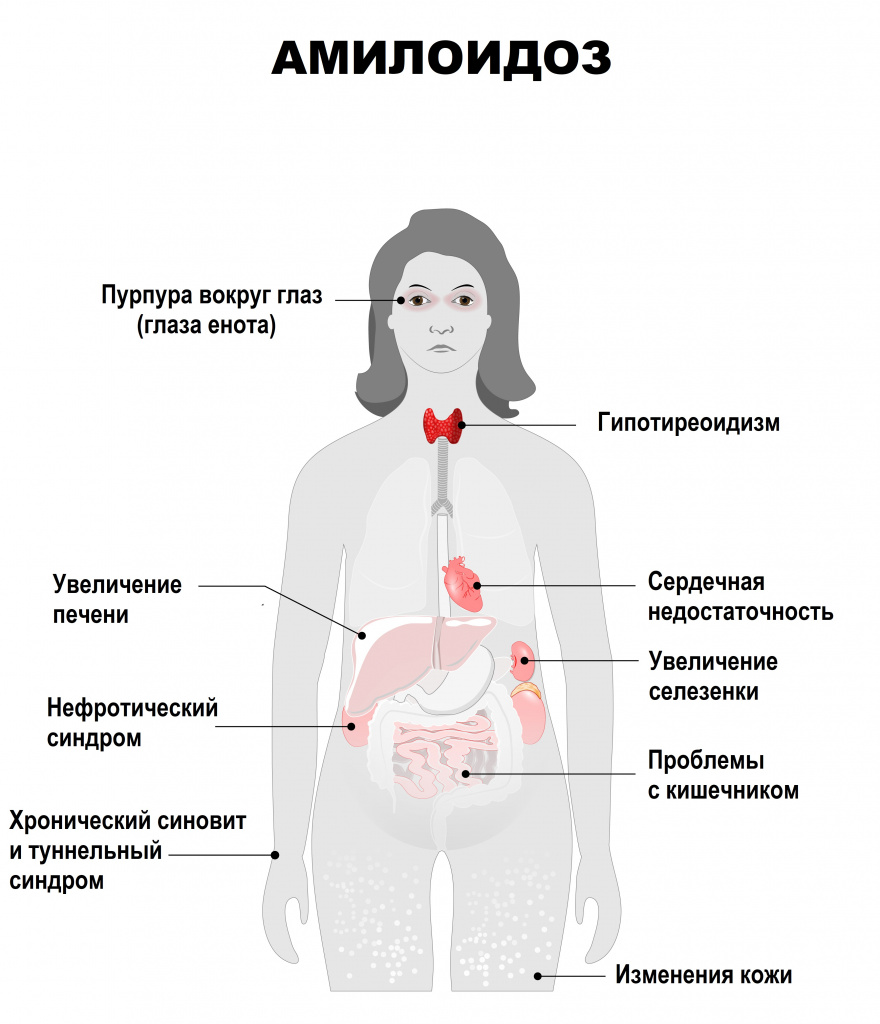
При поражении желудка пациенты жалуются на боль и тяжесть в эпигастрии, нарушение перистальтики, вздутие живота.
Амилоидоз кишечника манифестирует тупой болью и тяжестью в животе, диареей или запорами, непроходимостью кишечника, вздутием живота. Поражение пищеварительной системы сопровождается увеличением языка, трудностями при глотании, отрыжкой, частой изжогой.
Характерными признаками поражения печени становятся желтуха, боль в правом подреберье, асцит (скопление жидкости в брюшной полости), портальная гипертензия, которая проявляется снижением аппетита, тошнотой, рвотой, урчанием и вздутием живота, а также диареей и метеоризмом. Затем появляется боль в области пупка.
При амилоидозе сердца наблюдаются аритмия, одышка, плохо поддающаяся лечению сердечная недостаточность, проявляющаяся отеками.
Если амилоид откладывается в суставах, у больных развивается артрит: кожа в проекции суставов отекает и краснеет, движения в патологическом суставе становятся ограниченными.
Поражение нервной системы опасно нарушением умственных способностей, психическими отклонениями, параличами рук и ног.
Органы дыхания реагируют на патологию затруднением дыхания, одышкой, охриплостью голоса, бронхолегочными заболеваниями.
Для кожного амилоидоза характерно формирование бляшек, сыпи, узелков, шелушение.
Диагностика амилоидоза
Для выявления заболевания и определения степени поражения органов назначают:
-
ультразвуковое исследование органов брюшной полости;
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ МИКРООРГАНИЗМОВ
К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: Центральным научно-исследовательским институтом эпидемиологии (Н.А.Семина, С.В.Сидоренко); Государственным научным центром по антибиотикам (С.П.Резван, С.А.Грудинина); Научно-исследовательским институтом антимикробной химиотерапии Смоленской государственной медицинской академии (Л.С.Страчунский, О.У.Стецюк, Р.С.Козлов, М.В.Эйдельштейн); Кафедрой микробиологии и химиотерапии Российской медицинской академии последипломного образования (Е.А.Ведьмина, Л.Г.Столярова, И.В.Власова); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (З.С.Середа).
2. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 4 марта 2004 г.
3. ВВЕДЕНЫ ВЗАМЕН "Методических указаний по определению чувствительности микроорганизмов к антибиотикам методом диффузии в агар с использованием дисков", утв. Заместителем Главного государственного санитарного врача СССР В.Е.Ковшило 10 марта 1983 г. N 2675-83.
1. Область применения
1.1. В настоящих методических указаниях изложены стандартные методы определения чувствительности микроорганизмов к антибактериальным препаратам (методы серийных разведений и диско-диффузионный метод).
1.2. Методические указания предназначены для применения в микробиологических лабораториях учреждений государственной санитарно-эпидемиологической службы и здравоохранения.
2. Общие сведения
Определение чувствительности микроорганизмов - возбудителей инфекционных заболеваний человека к антибактериальным препаратам (АБП) - приобретает все более важное значение в связи с появлением и широким распространением антибиотико-резистентности у бактерий. Стандартные методы определения чувствительности микроорганизмов к АБП (диско-диффузионный и серийных разведений) были разработаны во второй половине 60-х - начале 70-х годов XX века и с тех пор с методической точки зрения не претерпели принципиальных изменений.
Однако внедрение в клиническую практику значительного количества новых АБП и появление новых механизмов антибиотико-резистентности у микроорганизмов потребовало более строгой стандартизации процедуры тестирования, разработки новых подходов к интерпретации результатов, внедрения современной системы внутреннего контроля качества на каждом этапе исследования.
В настоящих методических указаниях систематизированы современные подходы к определению чувствительности бактериальных возбудителей инфекционных заболеваний человека, учитывающие рекомендации Европейского комитета по определению чувствительности к антибиотикам, а также Национального комитета по клиническим лабораторным стандартам США.
Исследования чувствительности микроорганизмов к АБП осуществляются для решения следующих задач:
- обоснование целенаправленной индивидуальной антибактериальной терапии для лечения конкретной инфекционной болезни отдельным пациентам;
- обоснование эмпирической терапии отдельных нозологических форм инфекционных болезней в пределах лечебных учреждений или географических регионов;
- осуществление наблюдения за распространением антибиотико-резистентности в отдельных учреждениях или географических регионах;
- исследование новых химических соединений на наличие антибактериальной активности.
3. Показания для исследования чувствительности микроорганизмов
к антибактериальным препаратам
В ходе повседневной деятельности в бактериологических лабораториях из различных биологических материалов и объектов внешней среды выделяют множество бактерий, относящихся к различным таксономическим группам. Однако определение чувствительности выделенных микроорганизмов к АБП показано далеко не во всех случаях. Определение показаний для исследования чувствительности микроорганизмов к АБП является обязанностью врача-бактериолога.
Определять чувствительность к АБП представителей нормальной микрофлоры человека, при их выделении из естественных мест обитания, бактерий, выделенных из объектов внешней среды, за исключением случаев проведения специальных исследований, нецелесообразно.
Обязательному исследованию на чувствительность к АБП подлежат все микроорганизмы, выделенные из первично стерильных жидкостей, органов и тканей человека. В остальных случаях оценке чувствительности должна предшествовать оценка клинической значимости выделенного микроорганизма.
Определение чувствительности выделенного штамма микроорганизма показано, если уровень его устойчивости к АБП не может быть предсказан на основании данных идентификации или вероятной таксономической принадлежности микроорганизма. Практически важной задачей является выявление приобретенной резистентности к АБП у природно-чувствительных к ним микроорганизмов. Подтверждение природной чувствительности или резистентности микроорганизма к АБП не является целью практических исследований.
Исследованию по оценке антибиотикочувствительности подлежат чистые культуры микроорганизмов или материал изолированных колоний с плотных питательных сред после первичного посева образца клинического материала, в последнем случае параллельно необходимо провести идентификацию культуры.
При обнаружении на плотных питательных средах после первичного посева смешанной культуры исследовать антибиотикочувствительность до идентификации и оценки этиологической значимости отдельных микроорганизмов нецелесообразно.
Прямое определение чувствительности с использованием клинического материала (без выделения чистой культуры) возможно только в исключительных случаях при условии подтверждения однородности культуры и высокой степени обсемененности при окраске по Граму, причем исследование следует повторить после выделения чистой культуры микроорганизма.
Следует уделять особое внимание определению чувствительности микроорганизмов, относящихся к таксономическим группам, для которых характерна высокая частота распространения приобретенной резистентности.
У микроорганизмов, проявляющих универсальную чувствительность к каким-либо АБП, т.е. когда случаев резистентности не описано (например, Streptococcus pyogenes - все штаммы чувствительны к пенициллину), проводить определение чувствительности к этим препаратам в повседневной практике нецелесообразно.
Факты выявления резистентности у микроорганизмов, для которых этот феномен ранее не был описан в научной литературе, следует оценивать с крайней осторожностью и рекомендуется обращаться за консультациями в лаборатории, занимающиеся изучением антибиотико-резистентности.
Не следует в практических целях исследовать микроорганизмы, для которых методы определения чувствительности в настоящее время не стандартизованы и отсутствуют критерии интерпретации результатов. Результаты, полученные в данном случае, не могут служить основанием для назначения антибактериального препарата, если соответствующая нозологическая форма не приведена в утвержденной инструкции по его применению.
4. Методы определения чувствительности микроорганизмов
к антибактериальным препаратам
4.1. Общая характеристика методов
Современные стандартизованные методы определения чувствительности микроорганизмов к АБП подразделяют на методы серийных разведений и диффузионные.
Методы серийных разведений основаны на прямом определении основного количественного показателя, характеризующего микробиологическую активность АБП - величины его минимальной подавляющей концентрации (МПК).
МПК - минимальная концентрация, подавляющая видимый рост исследуемого микроорганизма в бульонной культуре или на плотной среде.
Для определения МПК заданные концентрации АБП вносят в питательную среду, которую затем засевают культурой исследуемого микроорганизма и после инкубации оценивают наличие или отсутствие видимого роста.
В зависимости от характера используемой питательной среды различают методы серийных разведений в агаре или в бульоне. В зависимости от объема используемой жидкой питательной среды выделяют методы серийных макро- и микроразведений.
Разновидностью метода серийных разведений является также метод, основанный на использовании только двух концентраций АБП, соответствующих пограничным значениям МПК (см. ниже). Этот принцип исследования широко используется в автоматизированных системах для определения чувствительности микроорганизмов.
Диффузионные методы определения чувствительности основаны на диффузии АБП из носителя в плотную питательную среду и подавлении роста исследуемой культуры в той зоне, где концентрация АБП превосходит МПК.
В настоящее время существуют две основные модификации диффузионного метода: диско-диффузионный и Е-тест.
В диско-диффузионном методе в качестве носителя АБП используют бумажный диск. Образование зоны подавления роста происходит в результате диффузии АБП из носителя в питательную среду. В определенных пределах величина диаметра зоны подавления роста обратно пропорциональна МПК. Однако диско-диффузионный метод позволяет лишь косвенно судить о величине МПК, а результатом исследования является отнесение микроорганизма к одной из категорий чувствительности (чувствительный, промежуточный или резистентный).
Е-тест представляет собой узкую полоску полимера (0,5х6,0 см), на которую нанесен градиент концентраций АБП (от минимальных до максимальных). Подавление роста микроорганизма вокруг полоски Е-теста происходит только в той зоне, где концентрация АБП, диффундирующего из носителя, выше МПК, при этом образуется каплевидная зона ингибиции. Значения концентрации АБП в каждом участке носителя типографским способом нанесены на наружной (обращенной к исследователю) поверхности Е-теста. Величину МПК учитывают в том месте, где граница зоны подавления роста вплотную подходит к носителю. Детальные инструкции по определению чувствительности с использованием Е-тестов прилагаются изготовителем к набору реактивов.
4.1.1. Основные этапы проведения тестирования
Оценка антибиотикочувствительности, независимо от конкретного метода, предполагает последовательное выполнение нескольких этапов:
- приготовление питательных сред;
- приготовление суспензии исследуемых микроорганизмов (инокулюма);
- учет и интерпретация результатов, формулировка рекомендаций по лечению.
Диффузионные методы включают также этап наложения дисков или полосок Е-теста на плотную питательную среду.
4.1.2. Приготовление питательных сред для определения чувствительности
Для оценки чувствительности используют специально предназначенные для этой цели среды, разрешенные к применению в Российской Федерации в установленном порядке и по своим характеристикам удовлетворяющие требованиям, приведенным в разделе 5. Внутрилабораторный контроль качества среды проводят при использовании всех сред, разрешенных к применению в Российской Федерации в установленном порядке.
Вид питательной среды для оценки чувствительности определяют выбранным методом проведения исследования (агар или бульон), а также видом тестируемого микроорганизма.
Агар разливают по чашкам слоем толщиной 4 мм (на чашку диаметром 100 мм требуется 25 мл агара, на чашку диаметром 90 мм - 20 мл). Чашки оставляют при комнатной температуре для застывания. Приготовленные указанным образом чашки Петри предпочтительнее использовать немедленно. Допускается хранение в запаянных полиэтиленовых пакетах в холодильнике при 4-8 °С в течение 5 суток.
4.1.3. Приготовление суспензии исследуемых микроорганизмов (инокулюма)
Общим и принципиально важным для всех методов тестирования является стандартизация суспензии исследуемого микроорганизма, ее концентрация должна составлять 1,5·10 КОЕ/мл. Практически наиболее приемлемым методом оценки концентрации бактериальной суспензии является измерение ее оптической плотности. Оптическая плотность бактериальной суспензии с концентрацией 1,5·10 КОЕ/мл при визуальном контроле соответствует стандарту мутности 0,5 по МакФарланду. Контроль оптической плотности суспензии можно также осуществлять спектрофотометрически (денситометрически). Существуют коммерчески доступные стандарты мутности и спектрофотометры. Бактериальную суспензию можно готовить либо из бульонной, либо из агаровой культуры.
Приготовление инокулюма из агаровой культуры
Для приготовления инокулюма используют чистую суточную культуру микроорганизмов, выросших на плотных питательных средах. Отбирают несколько однотипных, четко изолированных колоний, выросших на неселективных плотных питательных средах. Петлей переносят незначительное количество материала с верхушек колоний в пробирку со стерильным физиологическим раствором или питательным бульоном, доводя плотность инокулюма точно до 0,5 по стандарту МакФарланда. Инокулюм следует использовать в течение 15 мин после приготовления.
Приготовление инокулюма из бульонной культуры
При определении чувствительности быстро растущих бактерий с обычными питательными потребностями для приготовления инокулюма также можно использовать 5-6-часовую бульонную культуру микроорганизма. Для этого отбирают несколько однотипных изолированных колоний, петлей переносят незначительное количество материала в пробирку с 4,0-5,0 мл жидкой неселективной питательной средой. Инкубируют при 35 °С. Через 5-6 ч инкубации плотность микробной суспензии приблизительно соответствует необходимой, и ее точно доводят до 0,5 по МакФарланду путем добавления стерильного бульона или физиологического раствора.
Стандарт МакФарланда может быть либо приобретен, либо приготовлен в лаборатории.
4.1.4. Приготовление стандарта 0,5 по МакФарланду
К 0,5 мл раствора ВаСl в концентрации 0,048 моль/л (1,175% раствор ВаСl·2HO) медленно при тщательном перемешивании добавить 99,5 мл раствора HSO в концентрации 0,18 моль/л (1%) до получения гомогенной суспензии.
Полученную суспензию необходимо разлить по 4-6 мл в пробирки с герметично закрывающимися крышками. Пробирки должны быть такого же диаметра, как и используемые для приготовления бактериальной суспензии.
Хранить пробирки с суспензией необходимо в темноте при комнатной температуре.
Перед использованием пробирки необходимо тщательно встряхивать и оценивать однородность суспензии. При появлении видимых частиц пробирки изымаются из употребления.
Стандарт мутности необходимо обновлять или проверять его оптическую плотность ежемесячно.
4.2. Методы серийных разведений
4.2.1. Приготовление растворов АБП для методов серийных разведений
Общим и крайне важным этапом для всех методов серийных разведений является приготовление растворов АБП. Различают "основные" растворы АБП (пригодные для хранения) и "рабочие" - те, которые необходимо использовать "ех tempore" для приготовления питательных сред.
Для приготовления основных растворов АБП необходимо использовать субстанции АБП с известной активностью, лекарственные формы не пригодны. Для взвешивания субстанций необходимо использовать электронные лабораторные весы с точностью до 4 знака, для измерения объемов - калиброванные дозаторы и пипетки.
Категории МКБ: Амебиаз (A06), Анкилостомоз (B76.0), Аскаридоз (B77), Дикроцелиоз (B66.2), Дифиллоботриоз (B70.0), Другие инвазии, вызванные цестодами (B71), Инвазия, вызванная taenia saginata (B68.1), Инвазия, вызванная taenia solium (B68.0), Некатороз (B76.1), Описторхоз (B66.0), Стронгилоидоз неуточненный (B78.9), Токсоплазмоз (B58), Трихинеллез (B75), Трихуроз (B79), Фасциолез (B66.3), Цистицеркоз (B69), Энтеробиоз (B80)
Общая информация
Краткое описание
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ КЫРГЫЗСКОЙ РЕСПУБЛИКИ
ДЕПАРТАМЕНТ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ И ГОСУДАРСТВЕННОГО САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОГО НАДЗОРА
КЫРГЫЗСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ ПЕРЕПОДГОТОВКИ И ПОВЫШЕНИЯ КВАЛИФИКАЦИИ
КЫРГЫЗСКО-РОССИЙСКИЙ СЛАВЯНСКИЙ УНИВЕРСИТЕТ им. Б.Н.ЕЛЬЦИНА
ДИАГНОСТИКА, ЛЕЧЕНИЕ И ПРОФИЛАКТИКА ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ
Клинические протоколы
Клинические протоколы (КП) по диагностике, профилактике и лечению паразитарных заболеваний приняты Экспертным советом по оценке качества клинических руководств/протоколов от 15.12.2017 г. и утверждены приказом Министерства здравоохранения Кыргызской Республики (МЗ КР) № 42 от 18 января 2017 г.
Клиническая проблема
Кишечные гельминтозы, протозоозы и тканевые паразитозы
Название документа
Диагностика, профилактика и лечение паразитарных заболеваний
Этапы оказания помощи
1-3 уровни медицинской помощи
Клинические протоколы применимы
к пациентам с кишечными гельминтозами, протозоозами и тканевыми паразитозами.
Целевые группы
Врачи-инфекционисты, семейные врачи, педиатры, аллергологи, окулисты, пульмонологи, эпидемиологи, паразитологи, лабораторные специалисты, организаторы здравоохранения, специалисты Фонда обязательного медицинского страхования (ФОМС), ординаторы, аспиранты, студенты и др.
Планируемая дата обновления
Проведение следующего пересмотра КП планируется в 2020 г., либо раньше, по мере появления новых ключевых доказательств по лабораторной, клинической диагностике и/или лечению паразитарных болезней.
В связи с тем, что новая стратегия по противорецидивной, консервативной терапии эхинококкоза и альвеококкоза находится на стадии разработки, клинические протоколы лечения данных личиночных гельминтозов исключены из данного сборника протоколов. После рассмотрения экспертным советом и утверждения МЗ КР, они будут изданы как дополнение к данному сборнику. В процессе апробации и рецензирования клинического протокола были получены комментарии и рекомендации, которые были учтены при его доработке.
Ожидаемый результат от внедрения данного клинического протокола
Внедрение в практическое здравоохранение профилактического лечения круглых червей – нематодов у всех членов семьи, включая беременных женщин с 3 триместра в эпидемиологически неблагополучных регионах (область, район, село), обеспечит оздоровление от нематодозов всей семьи и предупреждению риска постоянного перекрестного инвазирования членов семьи друг от друга, а также от других членов сообщества (в детских садах, школах, коллективах и тд). Лечение женщин во время беременности приведет к оздоровлению будущей мамы и снижению риска передачи инвазии детям грудного и раннего возраста.
Введение
Гельминтные инвазии в основном бывают двух типов: передаваемые через воду и передаваемые через почву ‒ геогельминты. Последние принадлежат к двум группам: нематодам (круглые черви) и платигельминтам (плоские черви) и живут в кишечнике человека, ежедневно выделяя тысячи яиц, которые попадают в почву с фекалиями инфицированных людей. При этом, яйца проглатываются детьми, которые берут грязные пальцы в рот после игр на земле (контакт с почвой); вместе с овощами, если овощи, не моются, не очищаются и не готовятся надлежащим образом; с водой из загрязненных источников и т. д. 1 .
После развития зрелых гельминтов в организме человека, они могут вызвать нарушение переваривания жиров, снижение абсорбции витаминов (особенно витамина А), временную непереносимость лактозы, снижение гемоглобина и железа, подавление аппетита и иммунной реакции, оказывают воздействие на рост, вес и познавательные функции инфицированных детей. Некоторые нематоды, в частности Trichuris trichiura, присасываются в слизистую оболочку кишечника и питаются кровью. Они выделяют антикоагулянты, вследствие чего повреждения кровоточат, что в итоге вызывает железодефицитную анемию.
Таким образом, паразиты могут быть опасными как для здоровья каждого человека, так и для всего сообщества в целом, в связи с чем большинство стран мира осуществляют различные программы, рекомендованные ВОЗ по профилактике и лечению паразитозов среди населения, особенно среди групп риска 1
Стратегия ВОЗ по борьбе с геогельминтами 1
ВОЗ рекомендует проводить ПЛ раз в год в случае, если распространенность гельминтозов, передаваемых через почву превышает 20% и дважды в год в случае, если этот показатель в сообществе превышает 50%.
Данная стратегия преследует глобальную цель – профилактическое лечение (ПЛ), по меньшей мере, 75% всех детей школьного возраста, подвергающихся риску заболевания геогельминтами. Направлена на профилактику и установление контроля над заболеваемостью геогельминтами путем проведения периодического ПЛ населения без предварительного индивидуального диагностического исследования всех людей из групп риска (дети дошкольного возраста, дети школьного возраста, включая подростков, а также беременные женщины со 2-го триместра) в эндемичных районах. Освобождение организма от гельминтов, путем ПЛ приводит к улучшению аппетита, что может способствовать увеличению роста и прибавки веса, также снижает заболеваемость и бремя болезни, вызванное наличием паразитов.
Важно отметить, что прием препаратов, используемых для ПЛ, детьми в возрасте до 12-месячного возраста не рекомендуется, так как безопасность и эффективность этих препаратов у детей данной возрастной группы не были подтверждены.
Профилактическое лечение однократной дозой альбендазола (400 мг) или мебендазола (500 мг) рекомендуется для беременных женщин после первого триместра, проживающих в районах, где распространенность нематодозов и/или трихоцефалеза составляет 20% или более (40% и более среди беременных женщин) и где анемия является серьезной проблемой общественного здравоохранения (условная рекомендация, среднее качество доказательств) 2 или в качестве лечения инфицированных беременных женщин в неэндемичных районах 3 .
Рекомендуемые ВОЗ лекарственные средства: альбендазол (400 мг) и мебендазол (500 мг) — эффективны, недороги и просты для распространения немедицинским персоналом (например, учителями). Они прошли экстенсивное тестирование на безопасность и использовались среди миллионов людей, при этом наблюдалось лишь незначительное количество умеренных побочных эффектов.
Синонимы: TREC и KREC в крови методом ПЦР; анализ TREC и KREC для диагностики первичных иммунодефицитных состояний; TREC/KREC для постнатальной диагностики первичных иммунодефицитных состояний.
Краткое описание исследования TREC и KREC для диагностики иммунодефицитов
TREC и KREC являются кольцевыми ДНК-структурами и образуются как побочный продукт формирования специфических рецепторов T- и B-лимфоцитов. Благодаря их стабильной структуре и локализации внутри ядра их количество может быть измерено в периферической крови спустя длительное время после окончания дифференцировки клеток. Снижение уровня TREC и KREC является косвенным отражением лимфопении и нарушения созревания T- и/или B-лимфоцитов, сопровождающих целый ряд иммунодефицитных состояний.
TREC, или Т-рецепторное эксцизионное кольцо (T-cell receptor excision circle) формируется в тимусе в наивных Т-лимфоцитах в ходе VJ-рекомбинации TRA и TRD генов соответствующего рецептора. Образующиеся во время этого процесса кольцевидные фрагменты ДНК могут быть измерены методом количественной ПЦР. Концентрация TREC отражает общий пул наивных Т-лимфоцитов, недавно мигрировавших из вилочковой железы. Снижение уровня TREC ниже возрастных норм отражает как количественные изменения числа T-лимфоцитов, так и нарушение процессов их созревания и может наблюдаться при ряде иммунодефицитных состояний: тяжелые комбинированные иммунодефициты (ТКИН), 22q11 делеционный синдром (синдром Ди Джорджи), комбинированный иммунодефицит (КИН), атаксия-телеангиоэктазия (синдром Луи-Бар), синдром Вискотта-Олдрича, недостаточность DOCK8, гипогидротическая эктодермальная дисплазия с иммунодефицитом, трисомия 18 и 21 хромосомы, синдром Кабуки, CHARGE синдром, синдром Нунана, синдром Якобсена, синдром Ниймеген, синдром Фринса, синдром Шимке, метафизарная хондродисплазия Мак-Кьюсика, синдром CLOVES, синдром ЕЕС, дефект RAC2, синдром Ренпеннинга, TAR-синдром, а также состояния связанные с кольцевыми хромосомами 14, 17, а также микроделециями и микродупликациями хромосом 6p, 17p, 14q. Кроме этого, на концентрацию TREC могут влиять вторичные причины, такие как недоношенность ребенка, врожденные пороки сердца, хилоторакс, множественные аномалии развития, гастрошизис, неонатальная лейкемия, аутоиммунные заболевания у матери, ВИЧ-инфекция у матери, иммуносупрессия у матери.
KREC, или каппа-делеционное рекомбинационное эксцизионное кольцо (kappa-deleting recombination excision circle) образуется сходным образом в костном мозге в ходе рекомбинации IGK локуса легких цепей иммуноглобулинов B-лимфоцитов. Концентрация KREC отражает общий пул наивных недавно мигрировавших из костного мозга В-лимфоцитов. Уровень KREC снижен при нарушении дифференцировки B-клеточного звена иммунной системы и наблюдается при таких жизнеугрожающих состояниях как тяжелые комбинированные иммунодефициты (ТКИН), Х-сцепленной агаммаглобулинемии (болезнь Брутона) и XLA-подобных синдромах, синдроме Ниймеген. Кроме этого, на концентрацию KREC может влиять вторичные причины, такие как принятие различных медикаментов и иммуносупрессия у матери.
Причины изменения уровня TREC и KREC
В норме максимальные значения TREC и KREC наблюдаются у младенцев вскоре после рождения, затем их количество падает с течением жизни в связи с инволюцией тимуса и со снижением активности продукции наивных B-лимфоцитов в костном мозге. Однако снижение TREC и KREC ниже возрастных значений может быть проявлением приобретенных или стертых форм первичных и вторичных иммунодефицитов в любом возрасте. Часто причиной этого являются онкологические, гематологические, аутоиммунные заболевания, терапия иммуносупрессивными препаратами, инфицирование ВИЧ. Нередко снижение TREC и KREC обнаруживается у пациентов с вариабельными иммунодефицитами и у часто болеющих детей. Также восстановление количества TREC и KREC отражает эффективность репарации иммунной системы после перечисленных состояний, а также после перенесенной трансплантации костного мозга.
Читайте также:

