Острый гломерулонефрит развивается после перенесенной инфекции
Обновлено: 22.04.2024
Рассмотрены этиология и патогенез острого постинфекционного гломерулонефрита (ОПИГН), проведен анализ распространенности, особенностей клинико-лабораторной картины и течения ОПИГН у детей. Обсуждены вопросы профилактики ОПИГН, вызванного стрептококковой и
Acute glomerulonephritis with children- reasons of origin, clinical course and opportunities for prevention
Aetiology and pathogenesis of acute post-infectious glomerulonephritis (APIGN) were considered, analisis of prevalence and peculiarities of clinical and laboratory presentation and clinical course of APIGN with children was done. The issues of prevention of APIGN caused by streptococcosis were discussed.
Гломерулонефриты (ГН) по серьезности прогноза занимают одно из лидирующих положений в структуре болезней почек, возникающих в детском возрасте. Особое место среди ГН занимает острый постинфекционный гломерулонефрит (ОПИГН), представления об этиологии и патогенезе которого в последнее десятилетие претерпели значительные изменения. В настоящее время большинством клиницистов под ОПИГН понимается иммунокомплексное поражение гломерулярного аппарата почек, которое развивается после перенесенной бактериальной или вирусной инфекции. При типичном течении ОПИГН чаще проявляется острым нефритическим синдромом (артериальная гипертензия, отеки, макро- и микрогематурия, незначительная протеинурия), а также нарушением функции почек в остром периоде болезни вплоть до острой почечной недостаточности (ОПН). В клинической картине также возможны изменения со стороны сердечно-сосудистой системы, ангиоспастическая ретино- и энцефалопатия, которые связаны с объемной перегрузкой и представляют опасность для жизни. У больных с атипичным течением ОПИГН экстраренальные проявления отсутствуют либо они весьма незначительны и кратковременны.
Несмотря на выраженность клинических и лабораторных сдвигов, возникающих в дебюте заболевания, считается общепризнанным мнение о том, что в типичных случаях ОПИГН протекает циклически и у большинства детей заканчивается выздоровлением [2, 8, 10]. Однако правильность данной концепции находит подтверждение преимущественно при стрептококковой этиологии гломерулонефрита, при котором действительно допускается возможность полного выздоровления больных [1, 4–6, 12].
Материалы и методы
Нами проведен анализ распространенности, особенностей клинико-лабораторной картины и течения ОПИГН у 326 детей, которые в течение последних 10 лет находились на лечении в областной клинической больнице Новосибирска. Диагноз ОПИГН верифицировался на основании анамнеза (связь заболевания с предшествующей инфекцией, переохлаждением, отсутствие тех или иных заболеваний почек в прошлом, а также наследственной и врожденной почечной патологии у кровных родственников), выявления экстраренальных (отеки и артериальная гипертензия) и ренальных симптомов (гематурия, протеинурия и олигурия).
Результаты и их обсуждение
Мальчиков было в среднем в 1,4 раза больше по сравнению с девочками — 189 (57,9%) и 137 (42,1%) соответственно. Возраст их на момент заболевания оказался следующим: до 7 лет — 15,3% больных, 7–12 лет — 42%, старше 12 лет — 42,7% (табл. 1).
У 296 из 326 (90,8%) больных была доказана связь гломерулонефрита с предшествующей инфекцией (табл. 2). Проведенные в комплексе бактериологические и серологические исследования позволили доказать стрептококковую этиологию ГН у 191 из 296 (64,5%) наблюдаемых. При этом стрептодермия выявлена у 97 (29,8%) детей, острый стрептококковый тонзиллит у 81 (24,9%) пациента, скарлатина у 20 (6,1%) больных. У 22 (6,7%) детей этиологию первичного инфекционного процесса установить не удалось, хотя по характеру перенесенной инфекции и повышению титра антистрептококковых антител в крови (антистрептолизина-О) предполагалась стрептококковая этиология этих заболеваний. Так, у 10 детей были признаки подчелюстного лимфаденита, у 6 — гайморита, у 4 — пульпита, у 2 — отита. При возникновении у детей острой стрептококковой инфекции кожи и ротоглотки в лечении, как правило, не соблюдались 10-дневные схемы антибактериальной терапии пенициллинами либо макролидами с последующей обязательной бициллинопрофилактикой. При стрептодермии ошибки в лечении оказались наиболее частыми: антибиотики назначалась редко и с укорочением курса, чаще использовалась лишь местная терапия, при этом бициллинопрофилактика иммунокомплексных осложнений не проводилась.
У 10 (3,1%) других пациентов развитию ОПИГН предшествовал острый диарейный синдром неуточненной этиологии. У 1 больного был диагностирован и лабораторно подтвержден иерсиниоз.
Что касается ОРЗ, то оно предшествовало возникновению нефритического синдрома у 66 (20,3%) детей, характеризуясь лихорадкой и симптомами интоксикации. Переохлаждение как пусковой фактор развития ГН имело место у 30 (9,1%) детей. Вместе с тем у большинства из этих пациентов также обнаруживалось существенное увеличение (в 1,5–2 раза по сравнению с нормой) уровня антистрептококковых антител в анализах крови. Это позволяет говорить о наличии латентной стрептококковой инфекции, в рамках течения которой указанные выше состояния могли сыграть роль пускового фактора гломерулонефрита.
Отеки в остром периоде гломерулонефрита регистрировались у всех 258 детей, у 48 из них (14,7%) они были не только распространенными, но и значительными вплоть до появления гидроторакса, асцита, свободной жидкости в полости перикарда.
Артериальная гипертензия (АГ) отмечена у 159 (48,8%) больных, у 142 из них систолическое артериальное давление (САС) было увеличено до 130–150 мм рт. ст., диастолическое (ДАД) — до 90–95 мм рт. ст. Однако в 17 (10,7%) наблюдениях АГ протекала более злокачественно, достигала 170–180/100 мм рт. ст. и более, была торпидна к используемым гипотензивным лекарственным средствам, способствуя возникновению такого серьезного осложнения, как ангиоспастическая энцефалопатия (почечная эклампсия). Развитию почечной эклампсии предшествовали бессонница, головная боль, тошнота, повторные рвоты (28,8%), люмбальные боли у 32,5% детей, брадикардия, к которым в последующем присоединились беспокойство, тонико-клонические судороги, угнетение сознания. Таким образом, у наших больных почечная эклампсия встречалось в 10,7% случаев, что в 2–4 раза чаще по сравнению с литературными данными [7, 9].
У 234 (71,8%) больных регистрировалось транзиторное (в течение 1–2 недель) повышение в крови уровня мочевины — до 9–15 ммоль/л и креатинина — до 110–140 мкмоль/л, что рассматривалось как нарушение функции почек острого периода. В случае выраженной гиперволемии и олигурии отмечались относительная гипонатриемия и гиперкалиемия, которые, как и азотемия, ликвидировались по мере восстановления диуреза.
Мочевой осадок в 100% случаев был представлен умеренно выраженной протеинурией (не более 50 мг/кг в сутки), макро- или микрогематурией, абактериальной лейкоцитурией. Удельный вес мочи у всех больных в остром периоде заболевания был нормальным.
Таким образом, острое начало заболевания с появлением периферических отеков, артериальной гипертензией, изменением цвета мочи и олигурией полностью соответствовали критериям нефритического синдрома у 80% детей с гломерулонефритом.
У 68 из 326 (20,9%) больных ГН в дебюте протекал атипично, характеризуясь лишь незначительной пастозностью век, а преимущественно — патологией осадка мочи в виде микрогематурии (68% случаев), реже — макрогематурии (32% случаев), протеинурии до 0,5–1 г/л. При этом основные функции почек у них были сохранены.
Развитию атипичной формы ГН предшествовали у 6 (9,1%) из этих детей стрептодермия, у 14 (21,2%) — ОРЗ, у 7 (10,6%) — острая кишечная инфекция, у 9 (13,4%) — переохлаждение, в остальных 45,7% случаев пусковые факторы его установить не удалось.
Следует подчеркнуть, что отчетливой зависимости тяжести и особенностей течения ОПИГН от пола и возраста детей не отмечено.
Лечение больных осуществлялось с учетом существующих рекомендаций и включало постельный режим, бессолевую диету с ограничением животных белков до ликвидации экстраренальных симптомов и азотемии, антибиотики пенициллинового ряда.
Одновременно применялись средства, направленные на коррекцию нарушений в системе свертывания крови. При этом нефракционированный гепарин применялся по 200–300 Ед/кг в сутки в течение 3–4 недель с последующей постепенной отменой. Наряду с прямыми антикоагулянтами использовались дезагреганты, способствующие улучшению реологии крови.
Артериальная гипертензия, гиперкалиемия, олигурия, пре- и эклампсия служили основанием для назначения петлевых диуретиков (фуросемида), гипотензивных средств.
В ходе осуществления указанной терапии экстраренальные проявления ОПИГН были купированы в относительно короткие сроки — у 58,9% детей в течение 7–10 дней и у 41,1% — 14–15 дней после начала лечения, что в целом является характерным для типичной формы острого гломерулонефрита.
Катамнез заболевания нам удалось проследить у 300 из 326 (92%) детей. У 38 из них (12,9%) ГН принял хроническое течение, что согласуется с данными литературы [1, 2, 10, 11]. Установлено, что в дебюте заболевания средний возраст этих детей соответствовал 13 ± 0,8 года (минимальный возраст 7 лет, максимальный 15 лет). При этом связь ГН с перенесенной острой инфекцией была доказана в 100% случаев, но со стрептококковыми заболеваниями — лишь у 16 (42,1%) больных. У 20 (52,6%) больных гломерулонефрит в дебюте протекал манифестно, с нарушением функции почек острого периода, у остальных 18 (34,2%) — малосимптомно (атипично). Обращала также на себя внимание у 28 (73,7%) больных продолжительность макрогематурии — 11–14 дней, а у 55,3% детей — выраженность протеинурии в остром периоде болезни — 2,5–3 г/л.
Хронизация гломерулонефрита у всей группы детей произошла в сроки от 1 года до 10 лет (в среднем через 4,5 лет). Первый рецидив заболевания у 34 из 38 (89,5%) больных протекал в соответствии с традиционными представлениями о гематурической форме хронического ГН (ХГН): минимально выраженные экстраренальные проявления в виде пастозности век, боли в поясничной области, астенизация, снижение аппетита и трудоспособности, нарушение сна. При этом основные изменения обнаруживались главным образом в исследуемых анализах мочи. Так, макрогематурия имела место в 54% случаев, микрогематурия — в 46%, протеинурия от 0,5 до 1,5 г/л — у всех больных. Что касается повторных обострений заболевания, то у данной категории пациентов они возникали не чаще 1–2 раз в год.
Между тем у 4 (10,5%) больных при первом рецидиве заболевания наряду с макро- или микрогематурией в остром периоде имели место распространенные отеки, стойкая артериальная гипертензия, протеинурия более 50 мг/кг в сутки, цилиндрурия, а также транзиторное повышение уровня атерогенных фракций липидов, мочевины и креатинина в сыворотке крови в сочетании с гипопротеинемией, гипоальбуминемией. Обращали на себя внимание симптомы интоксикации, выраженной астенизации, продолжительная по времени протеинурия (более 3–4 недель).
Важно подчеркнуть, что дебют заболевания у всех 4 детей совпал с пубертатным периодом жизни, что сопровождалось интенсивным линейным ростом и половым созреванием. При этом острый гломерулонефрит протекал типично, с выраженными вплоть до анасарки отеками, высокой артериальной гипертензией с признаками ангиоспастической энцефало- и ретинопатии, макрогематурией, кратковременной выраженной протеинурией, а также нарушением функции почек острого периода. Хронизация процесса у этих больных произошла в течение первого года наблюдения.
Морфологический вариант ХГН был установлен у 32 из 38 больных. У всех выявлен мезангиопролиферативный вариант (у 8 с тубулоинтерстициальными изменениями).
К настоящему времени у 30 из 38 (78,9%) детей хронический гломерулонефрит протекает без нарушения функции почек. Однако у 8 больных, возраст которых достиг 19–26 лет, развилась хроническая почечная недостаточность (стадия I–II).
Заключение
Возрастная структура обследованных позволяет говорить о том, что острый гломерулонефрит сохраняет свою экспансию среди детей школьного и пубертатного возраста и молодых людей. Ведущим этиологическим фактором острого гломерулонефрита по-прежнему является стрептококковая инфекция. При этом в последние 10 лет широкое распространение получила стрептодермия, особенно у детей из семей с низким социальным и санитарно-гигиеническим уровнем жизни, детских домов и интернатов. Высока также роль острой респираторной инфекции как фактора, способствующего активации латентной стрептококковой инфекции.
При возникновении ОПИГН у детей типично развитие остронефритического синдрома с нарушением функции почек острого периода и в 10,7% почечной эклампсии. При этом отсутствует отчетливая связь ГН с полом и возрастом пациентов. Острый гломерулонефрит у детей в большинстве случаев заканчивается выздоровлением — 87,1% всех наблюдений. К факторам, прогнозирующим его хронизацию, можно отнести изменения в осадке мочи в виде продолжительной по времени макрогематурии и умеренно выраженной протеинурии.
Литература
С. А. Лоскутова, доктор медицинских наук, профессор
Е. И. Краснова, доктор медицинских наук, профессор
Н. А. Пекарева, кандидат медицинских наук
ГБОУ ВПО НГМУ Минздравсоцразвития России, Новосибирск
Что такое гломерулонефрит острый (нефритический синдром)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Застело Е. С., детского нефролога со стажем в 15 лет.
Над статьей доктора Застело Е. С. работали литературный редактор Вера Васина , научный редактор Кирилл Лелявин и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Острый гломерулонефрит (Acute glomerulonephritis) — это группа заболеваний почек, которые отличаются по своей структуре, подходам к лечению и причинам, но все они в первую очередь приводят к повреждению почечных клубочков. Клубочками, или гломерулами, называют пучки кровеносных сосудов с мелкими порами, через которые в почках фильтруется кровь.
При развитии болезни в моче внезапно появляется кровь и выявляется белок, повышается артериальное давление, возникают отёки и может временно нарушиться работа почек.

Распространённость
Острый гломерулонефрит встречается у пациентов всех возрастов, но выделяют два пика заболеваемости: в 5–12 лет и после 60 лет [3] [4] . Чаще гломерулонефритом болеют мужчины.
Ежегодно выявляют около 470 000 случаев острого гломерулонефрита, уровень заболеваемости колеблется от 9 до 29 случаев на 100 000 населения [3] [4] .
В России гломерулонефрит — это ведущая причина терминальной стадии хронической болезни почек. Эта болезнь несовместима с жизнью и требует дорогостоящей почечной заместительной терапии: диализа и трансплантации донорской почки [19] .
Причины острого гломерулонефрита
Острый гломерулонефрит зачастую возникает после перенесённой инфекции, вызванной бета-гемолитическим стрептококком группы А (БГСА).
К болезням почек могут приводить следующие штаммы:
- 1, 4, 12 (вызывают болезнь после фарингита);
- 2, 49, 55, 57, 60 (после кожных инфекций) [16] .
Такой гломерулонефрит называют острым постстрептококковым гломерулонефритом (ОПСГН) [2] . Риск развития ОПСГН зависит от локализации инфекции: после фарингита он возникает в 5–10 % случаев, после кожной инфекции, например стрептодермии, — в 25 % случаев [5] [6] . В последнее время ОПГСН в развитых странах встречается всё реже.
Стрептококк может также вызывать ангину, тонзиллит и скарлатину, поэтому эти заболевания часто предшествуют острому гломерулонефриту. Однако в большинстве случаев точную причину гломерулонефрита установить не удаётся: в посевах мочи и крови возбудитель отсутствует, в истории болезни нет перенесённых инфекций [1] [3] [11] [15] .
Помимо стрептококка, к развитию острого гломерулонефрита могут приводить:
- токсические факторы — отравление свинцом и ртутью, употребление органических растворителей и алкоголя, приём некоторых лекарств (Амикацина, рентгеноконтрастных препаратов);
- другие инфекции — бактерии (стафилококк, энтерококк, диплококк, бледная трепонема и др.), вирусы (цитомегаловирус, вирусы простого герпеса, гепатита В, Эпштейна — Барр, коронавирус).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острого гломерулонефрита
Острый гломерулонефрит может около трёх недель протекать без симптомов [2] [4] [10] . Затем развивается характерный острый нефритический синдром, включающий основные проявления болезни:
- отёки;
- гематурию (кровь в моче);
- гипертонию [12][15] .
Отёки возникают у 80–90 % пациентов [16] . Появление отёков при остром гломерулонефрите вызвано задержкой натрия и замедленной фильтрацией крови в клубочках [16] . У детей отёки распространяются по всему телу, у взрослых, как правило, отекают только ноги и лицо. В 10–50 % случаев отёки сопровождаются тупыми болями в пояснице, которые возникают из-за воспаления и растяжения капсулы почки.

Гипертония развивается у 50–90 % пациентов, из них более чем у 75 % больных давление сильно повышено [16] [19] . Гипертония может протекать бессимптомно или проявляться головными болями. Основные причины высокого давления при остром гломерулонефрите — это увеличение объёма циркулирующей крови, связанное с задержкой жидкости и натрия, а также повышение сердечного выброса и периферического сосудистого сопротивления.
С первых дней болезни уменьшается объём выделяемой мочи (диурез). При лечении он восстанавливается через 4–7 дней, после чего исчезают отёки и нормализуется артериальное давление (гипертония обычно наиболее выражена в разгар заболевания [16] ). Однако ещё в течение полугода отдельные симптомы могут сохраняться.
Острый постстрептококковый гломерулонефрит может протекать в двух формах:
- циклически — типичный вариант;
- ациклически — только с одним симптомом, атипичный вариант.
Циклическое течение
Болезнь начинается остро: состояние резко ухудшается, появляется выраженная слабость, тошнота, рвота и повышается температура.
Затем развивается нефритический синдром:
- с почечными симптомами — уменьшается объём выделенной мочи, в ней появляется кровь, белок и цилиндрические тельца;
- с внепочечными симптомами — болит голова, живот или поясница, возникает слабость, астения, снижается или пропадает аппетит.
Пациент, как правило, вспоминает, что этим симптомам предшествовала ангина, тонзиллит, скарлатина или другая бактериальная инфекция. Скрытый период после ангины и обострения хронического тонзиллита составляет 2–4 недели, после стрептодермии — 8–12 недель.
Ациклическое течение
Снижается диурез, появляется гематурия, но внепочечные симптомы не возникают, поэтому заболевание обычно переносится легче. Предугадать, как будет развиваться гломерулонефрит, невозможно — течение болезни зависит от состояния иммунной системы.
Патогенез острого гломерулонефрита
Известно, что гломерулонефрит развивается под действием бактериальных и токсических факторов, однако патогенез заболевания до конца не изучен. Выделяют три основных механизма развития болезни: иммунный, гемодинамический и метаболический. Наибольшее значение имеет первый фактор [16] [18] [19] [21] .
К иммунным механизмам развития гломерулонефрита относятся:
- образование иммунных комплексов в клубочках;
- захват клубочками циркулирующих иммунных комплексов;
- перекрёстная реакция между антигенами;
- прямая активации системы комплемента антигенами в клубочках [7][8][9] .
Рассмотрим эти механизмы более подробно на примере острого постстрептококкового гломерулонефрита (ОПСГН). Антиген нефритогенного, т. е. опасного для почек штамма, откладывается в клубочках, что запускает иммунные реакции.
Иммунная система состоит из гуморального и клеточного иммунитета. Клетки гуморального иммунитета — это B-лимфоциты, которые первыми встречают антигены. К антигенам относятся, например, вещества, которые содержатся в микроорганизмах или выделяются ими. Эти вещества организм рассматривает как чужеродные или потенциально опасные и начинает вырабатывать против них антитела. При остром гломерулонефрите клетки гуморального иммунитета вырабатывают нефритогенные антистрептококковые антитела. Эти антитела связываются с антигенами и образуются иммунные комплексы.

Затем активируется клеточный иммунитет. Его агенты — это макрофаги и Т-лимфоциты: Т-хелперы, Т-киллеры и Т-супрессоры [10] . При этом запускается система комплимента по классическому типу, из-за чего вырабатываются дополнительные медиаторы воспаления и привлекаются провоспалительные клетки. Система комплемента — это комплекс белков, которые защищают организм от действия чужеродных агентов. Из-за активации этой системы почечные клубочки начинают разрушаться [7] .
Повреждённые клетки вырабатывают провоспалительные цитокины: IL-1, IL-6, TNF-a, из-за чего клубочки пропитываются лейкоцитами и моноцитами, а макрофаги вызывают отёк тканей.
Стрептококковые М-белки и пирогенные экзотоксины (токсины, которые вызывают повышение температуры) выступают в качестве суперантигенов, т. е. могут массово активировать Т-лимфоциты, вырабатывающие провоспалительные цитокины. В активный период гломерулонефрита образуются специфические антитела и криоглобулины, что приводит к аутоиммунному воспалению [11] .
Согласно последним исследованиям, гломерулонефрит развивается из-за генетических нарушений Т-клеточного звена иммунитета [19] .
Классификация и стадии развития острого гломерулонефрита
По характеру течения гломерулонефрит бывает:
- острым;
- подострым (с бурным, часто злокачественным течением и развитием острой почечной недостаточности); .
По этиологическому фактору:
- Инфекционный — бактериальный, вирусный и паразитарный.
- Токсический — вызванный действием органических растворителей, лекарств, алкоголя, свинца и ртути.
- Гломерулонефриты при системных заболеваниях:
- Люпус-нефрит — осложнение системной красной волчанки.
- IgA-нефропатия — вид гломерулонефрита, который может длительно проявляться только микрогематурией, артериальное давление при этом не повышается. Макрогематурия развивается при присоединении респираторной инфекции или воспалении других слизистых оболочек.
- Пурпура Шенлейна — Геноха — воспаление мелких сосудов, проявляется геморрагической сыпью, артритом и болью в животе.
По морфологической картине:
- минимальные изменения;
- фокальный сегментарный гломерулосклероз;
- мембранозный гломерулонефрит (нефропатия);
- мезангиопролиферативный гломерулонефрит (IgA-нефропатия);
- мембранопролиферативный гломерулонефрит;
- полулунный гломерулонефрит;
- фибропластический гломерулонефрит (диффузный склероз) [4][10] .
Морфологические данные выявляются при биопсии почек. Их интерпретацией занимаются морфолог и клиницист.
Осложнения острого гломерулонефрита
Заболевание опасно следующими осложнениями:
- Острое почечное повреждение, острая или хроническая почечная недостаточность.
- Острая сердечная недостаточность — нарушается ритм сердца, его способность сокращаться и расслабляться, меняется степень напряжения сердечной мышцы перед и во время сокращения (преднагрузка и постнагрузка). Может возникать как у людей, страдающих болезнями сердца, так и у здоровых пациентов. Осложнение опасно для жизни и требует срочного лечения [13] .
- Энцефалопатия — накопление в головном мозге токсических органических кислот. Сопровождается неврологическими симптомами, уменьшить которые можно при помощи гемодиализа или перитонеального диализа. К ранним признакам уремической энцефалопатии относятся снижение внимания, быстрая утомляемость и апатия. В дальнейшем эти симптомы усиливаются, ухудшается память, возникает дезориентация в пространстве и неустойчивость настроения, нарушается режим сна и бодрствования [16][18] . — может возникать при беременности.
Без своевременной диагностики и лечения острого гломерулонефрита пациент может погибнуть [15] .
Диагностика острого гломерулонефрита
При подозрении на острый гломерулонефрит проводится лабораторная и инструментальная диагностика.
Лабораторная диагностика
Инструментальная диагностика
- Ультразвуковая диагностика почек — оцениваются размеры почек, структурные нарушения, наличие пороков и аномалий развития. Исследование проводится для дифференциальной диагностики с другими болезнями почек.
- Биопсия почек — показана в тех случаях, когда назначенная терапия оказалась неэффективной. С помощью биопсии можно уточнить тип гломерулонефрита, определить прогноз и тактику лечения [15] . Показания к биопсии: отягощённая наследственность по заболеваниям почек, нетипичные симптомы, высокая концентрация белка в моче и прогрессирующее снижение СКФ.
Основным критерием диагностики гломерулонефритов является морфологическая картина (т. е. состояние клеток и тканей почечных клубочков), так как она индивидуальна для каждого типа заболевания [16] [18] [19] [20] .
Дифференциальная диагностика острого и хронического гломерулонефритов
Лечение острого гломерулонефрита
При лечении острого гломерулонефрита применяют немедикаментозную, антибактериальную, симптоматическую и иммуносупрессивную терапию. В тяжёлых случаях может потребоваться заместительная терапия.
Лечение может проходить как амбулаторно, так и в больнице.
Показания к госпитализации:
- возраст до 18 лет;
- нарушение работы почек (как с уменьшением диуреза, так и без этого симптома);
- сохраняющаяся или нарастающая гипертония;
- признаки острой сердечной недостаточности;
- нефротический синдром.
Немедикаментозная терапия
- При тяжёлом течении болезни показаны покой и постельный режим. К признакам тяжёлого течения относятся кровь в моче, заметная визуально, отёки по всему телу и симптомы сердечной недостаточности.
- Следует потреблять до 1–2 г соли в сутки. Если появились отёки, особенно если они нарастают, нужно сократить потребление соли до 0,2–0,3 г в сутки [16] .
- При снижении функции почек рекомендуется есть менее 0,5 г/кг белка в сутки. Его количество нужно сократить за счёт животных белков, сохранив при этом калорийность рациона и содержание витаминов [15] .
- В острый период болезни следует меньше пить, необходимый объём жидкости рассчитывают с учётом диуреза за предыдущий день + 300 мл.
Диета и постельный режим помогают жидкости не задерживаться в организме. Питание и режим можно скорректировать после того, как исчезнут отёки и давление придёт в норму [16] .
Антибактериальная терапия
Всем пациентам с подтверждённой стрептококковой инфекцией (положительные результаты посевов с кожи, зева и высокие титры антистрептококковых антител в крови) рекомендуется проводить антибактериальную терапию. Её назначают с учётом чувствительности возбудителя. Наиболее часто применяются препараты пенициллинового ряда. Макролиды II и III поколений являются препаратами второй линии терапии [16] .
Симптоматическая терапия
Чтобы уменьшить отёки и предотвратить связанные с ними осложнения, назначаются мочегонные средства (диуретики) [16] . Для снижения артериального давления применяются блокаторы медленных кальциевых каналов. При выраженных изменениях со стороны крови, например повышенной свёртываемости, врач может назначить антикоагулянты. Продолжительность терапии зависит от различных факторов: тяжести заболевания, длительности почечных изменений по данным анализов, возраста и т. д.
Иммуносупрессивная терапия
При быстром развитии заболевания, сильных отёках и артериальном давлении выше 130/90 мм рт. ст. назначаются глюкокортикостероиды.
Заместительная почечная терапия
Заместительная терапия показана при развитии почечной недостаточности [15] .
Основные методы заместительной терапии:
- гемодиализ;
- перитонеальный диализ;
- трансплантация почки.

Прогноз. Профилактика
Прогноз в большинстве случаев благоприятный [7] . Как правило, отёки уменьшаются в течение 10 дней, уровень креатинина в сыворотке нормализуется за 3–4 недели [16] .
Среди детей осложнения встречаются редко. У пожилых пациентов может развиться острая сердечная и почечная недостаточность [14] . Тяжёлая почечная недостаточность возникает менее чем у 1 % больных [16] [18] .
Большинство пациентов полностью выздоравливают в течение 1–2 лет. В это период нужно соблюдать диету, терапия показана только при ухудшении клинических и лабораторных показателей.
Критический период после перенесённого острого гломерулонефрита составляет 1,5–2 месяца. В это время часто возникают рецидивы. Если симптомы сохраняются более полугода, такое течение называется затяжным. Симптомы, которые не проходят более года, указывают на развитие хронического гломерулонефрита.
Профилактика острого гломерулонефрита
Чтобы предотвратить развитие гломерулонефрита, нужно своевременно выявлять и лечить хронические заболевания. Для этого рекомендуется раз в год проходить осмотр у стоматолога, оториноларинголога и гинеколога.
Острый гломерулонефрит – это заболевание иммуновоспалительного характера, характеризующееся вовлечением структурных единиц почек – нефронов и преимущественным поражением клубочкового аппарата. Патология протекает с развитием экстраренальных синдромов (отечного и гипертонического) и ренальных проявлений (мочевого синдрома). В диагностике применяется исследование мочи (общий анализ, проба Реберга, Зимницкого, Нечипоренко), УЗИ почек, биохимическое и иммунологическое исследование крови, биопсия почечной ткани. Лечение требует соблюдения постельного режима и диеты, назначения стероидных гормонов, гипотензивных, диуретических средств.
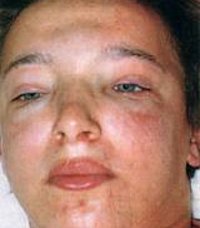
Общие сведения
Острый гломерулонефрит развивается преимущественно у детей в возрасте 2-12 лет и взрослых до 40 лет. Мужчины заболевают в 15,2 раза чаще, чем женщины. Пик заболеваемости приходится на влажное и холодное время года. При болезни происходит преимущественное поражение клубочков (почечных телец), кроме этого в патологический процесс вовлекаются канальца и межуточная ткань обеих почек. Поражение почек связано со специфической иммунной реакцией, обусловленной инфекционным или аллергическим процессом.

Причины
В большинстве случаев развитие острого гломерулонефрита сопряжено с перенесенной стрептококковой инфекцией – фарингитом, ангиной, обострением тонзиллита, скарлатиной, рожистым воспалением кожи. Этиологическим агентом в этих случаях, как правило, выступает b-гемолитический стрептококк группы А. О стрептококковой этиологии острого гломерулонефрита свидетельствует определение повышенного титра антител к стрептококковой гиалуронидазе и стрептолизину-О, увеличение ЦИК, содержащих антигены к стрептококку.
Иногда развитию болезни предшествует вирусная инфекция – грипп, эпидемический паротит, ветряная оспа, краснуха, инфекционный мононуклеоз, герпес, гепатит. Реже патология возникает после дифтерии, стафилококковых и пневмококковых пневмоний, малярии, бруцеллеза, инфекционного эндокардита, брюшного и сыпного тифа и других инфекций.
Кроме инфекционно-иммунных острых гломерулонефритов встречаются неинфекционно-иммунные формы заболевания, вызванные введением сывороток и вакцин, индивидуальной непереносимостью пыльцы растений, приемом нефротоксичных лекарственных препаратов, укусом насекомых или змей, алкогольной интоксикацией и др. причинами. Предрасполагающими факторами служат переохлаждение, анатомо-физиологическая незавершенность строения нефронов у детей.
Патогенез
Специалисты в сфере современной урологии придерживаются мнения, что острый гломерулонефрит - это иммунокомплексная патология. После инфекционного или аллергического воздействия происходит изменение реактивности организма, что проявляется образованием антител к чужеродным антигенам. Взаимодействуя с комплементом, иммунные комплексы откладываются на поверхностях базальных мембран капилляров клубочков. Изменяется структура капиллярных стенок, увеличивается проницаемость сосудов, создаются условия для тромбообразования.
Расстройство трофики почечной ткани ведет к тому, что в ишемической почке активизируется функция ренин-ангиотензин-альдостероновой системы, что приводит к спазму периферических сосудов и, как следствие, повышению АД. На этом фоне нарушаются процессы фильтрации и реабсорбции, происходит задержка Na и воды, в моче появляются патологические элементы.
Классификация
По вызывающим поражение причинам различают первичный, идиопатический и вторичный гломерулонефрит. Первичный гломерулонефрит связан с инфекционным, аллергическим или токсическим воздействием на почечную ткань; вторичный – служит проявлением системной патологии (геморрагического васкулита, СКВ и др.); идиопатический гломерулонефрит развивается по неопределенным причинам. В зависимости от этиофакторов гломерулонефриты могут быть инфекционно-иммунными и неинфекционно–иммунными.
Симптомы острого гломерулонефрита
Классическая картина включает триаду симптомокомплексов: почечный (ренальный) – мочевой синдром и внепочечные (экстраренальные) – отечный и гипертензивный синдромы. Патология обычно манифестирует спустя 1-2 недели после имевшего место этиологического воздействия (инфекции, аллергической реакции и т. д.).
Появление отеков – наиболее ранний и частый признак острого гломерулонефрита, встречается у 70-90% пациентов, у половины из них отеки бывают значительными. Отеки располагаются преимущественно в области лица: наиболее выражены по утрам и спадают днем, сменяясь отечностью лодыжек и голеней. В дальнейшем отечный синдром может прогрессировать до анасарки, гидроперикарда, гидроторакса, асцита. В некоторых случаях видимые отеки могут отсутствовать, однако ежедневное увеличение массы тела пациента свидетельствует о задержке жидкости в тканях.
Артериальная гипертензия обычно выражена умеренно: у 60-70% пациентов АД не превышает 160/100 мм рт. ст. Однако стойкая длительная гипертензия имеет неблагоприятный прогноз. Для острого гломерулонефрита характерно сочетание артериальной гипертензии с брадикардией менее 60 уд. в мин., которая может держаться на протяжении 1-2 недель. При остро развивающейся гиповолемии возможны явления недостаточности левого желудочка, выражающейся сердечной астмой и отеком легких.
Течение патологии может сопровождать болевой синдром различной степени выраженности: боли в пояснице чаще симметричны и обусловлены растяжением почечных капсул и нарушением уродинамики. Мочевой синдроме характеризуется ранним развитием олигурии и даже анурии в сочетании с сильной жаждой. При этом отмечается повышение относительной плотности мочи, появление в моче гиалиновых и зернистых цилиндров, эритроцитов, большого количества белка.
Диагностика
При диагностике острого гломерулонефрита учитывается наличие типичных клинических синдромов, изменений в моче, биохимическом и иммунологическом анализе крови, данные УЗИ и биопсии почки. Общий анализ мочи характеризуется протеинурией, гематурией, цилиндрурией. Для пробы Зимницкого типично уменьшение количества суточной мочи и повышение ее относительной плотности. Проба Реберга отражает снижение фильтрационной способности почек.
Изменения биохимических показателей крови могут включать гипопротеинемию, диспротеинемию (уменьшение альбуминов и увеличение концентрации глобулинов), появление СРБ, и сиаловых кислот, умеренную гиперхолестеринемию и гиперлипидемию, гиперазотемию. При исследовании коагулограммы определяются сдвиги в свертывающей системе – гиперкоагуляционный синдром. Иммунологические анализы позволяют выявить нарастание титра АСЛ-О, антистрептокиназы, антигиалуронидазы, антидезоксирибонуклеазы В; повышение содержания IgG, IgM, реже IgА; гипокомплементемию СЗ и С4.
УЗИ почек обычно показывает неизмененные размеры органов, уменьшение эхогенности, снижение скорости клубочковой фильтрации. Показаниями к проведению биопсии почки служат необходимость дифференциации острого и хронического гломерулонефрита, быстропрогрессирующего нефрита. При острой форме болезни в нефробиоптате определяются признаки клеточной пролиферации, инфильтрация клубочков моноцитами и нейтрофилами, наличие плотных депозитов иммунных комплексов и др. При гипертензивном синдроме необходимо проведение исследования глазного дна и ЭКГ.
Лечение острого гломерулонефрита
При выраженных отеках и артериальной гипертензии одновременно назначаются диуретические и гипотензивные средства. Антибиотикотерапия проводится при имеющихся признаках инфекции (тонзиллите, пневмонии, эндокардите и др.). При острой почечной недостаточности может потребоваться назначение антикоагулянтов, проведение гемодиализа. Курс стационарного лечения составляет 1-1,5 месяца, после чего пациента выписывают под наблюдение врача-нефролога.
Прогноз и профилактика
В большинстве случаев патология хорошо поддается терапии кортикостероидными гормонами и заканчивается выздоровлением. В 1/3 случаев возможен переход в хроническую форму; смертельные исходы крайне редки. На этапе диспансерного наблюдения пациенту требуется динамическое исследование мочи.
Профилактика развития первичного острого гломерулонефрита и его рецидивов заключается в лечении острых инфекций, санации хронических очагов в носоглотке и полости рта, повышении сопротивляемости организма, недопущении охлаждения и длительного нахождения во влажной среде. Лицам с повышенным аллергическим фоном (крапивницей, бронхиальной астмой, сенной лихорадкой) профилактические вакцинации противопоказаны.
Гломерулонефрит у детей – острое или хроническое воспаление почечных клубочков инфекционно-аллергической природы. Для острого гломерулонефрита у детей характерна триада синдромов: мочевой (олигурия, анурия, гематурия, протеинурия), отечный и гипертензивный; при хронических формах преобладает один из них или латентное течение. Диагноз гломерулонефрита у детей основан на данных анамнеза, характерной клинической картине, лабораторных показателях, УЗИ и пункционной биопсии почек. В остром периоде гломерулонефрита у детей назначается постельный режим, диета, антибиотикотерапия, кортикостероиды, антикоагулянты, мочегонные, гипотензивные и иммуносупрессивные препараты.
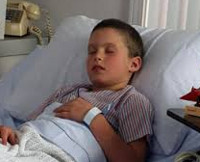
Общие сведения
Гломерулонефрит у детей – иммуно-воспалительное поражение клубочкового аппарата почек, приводящее к снижению их функции. В педиатрии гломерулонефрит является одной из самых распространенных приобретенных патологий почек у детей, занимая второе место после инфекций мочевыводящих путей. Большинство случаев гломерулонефрита регистрируется у детей дошкольного и младшего школьного возраста (3-9 лет), редкие эпизоды (менее 5%) – у детей первых 2-х лет жизни. У мальчиков гломерулонефрит возникает в 2 раза чаще, чем у девочек.
В основе развития гломерулонефрита у детей лежит инфекционная аллергия (образование и фиксация в почках циркулирующих иммунных комплексов) или аутоаллергия (выработка аутоантител), а также неиммунное повреждение органа вследствие развивающихся гемодинамических и метаболических нарушений. Помимо почечных клубочков в патологический процесс могут вовлекаться канальца и межуточная (интерстициальная) ткань. Гломерулонефрит у детей опасен риском развития хронической почечной недостаточности и ранней инвалидизации.

Причины
Выявить этиологический фактор удается в 80-90% острого гломерулонефрита у детей и в 5-10% случаев хронического. Основными причинами гломерулонефрита у детей являются инфекционные агенты – бактерии (в первую очередь, нефритогенные штаммы β-гемолитического стрептококка группы А, а также стафилококки, пневмококки, энтерококки), вирусы (гепатита В, кори, краснухи, ветряной оспы), паразиты (возбудитель малярии, токсоплазмы), грибы (кандида) и неинфекционные факторы (аллергены - чужеродные белки, вакцины, сыворотки, пыльца растений, токсины, лекарства). Чаще всего развитию острого гломерулонефрита у детей предшествует недавно перенесенная (за 2-3 недели до этого) стрептококковая инфекция в виде ангины, фарингита, скарлатины, пневмонии, стрептодермии, импетиго.
Хронический гломерулонефрит у детей обычно имеет первично хроническое течение, реже может быть следствием недолеченного острого гломерулонефрита. Основную роль в его развитии играет генетически детерминированный иммунный ответ на воздействие антигена, присущий данному индивидууму. Образующиеся при этом специфические иммунные комплексы повреждают капилляры почечных клубочков, что приводит к нарушению микроциркуляции, развитию воспалительных и дистрофических изменений в почках.
Гломерулонефрит может встречаться при различных заболеваниях соединительной ткани у детей (системной красной волчанке, геморрагическом васкулите, ревматизме, эндокардите). Развитие гломерулонефрита у детей возможно при некоторых наследственно обусловленных аномалиях: дисфункции Т-клеток, наследственном дефиците С6 и С7 фракций комплемента и антитромбина.
Предрасполагающими факторами развития гломерулонефрита у детей могут служить: отягощенная наследственность, повышенная чувствительность к стрептококковой инфекции, носительство нефритических штаммов стрептококка группы А или наличие очагов хронической инфекции в носоглотке и на коже. Способствовать активации латентной стрептококковой инфекции и развитию гломерулонефрита у детей могут переохлаждение организма (особенно во влажной среде), излишняя инсоляция, ОРВИ.
На течение гломерулонефрита у детей раннего возраста влияют особенности возрастной физиологии (функциональная незрелость почек), своеобразие реактивности организма ребенка (сенсибилизация с развитием иммунопатологических реакций).
Классификация
Гломерулонефрит у детей может быть первичным (самостоятельная нозологическая форма) и вторичным (возникающим на фоне другой патологии), с установленной (бактериальной, вирусной, паразитарной) и с неустановленной этиологией, иммунологически обусловленный (иммунокомплексный и антительный) и иммунологически необусловленный. Клиническое течение гломерулонефрита у детей подразделяют на острое, подострое и хроническое.
По распространенности поражения выделяют диффузный и очаговый гломерулонефрит у детей; по локализации патологического процесса – интракапиллярный (в сосудистом клубочке) и экстракапиллярный (в полости капсулы клубочка); по характеру воспаления - экссудативный, пролиферативный и смешанный.
Хронический гломерулонефрит у детей включает несколько морфологических форм: незначительные гломерулярные нарушения; фокально-сегментарный, мембранозный, мезангиопролиферативный и мезангиокапиллярный гломерулонефрит; IgA-нефрит (болезнь болезнь Берже). По ведущим проявлениям различают латентную, гематурическую, нефротическую, гипертоническую и смешанную клинические формы гломерулонефрита у детей.
Симптомы гломерулонефрита у детей
Острый гломерулонефрит у детей обычно развивается через 2-3 недели после перенесенной инфекции, чаще, стрептококкового генеза. При типичном варианте гломерулонефрит у детей имеет циклический характер, характеризуется бурным началом и выраженными проявлениями: повышением температуры, ознобом, плохим самочувствием, головной болью, тошнотой, рвотой, болью в пояснице.
Гематурический хронический гломерулонефрит является самым распространенным в детском возрасте. Имеет рецидивирующее или персистирующее течение с медленным прогрессированием; характеризуется умеренной гематурией, при обострениях - макрогематурией. Гипертензия не отмечается, отеки отсутствуют или слабо выражены.
У детей нередко обнаруживается склонность к латентному течению гломерулонефрита со скудными мочевыми симптомами, без артериальной гипертензии и отеков; в этом случае заболевание может выявляться только при тщательном обследовании ребенка.
Для нефротического гломерулонефрита у детей типично волнообразное, постоянно рецидивирующее течение. Преобладают мочевые симптомы: олигурия, значительные отеки, асцит, гидроторакс. Артериальное давление в норме, либо немного повышено. Наблюдается массивная протеинурия, незначительная эритроцитурия. Гиперазотемия и снижение клубочковой фильтрации проявляются при развитии ХПН или обострении заболевания.
Гипертонический хронический гломерулонефрит у детей встречается редко. Ребенка беспокоит слабость, головная боль, головокружение. Характерна стойкая, прогрессирующая гипертензия; мочевой синдром выражен слабо, отеки незначительные или отсутствуют.
Диагностика гломерулонефрита у детей
Диагноз острого гломерулонефрита у ребенка верифицируется на основании данных анамнеза о недавно перенесенной инфекции, наличии наследственной и врожденной почечной патологии у кровных родственников и характерной клинической картины, подтвержденных лабораторными и инструментальными исследованиями. Обследование ребенка с подозрением на гломерулонефрит проводится педиатром и детским нефрологом (детским урологом).
В рамках диагностики исследуется общий и биохимический анализ крови и мочи, проба Реберга, анализ мочи по Нечипоренко, проба Зимницкого. При гломерулонефрите у детей выявляются снижение диуреза, скорости клубочковой фильтрации, никтурия, микро- и макрогематурия, протеинурия, цилиндрурия. В крови отмечается небольшой лейкоцитоз и увеличение СОЭ; снижение фракций комплемента СЗ и С5; повышение уровня ЦИК, мочевины, креатинина; гиперазотемия, повышение титра стрептококковых антител (АСГ и АСЛ-О).
УЗИ почек при остром гломерулонефрите у детей показывает незначительное увеличение их объема и повышение эхогенности. Пункционная биопсия почек выполняется для определения морфологического варианта гломерулонефрита у детей, назначения адекватной терапии и оценки прогноза заболевания.
При гломерулонефрите у детей показаны консультация детского офтальмолога (с исследованием глазного дна для исключения ангиопатии сосудов сетчатки), генетика (для исключения наследственной патологии), детского отоларинголога и стоматолога (для выявления и санации очагов хронической инфекции).
Лечение гломерулонефрита у детей
При выраженных проявлениях гломерулонефрита у детей (макрогематурии, протеинурии, отечности, артериальной гипертензии) показано стационарное лечение с назначением постельного режима и специальной диеты (с ограничением соли и белка), проведением этиотропной, симптоматической и патогенетической терапии. Строгая бессолевая диета необходима до исчезновения отеков, а строгая безбелковая диета - до восстановления нормального объема выводимой жидкости.
В остром периоде гломерулонефрита у детей назначается антибиотикотерапия (пенициллин, ампициллин, эритромицин). Коррекцию отечного синдрома проводят с помощью фуросемида, спиронолактона. Из гипотензивных средств у детей используют ингибиторы АПФ пролонгированного действия (эналаприл), блокаторы медленных кальциевых каналов (нифедипин), в подростковом возрасте - блокаторы рецепторов к ангиотензину II (лозартан, валсартан). Применяются глюкокортикостероиды (преднизолон), при тяжелых формах хронического гломерулонефрита – иммуносупрессивные препараты (хлорбутин, циклофосфан, левамизол). Для профилактики тромбозов при выраженном нефротическом синдроме назначаются антикоагулянты (гепарин) и антиагреганты. При значительном повышении уровней мочевой кислоты, мочевины и креатинина в крови, сопровождающихся сильным зудом и иктеричностью кожного покрова, может применяться гемодиализ.
После выписки из стационара дети должны находиться на диспансерном учете у педиатра и детского нефролога в течение 5 лет, а при рецидивах гломерулонефрита – пожизненно. Рекомендуется санаторно-курортное лечение; профилактическая вакцинация противопоказана.
Прогноз и профилактика гломерулонефрита у детей
При адекватном лечении острый гломерулонефрит у детей в большинстве случаев заканчивается выздоровлением. В 1-2% случаев гломерулонефрит у детей переходит в хроническую форму, в редких случаях возможен летальный исход.
При остром гломерулонефрите у детей возможно развитие серьезных осложнений: острой почечной недостаточности, кровоизлияний в головной мозг, нефротической энцефалопатии, уремии и сердечной недостаточности, представляющих угрозу для жизни. Хронический гломерулонефрит у детей сопровождается сморщиванием почек и снижением почечных функций с развитием ХПН.
Профилактика гломерулонефрита у детей заключается в своевременной диагностике и лечении стрептококковой инфекции, аллергических заболеваний, санации хронических очагов в носоглотке и полости рта.
Читайте также:

