Острый и подострый инфекционный эндокардит что это такое
Обновлено: 24.04.2024
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Возбудители
Частота (основано на 1779 случаях 2000 – 036 JAMA2005; 293:3012)
- S.aureus: 32%
- Streptococcus viridians: 18%
- Enterococcus: 18%
- Коагулазо-негативные стафилококки: 11%
- Streptococcus bovis: 7%
- Другие стрептококки: 5%
- HACEK микроорганизмы: 2% (Haemophilus parainfluenzae, Haemophilus aphrophilus, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenalla corrodens, kingella kingie)
- Грамотрицательные бактерии: 2%
- Грибы: 2% (Candida spp., Aspergillus spp.[гемокультура редко позитивна для аспергилл])
- Отрицательная гемокультура: 8% (необходимо принимать во внимание НАСЕК микроорганизмы, Streptococcusspp. (н-р, Abiotrophia), Coxiella burnetii, Chlamydia psittaci, Mycoplasma spp., Legionella pneumophila, Bartonella spp.,Brucella spp., Tropheryma whipplei)
- Клинические критерииDuke: 1): 2 больших или 1 большой и + 3 малых или 5 малых.
- Большие (микробиология):
a) типичные микроорганизмы х 2 гемокультур (н-р, Strep. viridians, S.bovis, HACEK, S.aureus, или энтерококки) при отсутствии первичного очага инфекции,
c) сосудистые явления (артериальная эмболия, инфицированная аневризма, внутричерепные кровоизлияния, кровоизлияние под конъюнктиву, поражения Janeway);
d) иммунологические явления (гломерулонефрит, узелки Ослера, пятна Рота, положительный ревматоидный фактор);
Эндокардит, воспалительное заболевание внутренней оболочки сердца, может быть одним из проявлений ревматизма, а может быть и самостоятельным заболеванием инфекционной природы. Сейчас мы рассмотрим причины и главные симптомы инфекционного эндокардита (ИЭ), а так же методы его диагностики и лечения.
Этиология и пути заражения
Возбудителями эндокардита являются чаще всего такие микроорганизмы как стрептококки, стафилококки, энтерококки, однако причиной заболевания могут быть и представители нормальной микрофлоры ротоглотки, верхних дыхательных путей, а также грибы. Инфекция может попасть в организм, например, при хирургических вмешательствах (при протезировании клапанов, катетеризации крупных сосудов и даже при экстракции зуба). Довольно высока вероятность ИЭ у пациентов с ослабленным иммунитетом и наличием очагов хронической инфекции (хронический тонзиллит, фурункулы). Эндокардит формируется зачастую на фоне уже существующей сердечной патологии, поэтому группу риска представляют также больные с врожденными и приобретенными пороками сердца.
Из входных ворот инфекции возбудитель попадает с током крови в полость сердца, оседает на створках клапанов и образует вегетации (разрастания). Поверхность клапанов при этом изъязвляется и деформируется. Чаще всего повреждаются аортальный и митральный клапаны, реже – трехстворчатый и легочный. Здесь же оседают тромбоциты и нити фибрина, ответственные за формирование тромбов. Как только створки клапана деформируются настолько, что не могут полностью смыкаться, формируется клапанный порок, что, в свою очередь, может привести к сердечной недостаточности.
Микробные вегетации представляют также большую опасность еще и потому, что их элементы могут отрываться от эндокарда и с током крови распространяться по всему организму, заражая при этом другие органы и ткани и приводя к закупорке (эмболии) крупных сосудов. Именно поэтому при эндокардите нарушается кровоснабжение почек, селезенки, легких, головного мозга, а также самого сердца.
Течение заболевания может острым и подострым. Причиной острого ИЭ чаще всего являются ß-гемолитический стрептококк, золотистый стафилококк, пневмококк. Подострый ИЭ протекает легче, встречается при иммунодефицитных состояних и вызывается, например, зеленящим стрептококком, представителями нормальной микрофлоры дыхательных путей, ротоглотки.
Симптомы
Диагностика
Обследование при подозрении на ИЭ включает в себя подробный осмотр больного и особенно тщательную аускультацию сердца, различные анализы крови, ЭКГ, ультразвуковое исследование сердца (эхокардиография). В общем анализе крови выявляются типичные признаки воспаления (увеличение СОЭ, лейкоцитоз). Необходимо также дважды провести посев венозной крови с целью выявления конкретного возбудителя (для этого необходимо две пробы крови). Отрицательный результат посева крови, тем не менее, не исключает диагноз ИЭ. Решающую роль в диагностике играет эхокардиография (через переднюю грудную стенку или чреспищеводная), с помощью которой можно достоверно установить наличие микробных вегетаций, степень поражения клапанов и нарушения насосной функции сердца.
Что может сделать врач
Если диагноз ИЭ подтвержден, врач назначит антибактериальную терапию с учетом результатов посева крови. Как правило, используют антибиотики широкого спектра действия (пенициллины, цефалоспорины) в сравнительно больших дозах. Если возбудителем заболевания являются агресcивные бактерии, например, стафилококк, дополнительно назначают еще один антибиотик узкого спектра (ванкомицин, аминогликозиды). Грибковые эндокардиты крайне тяжело поддаются лечению. В редких случаях (при неэффективности антибиотикотерапии, необратимом поражении клапанов сердца, развитии тяжелой сердечной недостаточности) необходимо хирургическое иссечение микробных вегетаций.
Пациенты из группы риска обязательно получают профилактику антибиотиками после любой инвазивной процедуры или операции (тонзилэктомия, аденэктомия, удаление зуба, любые эндоскопические манипуляции, аборт, катетеризация мочевого пузыря и др.).
Что можете сделать Вы
Чтобы препятствовать развитию ИЭ, нужно стараться избегать чрезмерных физических и психических нагрузок, укреплять иммунитет. Важно помнить, что любой очаг хронической инфекции является потенциальной причиной эндокардита. Поэтому не следует затягивать с лечением даже самых банальных инфекций, таких как хронический тонзиллит, синусит или зубной кариес. Это особенно важно для пациентов с уже существующими пороками сердца.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
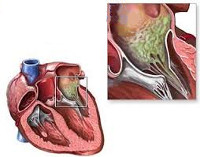
Общие сведения
Инфекционный эндокардит возникает при наличии следующих условий: транзиторной бактериемии, повреждения эндокарда и эндотелия сосудов, изменения гемостаза и гемодинамики, нарушения иммунитета. Бактериемия может развиваться при имеющихся очагах хронической инфекции или проведении инвазивных медицинских манипуляций.
Ведущая роль в развитии подострого инфекционного эндокардита принадлежит зеленящему стрептококку, в острых случаях (например, после операций на открытом сердце) – золотистому стафилококку, реже энтерококку, пневмококку, кишечной палочке. За последние годы изменился состав инфекционных возбудителей эндокардита: возросло число первичных эндокардитов острого течения, имеющих стафилококковую природу. При бактериемии золотистым стафилококком инфекционный эндокардит развивается почти в 100% случаев.
Эндокардиты, вызванные грамотрицательными и анаэробными микроорганизмами и грибковой инфекцией, имеют тяжелое течение и плохо поддаются антибактериальной терапии. Грибковые эндокардиты возникают чаще при длительном лечении антибиотиками в послеоперационном периоде, при долго стоящих венозных катетерах.
Адгезии (прилипанию) микроорганизмов к эндокарду способствуют определенные общие и местные факторы. В число общих факторов входят выраженные нарушения иммунитета, наблюдающиеся у пациентов при иммунносупрессивном лечении, у алкоголиков, наркоманов, людей пожилого возраста. К местным относятся врожденные и приобретенные анатомические повреждения клапанов сердца, внутрисердечные гемодинамические нарушения, возникающие при пороках сердца.
Большинство подострых инфекционных эндокардитов развивается при врожденных пороках сердца или при ревматических поражениях сердечных клапанов. Гемодинамические нарушения, вызванные пороками сердца, способствуют микротравме клапанов (преимущественно митрального и аортального), изменению эндокарда. На клапанах сердца развиваются характерные язвенно-бородавчатые изменения, имеющие вид цветной капусты (полипозные наложения тромботических масс на поверхности язв). Микробные колонии способствуют быстрому разрушению клапанов, может происходить их склерозирование, деформация и разрыв. Поврежденный клапан не может функционировать нормально - развивается сердечная недостаточность, которая очень быстро прогрессирует. Отмечается иммунное поражение эндотелия мелких сосудов кожи и слизистых, приводящее к развитию васкулитов (тромбоваскулитов, геморрагического капилляротоксикоза). Характерно нарушение проницаемости стенок кровеносных сосудов и появление мелких кровоизлияний. Нередко отмечаются поражения более крупных артерий: коронарных и почечных. Часто инфекция развивается на протезированном клапане, в этом случае возбудителем чаще всего бывает стрептококк.
Развитию инфекционного эндокардита способствуют факторы, ослабляющие иммунологическую реактивность организма. Заболеваемость инфекционным эндокардитом постоянно растет во всем мире. К группе риска относятся люди, имеющие атеросклеротические, травматические и ревматические повреждения сердечных клапанов. Высокий риск заболевания инфекционным эндокардитом имеют пациенты с дефектом межжелудочковой перегородки, коарктацией аорты. В настоящее время увеличилось число больных с протезами клапанов (механическими или биологическими), искусственными водителями ритма (электрокардиостимуляторами). Количество случаев инфекционного эндокардита увеличивается по причине применения длительных и частых внутривенных вливаний. Часто инфекционным эндокардитом болеют наркоманы.

Классификация инфекционных эндокардитов
По происхождению различают первичный и вторичный инфекционный эндокардит. Первичный обычно возникает при септических состояниях различной этиологии на фоне неизмененных клапанов сердца. Вторичный - развивается на фоне уже имеющейся патологии сосудов или клапанов при врожденных пороках, заболевании ревматизмом, сифилисом, после операции по протезированию клапанов или комиссуротомии.
По клиническому течению выделяют следующие формы инфекционного эндокардита:
- острая - длительность до 2 месяцев, развивается как осложнение острого септического состояния, тяжелых травм или медицинских манипуляций на сосудах, полостях сердца: нозокомиальный (внутрибольничный) ангиогенный (катетерный) сепсис. Характеризуется высокопатогенным возбудителем, выраженными септическими симптомами.
- подострая – длительность более 2 месяцев, развивается при недостаточном лечении острого инфекционного эндокардита или основного заболевания.
- затяжная.
У наркоманов клиническими особенностями инфекционного эндокардита являются молодой возраст, стремительное прогрессирование правожелудочковой недостаточности и общей интоксикации, инфильтративное и деструктивное поражение легких.
У пожилых пациентов инфекционный эндокардит обусловлен хроническими заболеваниями органов пищеварения, наличием хронических инфекционных очагов, поражением сердечных клапанов. Различают активный и неактивный (заживленный) инфекционный эндокардит. По степени поражения эндокардит протекает с ограниченным поражением створок сердечных клапанов или с поражением, выходящим за пределы клапана.
Выделяют следующие формы течения инфекционного эндокардита:
- инфекционно-токсическая - характерна транзиторная бактериемия, адгезия возбудителя на измененный эндокард, образование микробных вегетаций;
- инфекционно-аллергическая или иммунно-воспалительная - характерны клинические признаки поражения внутренних органов: миокардита, гепатита, нефрита, спленомегалии;
- дистрофическая – развивается при прогрессировании септического процесса и сердечной недостаточности. Характерно развитие тяжелых и необратимых поражений внутренних органов, в частности - токсическая дегенерация миокарда с многочисленными некрозами. Поражение миокарда возникает в 92 % случаев затяжного инфекционного эндокардита.
Симптомы инфекционного эндокардита
Течение инфекционного эндокардита может зависеть от срока давности заболевания, возраста пациента, типа возбудителя, а также от ранее проводимой антибактериальной терапии. В случаях высокопатогенного возбудителя (золотистый стафилококк, грамотрицательная микрофлора) обычно наблюдается острая форма инфекционного эндокардита и раннее развитие полиорганной недостаточности, в связи с чем клиническая картина характеризуется полиморфизмом.
У большинства пациентов с инфекционным эндокардитом выявляется поражение сердечной мышцы (миокардит), функциональные шумы, связанные с анемией и повреждением клапанов. При поражении створок митрального и аортального клапанов развиваются признаки их недостаточности. Иногда наблюдается стенокардия, изредка отмечается шум трения перикарда. Приобретенные пороки клапанов и поражение миокарда приводят к сердечной недостаточности.
При подострой форме инфекционного эндокардита возникают эмболии сосудов мозга, почек, селезенки оторвавшимися со створок сердечных клапанов тромботическими наложениями, сопровождающиеся образованием инфарктов в пораженных органах. Обнаруживаются гепато- и спленомегалия, со стороны почек - развитие диффузного и экстракапиллярного гломерулонефрита, реже - очагового нефрита, возможны артралгии и полиартрит.
Осложнения инфекционного эндокардита
Осложнениями инфекционного эндокардита с летальным исходом являются септический шок, эмболии в головной мозг, сердце, респираторный дистресс-синдром, острая сердечная недостаточность, полиорганная недостаточность.
При инфекционном эндокардите часто наблюдаются осложнения со стороны внутренних органов: почек (нефротический синдром, инфаркт, почечная недостаточность, диффузный гломерулонефрит), сердца (пороки клапанов сердца, миокардит, перикардит), легких (инфаркт, пневмония, легочная гипертензия, абсцесс), печени (абсцесс, гепатит, цирроз); селезенки (инфаркт, абсцесс, спленомегалия, разрыв), нервной системы (инсульт, гемиплегия, менингоэнцефалит, абсцесс головного мозга), сосудов (аневризмы, геморрагический васкулит, тромбозы, тромбоэмболии, тромбофлебит).
Диагностика инфекционного эндокардита
При сборе анамнеза у пациента выясняют наличие хронических инфекций и перенесенных медицинских вмешательств. Окончательный диагноз инфекционного эндокардита подтверждается данными инструментальных и лабораторных исследований. В клиническом анализе крови выявляется большой лейкоцитоз и резкое повышение СОЭ. Важной диагностической ценностью обладает многократный бакпосев крови для выявления возбудителя инфекции. Забор крови для бактериологического посева рекомендуется производить на высоте лихорадки.
Данные биохимического анализа крови могут варьировать в широких пределах при той или иной органной патологии. При инфекционном эндокардите отмечаются изменения в белковом спектре крови: (нарастают α-1 и α-2-глобулины, позднее – γ-глобулины), в иммунном статусе (увеличивается ЦИК, иммуноглобулин М, снижается общая гемолитическая активность комплемента, нарастает уровень противотканевых антител).
Ценным инструментальным исследованием при инфекционном эндокардите является ЭхоКГ, позволяющее обнаружить вегетации (размером более 5 мм) на клапанах сердца, что является прямым признаком инфекционного эндокардита. Более точную диагностику проводят при помощи МРТ и МСКТ сердца.
Лечение инфекционного эндокардита
При инфекционном эндокардите лечение обязательно стационарное, до улучшения общего состояния пациента назначается постельный режим, диета. Главная роль в лечении инфекционных эндокардитов отводится медикаментозной терапии, главным образом, антибактериальной, которую начинают сразу после бакпосева крови. Выбор антибиотика определяется чувствительностью к нему возбудителя, предпочтительнее назначение антибиотиков широкого спектра действия.
В терапии инфекционного эндокардита хороший эффект оказывают антибиотики пенициллинового ряда в комбинации с аминогликозидами. Трудно поддается лечению грибковый эндокардит, поэтому назначается препарат амфотерицин В в течение длительного времени (несколько недель или месяцев). Также используют другие средства с антимикробными свойствами (диоксидин, антистафилококковый глобулин и др.) и немедикаментозные методы лечения – плазмаферез, аутотрансфузию ультрафиолетом облученной крови.
При сопутствующих заболеваниях (миокардите, полиартрите, нефрите) к лечению добавляются негормональные противовоспалительные средства: диклофенак, индометацин. При отсутствии эффекта от медикаментозного лечения показано хирургическое вмешательство. Проводится протезирование клапанов сердца с иссечением поврежденных участков (после стихания остроты процесса). Оперативные вмешательства должны проводиться кардиохирургом исключительно по показаниям и сопровождаться приемом антибиотиков.
Прогноз при инфекционном эндокардите
Инфекционный эндокардит — одно из наиболее тяжелых сердечно-сосудистых заболеваний. Прогноз при инфекционном эндокардите зависит от множества факторов: имеющихся поражений клапанов, своевременности и адекватности терапии и др. Острая форма инфекционного эндокардита без лечения заканчивается смертельным исходом через 1 – 1,5 месяца, подострая форма - через 4–6 месяцев. При адекватной антибактериальной терапии летальность составляет 30%, при инфицировании протезированных клапанов — 50%. У пожилых пациентов инфекционный эндокардит протекает более вяло, часто сразу не диагностируется и имеет худший прогноз. У 10-15% больных отмечается переход болезни в хроническую форму с рецидивами обострения.
Профилактика инфекционного эндокардита
За лицами с повышенным риском развития инфекционного эндокардита устанавливается необходимое наблюдение и контроль. Это касается, прежде всего, пациентов с протезированными клапанами сердца, врожденными или приобретенными пороками сердца, патологией сосудов, с инфекционным эндокардитом в анамнезе, имеющих очаги хронической инфекции (кариес, хронический тонзиллит, хронический пиелонефрит).
Развитие бактериемии может сопровождать различные медицинские манипуляции: оперативные вмешательства, урологические и гинекологические инструментальные обследования, эндоскопические процедуры, удаление зубов и др. С профилактической целью при этих вмешательствах назначают курс антибиотикотерапии. Необходимо также избегать переохлаждения, вирусных и бактериальных инфекций (гриппа, ангины). Необходимо проведение санации очагов хронической инфекции не реже 1 раза в 3 - 6 месяцев.
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:

