Острый лейкоз и грибковая инфекция
Обновлено: 19.04.2024
Профилактика и лечение инфекционных осложнений острого лейкоза. Лечение инфекций при лейкозе
У многих пациентов уже до начала лечения выявляются лихорадка и нейтропения. Нераспознанные инфекции могут быстро диссеминировать и закончиться фатально, поэтому недопустима отсрочка назначения антибиотиков до появления развернутой клинической картины.
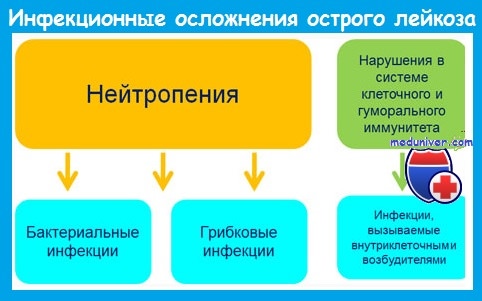
Наиболее важным предрасполагающим фактором развития инфекций является нейтропения. Риск инфекции зависит от уровня и длительности постцитостатической нейтропении и возрастает при количестве нейтрофилов меньше 1 • 10 9 /л.
При развитии агранулоцитоза (нейтрофилов меньше 0,5 • 10 9 /л) вероятность инфекции очень велика, а при количестве нейтрофилов меньше 0,1 • 10 9 /л инфекции развиваются у большинства пациентов и имеют чрезвычайно тяжелое течение.
До середины 1980-х годов грамотрицательные бактерии кишечного происхождения были причиной 70-80% бактериальных инфекций у больных острым лейкозом. В настоящее время 60-80% бактериальных инфекций вызывается грамположительными микроорганизмами. Это обусловлено:
1) использованием сосудистых катетеров;
2) проведением деконтаминации кишечника, подавляющей грамотрицательную микрофлору;
3) выбором антибактериальных препаратов для эмпирической антибактериальной терапии.
Наряду с бактериальными инфекциями большое значение у больных с нейтропенией имеют грибковые (кандидоз, аспергиллез), вирусные (вызванные herpes simplex и zoster, ЦМВ) и протозойные инфекции.
Инфекционные осложнения при остром лейкозе отличаются атипичным течением. Это обусловлено следующими обстоятельствами:
1) агранулоцитоз существенно изменяет реакцию организма на инфекционный агент, что клинически чаще всего проявляется развитием фебрильной температуры без других признаков локальной или системной инфекции;
2) многие антибиотики нарушают микрофлору больного, подавляют чувствительные микроорганизмы и способствуют пролиферации резистентных бактерий и грибов рода Candida (суперинфекция);
3) большое влияние на защитные механизмы оказывает химиотерапия, вызывающая миелосупрессию и повреждение эндотелия;
4) глюкокортикостероиды, часто вводимые больным как часть специфической терапии, также отрицательно влияют на защитные механизмы;
5) интубация, зондовое энтеральное питание и использование сосудистых катетеров вызывают нарушение целостности кожных покровов и/или повреждение слизистых оболочек.
В связи с высокой вероятностью развития инфекционных осложнений у больных острым лейкозом разработан комплекс профилактических мероприятий:
1) изоляция больного в период нейтропении, которая обеспечивает снижение частоты инфекций, передающихся воздушно-капельным путем;
2) обработка кожи и слизистых оболочек дезинфицирующими растворами (хлоргексидин и др.);
3) деконтаминация кишечника (per os назначаются неабсорбируемые антибактериальные препараты, например канамицин, и противогрибковые средства, чаще всего нистатин или суспензия амфотерицина В), позволяющая снизить количество грамотрицательных организмов кишечного происхождения;
4) гигиена ротовой полости (регулярное полоскание и использование мягких зубных щеток с целью предотвращения травмирования десен);
5) системная профилактика (бисептол или фторхинолоны);
6) отказ от ректальных и вагинальных манипуляций (кроме проводимых по неотложным и жизненным показаниям);
7) назначение препаратов гранулоцитарного или гранулоцитарно-моноцитарного колониестимулирующего фактора (КСФ) для более быстрого восстановления нейтрофилов и уменьшения вероятности инфекционных осложнений.
Показанием к назначению эмпирической антибактериальной терапии на фоне агранулоцитоза является фебрильная температура тела (выше 38 °С) более 2 часов, не связанная с инфузиями или аллергическими реакциями. Оптимально сочетание антипсевдомонального пенициллина или цефалоспорина с аминогликозидом.
Допустима монотерапия цефалоспорином 3-го или 4-го поколения или карбепенемом, например имепенемом. При отсутствии эффекта в течение 2-3 суток необходимо дополнение эмпирической антибактериальной терапии ванкомицином; в случае сохранения лихорадки в течение 4-6 дней назначается амфотерицин В в связи с высокой вероятностью системной грибковой инфекции. После идентификации возбудителя проводится целенаправленная антибактериальная, противовирусная и антимикотическая терапия.
Антибактериальная терапия проводится до повышения абсолютного содержания нейтрофилов в крови больше 0,5 • 10 9 /л и нормализации температуры тела. Длительность терапии у пациентов с документированной инфекцией должна быть не менее 10-14 дней.
Трансфузии гранулоцитов используются крайне редко. Единственным показанием к трансфузии является развившийся на фоне агранулоцитоза бактериальный сепсис при отсутствии ответа на адекватную антибактериальную терапию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кандидоз у больных лейкозом - частота, причины, механизмы развития
Эпидемиология кандидоза. Частота инвазивного кандидоза составляет 9—15 % при трансплантации гемопоэтических клеток крови (ТГКК), 1 — 13 % при острых лейкозах, 1—2 % при лимфомах, до 0,5 % при солидных опухолях. Из дрожжевых грибов наиболее частыми патогенами являются Candida albicans. Наблюдается тенденция к снижению частоты их выделения с 80-90 % (70-80-е годы) до 40-60 % (90-е годы).
Начиная с 90-х годов возрастает выделение Candida попalbicans: С. tropicalis, С. krusei, С. glabrata, С. kefyr, С. parapsilosis и др.. Одна из причин увеличения Candida non-albicans — проведение антифунгальной профилактики азоловыми препаратами. На долю инфекций, вызванных С. glabrata, приходится от 5 до 35 %, С. tropicalis — от 8 до 43 %.
С. lusitaniae, С. dubliniensis, С. guilliermondii относятся к редким патогенам. Высокая частота выделения Candida non-albicans при инвазивных микозах регистрируется прежде всего у больных с гемобластозами.
Факторы риска кандидоза
Определяющим фактором в развитии инвазивного кандидоза является длительность нейтропении. При нейтропении от 1 до 20 дней вероятность развития системного микоза не превышает 20 %, от 21 до 40 дней — 40 %, от 40 дней и более достигает 60 %. Другим не менее важным фактором возникновения инвазивного кандидоза является колонизация грибами слизистых оболочек.
Вероятность развития инвазивного кандидоза увеличивается, если при культуральном исследовании отделяемого со слизистых оболочек (рот, нос, влагалище, кишечник) определяются грибы рода Candida не из одного локуса, а из нескольких. Более значимым является выделение дрожжевых грибов в образцах, взятых из мест, не граничащих между собой (например, рост грибов в посевах изо рта и влагалища).
Это подтверждено в ряде исследований. Одно из них проведено P. Martino и соавт.. Системный кандидоз развился у 18 (32 %) из 56 больных при колонизации кандидами нескольких не граничащих между собой областей; только у 2 (1,2 %) из 170 пациентов при выявлении кандид из одного локуса и лишь у 1 (0,5 %) из 198 больных без признаков колонизации грибами.
Инвазивные микозы достоверно чаще регистрируются у больных с центральными венозными катетерами, находящихся на парентеральном питании, при терапии глюкокортикоидами. Чаще инвазивный кандидоз возникает у пациентов, которые получают антациды, Н2-блокаторы или иные средства, подавляющие кислотность желудочного сока, а также при длительном применении антибактериальных препаратов. Как правило, у больных с гранулоцитопенией имеется не один, а несколько факторов, потенцирующих развитие инвазивного кандидоза.
Патогенез кандидоза
Кандидоз — это прежде всего эндогенная инфекция. Кандиды могут заселять кожу, слизистую оболочку ротоглотки, кишечник, транслокация их происходит, особенно при нейтропении, через поврежденный эпителий кишечника после курсов цитостатической терапии. Описаны случаи передачи кандид от больного к больному при длительном пребывании их в стационаре через предметы окружающей среды.
В крови грибы циркулируют непродолжительное время, затем, повреждая эндотелий, они внедряются в органы, вызывая образование небольших абсцессов.
Нейтрофилы, моноциты и макрофаги составляют основное звено защиты для макроорганизма от инвазии такими грибами, как Candida spp., Aspergillus spp., Mucor spp. Инфекции, вызванные этими грибами, встречаются прежде всего при нарушенном фагоцитозе, что является следствием заболевания или результатом цитостатической терапии.
Течение инвазивного микоза может быть стремительно быстрым в случае развития его при глубокой нейтропении и вялым, медленным при возникновении у больных с невыраженной нейтропенией или при заболеваниях, сопровождающихся дефектами функции нейтрофилов.
Клеточное звено иммунитета является ведущим в защите от инвазии грибами Cryptococcus neoformans, Histoplasma capsulatum и Coccidioides immitis. При дефектах клеточного иммунитета чаще возникает диссеминированный микоз, вызванный этими грибами, чем ограниченный в легких. Выраженное поражение грибами рода Candida слизистых оболочек в отличие от инвазивного кандидоза развивается также при дефиците клеточного иммунитета.
Клинические симптомы кандидоза
Выделяют следующие формы кандидоза:
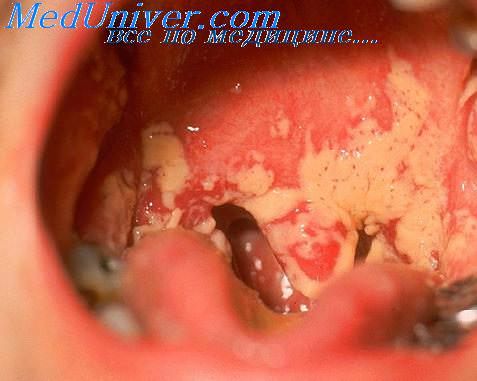
• поверхностный — поражение кожи и слизистых оболочек (при нейтропении чаще диагностируют орофарингеальный и эзофагеальный);
• инвазивный кандидоз, который включает кандидемию, острый диссеминированный кандидоз, хронический диссеминированный кандидоз, кандидозное поражение одного органа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Острый лейкоз – опухолевое поражение кроветворной системы, морфологической основой которого выступают незрелые (бластные) клетки, вытесняющие нормальные гемопоэтические ростки. Клиническая симптоматика острого лейкоза представлена прогрессирующей слабостью, немотивированным подъемом температуры, артралгиями и оссалгиями, кровотечениями различных локализаций, лимфаденопатией, гепатоспленомегалией, гингивитами, стоматитами, ангинами. Для подтверждения диагноза необходимо исследование гемограммы, пунктата костного мозга, биоптата подвздошной кости и лимфоузлов. Основу лечения острых лейкозов составляют химиотерапевтические курсы и сопроводительная терапия.


Общие сведения
Причины острого лейкоза
Первопричиной острого лейкоза является мутация гемопоэтической клетки, дающей начало опухолевому клону. Мутация кроветворной клетки приводит к нарушению ее дифференцировки на ранней стадии незрелых (бластных) форм с дальнейшей пролиферацией последних. Образующиеся опухолевые клетки замещают нормальные ростки гемопоэза в костном мозге, а в дальнейшем выходят в кровь и разносятся в различные ткани и органы, вызывая их лейкемическую инфильтрацию. Все бластные клетки несут в себе одинаковые морфологические и цитохимические признаки, что свидетельствует в пользу их клонального происхождения от одной клетки-родоначальницы.
Причины, запускающие мутационный процесс, не известны. В гематологии принято говорить о факторах риска, повышающих вероятность развития острого лейкоза. В первую очередь, это генетическая предрасположенность: наличие в семье больных с острым лейкозом практически утраивает риск заболевания у близких родственников. Риск возникновения острого лейкоза повышается при некоторых хромосомных аномалиях и генетических патологиях - болезни Дауна, синдроме Клайнфельтера, Вискотта-Олдрича и Луи-Барра, анемии Фанкони и др.
Вероятно, что активация генетической предрасположенности происходит под действием различных экзогенных факторов. В числе последних могут выступать ионизирующая радиация, химические канцерогены (бензол, мышьяк, толуол и др.), цитостатические препараты, используемые в онкологии. Нередко острый лейкоз становится следствием противоопухолевой терапии других гемобластозов – лимфогранулематоза, неходжкинских лимфом, миеломной болезни. Подмечена связь острых лейкозов с предшествующими вирусными инфекциями, угнетающими иммунную систему; сопутствующими гематологическими заболеваниями (некоторыми формами анемий, миелодисплазиями, пароксизмальной ночной гемоглобинурией и др.).
Классификация острого лейкоза
В онкогематологии общепринята международная FAB-классификация острых лейкозов, дифференцирующая различные формы заболевания в зависимости от морфологии опухолевых клеток на лимфобластные (вызываемые низкодифференцированными предшественниками лимфоцитов) и нелимфобластные (объединяющие остальные формы).
1. Острые лимфобластные лейкозы взрослых и детей:
- пре-В-форма
- В-форма
- пре-Т-форма
- Т-форма
- ни Т ни В-форма
2. Острые нелимфобластные (миелоидные) лейкозы:
- о. миелобластный (вызван неконтрорлируемой пролиферацией предшественников гранулоцитов)
- о. моно- и о. миеломонобластный (характеризуются усиленным размножением монобластов)
- о. мегакариобластный (связан с преобладанием недифференцированных мегакариоцитов – предшественников тромбоцитов)
- о. эритробластный (обусловлен пролиферацией эритробластов)
3. Острый недифференцированный лейкоз.
Течение острых лейкозов проходит ряд стадий:

Симптомы острого лейкоза
В развернутом периоде острого лейкоза развиваются анемический, геморрагический, интоксикационный и гиперпластический синдромы.
Анемические проявления обусловлены нарушением синтеза эритроцитов, с одной стороны, и повышенной кровоточивостью – с другой. Они включают бледность кожных покровов и слизистых, постоянную усталость, головокружение, сердцебиение, повышенное выпадение волос и ломкость ногтей и др. Усиливается выраженность опухолевой интоксикации. В условиях абсолютной лейкопении и упадка иммунитета легко присоединяются различные инфекции: пневмонии, кандидоз, пиелонефрит и т. д.
В основе геморрагического синдрома лежит выраженная тромбоцитопения. Диапазон геморрагических проявлений колеблется от мелких единичных петехий и синяков до гематурии, десневых, носовых, маточных, желудочно-кишечных кровотечений и пр. По мере прогрессирования острого лейкоза кровотечения могут становиться все массивнее вследствие развития ДВС-синдрома.
Гиперпластический синдром связан с лейкемической инфильтрацией как костного мозга, так и других органов. У больных острым лейкозом наблюдается увеличение лимфоузлов (периферических, медиастинальных, внутрибрюшных), гипертрофия миндалин, гепатоспленомегалия. Могут возникать лейкозные инфильтраты кожи (лейкемиды), оболочек мозга (нейролейкоз), поражение легких, миокарда, почек, яичников, яичек и др. органов.
Полная клинико-гематологическая ремиссия характеризуется отсутствием внекостномозговых лейкемических очагов и содержанием бластов в миелограмме менее 5% (неполная ремиссия – менее 20%). Отсутствие клинико-гематологических проявлений в течение 5 лет расценивается как выздоровление. В случае увеличения бластных клеток в костном мозге более 20%, их появления в периферической крови, а также выявления внекостномозговых метастатических очагов диагностируется рецидив острого лейкоза.
Терминальная стадия острого лейкоза констатируется при неэффективности химиотерапевтического лечения и невозможности достижения клинико-гематологической ремиссии. Признаками данной стадии служат прогрессирование опухолевого роста, развитие несовместимых с жизнью нарушений функции внутренних органов. К описанным клиническим проявлениям присоединяются гемолитическая анемия, повторные пневмонии, пиодермии, абсцессы и флегмоны мягких тканей, сепсис, прогрессирующая интоксикация. Причиной смерти больных становятся некупируемые кровотечения, кровоизлияния в мозг, инфекционно-септические осложнения.
Диагностика острого лейкоза
С целью подтверждения и идентификации разновидности острого лейкоза выполняется стернальная пункция с морфологическим, цитохимическим и иммунофенотипическим исследованием костного мозга. При исследовании миелограммы обращает внимание увеличение процента бластных клеток (от 5% и выше), лимфоцитоз, угнетение красного ростка кроветворения (кроме случаев о. эритромиелоза) и абсолютное снижение или отсутствие мегакариоцитов (кроме случаев о. мегакариобластного лейкоза). Цитохимические маркерные реакции и иммунофенотипирование бластных клеток позволяют точно установить форму острого лейкоза. При неоднозначности трактовки анализа костного мозга прибегают к проведению трепанобиопсии.
С целью исключения лейкемической инфильтрации внутренних органов производится спинномозговая пункция с исследованием ликвора, рентгенография черепа и органов грудной клетки, УЗИ лимфатических узлов, печени и селезенки. Кроме гематолога, больные острым лейкозом должны быть осмотрены неврологом, офтальмологом, отоларингологом, стоматологом. Для оценки тяжести системных нарушений может потребоваться исследование коагулограммы, биохимического анализа крови, проведение электрокардиографии, ЭхоКГ и др.
Дифференциально-диагностические мероприятия направлены на исключение ВИЧ-инфекции, инфекционного мононуклеоза, цитомегаловирусной инфекции, коллагенозов, тромбоцитопенической пурпуры, агранулоцитоза; панцитопении при апластической анемии, В12 и фолиеводефицитной анемии; лейкемоидных реакций при коклюше, туберкулезе, сепсисе и др. заболеваниях.

Лечение острого лейкоза
Пациентов с острым лейкозом лечат в стационарах онкогематологического профиля. В палатах организуется усиленный санитарно-дезинфекционный режим. Больные с острым лейкозом нуждаются в проведении гигиенической обработки полости рта, профилактики пролежней, туалета половых органов после физиологических отправлений; организации высококалорийного и витаминизированного питания.
Непосредственно лечение острых лейкозов проводится последовательно; основные этапы терапии включают достижение (индукцию) ремиссии, ее закрепление (консолидацию) и поддержание, профилактику осложнений. Для этого разработаны и используются стандартизированные схемы полихимиотерапии, которые подбираются гематологом с учетом морфологической и цитохимической формы острого лейкоза.
При благоприятной ситуации ремиссия обычно достигается в течение 4-6 недель усиленной терапии. Затем, в рамках консолидации ремиссии проводится еще 2-3 курса полихимиотерапии. Поддерживающая противорецидивная терапия осуществляется еще в течение не менее 3-х лет. Наряду с химиотерапией при остром лейкозе необходимо проведение сопроводительного лечения, направленного на предупреждение агранулоцитоза, тромбоцитопении, ДВС-синдрома, инфекционных осложнений, нейролейкемии (антибиотикотерапия, переливание эритроцитарной, тромбоцитарной массы и свежезамороженной плазмы, эндолюмбальное введение цитостатиков). При лейкемической инфильтрации глотки, средостения, яичек и др. органов проводится рентгенотерапия очагов поражения.
В случае успешного лечения достигается уничтожение клона лейкозных клеток, нормализация кроветворения, что способствует индукции длительного безрецидивного периода и выздоровления. Для предупреждения рецидивов острого лейкоза может быть проведена трансплантация костного мозга после предварительного кондиционирования путем химиотерапии и тотального облучения.
По имеющимся статистическим сведениям, использование современных цитостатических средств приводит к переходу острого лейкоза в фазу ремиссии у 60-80% больных; из них у 20-30% удается добиться полного выздоровления. В целом прогноз при острых лимфобластных лейкозах более благоприятен, чем при миелобластных.
В статье представлена клиническая характеристика грибковых инфекций как частого осложнения у гематологических больных, получающих химиотерапию, глюкокортикоиды, иммуносупрессивную терапию. Рассмотрены рекомендации по назначению противогрибковой терапии у больных гемобластозами с использованием всего арсенала противогрибковых препаратов системного действия различной эффективности. Обоснована необходимость раннего назначения противогрибковых препаратов с профилактической целью.
Одной из важных проблем агрессивной терапии гемобластозов является беззащитность пациента от инфекции на фоне депрессии иммунитета и агранулоцитоза.
Одной из проблем является беззащитность пациента от инфекции на фоне депрессии иммунитета и агранулоцитоза. В последние годы возросла роль грибковых инфекций, приводящих к тяжелым осложнениям и смерти у пациентов с иммунодефицитными состояниями [8, 17]. Частота развития грибковых инфекций также высока и среди пациентов с гематологическими злокачественными новообразованиями. По данным американской Системы надзора за нозокомиальными инфекциями (NNIS), в течение последних 10 лет было отмечено увеличение числа грибковых инфекций с 2,0 до 3,8 на 1 000 поступлений [32]. Частота нозокомиальных грибковых инфекций мочевыводящих путей возросла с 9,0 до 20,5 на 10 000 госпитализированных больных, частота хирургической раневой инфекции, вызываемой грибковыми микроорганизмами – с 1,0 до 3,1, а частота фунгемии – с 1,0 до 4,9 [24].
В последние годы был отмечен дальнейший рост числа грибковых инфекций, особенно у иммунокомпрометированных больных, в т.ч. онкогематологических. Среди последних группой риска являются в первую очередь больные с фебрильной нейтропенией после проведения цитостатической терапии (особенно с острыми лейкозами), а также с осложнениями после хирургических вмешательств на брюшной полости и находящиеся в отделениях интенсивной терапии [16], получающие длительную и массивную антибактериальную терапию. Развитию грибковой суперинфекции, т.е. грибковой инфекции на фоне уже имеющейся бактериальной инфекции, наряду с антибиотикотерапией и угнетением иммунитета в результате агрессивной цитостатической терапии, способствуют лечение кортикостероидами, наличие хронических заболеваний, пожилой возраст больных [11].
Несмотря на то что потенциально патогенными для человека являются более 100 видов грибов, причиной нозокомиальных инфекций являются не более 20 из них, среди которых превалируют дрожжеподобные грибы рода Candida. Значительно реже встречаются другие дрожжеподобные грибы (геотрихии, сахаромицеты), а также аспергиллы, Mucor, Fusarium spp., другие плесневые грибы [14]. Большинство грибов рода Candida существуют как сапрофиты на коже, в желудочно-кишечном тракте и в области гениталий. Они обычно слабовирулентны и не способны вызывать микозы у пациентов без нарушения защитных барьерных функций организма. Немаловажную роль в развитии кандидозов играет предшествующая колонизация слизистых оболочек. В условиях значительного количества факторов риска слизистые оболочки полости рта, желудочно-кишечного и мочевыводящего трактов онкологических больных, колонизированные грибами, могут стать источником диссеминации.
Кандиды вызывают до 86% всех грибковых инфекций [26]. Грибы рода Candida входят в число 10 наиболее часто выявляемых патогенов в клинике.
Кандиды у человека занимают 6-е место в ряду лидирующих нозокомиальных патогенов в США, вызывая до 86% всех грибковых инфекций [26]. Инвазивные кандидозы составляют до 10–15% всех нозокомиальных инфекций, а Candida входит в число 10 наиболее часто выявляемых патогенов в клинике. Заболеваемость кандидозом у больных гемобластозами может достигать 10–30%, в связи с чем эти пациенты составляют главную группу риска.
Инвазивный кандидоз характеризуется тяжестью клинических проявлений и летальностью от 30 до 70%.
Важными факторами риска при развитии кандидоза являются:
- колонизация кандиды;
- центральные венозные катетеры;
- антибиотики широкого спектра действия;
- кортикостероиды и другие иммуносупрессоры;
- цитостатические препараты;
- нейтропения;
- мукозит;
- индуцированный химиолучевой терапией.
Одной из наиболее частых локализаций грибковой суперинфекции являются ротовая полость (орофарингеальный кандидоз, молочница ротовой полости) [10, 12, 15]. Кандидоз у онкогематологических больных может варьировать от бессимптомных или легких форм стоматитов до угрожающих жизни кандидемий и метастатических инфекций. В полость рта грибы попадают алиментарным путем, однако для того, чтобы возникла колонизация орофарингеальной зоны или инфекция, необходимо наличие факторов риска.
Лечение антибактериальными препаратами приводит к быстрой замене количественного и качественного состава микрофлоры полости рта с преобладанием некоторых видов микробов, в т.ч. Сandida spp. Поражение полости рта и глотки может проявляться в различных формах, чаще всего в виде молочницы, иногда в виде толстого коричневого налета на языке. Эти формы поддаются терапии не абсорбируемыми формами имидазолов, например клотримазолом. При рефрактерности флоры альтернативным вариантом является кетоконазол (Низорал) либо флуконазол (Дифлюкан) [7, 22].
Поражение пищевода может протекать бессимптомно примерно у 25% больных, но они часто жалуются на дисфагию, боли при глотании и за грудиной, реже – на рвоту, тошноту, подъем температуры либо кровотечение из желудочно-кишечного тракта. Диагноз ставится после эзофагоскопии и обнаружении в пищеводе белых налетов, эритематозных участков и язв. Определенно диагноз может быть поставлен только после проведения микроскопии, т.к. аналогичная картина отмечается при бактериальном и вирусном поражении. Эзофагоскопию не назначают детям раннего возраста и больным с некорригированной тромбоцитопенией, а также клинически нестабильным пациентам [10, 13]. В данной ситуации желательно ограничиться эмпирическим назначением антимикотиков и противовирусных препаратов. Лечение кандидозного поражения пищевода зависит от гематологического и клинического статуса больного. В легких случаях достаточно назначение Дифлюкана. Лихорадящим пациентам с агранулоцитозом и высоким риском диссеминации назначают Амфотерицин В [27]. При аутопсии у больных с гранулоцитопенией всегда выявляется колонизация желудочно-кишеченого тракта Candida, но эта форма инфекции редко диагностируется при жизни. Наиболее частые находки при эндоскопии желудка – эрозии, язвы, псевдомембраны. После хирургических вмешательств может возникнуть кандидозный перитонит. При перфорации чаще возникает инфекция, вызванная С. albicans, в то время как катетер-ассоциируемый перитонит чаще вызван C. tropicalis. При подозрении необходимо удалить интраперитонеальный катетер, т.к. штаммы Candida активно адгезируют на силастических поверхностях [18].
Клинико-лабораторные проявления гепатолиенального кандидоза неспецифичны и включают:
- стойкую резистентную к антибиотикам лихорадку, сохраняющуюся после выхода из нейтропении;
- боли в животе;
- гепатоспленомегалию;
- поверхностный грибковый мукозит;
- повышение в крови уровней щелочной фосфатазы (ЩФ) и γ-глутамилтрансферазы (γ-ГТФ), что является ранним маркером вовлечения печени в патологический процесс и часто появляется уже в период аплазии кроветворения;
- реактивный лейкоцитоз;
- более чем в 50% случаев негативную гемокультуру [3, 10, 14].
Подходы к терапии такие же, как и при хроническом диссеминированном кандидозе. В случае развития обструктивных уропатий показано хирургическое лечение. При лечении опухолевых заболеваний диссеминированный кандидоз с вовлечением в процесс различных органов является угрожающим жизни осложнением. На ранних стадиях диагноз очень трудно поставить. Кандидемия может быть поздней находкой уже при органном поражении. Candida albicans – наиболее частая причина кандидемии, а С. tropicalis, C. krusei, C. parapsilosis чаще выявляются у больных с тяжелой нейтропенией.
Инвазивные формы кандидоза варьируют от острых молниеносных, потенциально летальных форм до хронических, локализованных либо диссеминированных. Эти разграничения условны и определяются длительностью процесса. Для больных с нейтропенией и инвазивным кандидозом характерна постоянная либо рекуррентная лихорадка во время терапии антибиотиками широкого спектра действия [25, 31]. Начало может быть острое, с септическим шоком, фебрилитетом и ознобом, нарушением сознания и падением артериального давления, кардиоваскулярным коллапсом. Косвенным указанием на наличие инвазивного кандидоза могут быть миалгии, кандидурия, метастатические кожные эрозии (чаще всего округлые одиночные либо со скоплениями до 1 см в диаметре). С мацерированных поверхностей кожи нужно обязательно взять посев и соскоб на микроскопию. Диагноз инвазивного кандидоза можно поставить при выявлении Candida в культурах крови либо других жидкостях (цереброспинальной, перитонеальной, синовиальной, плевральной). В процесс могут быть вовлечены печень, селезенка, почки, сердце, легкие, суставы и кости [20, 21].
Легочный кандидоз чаще возникает при аспирации либо гематогенным путем. На рентгенограмме выявляются характерные округлые инфильтраты. Наиболее часто возбудителем грибковых инфекций бронхов и легких являются Candida albicans. Крайне редко инфекцию могут вызывать C. glabrata,C.tropicalis и C. parapsilosis
Грибы рода Candida в основном чувствительны к амфотерицину В, но для C. krusei и C. glabrata минимальная подавляющая концентрация данного препарата достаточно высока, поэтому при терапии микозов, обусловленных этими видами грибов, нужно назначать максимальные дозы препарата.
Одной из важнейших проблем, связанных с грибковой патологией человека, является правильное проведение комплексного лечения с назначением антифунгальных препаратов, различающихся по механизму и спектру действия. Представители рода Candida обладают различной чувствительностью к противогрибковым препаратам, что необходимо учитывать при назначении терапии и профилактики грибковых инфекций. Грибы рода Candida в основном чувствительны к амфотерицину В, но для C. krusei и C. glabrata минимальная подавляющая концентрация данного препарата достаточно высока, поэтому при терапии микозов, обусловленных этими видами грибов, нужно назначать максимальные дозы препарата. Описаны случаи резистентности С. lusitaniae к амфотерицину В в клиниках, где этот препарат используется в целях профилактики [25, 28].
Механизм действия большинства противогрибковых препаратов обусловлен воздействием на основные ферменты, влияющие на процесс биосинтеза эргостерола, входящего в состав мембраны клеток гриба, однако уровень этого воздействия различен. Как известно, синтез эргостерола проходит следующие стадии: ацетил-коэнзим А – сквален – ланостерин – эргостерол.
Полиеновые антибиотики – амфотерицин В, Амфоглюкамин, нистатин, леворин, натамицин – вызывают нарушение синтеза собственно эргостерола. Амфотерицин B деоксихолат остается стандартным антифунгальным агентом для лечения инвазивного кандидоза, но необходимо помнить о высокой токсичности этого препарата [1, 31].
Азолы (производные имидазола) – кетоконазол, клотримазол , канизон, миконазол, эконазол, изоконазол, бифоназол, тенонитрозол, флуконазол, итраконазол – воздействуют на этапе перехода ланостерина в эргостерол и жирные кислоты, угнетая ферменты цитохрома Р-450, С-оксидазу и С14 - диметилазу, что ведет к нарушению проницаемости клеточной стенки гриба, накоплению азольного препарата в клетке, изменению текучести мембран. Флуконазол хорошо абсорбируется в желудочно-кишечном тракте, более 90% препарата попадает в системный кровоток. Флуконазол является препаратом выбора при кандидозном эзофагите, кандидемии (при стабильном состоянии пациента), инфекции мочевыводящих путей, перитоните, раневой инфекции, используется в лечении фебрильных нейтропений. Клинический эффект при кандидозном эзофагите составляет 95,1% [25, 34]. При кандидозе мочевыводящих путей назначают флуконазол в дозе 400 мг с последующим переходом на дозу 200 мг. При кандидемии и стабильном состоянии больного применяют флуконазол в дозе 600 мг, при нормализации температуры – 400 мг. Показано, что активность флуконазола в дозе 400 мг при кандидемии (70%) сопоставима с активностью амфотерицина В в дозе 0,5–0,6 мг/кг (79%) [9]. При лечении инфекции, вызванной C. glabrata, можно назначать флуконазол в дозе 800 мг/сут. В отдельных случаях применяли дозу 1 200 мг/сут без каких-либо выраженных побочных эффектов [27]. Флуконазол является наиболее эффективным препаратом для профилактики диссеминированных кандидозных инфекций после трансплантации костного мозга [9]. При онкогематологических заболеваниях флуконазол назначали в дозе 200–400 мг/сут в течение 5–14 дней. Хорошо известна активность итраконазола при кандидозе слизистых оболочек, но появление внутривенных форм позволяет лечить инвазивные формы заболевания. Вориконазол в настоящее время выпускают в форме для приема per os и парентерального введения. Он, так же как и флуконазол, активен при кандидозе пищевода, хотя его применения связано с большими побочными эффектами, что было представлено в недавних исследованиях. На основе этих данных вориконазол лицензирован в Европейском сообществе для лечения резистентной к флуконазолу серьезной инвазивной кандидозной инфекции (включая C. krusei) [25].
Аллиламины – тербинафин, нафтифин – отличаются высокоспецифическим подавляющим влиянием на фермент скваленэпоксидазу, которая катализирует один из этапов синтеза эргостерола клетками гриба, т.е. аллиламины подавляют синтез стеринов в грибной клетке на ранней стадии. Каспофунгин – первый антифунгальный эхинокандин. Как и все препараты этого класса, он доступен в форме только для парентерального введения, а спектр его действия в значительной степени ограничен грибами рода Candida и Aspergillus. При выборе эмпирической терапии следует помнить, что препараты этого класса не активны против Cryptococcus neoformans и мицелиальных грибов кроме Aspergillus [30]. Как было установлено, каспофунгин эффективен при лечении орофарингеального и эзофагального кандидоза. Likewise, Mora-Duarte и соавт. обнаружили, что каспофунгин (70 мг доза насыщения и затем 50 мг/день у взрослых) эквивалентен, но лучше переносится, чем амфотерицин В деоксихолат (0,6–1,0 мг/кг/день) в случаях инвазивного кандидоза (83% из которых были с кандидемией, 10% – с перитонитом и 7% – смешанные случаи). Применение каспофунгина также было эффективно у 72% пациентов с резистентным к флуконазолу кандидозом пищевода [31]. Этот препарат заявлен как эффективный против всех видов Candida, хотя МИК некоторых штаммов C. parapsilosis и Candida guillermondii относительно более высокие. Таким образом, полученные данные свидетельствуют о том, что эхинокандины могут быть успешно использованы для лечения фунгемии, обусловленной C. Parapsilosis.
Начальная медикаментозная противогрибковая терапия кандидемии у больных гемобластозами должна включать каспофунгин, флуконазол и препараты амфотерицина В или комбинированную терапию флуконазол + амфотерицин В.
Начальная медикаментозная противогрибковая терапия кандидемии у больных гемобластозами должна включать каспофунгин, флуконазол и препараты амфотерицина В или комбинированную терапию флуконазол + амфотерицин В. Выбор между этими лекарственными средствами зависит от клинического статуса пациента, знания врачом вида гриба и/или чувствительности возбудителя к антифунгальным агентам, относительной лекарственной токсичности, наличия органной дисфункции, которая может влиять на клиренс, доступной информации об имеющемся опыте применения конкретного препарата и реакции пациента на первое введение. Терапия для кандидемии должна продолжаться в течение 2 недель после получения последнего положительного культурального исследования и разрешения симптомов и признаков инфекции. При длительной терапии амфотерицин В или каспофунгин могут быть заменены внутривенным или пероральным введением флуконазола [18, 19]. Пациенты, у которых во время развития кандидемии наблюдалась нейтропения, должны получать рекомбинантные цитокины, ускоряющие выход из нейтропении (гранулоцитарный колоний-стимулирующий фактор или гранулоцитарный моноцитарный колоний-стимулирующий фактор). Другие факторы иммуносупрессии также должны быть по возможности устранены или сведены к минимуму (например, за счет снижения дозы системных кортикостероидов). Обострение (или персистенция) кандидемии на фоне проводимой антифунгальной терапии предполагает вероятность присутствия инфицированного внутрисосудистого устройства, выраженной иммуносупрессии или микробиологической резистентности. В таких случаях следует начать лечение препаратами других классов, а выделенные штаммы необходимо идентифицировать до вида и провести тесты на их чувствительность к антимикотикам. Инфицированные внутрисосудистые устройства следует по возможности удалить и провести мероприятия для снижения иммуносупрессии [4].
Грибковые инфекции являются наиболее частым осложнением у больных гематологического профиля, требуют раннего профилактического назначения антимикотических средств, нуждаются в длительной терапии противогрибковыми препаратами системного действия, приводят к летальным исходам.
1. Багирова Н.С. Дрожжевые грибы: идентификация и резистентность к противогрибковым препаратам в онкогематологическом стационаре/Н.С.Багирова, Н.В.Дмитриева//Инфекции и антимикробная терапия. - 2001. - Т. 3. - №6. - С. 178–182.
2. Белобородов В.Б., Синякова Л.А. Нозокомиальная кандидурия: алгоритм диагностики и лечения/В.Б.Белобородов, Л.А.Синякова//Consilium medicum. – Т. 05. - №7. - С. 2.
3. Бурова С.А. Особенности течения и терапии грибковых инфекций у детей/С.А.Бурова//Доктор. Ру. - 2003. - №12. – С. 24–25.
4. Гельфанд Б.Р. Кандидозная инфекция в хирургии и интенсивной терапии/Б.Р.Гельфанд, В.А.Гологорский, Е.Б.Гельфанд//Инфекции и антимикробная терапия. – 2000. – Т. 2. – №1. – С. 24–28.
5. Грибковые инфекции у больных солидными опухолями и гемобластозами/Н.В.Дмитриева, И.Н.Петухова, Л.Ф.Иванова и др.//Инфекции и антимикробная химиотерапия. - 2001. - Т. 3. - №3. – С. 92–93.
6. Долгих Т.И. Лабораторная диагностика – основа информационного обеспечения диагностического процесса при оппортунистических инфекциях (обзор литературы)/И.Т.Долгих//Клин. лаб. Диагностика. – 2008. – 1. - С. 49–51.
7. Ивашкин В.Т. Гастроэнтерология XXI века/В.Т.Ивашкин, Т.Л.Лапина//Рус. мед. журн. – 2000. – Т. 8. – №17 (118). - С. 697–703.
8. Клясова Г.А. Микотические инфекции: клиника, диагностика, лечение/Г.А.Клясова//Инфекции и антимикробная терапия. - 2000. - Т. 2. - №6. - С. 184–189.
Острый лимфобластный лейкоз – злокачественное поражение системы кроветворения, сопровождающееся неконтролируемым увеличением количества лимфобластов. Проявляется анемией, симптомами интоксикации, увеличением лимфоузлов, печени и селезенки, повышенной кровоточивостью и дыхательными расстройствами. Из-за снижения иммунитета при остром лимфобластном лейкозе часто развиваются инфекционные заболевания. Возможно поражение ЦНС. Диагноз выставляется на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
Общие сведения
В соответствии с классификацией ВОЗ различают четыре типа ОЛЛ: пре-пре-В-клеточный, пре-В-клеточный, В-клеточный и Т-клеточный. В-клеточные острые лимфобластные лейкозы составляют 80-85% от общего количества случаев заболевания. Первый пик заболеваемости приходится на возраст 3 года. В последующем вероятность развития ОЛЛ повышается после 60 лет. Т-клеточный лейкоз составляет 15-20% от общего количества случаев болезни. Пик заболеваемости приходится на возраст 15 лет.

Причины острого лимфобластного лейкоза
Непосредственной причиной острого лимфобластного лейкоза является образование злокачественного клона – группы клеток, обладающих способностью к неконтролируемому размножению. Клон образуется в результате хромосомных аберраций: транслокации (обмена участками между двумя хромосомами), делеции (утраты участка хромосомы), инверсии (переворота участка хромосомы) или амплификации (образования дополнительных копий участка хромосомы). Предполагается, что генетические нарушения, вызывающие развитие острого лимфобластного лейкоза, возникают еще во внутриутробном периоде, однако для завершения процесса формирования злокачественного клона нередко требуются дополнительные внешние обстоятельства.
В числе факторов риска возникновения острого лимфобластного лейкоза обычно в первую очередь указывают лучевые воздействия: проживание в зоне с повышенным уровнем ионизирующей радиации, радиотерапию при лечении других онкологических заболеваний, многочисленные рентгенологические исследования, в том числе во внутриутробном периоде. Уровень связи, а также доказанность наличия зависимости между различными лучевыми воздействиями и развитием острого лимфобластного лейкоза сильно различаются.
Так, взаимосвязь между лейкозами и лучевой терапией в наши дни считается доказанной. Риск возникновения острого лимфобластного лейкоза после радиотерапии составляет 10%. У 85% пациентов болезнь диагностируется в течение 10 лет после окончания курса лучевой терапии. Связь между рентгенологическими исследованиями и развитием острого лимфобластного лейкоза в настоящее время остается на уровне предположений. Достоверных статистических данных, подтверждающих эту теорию, пока не существует.
Вероятность развития острого лимфобластного лейкоза повышается при контакте матери с некоторыми токсическими веществами в период гестации, при некоторых генетических аномалиях (анемии Фанкони, синдроме Дауна, синдроме Швахмана, синдроме Клайнфельтера, синдроме Вискотта-Олдрича, нейрофиброматозе, целиакии, наследственно обусловленных иммунных нарушениях), наличии онкологических заболеваний в семейном анамнезе и приеме цитостатиков. Некоторые специалисты отмечают возможное негативное влияние курения.
Симптомы острого лимфобластного лейкоза
Болезнь развивается стремительно. К моменту постановки диагноза суммарная масса лимфобластов в организме может составлять 3-4% от общей массы тела, что обусловлено бурной пролиферацией клеток злокачественного клона на протяжении 1-3 предыдущих месяцев. В течение недели количество клеток увеличивается примерно вдвое. Различают несколько синдромов, характерных для острого лимфобластного лейкоза: интоксикационный, гиперпластический, анемический, геморрагический, инфекционный.
Интоксикационный синдром включает в себя слабость, утомляемость, лихорадку и потерю веса. Повышение температуры может провоцироваться как основным заболеванием, так и инфекционными осложнениями, которые особенно часто развиваются при наличии нейтропении. Гиперпластический синдром при остром лимфобластном лейкозе проявляется увеличением лимфоузлов, печени и селезенки (в результате лейкемической инфильтрации паренхимы органов). При увеличении паренхиматозных органов могут появляться боли в животе. Увеличение объема костного мозга, инфильтрация надкостницы и тканей суставных капсул могут становиться причиной ломящих костно-суставных болей.
О наличии анемического синдрома свидетельствуют слабость, головокружения, бледность кожи и учащение сердечных сокращений. Причиной развития геморрагического синдрома при остром лимфобластном лейкозе становятся тромбоцитопения и тромбозы мелких сосудов. На коже и слизистых выявляются петехии и экхимозы. При ушибах легко возникают обширные подкожные кровоизлияния. Наблюдаются повышенная кровоточивость из ран и царапин, кровоизлияния в сетчатку, десневые и носовые кровотечения. У некоторых больных острым лимфобластным лейкозом возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и дегтеобразным стулом.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции. При увеличении лимфатических узлов средостения отмечаются нарушения дыхания, обусловленные уменьшением объема легких. Дыхательная недостаточность чаще обнаруживается при Т-клеточном остром лимфобластном лейкозе. Нейролейкозы, спровоцированные инфильтрацией оболочек спинного и головного мозга, чаще отмечаются во время рецидивов.
При вовлечении ЦНС выявляются положительные менингеальные симптомы и признаки повышения внутричерепного давления (отек дисков зрительных нервов, головная боль, тошнота и рвота). Иногда поражение ЦНС при остром лимфобластном лейкозе протекает бессимптомно и диагностируется только после исследования цереброспинальной жидкости. У 5-30% мальчиков появляются инфильтраты в яичках. У пациентов обоих полов на коже и слизистых оболочках могут возникать багрово-синюшные инфильтраты (лейкемиды). В редких случаях наблюдаются выпотной перикардит и нарушения функции почек. Описаны случаи поражений кишечника.
С учетом особенностей клинической симптоматики можно выделить четыре периода развития острого лимфобластного лейкоза: начальный, разгара, ремиссии, терминальный. Продолжительность начального периода составляет 1-3 месяца. Преобладает неспецифическая симптоматика: вялость, утомляемость, ухудшение аппетита, субфебрилитет и нарастающая бледность кожи. Возможны головные боли, боли в животе, костях и суставах. В период разгара острого лимфобластного лейкоза выявляются все перечисленные выше характерные синдромы. В период ремиссии проявления болезни исчезают. Терминальный период характеризуется прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика острого лимфобластного лейкоза
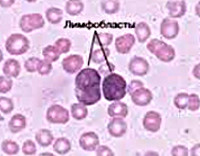
Диагноз выставляют с учетом клинических признаков, результатов анализа периферической крови и данных миелограммы. В периферической крови пациентов с острым лимфобластным лейкозом выявляются анемия, тромбоцитопения, повышение СОЭ и изменение количества лейкоцитов (обычно – лейкоцитоз). Лимфобласты составляют 15-20 и более процентов от общего количества лейкоцитов. Количество нейтрофилов снижено. В миелограмме преобладают бластные клетки, определяется выраженное угнетение эритроидного, нейтрофильного и тромбоцитарного ростка.
В программу обследования при остром лимфобластном лейкозе входят люмбальная пункция (для исключения нейролейкоза), УЗИ органов брюшной полости (для оценки состояния паренхиматозных органов и лимфатических узлов), рентгенография грудной клетки (для обнаружения увеличенных лимфоузлов средостения) и биохимический анализ крови (для выявления нарушений функции печени и почек). Дифференциальный диагноз острого лимфобластного лейкоза проводят с другими лейкозами, отравлениями, состояниями при тяжелых инфекционных заболеваниях, инфекционным лимфоцитозом и инфекционным мононуклеозом.
Лечение и прогноз при остром лимфобластном лейкозе
Основой терапии являются химиопрепараты. Выделяют два этапа лечения ОЛЛ: этап интенсивной терапии и этап поддерживающей терапии. Этап интенсивной терапии острого лимфобластного лейкоза включает в себя две фазы и длится около полугода. В первой фазе осуществляют внутривенную полихимиотерапию для достижения ремиссии. О состоянии ремиссии свидетельствуют нормализация кроветворения, наличие не более 5% бластов в костном мозге и отсутствие бластов в периферической крови. Во второй фазе проводят мероприятия для продления ремиссии, замедления или прекращения пролиферации клеток злокачественного клона. Введение препаратов также осуществляют внутривенно.
Продолжительность этапа поддерживающей терапии при остром лимфобластном лейкозе составляет около 2 лет. В этот период больного выписывают на амбулаторное лечение, назначают препараты для перорального приема, осуществляют регулярные обследования для контроля над состоянием костного мозга и периферической крови. План лечения острого лимфобластного лейкоза составляют индивидуально с учетом уровня риска у конкретного больного. Наряду с химиотерапией используют иммунохимиотерапию, радиотерапию и другие методики. При низкой эффективности лечения и высоком риске развития рецидивов осуществляют трансплантацию костного мозга. Средняя пятилетняя выживаемость при В-клеточном остром лимфобластном лейкозе в детском возрасте составляет 80-85%, во взрослом – 35-40%. При Т-лимфобластном лейкозе прогноз менее благоприятен.
Читайте также:

