Отпуск из аптеки препаратов от вич
Обновлено: 24.04.2024
Общая информация
Более 20 лет прошло с тех пор, как на фармацевтическом рынке появился новый класс антиретровирусных препаратов — ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ). В 1996 году американское Управление по санитарному надзору по качеству пищевых продуктов и медикаментов FDA одобрило невирапин, в 1997 году — делавирдин, а годом позже — эфавиренц. Однако, у значительной части пациентов с помощью ННИОТ не удалось добиться оптимального терапевтического ответа вследствие накопленной устойчивости вируса к монотерапии и/или неоптимальных режимов комбинированной терапии, поэтому усилия учёных всего мира были направлены на разработку новых молекул, с улучшенным профилем устойчивости. И они увенчались успехом.
Сегодня FDA одобрено применение пяти ННИОТ [1]:
-
;
- делавирдина;
- эфавиренца;
- этравирина;
- рилпивирина.
Представители ННИОТ принадлежат к разным классам ЛС по химической структуре, но имеют общий уникальный механизм действия: их взаимодействие с обратной транскриптазой ВИЧ-1 запускает цепь изменений, подавляющих активность этого фермента. Для ННИОТ характерна специфичность к ВИЧ-1, что делает их селективными ингибиторами вируса [1, 2].
Сегодня разрабатываются ННИОТ следующего, третьего поколения. Для улучшения приверженности лечению и снижения риска ошибок в дозировках при приёме препаратов была создана комбинация эфавиренц + два НИОТ (эмтрицабин и тенофовир) в одной таблетке, которую принимают один раз в день.
Фармакологическое действие
По всей видимости, ННИОТ вмешиваются в различные этапы реакций обратной транскриптазы ВИЧ-1. За счёт этого препараты блокируют активность РНК- и ДНК-зависимой ДНК-полимеразы, вызывая разрушение активного центра фермента [1, 2].
ННИОТ не оказывают значимого ингибирующего эффекта на ДНК-полимеразу клеток эукариот, таких как ДНК-полимеразы человека.
Следует отметить, что большинство ННИОТ не активны в отношении ВИЧ-2 — второго серотипа вируса иммунодефицита, который встречается гораздо реже ВИЧ-1 (преимущественно в Африке), является менее вирулентным и агрессивным по сравнению с первым серотипом [2]. При этом, исследования in vitro демонстрируют активность этравирина в отношении ВИЧ-2 [3].
Устойчивость к ННИОТ
ВИЧ-инфекция характеризуется очень высокой скоростью репликации: вирус производит от 1 до 10 миллиардов новых вирусных частиц в день у нелеченного инфицированного. Наряду со специфическими свойствами обратной транкриптазы ВИЧ, а также большой длиной вирусного генома (около 10 000 нуклеотидов) это создаёт предпосылки к высокой частоте развития мутаций: мутантный ген в каждом положении нуклеотида в вирусном геноме вырабатывается каждый день.
Как правило, развитие мутаций тесно связано с неоптимальной схемой лечения, например, монотерапией. Оно также ставит под угрозу эффективность последующих схем антиретровирусной терапии, поскольку в каждом классе препаратов наблюдается перекрёстная резистентность [4].
Мутации в домене гена обратной транскриптазы изменяют способность ННИОТ связывать фермент. Устойчивость препаратов первого поколения была связана с мутациями в нескольких кодонах. Однако, чтобы вызвать клиническую неэффективность делавирдина, эфавиренца или невирапина, достаточно наличия мутации К103N или Y181C [4].
Препараты второго поколения более устойчивы, для развития резистентности к ним необходимо более одной мутации. Клинические исследования выявили 17 мутаций устойчивости, связанных со снижением ответа на терапию этравирином [5]. Различные мутации в разной степени влияют на восприимчивость вирусов к этравирину. Рилпивирин, будучи препаратом с более высоким генетическим барьером, чем ННИОТ первого поколения, всё же связан с более частыми случаями развития устойчивости по сравнению с этравирином [6].
Фармакокинетика ННИОТ
ННИОТ демонстрируют значительную индивидуальную фармакокинетическую вариабельность. Все одобренные в настоящее время препараты этой группы используют систему цитохрома Р450 для метаболизма и оказывают или индукционное, или ингибирующее действие на определённые изоферменты (например, CYP3A4, CYP2C9). Это приводит к значительному потенциалу лекарственного взаимодействия [7].
За исключением невирапина, ННИОТ в существенной степени связываются с белками (98–99 %), в первую очередь с альбумином и альфа-кислотным гликопротеином. Периоды полураспада ННИОТ в сыворотке крови довольно продолжительны и составляют от 25 до 55 часов, за исключением делавирдина, имеющего более короткий период полувыведения (2–11 часов) [7].
Побочные эффекты
Самым частым побочным эффектом ННИОТ считается сыпь: она развивается в течение первых нескольких недель терапии и проходит при продолжении лечения. Все препараты этого класса, за исключением этравирина, обладают определённой гепатотоксичностью. Так, делавирдин и эфавиренц могут повышать уровень трансаминаз, в то время как невирапин способен вызывать тяжёлое поражение печени, включая некроз [8].
Эфавиренц способен вызывать неблагоприятные реакции со стороны центральной нервной системы — бессонницу, яркие сновидения, головокружение, спутанность создания и галлюцинации. Рилпивирин также связан с неврологическими побочными эффектами, но реже, чем эфавиренц [6].
Устойчивость к побочным эффектам со стороны ЦНС на фоне приёма эфавиренца обычно возникает после нескольких недель терапии. Их можно корректировать за счёт приёма препарата перед сном и отказа от применения во время еды. Лишь у небольшого числа пациентов воздействие на ЦНС может сохраняться и даже потребовать отмены препарата [9].
Использование эфавиренца также связано с повышением риска суицидов примерно в два раза по сравнению с плацебо. Они присутствуют как в начале лечения, так и при длительном применении. К группам риска по развитию суицидальной наклонности на фоне лечения эфавиренцом относятся пациенты, принимающие психоактивные препараты, имеющие психиатрический анамнез, с массой тела менее 60 кг, а также употребляющие инъекционные наркотические средства [10].
Особенности отдельных ННИОТ
Невирапин
Используется, как минимум, в сочетании с двумя другими антиретровирусными препаратами. Относительно безопасен при беременности. Хорошо проникает через гематоэнцефалический барьер, подвергается печёночному метаболизму (период полувыведения — 28 часов). Препарат индуцирует и собственный метаболизм, поэтому дозу увеличивают постепенно. В начале терапии его назначают один раз в день, а спустя две недели увеличивают кратность приёма до двух раз в день (при хорошей переносимости) [1, 4, 10].
Как правило, невирапин применяется в странах третьего мира, в том числе и для антиретровирусной терапии во время беременности. Результаты исследований показали, что он превосходит зидовудин по эффективности при однократном введении во время родов, однако приводит к развитию резистентности у леченных матерей, что может отрицательно повлиять на терапевтический ответ антиретровирусной терапии в дальнейшем [1, 8].
Делавирдин
Принадлежит к семейству бис (гетеро-арил) пиперазинов, открытых учёными компании Upjohn Laboratories. Имеет более объёмную кристаллическую структуру по сравнению с другими ННИОТ, благодаря чему выступает за пределы гидрофобного кармана, с которым связывается. Это объясняет его особый профиль устойчивости. Мутация, связанная с развитием резистентности к делавирдину, расположена на участке места связывания ННИОТ с карманом. Она вызывает гиперчувствительность ко всем другим препаратам этой подгруппы [1, 4].
Как и невирапин, делавирдин применяют в схемах лечения, когда возникает резистентность, которую невозможно предотвратить. Сегодня этот препарат назначают крайне редко.
Эфавиренц
Представитель подкласса бензоксазинов, открытый исследователями Merck в 1995 году. В отличие от невирапина и делавирдина, был изучен в исследованиях III фазы в качестве компонента лечения ННИОТ и продемонстрировал высокую эффективность.
Этравирин
Принадлежит к семейству диарилпиримидиновых соединений, стал результатом многолетних исследовательских усилий учёных из компаний Janssen Research Foundation и Tibotec, направленных на открытие новых ННИОТ с оптимальным профилем устойчивости и повышенным генетическим барьером для развития резистентности. In vitro демонстрирует более высокий генетический барьер устойчивости по сравнению с невирапином и эфавиренцем [4].
Период полувыведения этравирина составляет 41 час. Препарат назначают два раза в день после еды. Самый распространённый побочный эффект — сыпь, которая, как правило, появляется в течение первых 6 недель терапии. Также на фоне применения нередко развивается периферическая нейропатия [1, 10].
Обладает активностью против штаммов ВИЧ, резистентных к ННИОТ. Из-за потенциально значительных побочных эффектов не применяют в комбинации с другими ННИОТ. Обладает аддитивной противовирусной активностью в комбинации с ингибиторами протеазы ВИЧ, нуколеозидными ингибиторами обратной транскриптазы, а также с ингибитором слияния энвуфиртидом [4].
Рилпивирин
Ещё одно соединение, ставшее результатом дальнейшей оптимизации в рамках ННИОТ, направленной на создание препарата с лучшим профилем устойчивости. In vitro демонстрирует профиль резистентности и генетический барьер, сопоставимый с таковым у этравирина. Отличается высокой биодоступностью, в том числе по сравнению с этравирином. Фармакокинетические свойства позволяют применять один раз в день. Переносится лучше, чем эфавиренц, с более низкой частотой невропсихиатрических нежелательных явлений, сыпью, меньшим количеством липидных нарушений [4, 10].
С самого зарождения эпидемии ВИЧ медицинское научное сообщество было занято поиском эффективного способа предотвращения передачи ВИЧ-инфекции.
Кроме использования средств барьерной контрацепции (презервативов) существуют и иные способы обезопасить себя от ВИЧ-инфекции. Самый главный из них — PrEP, или так называемая доконтактная профилактика (ДКП).
Препараты PrEP — это те же вещества, которыми лечат ВИЧ, но принимаются они по усеченной, неполной схеме. Механизм действия ДКП прост: если лекарство успело попасть в организм заранее, то при попадании в него вируса оно способно убить ВИЧ еще до того, как тот успеет закрепиться в нем.
Защита, которую предлагает PrEP, достаточно надежна и приближается к 100 %, если принимать таблетки правильно.
Что это за таблетки?
Сразу стоит дать названия, существуют две схемы ДКП, которые рекомендованы для использования:
(в одной таблетке — тогда они называются Трувада, либо по отдельности);
Почему именно эти препараты? Для того чтобы ответить на вопрос, можно или нет использовать конкретное лекарство для ДКП, надо провести клиническое исследование. Без клинических исследований подтвердить такой тезис невозможно. Поэтому придерживаться стоит тех схем, которые уже были испытаны и утверждены в качестве PrEP.
Именно поэтому, когда мы говорим о доконтактной профилактике, как правило, речь идет о двух препаратах, как это уже было сказано: тенофовире и эмтрицитабине. Если вы обратитесь в аптеку, то их комбинация в одной таблетке будет стоить порядка 14 000 рублей. Однако допустимо применение и других апробированных для ДКП лекарств. Например, тенофовира и ламивудина. Эта схема также одобрена Всемирной организацией здравоохранения (ВОЗ), они, купленные по отдельности, будут стоить не 14 000, а порядка 1000 рублей.
Какой схемой воспользоваться — решать вам. В целом ДКП сейчас доступна в разных формах для пациентов с разным достатком, и самые дешевые ее схемы могут стоить не более двух тысяч рублей в месяц.
А можно подробнее про механизм действия?
Можно. Итак, доконтактная профилактика заключается в приеме двух препаратов, относящихся к классу ингибиторов обратной транскриптазы, ВИЧ-отрицательными людьми. То есть людьми, в чьем организме вируса пока еще нет.
Что делают эти препараты? На картинке ниже вы можете увидеть жизненный цикл вируса иммунодефицита, как он прикрепляется к клетке и вбрасывает внутрь нее свой генетический материал.
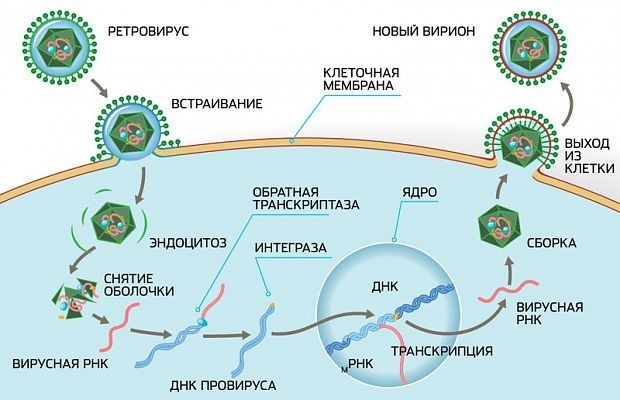
Этот генетический материал под воздействием особого фермента — обратной транскриптазы — запускает процесс репликации новых вирусов.
Два исследования — iPrEx и Partners (оба они проводились в США и Западной Европе) — продемонстрировали крайне высокую эффективность защиты PrEP, в отдельных случаях приближающуюся к 99 %.
В обоих лекарство тенофовир + эмтрицитабин, известное как Трувада, тестировалось на людях, относящихся к ключевым, то есть наиболее уязвимым для эпидемии, группам, — на мужчинах, практикующих секс с мужчинами, и трансгендерных женщинах (mtf). И именно у них этот метод профилактики показал свою наибольшую эффективность.
(Противо)показания к началу ДКП
В настоящее время в России ДКП одобрена Министерством здравоохранения в качестве дополнительного метода профилактики ВИЧ-инфекции и даже попала в клинические рекомендации, так что врач, пусть пока и не имеет возможности выдавать ее бесплатно, как выдаются препараты АРВТ, все же может легально рассказать своим пациентам, где можно приобрести необходимые таблетки, что для этого нужно сделать и как их принимать.
Главным противопоказанием к началу ДКП, конечно, является наличие у пациента ВИЧ-инфекции или симптомов, указывающих на так называемую острую фазу ВИЧ, которая имеет место примерно через две недели после проникновения вируса в организм.
Побочные эффекты
Безопасна ли ДКП? Да. Она безопасна. Оба режима одинаково эффективны. Всего в настоящий момент мы знаем лишь о семи случаях получения вируса на PrEP. А учитывая, что во всем мире примерно полмиллиона человек принимают доконтактную профилактику, семь случаев — это весьма немного.
Два из них были связаны с низкой приверженностью (пропуском приема профилактического препарата), два — с наличием резистентного к эмтрицитабину штамма ВИЧ. Два человека были инфицированы еще до начала доконтактной профилактики. Буквально недавно мировые СМИ сообщили о еще одном случае инфицирования ВИЧ на доконтактной профилактике. На этот раз вирус получил активист в Австралии, который более пяти лет принимал PrEP именно в разовом режиме.
Сейчас идет расследование этого инцидента, и мы пока не знаем точно, в чем была его причина. Что же касается побочных эффектов, они встречаются крайне редко и при должном внимании врача легко контролируются.
Долгосрочные эффекты, например деминерализация костной ткани, появляются не сразу, и, по большому счету, слишком бояться их не стоит. Деминерализация костной ткани, связанная с тенофовиром, проходит в течение, как правило, месяца после остановки приема и не является необратимой. То же самое касается снижения функции почек.
Когда он появится на наших прилавках — сказать сложно. Но в любом случае стоит помнить: даже если это лекарство и появится в России, ДКП — это не витамины, которые можно принимать самостоятельно. Любые побочные эффекты должен отслеживать врач, равно как и назначать сам препарат. Кому стоит обратиться к ДКП, а кому повременить? В идеале такое решение должен принимать не сам пациент в режиме самолечения, а специалист, обладающий достаточной квалификацией.
Как правильно приостановить прием ДКП?
Если вы мужчина или трансгендерная женщина и хотите безопасно прекратить прием доконтактной профилактики, вам необходимо принимать ДКП как минимум еще два дня после последнего рискованного полового контакта. И только через два дня в случае отсутствия в течение этого времени опасных контактов перестать пить таблетки.
Для женщин на ДКП необходимо как минимум семь дней приема ДКП после последнего рискованного контакта. Это связано с особенностями женского организма и того, как ведут себя препараты PrEP в нем.
Чтобы возобновить прием доконтактной профилактики, вы должны быть уверены в отсутствии рисков в период без ДКП. Если риски все же были, то необходимо сделать тест на ВИЧ. Но помните про период серонегативного окна — 4-6 недель с момента последнего риска.
Чтобы начать пить доконтактную профилактику на постоянной основе, необходимо непрерывно принимать ДКП на протяжении семи дней до первого рискованного контакта. Либо (только для мужчин) можно принять двойную дозировку, а затем каждые 24 часа принимать по одной дозе ДКП.
Постконтактная профилактика ВИЧ (ПКП)
Если опасный контакт все-таки случился, а вы не успели обезопасить себя ни с помощью презерватива, ни с помощью препаратов ДКП, и со времени контакта прошло не более 72 часов, избежать инфицирования вам может помочь так называемая постконтактная профилактика.
Заключается она в том, что в указанный срок вам необходимо начать прием препаратов, которыми обычно лечат ВИЧ-инфекцию, но, в отличие от PrEP, тут принимать лекарства придется в полной дозировке, такой, какую принимают люди, у которых уже диагностирована инфекция.
Многочисленными исследованиями доказано: если начать такой прием вовремя, есть большой шанс, что вирус не успеет закрепиться в организме и заболевания удастся избежать. Идеально начать прием лекарств в первые два часа или хотя бы в первые сутки после контакта. Чем позже будет начат такой прием, тем меньше вероятность, что терапия сработает.
Курс профилактики длится 28 дней, и по завершении его необходимо сделать тест, чтобы удостовериться в его эффективности.
Важно! Лекарства, которые вам придется принимать, по факту продаются БЕЗ РЕЦЕПТА, но найти их можно не в каждой аптеке. Поэтому времени на раздумья у вас немного. Возможно, на то, чтобы собрать необходимую комбинацию таблеток, у вас может уйти более суток, так что поиск стоит начать прямо сейчас.
Всего вам придется купить три препарата и принимать нужно будет все три. По отдельности они не работают.
Постконтактная профилактика (ПКП, или PEP) назначается ВИЧ-отрицательным пациентам сразу после опасного контакта, чреватого передачей вируса. И подразумевает использование антиретровирусных препаратов с целью предотвращения инфицирования вирусом иммунодефицита человека.
Чтобы остаться в организме, вирус иммунодефицита должен закрепиться в его клетках. Прежде всего ВИЧ необходимо прилепиться к клетке, затем встроить свою генетическую информацию в ДНК клетки-хозяина и, наконец, начать репликацию. Но для того чтобы сделать все это, ему необходимо некоторое время.
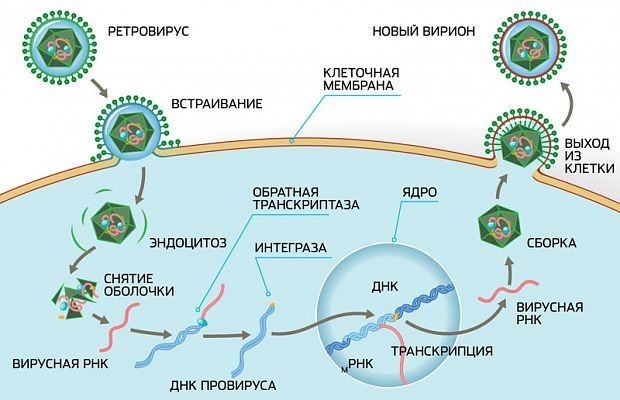
Репликация вируса в организме человека
Как работает такая профилактика? При своевременном начале ПКП изначально инфицированные клетки умирают естественным путем, отработав свой ресурс, за короткий промежуток времени, лекарство не дает вирусу заразить еще здоровые клетки, а инфекции — принять хроническую форму. Важно, что наиболее эффективной постконтактная терапия будет, если начинать ее прием в течение 24 часов после возможного проникновения вируса и не позже, чем через 72 часа после опасного контакта. Поэтому ПКП — это всегда отчасти бег наперегонки со временем: чем раньше нужные лекарства окажутся в организме, тем больше вероятность, что терапия сработает.
Но перед тем как оказаться в организме, препараты должны оказаться в кармане пациента. В России для их приобретения не нужен рецепт. Но насколько реально их купить? СПИД.ЦЕНТР решил поставить эксперимент и проверить, возможно ли в указанные 72 часа самостоятельно приобрести необходимые препараты в Москве.
Первые 24 часа
При своевременном начале ПКП инфицированные клетки умирают естественным путем, а лекарство не дает инфекции — принять хроническую форму.
— Постконтактная профилактика ВИЧ.
48 часов
Через некоторое время из соседней двери появляется фармацевт и открывает лавочку. Смотрит в нашу шпаргалку, в наличии только тенофовир, ничего другого нет. Не завозят. Но и на том спасибо. Аптекарь предлагает расплатиться за пачку переводом на сберкарту. Терминала в заведении нет.
Финишная прямая
Пока эфавиренз ждет в Вешняках, наудачу лезем опять в интернет. Неожиданно частная клиника, которая располагается неподалеку, продает всю схему. Там предлагают немедленно забрать необходимое и даже обещают отложить пачку на случай, если кто-то доберется до лекарств раньше нас.

За МКАДом
Итог: весь набор постконтактной профилактики в столице, пусть и с некоторыми трудностями, удается собрать чуть больше чем за 1,5 суток. Впрочем, в провинции, где и аптек меньше, и поиск только по телефону, подобный финт вряд ли бы удался.
Как объясняют активисты из Нижнего Новгорода, во время проведения Чемпионата мира по футболу в 2018 году в ряде аптек города можно было найти АРВ-терапию в свободном доступе. Но, по их словам, появилась она там только по отдельной разнарядке Минздрава по случаю наплыва иностранцев. Если Мундиаль ваш город миновал, то рассчитывать на благосклонность министерства не стоит.
Да и в самом Нижнем за год до чудесного приказа попытка купить схему антиретровирусных препаратов не увенчалась успехом. Ее просто не продали.
АРВ-терапия в свободном доступе появилась по отдельной разнарядке Минздрава только по случаю наплыва иностранцев.
Проблема спроса
В некоторых регионах, впрочем, рецепт во внутреннюю аптеку центра могут выписать и постороннему, если на приеме у врача описать положение. Так, по словам Марии Годлевской, можно получить ПКП в Питере. Но это если повезет.

. Или на государственную поддержку программ обеспечения жителей ПКП, которой в России пока что просто нет.
В других странах, например, в Канаде, обеспечением ПКП в регионах с 1992 года занимается государственная организация B.C. Centre for Excellence in HIV/AIDS. В центре работает горячая линия; он предоставляет рекомендации, как вести себя в случае опасного контакта, и обеспечивает постконтактной профилактикой несколько медицинских центров по всей стране.
А в Австралии, где число новых случаев ВИЧ-инфекции за последний год достигло рекордного минимума — 835 случаев на 25 миллионов человек (для сравнения: в Санкт-Петербурге на пять миллионов человек приходятся три тысячи случаев инфицирования) — ПКП доступна во всех центрах планирования семьи. А в случае, если встречу с врачом не удается запланировать в нужный срок, пациенты могут обратиться в кабинеты неотложной помощи, где врачи или медсестры проверят клиента на ВИЧ-инфекцию и ИППП и при необходимости назначат и выдадут ПКП.
Сколько времени займет такой поиск — сказать сложно. Но если очень повезет, возможно, лекарства удастся раздобыть быстрее, чем за пресловутые 72 часа.
История Георгия — не единственная. Сейчас обеспокоены все люди с положительным ВИЧ-статусом. И это понятно. Перерывы в терапии пациентов с ВИЧ опасны тем, что вирус снова начинает размножаться, приобретет лекарственную устойчивость, а значит, постепенно будет угнетать иммунную систему.
Что делать в случае перебоев с АРТ
«Всегда хорошо иметь запас, но также важно не устраивать „ажиотажные визиты“ в центры борьбы со СПИДом. Если таблетки в центре закончились, врач может предложить перейти на другую схему лечения. Если и таких вариантов нет, то можно попробовать самостоятельно найти препарат бесплатно в резервных аптечках (часто на базе НКО) или за деньги в обычных аптеках.
В крайнем случае перерыв в приеме терапии — если у вас нормальный иммунный статус и нет вторичных заболеваний на фоне ВИЧ — не должен сказаться на здоровье в долгосрочной перспективе.
Какие препараты вошли в список ЖНВЛП в 2022 году
По словам Норова, иностранные граждане также могут рассчитывать на качественную и эффективную помощь на территории России.
Справка: еще раз объясняем про схемы АРТ и их смену
-
Какие используются схемы терапии?
Сам смысл терапии, как известно, в комбинации нескольких препаратов. Бывает комбинация в одной таблетке (в России встречается нечасто), бывает в разных, от трех до восьми. Как правило, меняются один или два компонента. Есть так называемая основа схемы, препараты, которые используются чаще всего, и к ним добавляется третий, иногда третий плюс четвертый препарат. Чаще всего проблемы возникают именно с этим третьим или четвертым препаратом либо с какими-то комбинированными их формами.
Это очень сильно зависит от самой схемы. Например, если мы говорим о замене внутри одного класса препаратов, то есть из той же группы, то не грозит практически ничем.
Сказать однозначно, чем грозит замена терапии, нельзя, потому что может быть, наоборот, произойдет оптимизация схемы: какой-то препарат начинает использоваться меньше и будет заменен на более современный. Такое тоже бывает.
В теории пропасть может любой препарат, другое дело, что на практике во многих центрах этого не происходит уже довольно давно. Сейчас ситуация у нас, конечно, нестандартная, и предсказать что-либо сложно.
Но важно помнить, что любая полноценная современная схема АРТ лучше, чем отказ от приема терапии.
Почему не стоит бояться смены схемы терапии АРТ
— Понятно, что врачи исходят из того, что доступно на сегодняшний день. Они прекрасно понимают, что необходимо следовать трем основным принципам: эффективность лечения (подавление вирусной нагрузки), хорошая переносимость (отсутствие побочных эффектов) и долгосрочное влияние на организм пациента во избежание каких-либо ассоциированных с препаратом побочных действий длительного эффекта (речь идет о влиянии на сердечно-сосудистую систему, на метаболизм и прочее).
Если схема терапии неизбежна, то в идеале препараты должны меняться на более современные и более благоприятные для пациента по всем этим трем параметрам, в чем и заключается весь смысл индивидуального подбора терапии.
Если говорить о реалиях, то бывает по-разному. Конечно, мы всегда ожидаем перебоев, готовы к сложностям, но однозначно сейчас сказать, что это ударит по пациентам, нельзя. Дело в том, что не всегда смена терапии может нести негативную коннотацию. Бывало, что измененная схема не подходила какому-то человеку, но ведь это возможно с любой схемой терапии. Врачи не заинтересованы в том, чтобы безосновательно менять схемы, создавая тем самым сложности пациенту — безусловно, они всегда будут искать и ищут какой-то компромисс, баланс.
Пока мы не понимаем, насколько серьезно все отразится на препаратах и их доступности, но мне хотелось бы дать умеренно обнадеживающий прогноз, все-таки это сфера, попадающая под санкции далеко не в первую очередь, область эта достаточно сильно локализована (не всегда полностью) и важная стратегически, находящаяся на особом контроле. Надеюсь, что так и будет продолжаться.
Цель современной фармацевтической отрасли — создание эффективных лекарственных средств, которые позволяют пациентам сохранять активность и высокое качество жизни даже при неизлечимых заболеваниях. Примером этого стало открытие средств для антиретровирусной терапии, которая перевела изначально смертельную ВИЧ-инфекцию в хроническое контролируемое заболевание. И одними из первых представителей этого класса стали нуклеозидные ингибиторы обратной транскриптазы ВИЧ.
Общая информация
Нуклеозидные ингибиторы обратной транскриптазы ВИЧ (НИОТ) — первый класс антиретровирусных препаратов, одобренных американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов FDA [1]. НИОТ активны в отношении ВИЧ-1 (наиболее распространённого серотипа вируса) и ВИЧ-2. Несмотря на то что препараты этой группы менее эффективны против вируса иммунодефицита, чем ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), они играют центральную роль в антиретровирусной терапии и остаются важной частью процесса лечения [4].
В группу нуклеозидных ингибиторов обратной транскриптазы входят 9 препаратов:
- зидовудин;
- диданозин;
- ламивудин;
- эмтрицитабин;
- абакавир;
- ставудин;
- тенофовира дизопроксила фумарат;
- тенофовира алафенамид;
- залцитабин.
Фармакологическое действие
Нуклеозидные ингибиторы обратной транскриптазы представляют собой модифицированные аналоги нуклеозидов (тимидина, аденина, цитилина, гуанина), которые фосфорилируются в организме под влиянием клеточных киназ. Все НИОТ — пролекарства: после превращения в соответствующие трифосфаты они ингибируют активность обратной транскриптазы ВИЧ [1].
Известно, что обратная транскриптаза проявляет три эффекта:
- обеспечивает синтез односпиральной комплементарной ДНК (кДНК) на матрице вирионной РНК;
- участвует в синтезе второй спирали ДНК ВИЧ;
- гидролизует РНК в составе гибридного комплекса РНК-ДНК.
Таким образом, обратная транскриптаза позволяет транскрибировать РНК ВИЧ в одноцепочечную и, в конечном счёте, в двухцепочечную провирусную ДНК и включать её в геном клетки-хозяина [1–3].
Нуклеозидные ингибиторы обратной транскриптазы, ингибируя активность обратной транскриптазы ВИЧ, препятствуют образованию ДНК на матрице вирусной РНК, блокируя ранние стадии цикла размножения вируса. Немаловажно, что способность препаратов этой группы ингибировать обратную транскриптазу ВИЧ в сотни раз выше по сравнению со способностью подавлять ДНК-полимеразу человека [2]. Поэтому НИОТ активны именно в инфицированных ВИЧ Т-клетках и макрофагах.
Устойчивость к НИОТ
Резистентность к нуклеозидным ингибиторам обратной транскриптазы возникает по одному из двух механизмов: нарушение включения в цепь провирусной ДНК или удаление провирусной ДНК из цепи [4, 5]. Мутации, приводящие к устойчивости, обычно развиваются постепенно. Как правило, необходимо накопление сразу нескольких мутаций для развития клинически значимой резистентности. Исключение — мутация M184V, которая гарантирует высокий уровень устойчивости к нескольким препаратам, в частности, к ламивудину и эмтрицитабину.
Известно несколько мутаций, приводящих к развитию устойчивости к НИОТ:
- мутации, которые выборочно нарушают включение в цепь провирусной ДНК — M184V, Q151M и K65R;
- мутации аналога тимидина, связанные с устойчивостью к зидовудину — M41L, D67N, K70R, L210W, T215Y, T215F, K219Q, K219E.
Фармакокинетика НИОТ
Пероральная биодоступность нуклеозидных ингибиторов обратной транскриптазы колеблется в пределах от 25 % до 93 %, причём самые низкие показатели характерны для двух средств — тенофовира и диданозина. Пища не оказывает значимого влияния на абсорбцию НИОТ. Исключение составляет диданозин, который принимают натощак. Остальные препараты можно принимать независимо от приёма пищи.
Большинство НИОТ выводятся через почки и требуют корректировки дозы у больных с почечной недостаточностью. Исключение — абакавир: его назначают в обычной дозе независимо от клиренса креатинина.
НИОТ не метаболизируются системой цитохрома Р450, поэтому лекарственные взаимодействия для них не характерны. В клинически значимые взаимодействия вступает лишь диданозин: при приёме с тенофовиром биодоступность диданозина увеличивается, поэтому целесообразно использовать более низкие дозы во избежание развития серьёзных побочных эффектов. Похожая реакция развивается и при одновременном приёме диданозина с рибавирином (у больных с сочетанным ВИЧ и вирусным гепатитом С). В подобных случаях этого сочетания препаратов следует избегать [4].
Побочные эффекты НИОТ
Неблагоприятные реакции нуклеозидных ингибиторов обратной транскриптазы включают митохондриальную токсичность, в частности, лактоацидоз, панкреатит, периферическую нейропатию, стеатоз печени и липоатрофию [4].
Митохондриальная токсичность обусловлена связыванием НИОТ с ферментом митохондриальной ДНК-полимеразы гамма человека, что ведет к переходу нормального аэробного метаболизма в анаэробный и нарушению клеточного дыхания. Афинность связывания НИОТ с митохондриальной ДНК-полимеразой гамма позволяет прогнозировать развитие потенциальных побочных эффектов. В порядке убывания афинности (а, следовательно, повышения профиля безопасности) НИОТ можно расположить так: залцитабин, диданозин, ставудин, ламивудин/эмтрицитабин, зидовудин, абакавир и тенофовир [6, 7].
Отдельные побочные эффекты, характерные для НИОТ, включают подавление активности костного мозга, миопатию, головную боль при приёме зидовудина и реакцию системной гиперчувствительности при приёме абакавира. Приём абакавира и диданозина также связан с повышенным риском сердечно-сосудистых событий [8].
На начальных этапах терапии НИОТ может регистрироваться повышенный обмен костной ткани и потеря костной массы в позвоночнике и бедренной кости, причём она может составлять около 6 % в течение 1 года после начала лечения [9].
В клинических исследованиях у больных, получающих комбинированную терапию элвитегравир + кобицистат + тенофовира алафенамид + эмтрицитабин, было выявлено большее увеличение уровня общего холестерина и липопротеинов высокой плотности по сравнению с пациентами, получавшими другие схемы антиретровирусной терапии [9].
Пациентам с тяжёлой почечной недостаточностью не рекомендуется принимать тенофовира алафенамид, однако при умеренной форме заболевания препарат может применяться. По всей вероятности, алафенамиду присуща меньшая токсичность для почек и менее выраженное снижение плотности костной ткани по сравнению со схемами, содержащими тенофовир, которые использовались раньше [10].
Особенности отдельных НИОТ
Первый синтезированный антиретровирусный препарат, аналог тимидина. При использовании в составе монотерапии резистентность к нему развивается быстро за счёт последовательного накопления мутаций. При включении препарата в состав комбинированной терапии наряду с ламивудином и эмтрицитабином восприимчивость к нему увеличивается. Выпускается в парентеральной и пероральной формах. Применяется для лечения ВИЧ-инфекции как часть комбинированного режима, а также антенатально у матери и в качестве монотерапии новорождённых [1, 11].
Активность сопоставима с зидовудином. Обладает коротким периодом полураспада, однако проявляет более длительный внутриклеточный эффект по сравнению с зидовудином, что обеспечивает пролонгированную антиретровирусную активность. Лучше принимать натощак или не менее чем через 2 часа после еды [1, 11].
Ламивудин и эмтрицитабин
Ламивудин стал первым аналогом нуклеозидов, рекомендованным для терапии хронического гепатита B в составе монотерапии, а также для лечения сочетанного гепатита B и вируса иммунодефицита человека инфекции в составе с тенофовиром. Устойчивость развивается через 1 год терапии у 30 % пациентов и через 5 лет терапии — у 70 % пациентов.
Эмтрицитабин имеет аналогичную с ламивудином структуру, переносимость, эффективность и уровень резистентности, поэтому эти два НИОТ не используют в комбинации [1, 11].
Выделяется в ряду НИОТ высокой терапевтической эффективностью. Обычно хорошо переносится, но у 8 % пациентов могут возникать реакции гиперчувствительности, особенно в начале лечения [1, 11].
Тенофовир, вводимый перорально в качестве пролекарства тенофовира фумарата, эффективен против вируса гепатита B [1,11].
Ингибирует обратную транскриптазу и дополнительно включается в вирусные ДНК, прекращая удлинение цепи. Применение препарата ограничено из‑за связанного с ним аномального перераспределения жира с лица и конечностей на туловище, шею, грудь и живот — липоатрофии [1, 11].
Широко используется для лечения хронического гепатита B, активен в отношении штаммов, устойчивых к ламивудину. Вводится перорально. Как правило, хорошо переносится. Резистентность развивается гораздо реже, чем при применении ламивудина (через 5 лет лечения у 30 % пациентов). Это связывают с гибкостью молекулы адефовира. Терапевтические дозы при гепатите B недостаточны для эффективного лечения ВИЧ-инфекции, поэтому ВИЧ-статус должен быть определён/подтверждён до начала приёма препарата при вирусе гепатита B [1, 11].
Читайте также:

