Отравление организма мочевой кислотой
Обновлено: 22.04.2024
В основе энергетического обеспечения физической активности лежит расщепление аденозинтрифосфорной кислоты, достаточно известной даже неспециалистам (под аббревиатурой АТФ). В организме пополнение резервов АТФ происходит в рамках сложного биохимического процесса, суть которого – каскадная переработка глюкозы в последовательность органических кислот (лимонную, муравьиную и т.д.). Эта цепочка называется циклом лимонной кислоты, цитратным циклом или циклом трикарбоновых кислот, но чаще всего циклом Кребса, – по фамилии ученого, совместно с Ф.Липманом получившего в 1953 году Нобелевскую премию за исследование клеточного энергетического метаболизма.
Молочная кислота образуется на заключительных стадиях цикла и должна циклически же утилизироваться; за ее восстановление в гликоген отвечает печень. По мере необходимости происходит ферментация гликогена обратно в глюкозу – и все начинается сызнова. Впрочем, постичь все эти реакции способен только профессиональный биохимик, поэтому нет особого смысла описывать их подробно.
Вернемся к интересующему нас продукту метаболизма, а именно к молочной кислоте. Ее избыток приводит к развитию патологического симптомокомплекса, который очень тормозит развитие спортивных амбиций человечества, поскольку стоит, как Цербер, на страже мировых и олимпийских рекордов.
Причины
В большом спорте главной причиной мышечной лактат-закисленности выступает слишком интенсивный и, скажем так, нетерпеливый график тренировок, когда скорость наращивания нагрузок превышает природный темп энергообменных процессов в организме. Форсировать тренировки до бесконечности, а тем более давать организму взятки в виде допингов, – нельзя: и опасно, и, по большому счету, бесполезно. Хорошо еще, если дело ограничится очередным допинговым скандалом. Но можно попросту лишиться перспективного спортсмена как завоевателя мест и рекордов, – а заодно и всех тех немалых благ, моральных и материальных, которые не только ему полагаются за высшие спортивные достижения.
Симптоматика
Диагностика
Признаки лактат-закисленности достаточно специфичны, чтобы их легко распознал спортивный врач – особенно если общее состояние спортсмена, кислотно-щелочной показатель и биохимические параметры находятся под постоянным контролем.
Лечение

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 27.12.2021
- Reading time: 4 минут чтения
Мочевая кислота — результат трансформации азотистых оснований, в основном выводимый с мочой. Ее концентрация зависит от разницы между количеством, вырабатываемым в организме и выводимым почками. Лишняя мочевая кислота (гиперурикемия) откладывается в виде кристаллов, давая серьезные симптомы.
Анализ на мочевую кислоту в крови или в моче обычно выполняется при симптомах подагры и заболеваний почек. Многих больных, получивших негативный результат, беспокоит вопрос о том, как убрать излишки мочевой кислоты, тем самым уменьшив боль, сопровождающую гиперурикемию.
Что такое мочевая кислота? Откуда она берется в организме?
Мочевая кислота — это конечный и естественный продукт метаболизма пуринов — элемента нуклеиновых кислот (ДНК и РНК) клеток всех организмов. Источники азотистых оснований — внутренний синтез этих соединений и физиологический распад клеток. Некоторые пурины также попадают в организм с продуктами: пивом, красным мясом, копченой рыбой, какао.
Пурины благодаря ферментам деградируют в гепатоцитах печени. Это означает, что конечный продукт их распада должен выводиться, так как больше ни во что не преобразуется. Примерно 70% мочевой кислоты выводится с мочой, фильтруемой через почки, остальное, при участии пищеварительной системы, с калом.
Выведение моч. к-ты затрудняется, например, в случае мочекаменной болезни или подагры. Также это вещество накапливается в больших количествах в крови, в ходе некоторых метаболических заболеваний.
Когда назначаются анализы?
Измерить уровень мочевой кислоты нужно в ряде случаев:
- Подозрение на подагру. Ее симптомы: болезненность, покраснение и отек суставов, особенно воспаление основания сустава большого пальца ноги. Подагра часто вызывает воспаление суставов, особенно первого плюснефалангового сустава.
- Диагностика мочекаменной болезни . Патология связана с выведением большого количества мочевой кислоты. В случае тяжелой почечной колики анализ помогает определить тип мочевых камней у больного. Почечная колика характеризуется сильной болью внизу живота, иррадиирующей вплоть до спины. Также у больных отмечается выраженное уменьшение выделяемой мочи, гематурия или изменение цвета мочи.
- Почечная недостаточность .
- Гестоз у беременных .
Дополнительные (неспецифические) симптомы при повышении мочевой кислоты:
- боль и жжение в области мочевого пузыря;
- Увеличение количества мочи;
- лихорадка;
- боль в животе и поясничной области;
- тошнота и рвота.
Обследование также должно проводиться среди онкологических больных, проходящих химиотерапию и лучевую терапию. Химиотерапия ускоряет разрушение раковых клеток с высвобождением из них пуриновых соединений, впоследствии превращающихся в мочевую кислоту. Также анализы назначаются для контроля за ходом лечения у больных подагрой.
Определение мочевой кислоты в крови и моче. Как подготовиться к исследованию?
Уровень мочевой кислоты может определяться в моче и в сыворотке крови. В случае определения сыворотки венозная кровь берется натощак: желательно выждать 12 часов с момента приема пищи. Важно понимать, что употребление продуктов, богатых пуринами, может фальсифицировать результат, поэтому за двое суток нужно исключить такие продукты из меню.
При подготовке к обследованию нужно избегать физических нагрузок 2-3 дня до анализа. Также нужно ограничить стрессовые факторы. Риск повреждения клеток и временного повышения концентрации мочевой кислоты в крови должен быть сведен к минимуму.
Во время сбора мочи следует придерживаться тех же рекомендаций, что и при подготовке к сывороточному тесту.
Как делают анализ
Измерение концентрации мочевой кислоты заключается в единовременном сборе крови из локтевой вены, с помощью одноразовой иглы и пробирки. Методика проведения теста — спектрофотометрия (колориметрический иммуноферментный метод).
Концентрацию МК в моче можно определить как в одном образце, так и в суточном сборе мочи. Второй метод заключается в сборе всех образцов мочи, сданных в течение 24 часов, в один стерильный сосуд. Затем нужно измерить объем мочи и взять из нее образец, предназначенный для исследования в лаборатории.
Мочевая кислота – нормы для женщин, мужчин и детей
Уровень мочевой кислоты зависит от пола, а дополнительно увеличивается с возрастом, примерно до 70 лет. Анализ результатов испытаний всегда должен основываться на референсных значениях лаборатории, в которой они были выполнены, и находящихся в пределах заданных диапазонов стандартов.
Таблица 1. Средние нормы мочевой кислоты в сыворотке крови (Европа)
| Пол, возраст | Норма мочевой кислоты |
| Мужчины | 300-360 мкмоль/л (5-6 мг/дл) |
| Женщины | 240-300 мкмоль/л (4-5 мг/дл) |
| Дети | 210-240 мкмоль/л (3,5-4 мг/дл) |
Гиперурикемия диагностируется после нескольких определений концентраций выше 420 мкмоль/л (>7 мг/дл). Среднее выведение мочевой кислоты с мочой составляет около 400-650 мг/сут. Верхний предел обычно составляет 800 мг / день (4,8 ммоль / 24 часа).
Приступ подагры может быть у больного с нормальным уровнем мочевой кислоты и наоборот – повышенный уровень мочевой кислоты не всегда дает симптомы подагры. Наиболее частая причина подагры: генетическая склонность к избыточной выработке мочевой кислоты и нарушение выделительной функции почек. Поэтому, перед тестом расскажите врачу о прошлых заболеваниях и о лекарствах, которые вы принимаете.
Низкий и высокий уровень мочевой кислоты — чем это опасно?
Высокий и низкий уровень мочевой кислоты влияет на правильное функционирование организма. МК обладает противоположными эффектами:
- С одной стороны это ненужный продукт метаболических изменений. Поэтому повышение ее концентрации опасно для здоровья. Гиперурикемия приводит к подагре, нефролитиазу и другим заболеваниям почек. Также у людей с повышенной мочевой кислотой часто диагностируются гипотиреоз, гемолитическая анемия и сердечно-сосудистые заболевания, в том числе инфаркт, что говорит о связи этих факторов.
- С другой — мочевая кислота обладает антиоксидантным действием, защищая организм от свободных радикалов и вызванных ими повреждений клеток. Ее дефицит, например, увеличивает риск развития деменции, болезни Паркинсона.
Нельзя самостоятельно интерпретировать результаты анализов. Результат определения мочевой кислоты часто трактуется как вспомогательный к комплексной диагностике.
Расшифровка анализа: высокий уровень мочевой кислоты
Гиперурикемия может быть связана с чрезмерной выработкой МК или ее высвобождением из клеток, например:
- при генетических заболеваниях (болезнь Леша-Нихана, болезнь фон Гирке);
- из-за разрушения клеток в процессе лечения рака, при лучевой терапии или химиотерапии;
- из-за отравления свинцом;
- в случае лейкоза;
- в постменопаузальном периоде.
Гиперурикемия также возникает у людей с больными почками при ацидозе или злоупотреблении алкоголем. Также может повлиять диета с большим количеством белка и физические перегрузки. Ещё повышает уровень мочевой кислоты прием барбитуратов и диуретиков.
Наиболее распространенные симптомы гиперурикемии:
- Почечная колика . Больной чувствует сильную поясничную боль, иррадиирующую в сторону и в нижнюю конечность. Она имеет тенденцию смещаться. Часто боль сопровождается слабостью, лихорадкой и тошнотой;
- Подагра. Сопровождается лихорадкой и слабостью. Это следствие отложения кристаллов моч. к-ты в суставах, в результате чего возникает воспаление суставов.
Расшифровка анализа: низкий уровень мочевой кислоты
Концентрация МК в крови может быть снижена. Однако это не указывает на конкретное заболевание, а скорее возникает как сопутствующий симптом. Снижение может происходить при:
- Болезни Вильсона;
- синдроме Фанкони;
- заболеваниях, связанных с избыточной секрецией гормона роста;
- Синдроме Шварца-Барттера.
Слишком низкий уровень мочевой кислоты также может указывать на продолжающееся воспаление в почках и печени, целиакию, лимфомы и другие виды рака.
Снижают концентрацию препараты, применяемые для лечения гиперурикемии: салицилаты, аллопуринол, пробенецид, эстрогены, кортикотропин, фенотиазины.
Как снизить мочевую кислоту?
Основа лечения гиперурикемии — излечение основного заболевания, так как избыток моч. к-ты может быть результатом врожденных генетических состояний, результатом ожирения, неправильного питания, диабета или обезвоживания.
Чтобы очистить организм от избытка кристаллов мочевой кислоты, нужно увеличить физическую активность и следовать принципам рационального питания.
Диета больных с высоким уровнем мочевой кислоты основывается в первую очередь на употреблении негазированной воды и отказе от крепкого кофе, чая и пива. Также повышают мочевую кислоту в крови напитки, содержащие фруктозу и фруктовые соки. Второй принцип — ограничение пуринов. Это диета, бедная рыбой, красным мясом, бобовыми, грибами.
Количество соли в блюдах следует ограничить, так как избыток натрия тормозит выведение мочевой кислоты с мочой.
Нужно есть больше постного мяса птицы, фруктов и зерновых. Очень хороший эффект дают настои, приготовленные из листьев березы, одуванчика и крапивы.
Назначается фармакотерапия, понижающая мочевую кислоту в крови. Наиболее распространенные лекарства: фебуксостат и аллопуринол. Помимо приема лекарств нужно бросить курить.
Точные рекомендации всегда должны быть согласованы с лечащим врачом (например, урологом, ревматологом), который также принимает решение о необходимости возможной фармакотерапии.

Студент медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 27.06.2019
- Reading time: 2 минут чтения
Интоксикация — это отравление организма, вызванное воздействием какого-либо вещества.
Стадии отравления
В зависимости от тяжести интоксикации принято выделять три стадии течения патологического процесса.
- Первая стадия (легкая степень). Симптоматика в этом случае ограничивается изменением дыхания: оно становится частым и неритмичным. Характерно появление преходящих хрипов при дыхании. Наблюдается появление немотивированной эйфории, апатии и их чередование. Такие изменения психоэмоционального фона провоцируются отёком головного мозга. Для этой стадии характерны сердечно-сосудистые нарушения в виде тахикардии и/или незначительная артериальная гипотензия.
- Вторая стадия. Такое состояние характеризуется головными болями, ознобом, мышечными спазмами и судорогами. Больной жалуется на бессонницу на фоне слабости и усталости, снижение аппетита вплоть до его отсутствия, тошноту.
- Третья стадия. Это тяжёлая лихорадка, способная привести к летальному исходу. Человека беспокоят мышечные боли, озноб, выраженная тахикардия и снижение артериального давления. Галлюцинации и бредовые состояния на этой стадии не редкость. При отсутствии адекватной терапии возможна кома.
Клиническая картина острой интоксикации
Характерная черта этого расстройства — появляется оно сразу, незамедлительно. В этом случае важно оказать помощь на ранней стадии.
Возникновение острой интоксикации связано с проникновением в организм большого количества веществ, обладающих токсическим действием, употреблением пищи или воды ненадлежащего качества или выраженной передозировкой лекарственных препаратов. Характер течения и степень тяжести интоксикации определяется разновидностью токсического вещества, попавшего в организм.
Проявления острой интоксикации
Наиболее характерные проявления острой интоксикации:
- выраженная резкая боль в области желудка;
- неудержимая рвота;
- остро появившийся жидкий стул.
Рвота и понос в этой ситуации — реакция организма на отравление, с помощью которой он старается очиститься от токсического вещества. Поэтому первое время после появления такой симптоматики нет смысла стараться ее заблокировать.
Особенности клинической картины в зависимости от происхождения интоксикации могут варьироваться. Это помогает при диагностике, когда необходимо отличить экзогенную интоксикацию от эндогенной.
Экзогенная интоксикация
Токсические вещества, вызывающие расстройства, могут проникать в организм различными способами: через пищеварительный тракт, слизистые оболочки, кожный покров, через дыхательные пути.
Заподозрить экзогенную интоксикацию помогут следующие симптомы:
- Выраженная гипертермия.
- Лихорадочное состояние.
- Острая реакция со стороны пищеварительного тракта: рвота, диарея, выраженная изжога. При отравлении растворами, имеющими щелочную или кислую реакцию, в рвоте могут присутствовать сгустки крови.
- Судорожные сокращения мышц конечностей.
- Ухудшение картины рефлексов.
В случае трансдермального проникновения яда в организм или попадания его через слизистую оболочку, в большинстве случаев наблюдается местная реакция в виде выраженных аллергических проявлений: покраснений, очагов высыпаний, напоминающих ожоги.
Важным признаком экзогенной интоксикации синдрома является острое кислородное голодание всех тканей организма. Оно обусловлено способностью токсинов блокировать возможность эритроцитов переносить кислород. Гипоксия приводит к расстройству всех систем жизнеобеспечения организма человека:
- снижается частота пульса;
- развивается распространённый отёчный синдром, наиболее опасны отёк лёгких и головного мозга.
Эндогенная интоксикация
Интоксикационный синдром эндогенного происхождения — не самостоятельное заболевание. Он сопровождает многие заболевания и является частью их патогенеза.
Эндотоксинами или аутоядами называются вещества, которые вырабатываются внутри организма в результате распада молекул или клеточных структур. Обладая токсическими свойствами, эти вещества вызывают развитие недостаточности работы жизненно важных органов: почек, печени, сердца.
Проявления эндогенной интоксикации:
- головная боль;
- нарушение сна;
- исчезновение аппетита.
Такой симптомокомплекс часто наблюдается при интоксикационном синдроме, сопровождающем инфекционно-воспалительные заболевания.
В случае более выраженной степени интоксикации добавляются следующие симптомы:
- снижение суточного объёма мочи;
- головокружение;
- ощущение прогрессирующей накопившейся хронической усталости;
- нарушение ритма работы сердца;
- галлюцинации — признак тяжёлого интоксикационного синдрома, который сопровождается лихорадкой, в частности, этот симптом характерен для ожоговых травм при поражении большой площади тела с глубиной ожогов 3–4 степени.
В некоторых случаях к указанной симптоматике общего характера добавляются специфические признаки, которые могут помочь при диагностике. Например, желтушное окрашивание склер и кожных покровов при поражении печени билирубином.
Медицинская помощь при отравлении с разными типами интоксикации
Остановить прогрессирование патологических изменений при интоксикации независимо от её характера можно, если прекратить воздействие отравляющего вещества на организм и максимально быстро провести комплекс мероприятий по выведению его из организма больного. В зависимости от механизма отравления для этого применяются следующие методы:
- промывание желудка;
- приём сорбентов;
- форсированный диурез;
- гемодиализ.
В некоторых случаях эти методы дополняют друг друга.
Одновременно необходимо принимать меры по восстановлению жизненно важных функций организма больного. Особенно это важно при тяжёлой степени отравления. Нарушение водно-электролитного баланса и обезвоживание, возникшие в результате рвоты и диареи, корректируется при помощи обильного питья и/или инфузионной терапии.
При этом существует опасность усугубления отёка головного мозга и лёгких, поэтому за больным необходимо постоянное наблюдение с целью своевременной коррекции нарушений.
На фоне адекватной инфузионной терапии сердечно-сосудистые нарушения могут начать регрессировать самостоятельно. В противном случае приходится брать под контроль давление и удерживать его с помощью соответствующих медикаментов.
При лечении интоксикации на любой стадии может понадобиться и симптоматическая терапия:
Гиперурикемия – это лабораторный симптом, характеризующийся повышением уровня мочевой кислоты в сыворотке крови более 400 мкмоль/л. Данное состояние свидетельствует о нарушении пуринового обмена. Причинами гиперурикемии могут выступать чрезмерное употребление мясной пищи, прием медикаментов, метаболические расстройства и пр. В некоторых случаях наблюдаются такие симптомы как боль, покраснение и припухлость суставов, образование тофусов. Концентрация мочевой кислоты измеряется при биохимическом анализе крови. Для коррекции гиперурикемии назначается диета, уратснижающая терапия.
Классификация
По этиологии выделяют 2 основных вида гиперурикемии:
- Первичный – возникает вследствие генетически детерминированного дефекта ферментов, участвующих в метаболизме мочевой кислоты.
- Вторичный – развивается на фоне некоторых заболеваний, действия токсинов, лекарственных препаратов и т.д.
По патогенезу различают 3 типа гиперурикемии:
- Метаболический (гиперпродуктивный) – связан с усилением образования мочевой кислоты.
- Почечный (гипоэкскреторный) – обусловлен замедлением выделения мочевой кислоты из организма с мочой.
- Смешанный.
По клиническим проявлениям выделяют:
- бессимптомную гиперурикемию;
- острый/интермиттирующий артрит;
- межприступный период;
- хроническую тофусную подагру.
Причины
Физиологические причины
У здоровых людей может встречаться кратковременное или незначительное повышение концентрации мочевой кислоты (МК) без каких-либо клинических симптомов. Наиболее часто гиперурикемия наблюдается при употреблении мясной пищи, так как мясные продукты богаты пуриновыми основаниями (аденин, гуанин), которые являются субстратом для синтеза МК. Также гиперурикемия встречается при обезвоживании, интенсивной физической нагрузке, приеме алкоголя.
Подагра
Данное ревматологическое заболевание можно считать клинической манифестацией гиперурикемии. Подагра развивается вследствие генетически обусловленного дефекта ферментов, регулирующих обмен МК. К таким дефектам относятся дефицит гипоксантин-гуанинфосфорибозилтрансферазы, повышение активности 5-фосфорибозил-1-синтетазы. Нарушение функциональной активности этих ферментов приводит к усилению синтеза МК.
В периферических тканях, особенно в суставных сумках, хрящах, происходит кристаллизация солей мочевой кислоты и их отложение. В результате появляются следующие симптомы: острая, интенсивная боль в суставах (чаще в I плюснефаланговом суставе), припухлость сустава с покраснением кожных покровов. Достаточно специфичным симптомом подагры считается образование узелков – тофусов, локализующихся в основном на ушных раковинах, задней поверхности локтевых суставов. Также подагра может развиться на фоне заболеваний, влияющих на пуриновый метаболизм.

Гиперпродукция мочевой кислоты
При интенсивном разрушении клеток и их ядер происходит высвобождение нуклеотидов, из которых в последующем образуется большое количество МК, что приводит к возрастанию уровня МК. Наличие клинических симптомов возникшей гиперурикемии определяется степенью разрушения тканей. Усиленный катаболизм наблюдается при следующих заболеваниях и патологических состояниях:
- Миелопролиферативные и лимфопролиферативные заболевания (лейкозы, лимфомы).
- Синдром лизиса опухоли после курсов химиотерапии.
- Врожденные и приобретенные гемолитические анемии.
- Тяжелый генерализованный псориаз.
- Болезни накопления: болезнь Гоше, гликогенозы.
Медленное выведение мочевой кислоты
Примерно 2/3 от общего количества МК выводится с мочой. Поэтому любое нарушение выделительной функции почек вследствие их органического поражения может привести к гиперурикемии. То же нередко происходит при снижении эффективного объема крови, из-за чего нарушается кровоснабжение почек. Ниже приведены основные причины подавления клиренса МК:
- Гломерулонефрит.
- Интерстициальный нефрит.
- Хроническая почечная недостаточность.
- Массивное кровотечение.
- Застойная сердечная недостаточность.
- Отравление свинцом (свинцовая нефропатия).
- Прием тиазидных диуретиков.
Другие причины
- Эндокринные расстройства: гипопаратиреоз, гипотиреоз.
- Диабетический кетоацидоз.
- Лактатацидоз.
- Преэклампсия.
- Саркоидоз.
- Прием лекарственных препаратов: ацетилсалициловая кислота, цитотоксические препараты (циклоспорин, микофенолат натрия), противотуберкулезные ЛС (этамбутол, пиразинамид), никотиновая кислота.
Диагностика
При обнаружении гиперурикемии необходимо обратиться к врачу-терапевту для выяснения причины ее возникновения. На приеме уточняется наличие симптомов, характерных для данного состояния. Внимательно осматриваются беспокоящие больного суставы на предмет отека или покраснения. Выясняется, имеются ли у пациента какие-либо хронические заболевания, состоит ли он на диспансерном учете, какие лекарственные средства принимает. Назначается дополнительное обследование, включающее:

Коррекция
Медикаментозное лечение
Чтобы скорректировать гиперурикемию, необходимо устранение этиологического фактора. Если в процессе сбора анамнеза выясняется, что больной принимает ЛС, вызывающее гиперурикемию, нужно рассмотреть вопрос либо о снижении дозировки, либо о замене препарата на альтернативный, но не имеющий такого побочного действия. Тактика лечения во многом определяется наличием клинических симптомов, а также их выраженностью.
- Диета. Людям, страдающим подагрой, нужно обязательно отказаться от приема алкоголя и исключить из рациона питания высокопуриновые продукты (красное мясо, печень, копчености), так как они способны провоцировать усиление симптомов.
- Колхициновые алкалоиды. Основная группа препаратов для купирования острого подагрического приступа. Уменьшение симптомов наступает в течение 12 часов после первого приема.
- НПВС. Назначаются в дополнение к колхициновым алкалоидам с целью облегчения симптомов артрита. Предпочтение отдается ЛС с наиболее выраженным анальгетическим и противовоспалительным эффектом.
- Глюкокортикостероиды. Гормональные средства применяют для устранения симптомов в случае индивидуальной непереносимости колхицина и НПВС или при наличии у пациента строгих противопоказаний к их приему.
- Урикодепрессоры. Препараты данной группы снижают содержание МК за счет подавления активности фермента, участвующего в синтезе МК (ксантиноксидаза). Длительный прием способствует снижению частоты возникновения симптомов подагры, замедлению отложения кристаллов и формирования тофусов.
- Селективные ингибиторы ксантиноксидазы. Основное отличие от урикодепрессоров – более низкая частота возникновения нежелательных побочных реакций, таких как инфекции верхних и нижних дыхательных путей, гепатотоксичность, реакции гиперчувствительности.
- Урикозурические ЛС. Эти средства тормозят реабсорбцию МК в канальцах почек, тем самым увеличивая экскрецию МК.
- Антиподагрические ЛС смешанного действия. Также существуют комбинированные лекарственные препараты, одновременно действующие на 2 звена метаболизма МК. Они содержат урикодепрессивный компонент и урикозурическое средство.
- Ощелачивающие препараты. Для профилактики развития уратной нефропатии и отложения уратных камней основная уратснижающая терапия должна дополняться приемом ЛС для ощелачивания мочи – цитрат натрия, гидрокарбонат натрия.
Экспериментальная терапия
Продолжаются разработки и клинические исследования новых лекарственных средств для борьбы с гиперурикемией. Расбуриказа – препарат, содержащий рекомбинантную уриказу (фермент, разрушающий мочевую кислоту), показал высокую эффективность в лечении синдрома лизиса опухоли. Также данное ЛС отличается возможностью резорбции отложенных кристаллов моноурата натрия.
Перспективным является использование генно-инженерных биологических препаратов – антагониста рецепторов интерлейкина-1 (анакинра), полностью гуманизированных моноклональных антител к ИЛ-1-бета (канакинумаб), растворимого белка ИЛ-1 (рилонацепт). Их применение продемонстрировало достаточную эффективность в профилактике обострений симптомов хронического подагрического артрита.
Прогноз
Длительная гиперурикемия ассоциирована с большей частотой кардиоваскулярных осложнений – инфарктов, инсультов. Данное состояние также негативно влияет на углеводный и липидный обмен – повышает уровень липопротеидов низкой плотности, увеличивает инсулинорезистентность и усугубляет течение уже имеющегося сахарного диабета 2 типа. Поэтому обнаружение гиперурикемии требует тщательного обследования пациента и своевременного назначения терапии.
Токсическая нефропатия — это повреждение гломерулярного аппарата и почечных канальцев, вызванное действием экзо- и эндотоксинов, гемодинамическими и метаболическими нарушениями при отравлениях. Проявляется болями в пояснице, астеническим синдромом, отечностью, олигоанурией, которая впоследствии сменяется полиурией, полиорганными нарушениями. Диагностируется при помощи общего, биохимического анализов крови и мочи, проб Реберга, Зимницкого, УЗИ и томографии почек, УЗДГ почечных сосудов, химико-токсикологических исследований. Лечение включает проведение дезинтоксикационной терапии, инфузионной коррекции нарушений метаболизма, ЗПТ.
МКБ-10
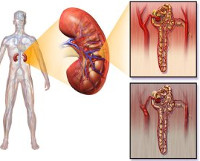
Общие сведения
Токсическая нефропатия — собирательное понятие, объединяющее ряд нефрологических заболеваний со сходным этиопатогенезом и клинической картиной. Распространенность патологии достигает 0,04%, что составляет до 20% всех регистрируемых случаев ОПН. Рост заболеваемости связан со все более широким применением химических веществ на различных производствах и в быту: по наблюдениям, ежегодно до 10 млн. человек постоянно контактирует с нефротоксичными химикатами. Кроме того, обратной стороной успехов фармацевтической отрасли стало появление новых лекарственных средств, оказывающих влияние на почки. Актуальность своевременного выявления токсической формы нефропатий обусловлена высоким уровнем смертности и тяжелыми исходами при необратимой деструкции ткани почек.

Причины
Поражение почечной паренхимы обусловлено воздействием химических веществ, оказывающих прямой или опосредованный нефротоксический эффект. В большинстве случаев ренальную дисфункцию, а в тяжелых случаях и деструкцию тканей, вызывают экзогенные производственные и бытовые яды, хотя у некоторых пациентов заболевание вызвано эндогенной интоксикацией. Специалисты в сфере урологии и нефрологии выделяют следующих группы причин, которые приводят к развитию нефропатии:
- Прием веществ с нефротоксическим эффектом. При попадании в почки ядов этой группы возникают острая гломерулопатия или тубулярный некроз, вызванный реабсорбцией большого количества токсических веществ. Непосредственным повреждающим эффектом на почечную ткань обладают соли тяжелых металлов (кадмия, свинца, ртути, золота, мышьяка, йода, висмута, хрома и др.), этиленгликоль, щавелевая и борная кислоты, бензин, фенол, толуол, орелланиновые грибные токсины, яды некоторых животных.
- Опосредованное токсическое повреждение почек. Отравления веществами с гемолитическим эффектом (уксусной кислотой, мышьяковистым водородом, медным купоросом, змеиным ядом и др.) осложняются закупоркой нефронов гемоглобином. Аналогичное повреждение вызывают массивное размозжение тканей и синдром длительного сдавления, при которых наблюдается миоглобинурия. При токсическом поражении печени ренальная паренхима вторично повреждается ксенобиотиками и эндогенными токсинами.
- Общие клинические проявления отравления. Ряд химических веществ не оказывают прямого нефротоксического эффекта, однако системные проявления, возникающие при их приеме, приводят к тяжелой ренальной дисфункции. Чаще всего токсические формы нефропатии развиваются на фоне отравлений с клиникой шока, некомпенсированного ацидоза, выраженных метаболических расстройств. Такая же ситуация возникает под влиянием эндо- и экзотоксинов патогенной и условно-патогенной микрофлоры.
Постоянное расширение ассортимента медикаментозных препаратов, в первую очередь антибактериальных и противоопухолевых средств, привело к увеличению количества случаев токсической лекарственной нефропатии. По результатам исследований, более чем у 30% пациентов неолигурическая почечная недостаточность связана с приемом фармацевтических препаратов.
Нефротоксичные медикаменты могут прямо повреждать почечные канальцы (аминогликозиды, амфотерицины, иммуноглобулины, НПВС и др.), вызывать их закупорку (сульфаниламиды, циклоспорины, производные пуриновых нуклеозидов), системно нарушать ренальную гемодинамику (β-адреноблокаторы, некоторые диуретики) или оказывать сочетанное действие. Развитие токсической ятрогенной нефропатии также возможно при проведении лучевой терапии.
Патогенез
Механизм развития токсической нефропатии определяется причинами, спровоцировавшими почечную дисфункцию. Патогенез расстройств, вызванных нефротоксинами прямого действия, основан на нарушении биохимических процессов в нефронах, эпителиоцитах проксимальных и дистальных канальцев. После фильтрации клубочками токсическое вещество попадает в канальцевую систему, где вследствие реабсорбции воды его уровень возрастает почти в 100 раз. Возникающий градиент концентрации способствует поступлению и накоплению ксенобиотика в канальцевом эпителии до определенного критического уровня.
В зависимости от типа экзотоксина в эпителиоцитах происходят процессы деструкции клеточных и митохондриальных мембран, лизосом, компонентов цитоплазмы, гладкого эндоплазматического ретикулума, рибосом и т. п. с развитием в наиболее тяжелых случаях острого тубулярного некроза. Некоторые нефротоксины за счет инициации гипериммунных процессов разрушают гломерулярный аппарат коркового слоя. Осаждение в клубочковых структурах иммунных комплексов или образование в мембранах комплексных антигенов с последующей атакой антител провоцируют начало острого гломерулонефрита или интерстициального нефрита без повреждения канальцевых эпителиоцитов. Важным фактором прямой нефротоксичности является способность некоторых веществ стимулировать образование свободных радикалов.
Патогенез опосредованного повреждения почек при закупорке канальцев основан на развитии в их клетках некротических процессов, нарушении реабсорбционной способности. Внутриренальный застой мочи сопровождается ретроградным током гломерулярного фильтрата и последующим повреждением нефронов. При нефропатиях, возникших на фоне общих отравлений, основой патоморфологических изменений обычно становится ишемия клеток и нарушение биохимических процессов за счет кислотно-щелочного и водно-электролитного дисбаланса. На начальном этапе возникает дисфункция эпителиоцитов, которая впоследствии может осложниться токсической дегенерацией и некрозом канальцевого эпителия, деструкцией гломерулярных базальных мембран, интерстициальным отеком.
Классификация
Систематизация форм токсической нефропатии проводится с учетом особенностей этиопатогенеза заболевания и тяжести симптоматики. Такой подход позволяет выработать оптимальную тактику ведения пациента, а в ряде случаев предупредить развитие необратимой деструкции тканей. С учетом этиологического фактора и механизма повреждения почек различают следующие формы заболевания:
- Токсическая специфическая нефропатия. Развивается под влиянием экзогенных и эндогенных веществ с прямыми и опосредованным нефротоксическим эффектом. Отличается быстрым развитием тканевой деструкции, которая у части пациентов является необратимой. Чаще требует раннего начала заместительной почечной терапии.
- Токсическая неспецифическая нефропатия. Осложняет течение отравлений и заболеваний с выраженным интоксикационным синдромом, при которых ведущими становятся гемодинамические и метаболические расстройства. На начальных этапах нарушения носят функциональный характер и лишь позднее начинается разрушение тканей.
При легком течении нефропатия выявляется лабораторно: в клиническом анализе мочи определяется повышенное содержание белка, лейкоцитов, эритроцитов, появляются цилиндры. Средняя степень характеризуется уменьшением количества мочи и нарушением фильтрационной функции с увеличением уровня мочевины, креатинина, калия в сыворотке крови. Для тяжелого течения характерна клиника ОПН, вплоть до наступления уремической комы.
Симптомы токсической нефропатии
Возникают тошнота, рвота, понос. Кожные покровы и видимые слизистые становятся сухими, желтушными. Нарастание почечной недостаточности сопровождается практически полным прекращением мочевыделения, усилением отечности, ее нисходящим распространением на другие отделы тела, появлением петехиальной сыпи. При тяжелых поражениях развивается мозговая симптоматика — вялость, заторможенность, оглушенность, слуховые, зрительные, тактильные галлюцинации, судорожный синдром. Признаки выраженной ренальной дисфункции обычно сохраняются в течение 7-14 суток.
На следующем этапе развития заболевания, длящемся от 10-15 до 30 дней, олигоанурия сменяется постепенным усилением диуреза. Больной выделяет за сутки от 1,8 до 5-8 л и более мочи. Сохраняются слабость, утомляемость, мучительная жажда, уменьшается масса тела. Длительность периода реконвалесценции при интоксикационной нефропатии зависит от объема и характера поражения. Обычно для восстановления функциональной состоятельности органа требуется от 6 месяцев до 2 лет.
Осложнения
В 20-70% случаев токсическая нефропатия завершается летальным исходом из-за массивной необратимой деструкции ренальной паренхимы. Снижение фильтрационной функции у пациентов с ОПН приводит к гиперкалиемии с замедлением сердечного ритма, фибрилляцией и асистолией желудочков. Нарушение работы сердца в сочетании с гипопротеинемией повышает риск развития отека легких.
Длительная уремия сопровождается усиленным выделением азотистых метаболитов через кожу, серозные и слизистые оболочки с развитием уремического перикардита, плеврита, гастрита, энтероколита, ларинготрахеита, токсическим поражением печени, костного мозга. При нарушении секреции компонентов ренин-ангиотензиновой системы возможно развитие артериальной гипертензии. Отдаленными последствиями токсического поражения почек являются хронический тубулоинтерстициальный нефрит, хроническая почечная недостаточность, новообразования органов мочевыделительного тракта.
Диагностика
Постановка диагноза токсической нефропатии обычно не представляет сложности в тех случаях, когда заболевание возникло после отравления химическим веществом. Диагностический поиск направлен на оценку характера, объема возможного повреждения тканей, определение выраженности ренальной дисфункции. Пациентам с нефропатией рекомендованы следующие лабораторно-инструментальные методы исследований:
- Общий анализ мочи. Определяются протеинурия, лейкоцитурия, микрогематурия, цилиндрурия. Относительная плотность мочи в олигоанурической фазе превышает 1030 г/л, в полиурической составляет ниже 1003 г/л. Дополнительное проведение пробы Зимницкого при полиурии выявляет снижение концентрационной функции.
- Биохимический анализ крови. До восстановления объема диуреза повышаются сывороточные уровни креатинина, мочевой кислоты, азота мочевины, калия, кальция, неорганического фосфора. Нарушение фильтрационной способности гломерул также подтверждается результатами нефрологического комплекса и пробы Реберга.
- УЗИ почек. При эхографии нефропатия токсического типа проявляется увеличением размеров почечной паренхимы за счет интерстициального и лимфостатического отека. Участки некроза имеют вид гипоэхогенных полостей или гиперэхогенных включений. УЗДГ ренальных сосудов выявляет гемодинамические нарушения.
- Томография почек. Компьютерная томография почек позволяет получить послойное изображение ренальных тканей и обнаружить даже небольшие участки деструкции. В целях безопасности при токсических поражениях исследование рекомендуется проводить без контраста или заменить его МРТ, хотя в таком случае информативность несколько снижается.
Для подтверждения токсического характера нефрологической патологии по возможности проводятся химико-токсикологические исследования, позволяющие установить химическое вещество, которое вызвало расстройство. Контрастные методы исследований (экскреторная урография, ангиография почек) применяют с осторожностью в связи с риском усугубления клинической ситуации контраст-индуцированными деструктивными процессами. Для контроля за состоянием других органов и систем проводятся биохимические пробы печени, коагулограмма, ЭКГ. Изменения общего анализа крови неспецифичны: могут выявляться анемия, умеренный лейкоцитоз, повышение СОЭ, тромбоцитопения.
Нефропатию токсического происхождения дифференцируют со вторичными нефропатиями другого генеза (контраст-индуцированной, диабетической, дисметаболической и др.), острым гломерулонефритом, ишемическим некрозом почек, травматическими повреждениями почечной паренхимы, атероэмболической болезнью. По назначению уролога-нефролога пациента консультируют токсиколог, анестезиолог-реаниматолог, невролог, терапевт, кардиолог, пульмонолог, гепатолог.
Лечение токсической нефропатии
Больных, почки которых повреждены в результате отравления экзо- или эндотоксинами, госпитализируют в палату интенсивной терапии. Основными терапевтическими задачами являются скорейшая элиминация химического вещества, коррекция метаболических расстройств, предупреждение возможных осложнений. С учетом этапа заболевания пациентам показаны:
- Дезинтоксикационная терапия. Проводится в первые часы и сутки после отравления. Для ускоренного выведения токсина проводят промывание желудка, форсированный диурез с назначением осмотических мочегонных и салуретиков, используют адсорбенты, слабительные средства, специфические антидоты. В сложных случаях эффективны плазмаферез, гемосорбция, гемофильтрация, ультрафильтрация, гемодиализ, перитонеальный диализ. Некоторым пациентам назначают переливание крови и ее компонентов.
- Инфузионная коррекция метаболических нарушений. Начинается сразу после госпитализации и продолжается в олигоанурическом периоде ОПН. Для восстановления электролитного баланса и кислотно-щелочного равновесия применяют антагонисты калия (обычно — препараты кальция), инфузию глюкозы с инсулином, ощелачивающие полиионные растворы. Возможен дальнейший прием энтеросорбентов, связывающих токсические метаболиты. При значительной ренальной дисфункции оправдано проведение ЗПТ.
При утяжелении состояния больного проводится комплексная противошоковая терапия, купируются неотложные состояния (уремическая кома, отек легких, судорожный синдром, гипертонический криз). В полиурической фазе продолжается массивная (до 5-6 л/сут) инфузионная терапия для поддержания ОЦК и физиологической концентрации метаболитов. На этапе восстановления проводится общеукрепляющее лечение и определяется тактика дальнейшего ведения пациента с учетом степени сохранности почечных функций.
Прогноз и профилактика
Токсическая нефропатия — тяжелое, прогностически неблагоприятное расстройство с высокими показателями летальности. Своевременное установление токсина, правильная оценка морфологической сохранности и функциональной состоятельности почечной паренхимы, проведение адекватной интенсивной терапии повышают шансы благоприятного исхода нефропатии. Профилактика заболевания направлена на предупреждение попадания в организм токсических веществ: ограничение времени контакта с нефротоксичными ядами, использование средств индивидуальной защиты (респираторов, защитной одежды), отказ от употребления в пищу незнакомых грибов.
Работникам предприятий с вредными условиями производства рекомендовано прохождение профилактических медосмотров для раннего выявления почечной дисфункции. Для снижения количества случаев гемодинамического и метаболического поражения почечных клеток при системных нарушениях пациентам с отравлениями рекомендован регулярный контроль функциональной состоятельности почек и адекватное купирование острого состояния. С учетом роста распространенности лекарственных нефропатий при назначении нефротоксичных лекарственных средств необходимо тщательное обследование пациента для выявления предпосылок к токсическому повреждению ренальной паренхимы.
2. Патогенез токсических нефропатий/ Гоженко А.И. // Актуальные проблемы транспортной медицины. — 2006 — № 2.
3. Клинико-морфологические изменения при токсической нефропатии, вызванной отравлением некоторыми спиртсодержащими жидкостями: Автореферат диссертации/ Морозов В.И. – 1996.
4. Механизмы хронической токсической нефропатии у рабочих химической промышленности: Автореферат диссертации/ Письменский А.В. – 2006.
Читайте также:

