Ожоговый сепсис у детей
Обновлено: 19.04.2024
Диагностика: признаки сепсиса у детей
Этим заболеванием, по данным ВОЗ, каждый год болеет не менее трех миллионов детей и 1.2 млн новорожденных. 1 Недуг почти всегда сопровождается жаром, дыхательной недостаточностью, дисфункцией сердечно-сосудистой системы и других органов.
У детей все процессы скоротечны, поэтому есть ряд признаков, на которые надо обратить внимание родителям. Итак, каковы симптомы сепсиса у детей?
- слабость;
- увеличение частоты дыхания;
- кашель при воспалении легких;
- боли в спине при пиелонефрите;
- лихорадка с температурой выше 38,3°С;
- учащение пульса до 160 ударов в минуту;
- нарушения моторики ЖКТ с тошнотой и рвотой;
- снижение температуры тела ниже 36°С
Если вовремя не диагностировать сепсис крови у ребенка, то может наступить и летальный исход от септического шока. 2
Как и любая инфекция, сепсис 3 не возникает сам по себе. У детей его могут вызвать следующие микроорганизмы:
- респираторно-синцитиальный вирус;
- листерии (палочковидные бактерии);
- вирус простого герпеса;
- грибки рода Кандида;
- кишечная палочка;
- цитомегаловирус;
- стрептококки;
- менингококк;
- сальмонелла;
- пневмококк
Инфекция может попасть в организм ребенка, как при контакте с больными людьми (например, в условиях стационара), так и при каких-то медицинских манипуляциях, а также при контакте с носителями в общественных местах и при несоблюдении правил гигиены.
Факторы риска сепсиса у новорожденных детей
Когда речь идет о новорожденных, 4 то тут нужно сказать о возможности заражения ребенка еще во внутриутробном состоянии или при родах. Также это может быть и больничный сепсис.
Фактором, сопутствующим развитию недуга у новорожденных может быть осложнения беременности: лихорадка у матери во время родов, инфекции половых органов, а также ВИЧ-инфицирование матери.
Заболевание может возникнуть, если у ребенка есть такие неблагоприятные показатели как:
- врожденный порок сердца, эндокардит;
- преждевременные роды (до 37 недель);
- инфекции уха, дыхательных путей;
- большая поверхность ожогов;
- возраст менее 3-х месяцев;
- множественные травмы;
- мочеполовые аномалии;
- дисфункции селезенки
У новорожденных риск развития сепсиса очень велик, так как этому может способствовать теоретически любой воспалительный процесс. Дело в том, что у маленьких детей инфекционный процесс имеет склонность к генерализации. То есть, если у взрослого, например, возникает очаг инфекции на коже, то организм будет стараться сдерживать его в месте появления. Дети же реагируют иначе: инфекция может быстро распространиться по всему организму.
К такому диагнозу приводят бактериальные пневмонии и пиелонефриты, менингококковая инфекция. Чаще всего недуг развивается у детей, которые родились раньше срока или с экстремально низкой массой тела. У новорожденного ребенка иммунная система находится в процессе формирования, поэтому она еще не способна, в полной мере, обезопасить малыша. В первые несколько месяцев жизни малыш получает защитные антитела с молоком матери.
Таким образом, раннее искусственное вскармливание тоже можно отнести к предрасполагающим факторам развития недуга. Большому риску заражения инфекцией подвергаются грудные дети, которые проходят лечение в условиях стационара, так как именно там чаще всего встречаются бактерии невосприимчивые к антибиотикам.
Отдельно следует сказать о присущем только новорожденным – пупочном сепсисе. Как правило, он развивается при неправильных манипуляциях с пуповиной младенца при родах, особенно при популярных в последнее время домашних родах, вне стационара. В антисептических условиях в пупочную область ребенка может попасть любая инфекция и привести к летальному исходу.
Лечение сепсиса у детей
ВАЖНО! Лечение проводится только в условиях стационара!
Лечение сепсиса комплексное, включает массивную антибактериальную 5 или противогрибковую терапию, дезинтоксикационную терапию. Должно проводиться в условиях отделения интенсивной терапии. В некоторых случаях может потребоваться переливание компонентов крови.
Прогноз при любой форме данного заболевания всегда серьезен. Чем раньше начато лечение, тем выше вероятность полного выздоровления. Сложность диагностики и лечения инфекции заключается в наличии большого количества стертых форм, когда клиническая картина не столь яркая.
Поэтому при лечении применяются антибактериальные препараты широкого спектра действия. Кроме того, в состав комплексной терапии могут быть включены и противовирусные и иммуномодулирующие препараты. Препарат ВИФЕРОН Свечи разрешен для применения у детей с первых дней жизни, в том числе недоношенным малышам. При комплексной терапии сепсиса рекомендуемая доза для новорожденных детей, в том числе недоношенных с гестационным возрастом более 34 недель ВИФЕРОН 150000 МЕ ежедневно по 1 суппозиторию 2 раза в сутки через 12 ч. Курс лечения – 5 суток.
Недоношенным новорожденным детям с гестационным возрастом менее 34 недель рекомендовано применение препарата ВИФЕРОН 150000 МЕ ежедневно по 1 суппозиторию 3 раза в сутки через 8 ч. Курс лечения – 5 суток.
Рекомендуемое количество курсов при сепсисе – 2-3 курса.
Благодаря своему уникальному составу, препарат Виферон помогает не только поддержать иммунную систему пациента и блокировать размножение вирусов, но и снизить дозу антибактериальных препаратов и уменьшить интоксикацию организма.
Применение интерферона при заражении крови
Эти исследования легли в основу создания препарата ВИФЕРОН, который вот уже более 20 лет используется для лечения различных инфекционных заболеваний у взрослых и детей.
Сепсис у детей: рекомендации по профилактике
Какие меры профилактики этого заболевания можно принять?
- Прежде всего, соблюдения личной гигиены мамы и малыша. Простые правила мытья рук и смены одежды, прежде чем прикасаться к новорожденному могут сберечь ему здоровье и жизнь.
- Кроме того, нужно каждой маме ответственно подходить к рождению ребенка и перед зачатием проверить собственное здоровье и вылечить, по возможности, хронические заболевания половых органов.
- Рождение ребенка должно проходить в нормальных санитарных условиях в стенах медицинского учреждения.
Перед выпиской ребенка домой из роддома хорошо бы провести ремонтные работы в помещении, особенно, если нет уверенности, что на стенах и старых обоях нет патогенных организмов и плесени. Ну, и, конечно же, при первых подозрениях на сепсис следует тут же обратиться за квалифицированной медицинской помощью.
Сепсис в комбустиологии
Крутиков М.Г.
Научно-практический центр термических поражений МЗ РФ
Института хирургии им. А.В.Вишневского РАМН
г. Москва
Обширное ожоговое поражение сопровождается развитием целого комплекса изменений в организме пострадавших, получивших название ожоговой болезни. В патогенезе ожоговой болезни одно из ведущих мест принадлежит инфекции. При этом, инфекционный процесс, начавшийся в ожоговой ране, имеет тенденцию к генерализации и часто приводит к такому тяжёлому осложнению, как сепсис.
Вместе с тем, сепсис следует рассматривать, как наиболее грозное инфекционное осложнение ожоговой болезни, вызываемое разнообразными возбудителями или их токсинами на фоне измененной реактивности организма больного.
В настоящее время отмечается не только увеличение частоты сепсиса при термических поражениях, но и ухудшение прогноза, что во многом является следствием неадекватного и
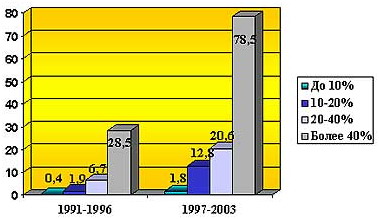
Рис. 1 Частота сепсиса у обожженных в зависимости от площади глубоких ожогов.
несвоевременного лечения пострадавших с первых часов после травмы (2,3). Данные нашего Института за последние годы полностью подтверждают это положение. При этом обращает на себя внимаение связь между частотой развития сепсиса и тяжестью травмы (рис.1)
Значительно выросла и летальность при сепсисе (рис. 2)
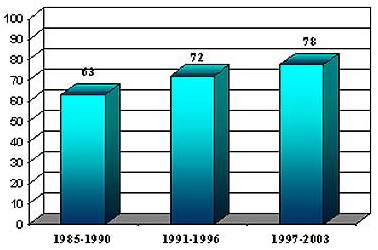
Рис.2 Летальность у больных с ожоговым сепсисом
В ряде случаев основное значение в развитии сепсиса имеют микроорганизмы, которые распространяясь с током крови приводят к развитию метастатических гнойников, в других случаях основное значение имеют микробные токсины, действие которых приводит к запуску каскада реакций в организме больного, приводящих к поражению внутренних органов (3). Помимо этого влияние на развитие сепсиса оказывают продукты распада тканей при их разрушении.
В патогенезе развития сепсиса ведущую роль играет состояние макроорганизма. Только состоянием защитно-приспособительных сил больного, которое не всегда удается конкретизировать диагностически, можно объяснить развитие сепсиса у больных с ограниченными ожогами и, напротив, отсутствие септических проявлений у больных с обширными глубокими термическими повреждениями.
Ожоговая травма создает все предпосылки, благоприятствующие ослаблению иммунобиологических сил организма: это ожоговый шок, нарушения обменных процессов, эндокринной регуляции, интоксикация, белково-энергетическая недостаточность. Вместе с тем, важное значение, по-видимому, принадлежит неблагоприятным факторам, воздействующим на иммунную реактивность больного до получения ожоговой травмы: недостаток и несбалансированность питания, авитаминозы, алкоголизм, повторные травмы, хронические заболевания, эндокринопатии и т.д. Следует учитывать также возраст больного. К сожалению, учесть весь комплекс предрасполагающих факторов, определить исходное состояние иммуннобиологических систем больного не представляется возможным.
В качестве патогенетических звеньев, приводящих к генерализации инфекции, со стороны иммунной системы и факторов неспецифической защиты организма в первую очередь следует рассматривать функциональную недостаточность фагоцитарного звена иммунитета (8). Как показали наши исследования, снижение поглотительной и переваривающей функций фагоцитов в ране, нарушение выработки ими супероксиданионов приводит к недостаточности местных барьерных механизмов и способствует поступлению бактерий и их токсинов в кровяносное русло. Часто сами фагоциты являются средством транспортировки бактерий, которые находясь внутри этих клеток преобретают дополнительную защиту от бактерицидных субстанций крови и действия антибиотиков (1,4). Риск развития сепсиса многократно возрастает при стойких нарушения Т- и В- звеньев клеточного иммунитета и нарушении выработки иммуноглобулинов, особенно класса G (1,5). Большое значение для характера течения сепсиса и его исхода имеет состояние обезвреживающей функции ретикулоэндотелиальной системы. При сепсисе органы, богатые ретикулоэндотелиальной тканью (печень, селезенка, костный мозг, почки и др.) активно участвуют в дезинтоксикации организма и освобождении его от инфекции. Чем выше фагоцитирующая способность клеток этих органов, тем меньше вирулентность микробов и больше вероятность благоприятного исхода. Чем эта способность ниже, тем больше вероятность не только дегенеративного, но и метастатического поражения этих органов, приводящая к летальному исходу. Токсинемия, как один из ведущих компонентов сепсиса, приводит к тяжелым нарушениям функций, а затем и морфологии паренхиматозных органов, вызывает нарушения белкового, углеводного обменов, витаминного, электролитного и кислотно-щелочного балланса, нарушает систему кроветворения, что приводит к развитию анемии. Эти нарушения в еще большей степени снижают сопротивляемость организма к инфекции, что создает порочный круг, приводящий к прогрессированию заболевания и часто к летальному исходу (1).
Роль микробного фактора, в первую очередь, определяется свойствами возбудителя. Так, стафилококковый сепсис большей частью протекает с метастазами, тогда как сепсис, вызванный грамотрицательными микроорганизмами чаще приводит к картине токсического повреждения органов и тканей, в значительном проценте случаев приводя к развитию септического шока. Важным фактором в плане возможности развития сепсиса следует считать количество микроорганизмов, выделяемых из ожоговых ран (6). Наши исследования показали, что в абсолютном большинстве случаев при развитии сепсиса количество микроорганизмов превышало критический уровень 105 КОЕ в 1 гр ткани раны (Lg КОЕ > 5), часто Lg КОЕ превышал 9 — 11.
Распространение инфекции из очага поражения, которым в большинстве случаев является ожоговая рана, осуществляется в основном гематогенным, реже лимфогенным путем. Помимо источника бактерий и токсинов ожоговая рана является источником многочисленных нарушений в организме пострадавших, усугубляющих течение ожоговой болезни и сепсиса, что предопределяет важность ее как можно более раннего закрытия. Однако, даже полное восстановление целостности кожных не всегда приводит к видимому влиянию на течение сепсиса, что в ряде случаев бывает связано с уже развившимися метастатическими очагами, или с цепью системных патологических реакций, развившихся в ответ на действие микробных токсинов.
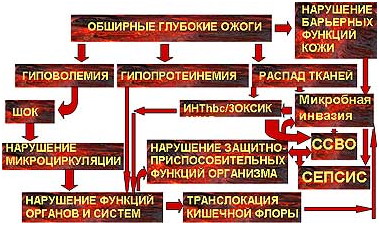
Таким образом, патогенез ожогового сепсиса чрезвычайно сложен и зависит от многочисленных факторов и их сочетаний (рис 3). Только основанная на постоянном динамическом наблюдении оценка изменений в организме обожженного позволяет прогнозировать и диагностировать сепсис, построить эффективную схему комплексного патогенетического лечения этого осложнения.
Комплексное обследование и лечение 327 больных с ожогами от 25 до 85% поверхности тела при площади глубоких ожогов от 9 до 75% поверхности тела, из которых у 211 был диагностирован сепсис, позволяет определить наиболее характерные и достоверные клинические и лабораторные критерии этого осложнения.
- Внезапное ухудшение общего состояния больного, не соответствующее стадии развития заболевания и характеру течения раневого процесса.
- Высокая лихорадка постоянного или, чаще, гектического характера с потрясающими ознобами.
- Расхождение частоты пульса и температуры тела.
- Прогрессирующее ухудшение общего состояния, несмотря на активное лечение, нарушения сердечно-сосудистой деятельности, функций почек и печени.
- Резкое ухудшение состояния ожоговой раны с появлением атрофичных грануляций, очагов вторичных некрозов.
- Прогрессирующая анемизация с уровнем гемоглобина не превышающим 90 ЕД.
- Лимфопения со снижением количества лимфоцитов менее 10 в 1 мл крови, нейтрофилез со сдвигом лейкоцитарной формулы влево.
- Увеличение СОЭ более 60 мм/час
- Высокая обсемененность ожоговых ран, превышающая критическую величину.
- Выделение при биопсии микробов в составе ассоциации из 4 -5 и более микроорганизмов.
- Стойкая бактериемия, определение в гемокультуре ассоциаций микроорганизмов.
- Признаки иммуносупрессии, проявляющиеся в снижении функциоальных резервов нейтрофильных лейкоцитов (уменьшение фагоцитарного числа и фагоцитарного индекса, снижение продукции супероксиданиона угнетение или гиперстимуляция спонтанной люминолзависимой хемилюминисценции с одновременным снижением индекса хемилюминисценции), прогрессирующее уменьшение количества Т и Т-активных лимфоцитов, В-лимфоцитов, угнетение продукции иммуноглобулина G, прогрессивное увеличение уровня макромолекулярных циркулирующих иммунных комплексов с параллельным снижением уровня церуллоплазмина, снижение уровня сывороточного лизоцима.
Таким образом, дифференциальная диагностика сепсиса и проявлений септикотоксемии, как стадии ожоговой болезни, являющейся по сути гнойно-резорбтивной лихорадкой, достаточно трудна. Для своевременной диагностики сепсиса у обожженных необходимо постоянное динамическое наблюдение за больными с анализом всех перечисленных выше симптомов. Диагносцированный сепсис или высокий риск его развития требует немедленного начала комплексной интенсивной терапии, учитывающей все звенья патогенеза этого осложнения.
Комплекс лечебных мероприятий можно условно разделить на две группы:
Основные задачи общего лечения сепсиса:
- Борьба с инфекцией и интоксикацией.
- Нормализация иммунологического статуса организма.
- Поддержание гомеостаза.
- Коррекция нарушенных функций органов и систем.
В борьбе с инфекцией основное значение имеет рациональная антибактериальная терапия. Выбор антибактериального препарата должен основываться на данных антибиотикограмм с обязательным учетом чувствительности выделенной из крови или ожоговых ран микрофлоры. Антибактериальную терапию следует проводить длительно, со своевременной сменой препаратов в максимальных дозах. Все препараты вводятся внутривенно. Микробиологический мониторинг проводится 1 раз в 7 — 10 дней. При тяжелом течении инфекции проводится комбинированная антибактериальная терапия двумя или тремя препаратами. При сепсисе, вызванном грамположительной флорой антибиотиками выбора являются полусинтетические пенициллины широкого спектра действия, цефалоспорины II поколения, линкомицин, а также фузидин и диоксидин. Альтернативная терапия — фторхинолоны и ванкомицин. При грамотрицательном сепсисе лечение проводят карбенициллином, гентамицином или амикацином в максимкальных дозах. Предпочтительнее комбинация карбенициллина с аминогликозидом. Альтернативная терапия — цефалоспорины III поколения (цефтриаксон, цефоперазон или сульперазон, цефтазидим и др.), ципрофлоксацин, карбепенемы. В лечении сепсиса хорошо зарекомендовали себя комбинации ципрофлоксацина с диоксидином, карбенициллина с гентамицином и диоксидином. Сепсис, вызванный неспорогенными анаэробными бактериями требует терапии клиндамицином, далацином С или метронидазолом. При грибковом сепсисе — препараты выбора — амфотеррицин В и флюконазол. Тяжелый сепсис требует немедленного включения в терапию карбепенемов (имипенем, меропинем), при сепсисе, вызванном MRSA — ванкомицина или линезолида.
Дезинтоксикационная терапия осуществляется с помощью форсированного диуреза, либо с применением методов экстракорпоральной дезинтоксикации (плазмаферрез или гемосорбция).
К средствам, повышающим реактивность организма, можно отнести переливание компонентов крови. Из средств пассивной иммунизации хороший эффект в зависимости от возбудителя сепсиса получен при использовании гиперимунной антистафилококковой или антисинегнойной плазмы, антистафилококкового гамма-глобулина. При угнетении различных звеньев иммунитета на основании данных иммунограмм применяют препараты тимуса (тималин, Т-активин), лейкинтерферон, декариес, препараты человеческих иммуноглобулинов, тромбо-лейкомассу, лейкоцитарную массу иммунизированных доноров или ожоговых реконвалисцентов. Основным методом иммунокоррекции является иммунозаместительная терапия очищенными человеческими иммуноглобулинами.
С целью лечения белково-каллорийной недостаточности широко применяется парентеральное и энтеральное питание. Важное место занимает в комплексном лечении сепсиса коррекция электролитных расстройств, кислотно-щелочного равновесия, борьба с гипоксией.
При нарушении функций сердечно-сосудистой системы в комплексную терапию включается кардиотропная поддержка, при поражении печеночной паренхимы — гепатопротекторы, при поражении легких необходима респираторная поддержка, вплоть до проведения ИВЛ, ингаляционная терапия, применение муколитических и бронхолитических средств. В особо интенсивных лечебных мероприятиях нуждаются больные с клиникой септического эндокардита.
Несмотря на комплекс терапевтических мер, направленных на борьбу с ожоговым сепсисом, прогноз при этом осложнении остается серьезным, хотя во многом зависящем от ранней диагностики и максимально интенсивной и последовательной терапии. В этой связи огромное значение приобретает комплекс мер, направленных на профилактику развития сепсиса у обожженных. Этот комплекс мер включает в себя: своевременное и адекватое лечение ожогового шока, адекватную дезинтоксикацию в периоде острой ожоговой токсемии и септикотоксемии, как можно более раннее очищение ожоговых ран от некроза и их аутодермопластическое закрытие, коррекцию нарушенного метаболизма, нормализацию антиинфекционной резистентности организма, борьбу с раневой инфекцией. Всех больных с площадью глубоких ожогов более 20% поверхности тела следует рассматривать в качестве группы риска в плане возможной генерализации инфекции и применять все доступные средства и методы общего и местного лечения для предотвращения этого грозного и опасного для жизни осложнения ожоговой болезни.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Ожоговая болезнь - совокупность нарушений функций различных органов и систем, возникающих вследствие обширных ожогов. Ожоговая болезнь имеет следующие периоды: ожоговый шок, острая ожоговая токсемия, период гнойно-септических осложнений и реконвалесценции.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Острая токсемия
После купирования ожогового шока (обычно это 2-3 сут после травмы) в результате резорбции жидкости из очага поражения в сосудистом русле скапливается большое количество токсических веществ - продуктов распада тканей и бактериальной флоры. Другими словами, ожог с некротическими тканями становится источником интоксикации организма. Основная масса токсических веществ поступает в кровь в течение первой недели, когда и разыгрывается развёрнутая картина тяжёлой интоксикации. В эти сроки объём циркулирующей плазмы возрастает, а количество циркулирующих эритроцитов продолжает уменьшаться вследствие их разрушения и угнетения костномозгового кроветворения. На 4-6 сут после травмы развивается анемия. Транспорт кислорода вследствие анемии существенно снижается. АД колеблется в пределах нормальных значений, у небольшой части больных наблюдают умеренную гипотензию. При электрокардиографическом исследовании выявляют признаки гипоксии миокарда, а у пожилых и ослабленных больных - недостаточность кровообращения. В связи с нарушением вентиляционной функции лёгких, нарастанием одышки и повышением выделения углекислого газа нередко развивается дыхательный алкалоз. Происходит нарушение функций печени. Работа почек нормализуется, однако остаются пониженными величина плазмотока и показатели клубочковой фильтрации; выявляют недостаточность почечной осморегулирующей функции.
Ожоговая болезнь характеризуется бредом, галлюцинациями, бессонницой, нередко возникает двигательное возбуждение. Больные дезориентированы во времени и пространстве, пытаются встать с кровати, срывают повязки. Частота психических нарушений прямо пропорциональна тяжести ожоговой травмы: если при поверхностных ожогах интоксикационный делирий - это редкость, то при глубоких поражениях, превышающих 20% поверхности тела, он возникает у 90% пострадавших. Возникновению наиболее тяжёлых и затяжных форм делирия способствует злоупотребление алкоголем до травмы.
Ожоговая болезнь часто осложняется пневмониями. При этом состояние больных резко ухудшается, температура тела повышается, появляется кашель, одышка, цианоз. В лёгких выслушивают влажные хрипы. Двусторонняя пневмония нередко приводит к развитию дыхательной недостаточности, одной из наиболее частых причин летального исхода. Особенно неблагоприятным считают сочетание тяжёлых ожогов кожных покровов с ингаляционной травмой, когда пневмония развивается в ранние сроки у всех больных (через 2-4 сут после поражения).
При обширных ожогах часто возникают токсический миокардит и гепатит. Об этом свидетельствует повышение в сыворотке крови уровня трансаминаз и билирубина. Распад белка и выделение азота с мочой возрастают, имеют место выраженные расстройства водно-электролитного баланса.
В этом периоде аппетит снижен, моторная функция кишечника нарушена, возможны заторможенность или двигательное возбуждение с признаками интоксикационного делирия, зрительными и слуховыми галлюцинациями, нарушением сна. Степень интоксикации зависит от характера повреждения тканей. Наиболее тяжело период токсемии протекает при наличии влажного некроза с нагноением ожоговых ран. При сухом - интоксикация выражена значительно меньше. Длительность этого периода ожоговой болезни составляет 7-9 сут.

[11], [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25]
Период гнойно-септических осложнений
Этот период ожоговой болезни следует после острой токсемии, но нередко границу между ними провести трудно. Обычно он начинается с 10-12 сут после получения ожога и совпадает с нагноением ран и началом отторжения нежизнеспособных тканей. Этот период наблюдают и при обширных ожогах IIIА степени в случае выраженного нагноения ран. Длительность этого периода либо до заживления ожоговых ран или закрытия их аутотрансплантатами, либо до момента смерти пострадавшего.
Гнойный процесс в ранах сопровождается тяжёлой системной воспалительной реакцией и сепсисом. Длительность лихорадочного состояния в среднем составляет 2-3 нед, однако в случае развития осложнений может составить 2-3 мес. После отторжения ожогового струпа температура тела обычно снижается на 1-1,5 °С. Общее состояние больных остаётся тяжёлым, они предъявляют жалобы на постоянные боли в местах ожогов, плохой сон, снижение аппетита, раздражительность, капризность, часто плаксивость. Нарастает анемия, среди причин которой следует отметить деструкцию эритроцитов, угнетение эритропоэза, инфекционные осложнения, кровотечения из гранулирующих ран, язв и эрозий ЖКТ. При тяжёлых ожогах развивается нейтрофилёз с преимущественным увеличением количества палочкоядерных нейтрофилов (до 30%) и появлением их юных форм. Неблагоприятным признаком считают эозино- и лимфопению. Количество лейкоцитов несколько снижается после отторжения нежизнеспособных тканей. У тяжёлых больных обнаруживают токсическую зернистость лейкоцитов. Постоянно происходит потеря тканевых и сывороточных белков, достигающая 80г/сут и более. Прогрессирующая гипопротеинемия служит прогностически неблагоприятным признаком. Гипоальбуминемия и увеличение количества глобулиновых фракций отражает активность раневой инфекции и свидетельствует о нарушении процессов синтеза и ресинтеза белка. Прямым подтверждением сепсиса служит рост микроорганизмов при посеве крови на питательные среды.
В стадии сепсиса инфекционные осложнения отличаются большим разнообразием: возможно развитие пневмонии, бронхита, флегмон, абсцессов, артритов. Нередки расстройства пищеварения, особенно часто - парезы ЖКТ. Ожоговая болезнь осложняется образованием острых (стрессовых) язв Курлинга, которые часто сопровождаются кровотечением и перфорацией в брюшную полость.
С развитием тяжёлого сепсиса состояние обожжённых значительно ухудшается: сознание спутано, ориентация в окружающей обстановке нарушена, кожные покровы приобретают желтушную окраску, нередки кровоизлияния и петехиальная сыпь. Ожоговая болезнь характеризуется образованием метастатических гнойников в подкожно-жировой клетчатке, мышцах, внутренних органах. Лихорадка носит гектический характер, плохо поддаётся лекарственной терапии и сопровождается ознобом и профузным потом.
При сепсисе быстро развивается стойкая гипохромная анемия, гипопротеинемия, выраженный лейкоцитоз, повышение концентраций остаточного азота и билирубина сыворотки крови. В моче обнаруживают эритроциты, лейкоциты, цилиндры, белок. Высокий лейкоцитоз и сдвиг лейкоцитарной формулы влево до появления миелоцитов свидетельствуют об активности инфекционно-токсическо-го фактора при сохранившейся реактивности организма, в то время как эозино- и лимфоцитопению считают неблагоприятными признаками.
Если в течение 1,5-2 мес утраченный кожный покров не восстанавливают оперативным путём, ожоговая болезнь переходит в истощение, к которому приводят выраженные дистрофические изменения внутренних органов, глубокие нарушения обменных процессов, резкое угнетение защитных сил организма. У больных возникают пролежни, разнообразные осложнения со стороны сердечно-сосудистой, дыхательной, выделительной и нервной систем. Потеря массы тела достигает 25-30%. При ожоговом истощении репаративные процессы в ранах резко замедлены или отсутствуют. Грануляции бледные, стекловидные, с серым налётом и большим количеством гнойного отделяемого. Нередко в ранах видны гематомы, вторичные некрозы, распространяющиеся на участки здоровой кожи. Из ран высевают гнилостную анаэробную микрофлору, Proteus spp., Pseudomonas aeruginosa.
Обширные гнойные раны - причина постоянной интоксикации, гипопротеинемии и лихорадки. У больных развивается ареактивность, снижается иммунитет, прогрессирует истощение. Образовавшиеся пролежни достигают больших размеров. Ожоговая болезнь часто сопровождается возникновением гнойных артритов, атрофией мышц, тугоподвижностью суставов, контрактурами. Течение истощения осложняется поражением внутренних органов с развитием тяжёлого сепсиса, который и становится непосредственной причиной смерти.
Длительность периода гнойно-септических осложнений определяется сроком существования ожоговых ран. При успешном восстановлении утраченного кожного покрова оперативным путём больной начинает медленно, но уверенно выздоравливать: постепенно проходит лихорадка, улучшаются сон и аппетит, исчезает анемия и гипопротеинемия, нормализуются функции внутренних органов. Пациенты быстро прибавляют в весе, активизируются, что свидетельствует о начале последнего периода ожоговой болезни.
Реконвалесценция
Длительность периода - 1-1,5 мес. Однако не всех, у которых была ожоговая болезнь, в дальнейшем можно считать здоровыми людьми: одни страдают хроническими почечными заболеваниями (пиелонефрит, почечно-каменная болезнь), у других выявляют признаки дистрофии миокарда. Наиболее многочисленной группе реконвалесцентов необходимо реконструктивно-восстановительное лечение рубцовых контрактур и деформаций, возникших на месте глубоких ожогов, поэтому период реконвалесценции у данной категории пострадавших увеличен.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Сепсис новорожденных - генерализованная форма гнойно-воспалительной инфекции, вызванной условно-патогенной бактериальной микрофлорой, патогенез которой связан с дисфункцией иммунной системы (преимущественно фагоцитарной) с развитием неадекватной системной воспалительной реакции (СВР) в ответ на первичный септический очаг.
Системная воспалительная реакция - общебиологическая неспецифическая иммуноцитологическая реакция организма в ответ на действие повреждающего эндогенного или экзогенного фактора. В случае развития инфекции СВР возникает в ответ на первичный гнойно-воспалительный очаг. Для СВР характерно бурное нарастание продукции провоспалительных (в большей степени) и противовоспалительных (в меньшей степени) цитокинов, неадекватное действию повреждающего фактора, что индуцирует апоптоз и некроз, обусловливая повреждающее действие СВР на организм.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Код по МКБ-10
Эпидемиология сепсиса новорожденных
В отечественной литературе нет достоверных данных о частоте инфекции среди новорождённых, что в значительной степени связано с отсутствием общепринятых диагностических критериев диагноза. По зарубежным данным, частота септических состояний среди новорождённых составляет 0,1-0,8%. Особый контингент больных - дети, находящиеся в отделениях реанимации и интенсивной терапии (ОРИТ), а также недоношенные новорождённые, среди них частота развития данного заболевания в среднем составляет 14%.
В структуре неонатальной смертности септические состояния составляет в среднем 4-5 на 1000 живорождённых. Показатели летальности от инфекции крови также довольно стабильны и составляют 30-40%.

[11], [12], [13], [14], [15]
Чем вызывается сепсис новорожденных?
Септическое состояние обусловлен исключительно условно-патогенной микрофлорой. В ряде случаев, например при иммунодефиците новорождённого, инфекция крови может быть составной частью генерализованной смешанной инфекции - вирусно-бактериальной, бактериальногрибковой и т.д.
Причиной данного заболевания у детей могут стать свыше 40 условно-патогенных микроорганизмов, но чаще всего инфекция крови обусловлен стрептококками, стафилококками, кишечной палочкой, клебсиеллой и другими грамотрицательными бактериями и анаэробами.
Этиологическая структура сепсиса новорождённых зависит от времени инфицирования плода и новорождённого.
Ранний (врождённый) неонатальное септическое состояние чаще всего обусловлен грамположительными кокками S. agalacticae относящимися к стрептококкам группы В. Данный возбудитель может быть причиной антенатального и интранального инфицирования плода;
Наиболее вероятная этиология раннего сепсиса новорождённых в зависимости от времени инфицирования плода и новорождённого
S. agalacticae
E. coli (редко)
S. agalacticae
E. coli
S. aureus
S. aureus et epidermidis
E. coli
Klebsiella spp.
S. pyogenes
E. coli и другие представители семейства кишечных грамотрицательных бацилл вызывают инфицирование плода значительно реже.
Поздний неонатальный сепсис новорожденных обычно возникает вследствие постнатального инфицирования. Основные возбудители - E. coli, S. aureus и Klebsiella pneumoniae; стрептококки группы В встречаются редко. Возрастает значение стрептококков группы А, псевдомонад и энтерококков.
В структуре грамотрицательных возбудителей данного заболевания, составляющих около 40%, в течение последних 10 лет произошли некоторые изменения. Возросла роль Pseudomonas spp. Klebsiella spp. и Enterobacter spp. Как правило, эти возбудители вызывают инфекцию крови у пациентов ОРИТ, находящихся на искусственной вентиляции лёгких (ИВЛ) и парентеральном питании, хирургических больных.
На этиологическую структуру постнатальной заболеваемости существенное влияние оказывает локализация первичного септического очага. Например, в этиологии пупочного вида инфекции ведущую роль играют стафилококки и E. coli, а в этиологии кожного и риноконъюнктивального септического состояния - стафилококки и ß-гемолитические стрептококки группы А. Также спектр возбудителей госпитальной инфекции зависит от входных ворот инфекции. Например, при катетеризационном септическом состоянии преобладающую роль играют стафилококки или смешанная генерализованная инфекция, обусловленная ассоциацией стафилококков с грибами рода Candida. При абдоминальном госпитальной инфекции часто выделяют энтеробактерии, анаэробы.
Наиболее вероятные возбудители сепсиса новорождённых в зависимости от локализации первичного очага инфекции
Локализация первичного очага
Наиболее вероятные возбудители
S. aureus et epidermidis
E. coli
K. pneumoniae
S. aureus et epidermidis Ps. aeruginosa (при ИВЛ)
Acinetobacter spp. (при ИВЛ)
Enterobacteriaceae spp.
Enterobacter spp.
Брюшная полость (после хирургических вмешательств)
Enterobacteriaceae spp.
Enterococcus spp.
Ps. aeruginosa
Анаэробы
Кожа, риноконъюнктивальная область
S. epidermidis et aureus
S. pyogenes et viridans
Ротоглотка и носоглотка, среднее ухо
S. epidermidis et aureus
S. pyogenes et viridans E. coli
E. coli и другие виды семейства Enterobacteriaceae Enterococcus spp.
Венозное русло (после применения внутривенного катетера)
S. aureus et epidermidis
Этиология генерализованных инфекций у иммунокопрометированных пациентов (в том числе у глубоко незрелых новорождённых) также имеет ряд особенностей и зависит от характера иммуносупрессии (приобретённые дисфункции иммунной системы, вторичная иммунная недостаточность, медикаментозная иммуносупрессия, врождённая, наследственная или приобретённая нейтропения, первичные иммунодефициты и ВИЧ-инфекция). Далеко не всегда инфекцией, развивающейся на таком фоне, бывает именно сепсис новорождённых.
Патогенез сепсиса новорожденных
Пусковой момент заболевания - наличие первичного гнойного очага на фоне изначальной несостоятельности противоинфекционной защиты. В этой ситуации массивное микробное обсеменение, превосходящее возможности противомикробной защиты, приводит к прорыву инфекционного начала в системный кровоток больного (бактериемия).
Наиболее вероятные возбудители генерализованных инфекций при иммунодефицитах у младенцев
Наиболее вероятные возбудители
Вторичные иммунные дисфункции, включая дисфункции при гестационной незрелости
Enterobacteriaceae spp.
Staphylococcus spp.
S. pyogenes
Грибы рода Candida
Цитомегаловирус
Enterobacteriaceae spp.
S. Aureus
Грибы рода Aspergillus et Candida
S. aureus E. coli
Грибы рода Candida
Оппортунистическая микрофлора (грибы, микобактерии, цитомегаловирус и т.д.)
Enterobacterioceae spp.
S. aureus et epidermidis Гемолитические стрептококки группы А
Помимо описанного выше, нейтрофилы играют роль фагоцитов. Значимость фагоцитоза, осуществляемого нейтрофилами и макрофагами, существенно различается - истинный фагоцитоз осуществляют именно макрофаги. Нейтрофильный фагоцитоз, хотя и протекает более интенсивно, чем у мононуклеаров, обусловлен другими биохимическими процессами, потому что задача у них иная. Основная функция нейтрофилов - инициация воспалительной реакции. Биологически активные вещества, секретируемые нейтрофильными гранулоцитами, имеют провоспалительную направленность; среди них различают цитокины, работающие в очагах острого воспаления (ИЛ-8, ИЛ-1, фактор некроза опухоли, гранулоцитарно-макрофагальный колониестимулирующий фактор и гранулоцитарный колониестимулирующий фактор) и участвующие в регуляции хронического воспаления (ИЛ-6, у-интерферон, трансформирующий фактор роста). Нейтрофилы синтезируют широкий спектр поверхностных адгезивных молекул, с помощью которых они взаимодействуют с клетками эндотелия сосудов, иммунной системы, тканей и органов. В результате адгезии изменяется чувствительность самих нейтрофилов к цитокинам и другим медиаторам, что позволяет им адекватно реагировать на изменения в тканях и органах. Цитотоксичность нейтрофилов значительно выше, чем у киллерных лимфоидных клеток (Т-лимфоцитов) и натуральных киллеров (NК-клеток). Факторы цитотоксичности нейтрофилов нацелены на ядерные структуры клеток-мишеней, структурные элементы генетического аппарата поглощённого объекта, разрушение генома с использованием факторов, индуцирующих апоптоз (ФИА). Клетки, подвергающиеся апоптозу, становятся объектами фагоцитоза и быстро разрушаются.
Нейтрофилы активно фагоцитируют микроорганизмы, не заботясь об истинном их переваривании, выбрасывают в межклеточное пространство значительные количества ФИА, чтобы как можно быстрее вызвать повреждения генетического аппарата патогенных микроорганизмов. Влияние высвобождения содержимого нейтрофильных гранул на процессы воспаления огромно. Содержимое нейтрофильных гранул индуцирует агрегацию тромбоцитов, выход гистамина, серотонина, протеаз, производных арахидоновой кислоты, активаторов свёртывания крови, системы комплемента, кинин-каллекреиновой системы и др. ФИА нейтрофилов губительны для любых клеток, так как вызывают разрушение нуклеопротеиновых комплексов генома.
Таким образом, в условиях инфекционного процесса нейтрофилы инициируют СВР, участвуют в презентации антигена возбудителя для активации специфического иммунного ответа организма. При чрезмерной активации нейтрофилов их цитотоксическое действие не ограничивается чужеродными клетками, реализуясь в отношении собственных клеток и тканей организма.
Чрезмерная СВР лежит в основе гиперактивации гипоталамо-гипофизарно-надпочечниковой системы, в норме обеспечивающей адекватную реакцию организма на стресс. Активация этой системы приводит к выбросу АКТГ и повышению содержания кортизола в крови. Чрезмерная активация гипоталамо-гипофизарно-надпочечниковой системы при септическом шоке, молниеносном течении данного заболевания приводит к неадекватной реакции на выброс АКТГ. Наряду с этим значительно снижается функциональная активность щитовидной железы, с чем связано замедление окислительного метаболизма, ограничивающее адаптивные возможности организма новорождённого. При тяжёлом септическом состоянии (молниеносное течение, септический шок) у ряда больных падает содержание соматотропного гормона (СТГ). Низкое содержание СТГ в условиях базальной гиперкортизолемии способствует бурному развитию некротических процессов (СТГ тормозит воспалительный процесс).
Другое проявление неадекватной СВР - неуправляемая активация свёртывающей системы крови, в условиях нарастающей депрессии фибринолиза неизбежно приводящая к тромбоцитопатии и коагулопатии потребления.
Таким образом, СВР, индуцированная чрезмерной активацией нейтрофилов периферической крови, активацией гипоталамо-гипофизарно-надпочечниковой системы и системы гемостаза, лежит в основе формирования полиорганной недостаточности, приводящей к глубоким расстройствам гомеостаза, иногда несовместимым с жизнью.
Для мононуклеаров нейтрофилы - клетки-помощники. Основная роль моноцитов и макрофагов - истинный фагоцитоз с дальнейшим тщательным перевариванием полуразрушенных нейтрофилами частиц клеток-мишеней, самих нейтрофилов и воспалительного клеточного дендрита. Фагоцитоз, осуществляемый макрофагами, способствует стиханию процессов воспаления и заживлению повреждённых тканей.
Формирование медиаторного ответа на бактериальную инфекцию, лежащего в основе синдрома СВР, - генетически контролируемый процесс, в котором участвуют рецепторы клеток, распознающие различные структуры микробного происхождения и индуцирующие экспрессию факторов неспецифической резистентности.
Синдром СВР лежит в основе прогрессирующей органной дисфункции, в ряде случаев достигающей степени органной недостаточности. Для патогенеза септического состояния характерно стремительное развитие полиорганной недостаточности и глубокие расстройства гомеостаза. Один из признаков нарушения гомеостаза при инфекции крови - выраженная пролиферация условно-патогенной микрофлоры, создающая предпосылки для возникновения новых инфекционных очагов и дополнительной транслокации инфекционного начала в системный кровоток. В настоящее время популярна концепция, согласно которой нарушения гомеостаза связаны с попаданием в кровь эндотоксина или липополисахаридного комплекса эндотоксина грамотрицательных бактерий, бурно колонизирующих верхние отделы тонкого кишечника в условиях тканевой гипоксии. Эндотоксин значительно усиливает СВР, провоцирует нарушения гомеостаза, рефрактерную к лечению гипотензию. Поступление в кровоток антигенов приводит к дезорганизации СВР - медиаторному хаосу. Антигенная перегрузка - причина выраженной иммуносупрессии в условиях бактериемии и нарушения микроциркуляции, способствующая формированию метастатических гнойных очагов, поддерживающих СВР, токсинемию и антигенемию. Дезорганизация СВР - основа развития септического шока.
Симптомы сепсиса новорождённых
Симптомы сепсиса новорожденных, независимо от формы (септицемия или септикопиемия), характеризуются тяжесть общего состояния новорождённого. Выражены нарушения терморегуляции (у доношенных морфофункционально зрелых новорождённых - лихорадка, у недоношенных, маловесных детей, на отягощённом преморбидном фоне - прогрессирующая гипотермия), нарушено функциональное состояние ЦНС (прогрессирующее угнетение). Характерен грязновато-бледный или сероватый оттенок кожных покровов с желтушностью и геморрагиями, участками склеремы. Выражена мраморность кожи, возможен акроцианоз. Рано возникает и быстро нарастает желтуха. Нередко развивается общий отёчный синдром. Характерна склонность к спонтанной кровоточивости. Черты лица нередко заострены.
Дыхательная недостаточность развивается без воспалительных изменений на рентгенограмме, часто происходит повреждение сердца по типу токсической кардиопатии, сопровождающееся развитием острой сердечной недостаточности. Характерно увеличение размеров селезёнки и печени, вздутие живота, выражена венозная сеть на передней брюшной стенке, часто наблюдаются срыгивания, рвота и анорексия, дисфункция желудочно-кишечного тракта вплоть до пареза кишечника. Типично отсутствие прибавки массы тела, формирование гипотрофии.
Для недоношенных детей типично подострое течение данного заболевания в виде синдрома дыхательных расстройств (одышка с периодами брадипноэ или апноэ), брадикардии, нарушения сосательного рефлекса, тенденции к гипотермии. Перечисленные симптомы сепсиса новорожденных отражают различные степени развития полиорганной недостаточности. Наиболее типичные синдромы полиорганной недостаточности при инфекции крови, а также характерные для них изменения, обнаруживаемые при лабораторных и инструментальных методах обследования, отражены в таблице.
Первичный септический очаг
Как было отмечено выше, изучая клиническую картину заболевания при позднем сепсисе новорождённых, в большинстве случаев можно обнаружить первичный септический очаг.
После внедрения первичной хирургической обработки пуповинного остатка произошло снижение частоты возникновения омфалита; в настоящее время эти заболевания встречаются не более чем в трети случаев. На этом фоне значительно возросла частота развития лёгочного (до 20-25%) и кишечного септического состояния (не менее 20%). Другие локализации первичного очага встречаются значительно реже и не превышают 2-6%. В отдельных случаях входные ворота инфекции установить не удаётся. Это особенно характерно для детей с малым гестационным возрастом, у которых слабо выражены процессы альтерации.
Клинические и лабораторные критерии органной недостаточности при септическом состоянии (Балк Р. и др., 2001, в модификации)
Читайте также:

