Папилломавирусная инфекция и бесплодие
Обновлено: 24.04.2024
Классические представления о роли вируса папилломы человека (ВПЧ) в развитии онкозаболеваний репродуктивных органов
Папилломавирусная инфекция (ПВИ) признана в настоящее время одной из самых распространенных инфекций, поражающих шейку матки, влагалище и вульву. Более 75% сексуально активных женщин хотя бы раз в жизни инфицируются ВПЧ [1].
До последнего времени преимущественно обсуждалась ключевая роль ПВИ в развитии рака шейки матки, а также ее вклад в развитие других онкологических заболеваний аногенитальной области (ануса, вульвы, влагалища, полового члена) [2, 3]. Степень заболеваемости раком шейки матки коррелирует с уровнем экономического развития страны и колеблется от 9,9 на 100 тыс. женщин в развитых странах до 15,7 на 100 тыс. женщин в развивающихся странах [3].
Обращает на себя внимание, что в последние годы в России обнаружилась тенденция к росту заболеваемости раком шейки матки у пациенток репродуктивного возраста: за 15 лет у женщин этого возраста заболеваемость раком шейки матки увеличилась более чем в 2 раза. В возрасте 15–40 лет рак шейки матки занимает второе место (после рака молочной железы) среди причин смерти больных злокачественными опухолями (15%) [4, 5].
Так, по онкогенной опасности для человека условно выделяют 3 группы типов ВПЧ:
Всего же группа ВПЧ обширна и включает более 200 различных генотипов.
Течение ПВИ зависит от состояния иммунной системы и может быть транзиторным, латентным или персистирующим. В 70–80% наблюдений течение ПВИ является транзиторным, и в этом случае может наблюдаться спонтанная элиминация ВПЧ. Латентное течение характеризуется отсутствием клинических и морфологических изменений при обнаружении ДНК ВПЧ.
Согласно международным данным, табакокурение, большое количество родов, длительное использование гормональной контрацепции и сопутствующая ВИЧ-инфекция относятся к установленным кофакторам развития рака шейки матки у ВПЧ-инфицированных женщин, тогда как инфекции, передающиеся половым путем (хламидиоз, герпетическая инфекция), иммуносупрессия, нутритивный дефицит рассматриваются лишь как вероятные кофакторы. Не ясна и обсуждается на сегодняшний день роль генетических факторов со стороны пациента и влияния типа вируса и вирусной нагрузки [3], что обусловливает необходимость дальнейшего изучения.
ПВИ и бесплодие
В то время как вопросы ассоциации ВПЧ с раком шейки матки давно изучены, крайне мало данных (и они противоречивы) о возможном влиянии ВПЧ инфекции на женскую и мужскую фертильность, тем более, что существующие исследования в данной области представляют немалый интерес и, возможно, открывают новые, пока недостаточно изученные, аспекты этой вирусной инфекции.
Так, ранее рядом авторов было показано, что у женщин с бесплодием частота носительства ВПЧ высокого онкогенного риска, а также аномальных цитологических результатов выше, чем в общей популяции.
В частности, по результатам исследования L.D. Zhang с соавт. (2007) установлено, что уровень инфицированности ВПЧ у бесплодных пациенток составил 25,38%, тогда как в контрольной группе – 11,33% [7]. Другие исследователи приводят данные о распространенности аномальных цитологических результатов в группе бесплодных пациенток, которые составляют от 6,1 до 11,3%, тогда как в группе сравнения – 3–3,9% [8–11]. На момент проведения данных исследований (2006–2013 гг.) авторы не расценили ВПЧ как самостоятельный фактор развития бесплодия. Было выдвинуто предположение, что повышенная распространенность ВПЧ среди бесплодных женщин может быть обусловлена частым сочетанием ПВИ с другими инфекциями, передающимися половым путем, в том числе с хламидиозом, который уже в тот период являлся признанным фактором развития трубного бесплодия [8].
Однако при анализе результатов своей работы сами исследователи приходят к выводу, что данная гипотеза несостоятельна, так как большинство ВПЧ-ассоциированных поражений шейки матки (от легкого дискариоза до развития carcinoma in situ) было выявлено в группе пациенток с бесплодием неясного генеза и мужским фактором, а не у пациенток с трубным фактором [8]. Таким образом, повышенная частота инфицирования ВПЧ бесплодных женщин не может быть объяснена простым совпадением.
Эти данные положили начало исследованиям роли самой ПВИ в генезе бесплодия, как женского, так и мужского.

Вирус папилломы у человека поражает половые органы. ВПЧ и бесплодие имеют определенную взаимосвязь. У женщин ВПЧ встречается в четырех разновидностях. Типы 18 и 16 связывают с раком шейки матки, типы 11 и 6 провоцируют кондиломы остроконечной формы.
В некоторых случаях заболевание может исчезнуть само по себе, но при отсутствии лечения оно может стать причиной рака матки. Если женщина планирует беременность, имея ВПЧ, она может столкнуться с затруднениями, вплоть до передачи вируса плоду. Узнаем, может ли ВПЧ быть причиной бесплодия.
Совместимость беременности и ВПЧ
ВПЧ имеет множество подвидов. Принято разделять вирус на три группы:
- Неонкогенный;
- Низкого онкогенного риска;
- Высокого онкогенного риска.
Заражение происходит от человека. Вирус не может существовать вне клеток организма. В основном, ВПЧ передается половым путем. Известно, что вероятность инфекции увеличивается при урогенитальном и анальном контактах. Причиной является пониженная реактивность локального иммунитета в прямой кишке или во рту по отношению к инфекциям, которые передаются половым путем.
Вирус папилломы человека, оказывает негативное влияние на иммунную систему. Если работа иммунитета ухудшилась, значит, снизилась защита организма, поэтому вырастает риск появления инфекций. Такая ситуация всегда отрицательно сказывается на возможности зачатия.
Суть зачатия заключается в слиянии половых клеток женщины и мужчины, вследствие чего формируется эмбрион. Он сам по себе считается новым образованием в женском организме. Как известно, ключевая функция иммунитета – защита от посторонних клеток. В процессе беременности, организм женщины производит перепрограммирование иммунной системы. Поэтому организм начинает видеть эмбрион не посторонним образованием, а частью организма.
Вызывает ли ВПЧ бесплодие
Наличие вируса папилломы человека может привести к нарушению процесса перепрограммирования. Таким образом, клетки иммунной системы женщины начнут атаковать клетки мужчины, что приведет к невозможности зачатия и вероятности бесплодия. Если зачатие все же произошло, из-за ВПЧ эмбрион может быть подвержен атакам иммунной системы на любом этапе формирования.
Часто женщина не знает о вирусе и не может предположить, что это является причиной бесплодия. Если установлено иммунное бесплодие, необходимо проконсультироваться с иммунологом либо репродуктологом. Только при комплексном анализе крови можно выявить скрытые причины и определить стратегию лечения.

Клиническая картина
Вирус папилломы человека локализуется на слизистых гениталий. При остроконечных папилломах, чаще всего принимается решение об их ликвидации. Нюансы ликвидации папиллом врач подбирает в индивидуальном порядке. При беременности всегда учитываются риски для плода. После процедуры необходим врачебный контроль вплоть до рождения ребенка.
Если вирус папилломы провоцирует поражения шейки матки или онкологию, потребуется оперативное вмешательство и беременность прерывается. Когда пройден полный курс терапии, женщина может начинать планирование следующей беременности.
При проблемах с зачатием и ВПЧ, может быть принято решение об экстракорпоральном оплодотворении. Вирус папилломы человека опасен своими осложнениями. Если лечение отсутствует длительное время, то возникает вероятность удаления матки.
Опасность ВПЧ для беременности
Вирус влияет на возможность забеременеть и на общую фертильность. Медики связывают это с тем, что изменяются свойства эпителия шейки матки. Всегда есть вероятность предраковых патологий, а также формирования злокачественного новообразования.
Сейчас ранние стадии рака шейки матки можно лечить с высокой эффективностью. Чтобы не допустить развития недуга, нужно регулярно проходить скрининг, чтобы вовремя обнаружить атипичные клетки.
При ВПЧ до беременности часто появляются кондиломы на гениталиях, в том числе, и на шейке матки. Вследствие этого часто изменяется характер выделений. Качество цервикальной слизи напрямую связано с возможностью оплодотворения, она способствует попаданию сперматозоидов в матку.
Если свойства цервикальной слизи изменяются, то она может не пропустить половые клетки мужчины, поэтому зачатия не произойдет. Вирус обеспечивает себе благоприятные условия, поэтому ВПЧ и бесплодие имеют определенную взаимосвязь. Заражение ребенка ВПЧ выполняется через амниотические оболочки и при родах. Установлено, что есть примерно одинаковая вероятность заражения и при кесаревом сечении, и при обычном родоразрешении.
Особенности лечения вируса папилломы человека
Когда диагностирован вирус папилломы человека, следует приступить к лечению. Могут быть назначены противовирусные лекарства, а также препараты, повышающие иммунитет. Иногда показано хирургическое вмешательство, которое заключается в точечном удалении тканей. При этом в половине случаев возникает рецидив. Это объясняется тем, что при операции удаляются видимые очаги поражения, но это не гарантия полного ухода вируса из организма. Поэтому после вмешательства нужно принимать определенные препараты для угнетения вируса.
ВПЧ необходимо обязательно лечить. Схема может включать в себя:
- противовирусные лекарства;
- хирургию;
- иммуномодуляторы.
Наша клиника является лидером в области репродуктивной медицины. Имеется собственная операционная и стационар. Специалисты работают под руководством акушера-гинеколога высшей категории, доктора медицинских наук Здановского Валерия Мстиславовича. Именно он впервые начал практиковать экстракорпоральное оплодотворение. С помощью наших врачей появилось на свет уже более 8172 ребенка.
Мы скрупулезно изучаем особенности организма женщины, поскольку ВПЧ и бесплодие связаны между собой. Женщина, обратившись в нашу клинику, получает квалифицированное обследование и лечение. Мы заботимся об улучшении работы иммунной системы, чтобы появилась возможность успешного зачатия и вынашивания ребенка. Лечащий врач назначает необходимую диагностику и рекомендует медикаментозные средства, которые смогут защитить организм от бактерий и вредных микробов.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
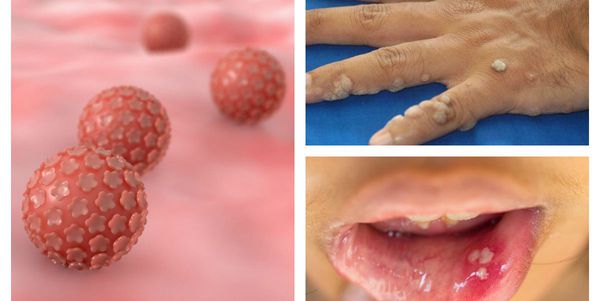
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
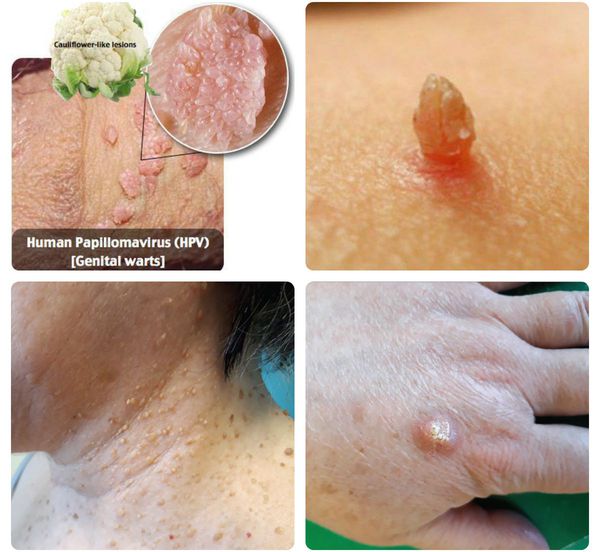
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
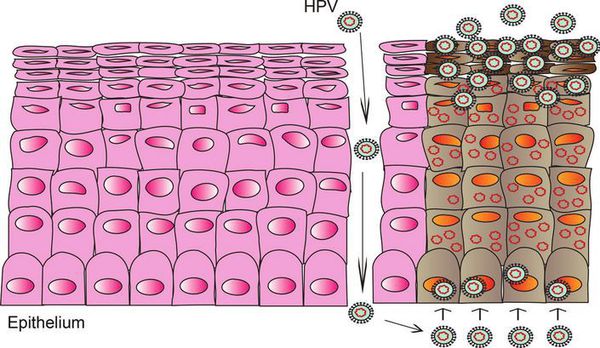
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
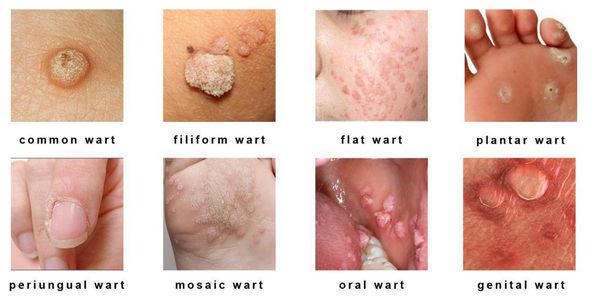
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
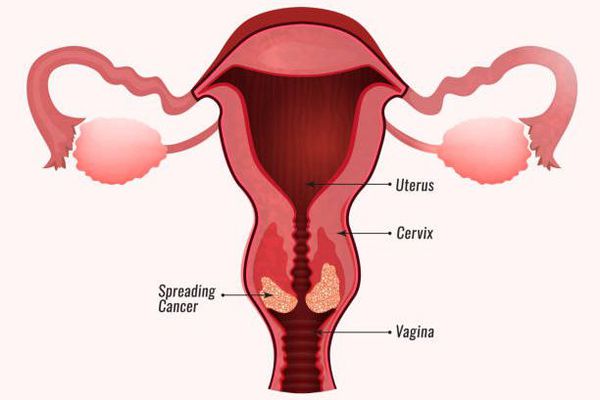
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
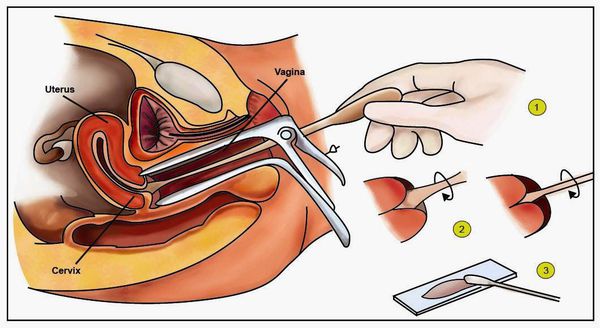
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
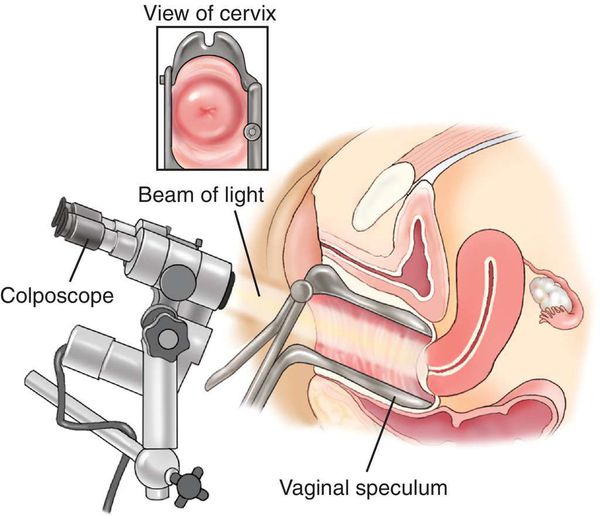
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
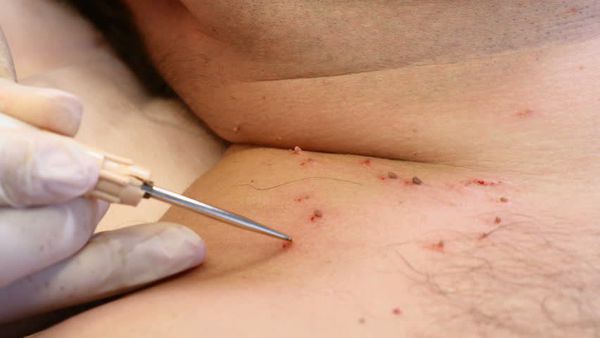
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
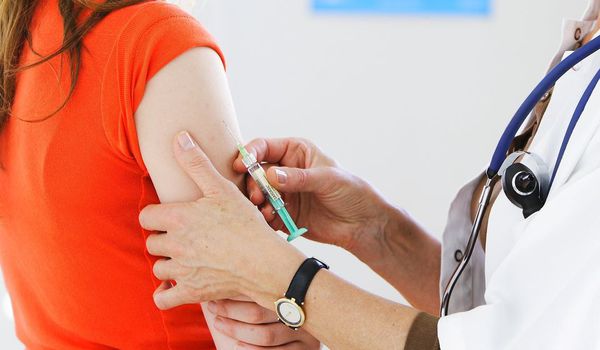
Введение. Бесплодие – это сложная и актульная проблема репродуктологии. Примерно 15% сексуально активных пар не достигают беременности в течение 1 года и обращаются за лечением, а 5% пар остаются бездетными, несмотря на использование широкого арсенала методов лечения. У половины (50%) бездетных пар бесплодие связано с мужским фактором, проявляющимся отклонениями в параметрах эякулята [1]. Данный факт существенно влияет на качество жизни людей и обусловливает огромные социально-экономические издержки [2].
В 30–40% случаев не удается выявить причинный фактор бесплодия даже по результатам всестороннего обследования (идиопатическое бесплодие). У данных пациентов в анамнезе нет заболеваний, нарушающих фертильность, изменений при физикальном обследовании или в показателях гормональных, генетических и биохимических исследований. При этом при анализе эякулята выявляется снижение числа сперматозоидов (олигозооспермия), нарушение подвижности (астенозооспермия) и патология морфологических характеристик (тератозооспермия). Кроме того, часто данные виды патоспермии наблюдаются одновременно и обозначаются как олигоастенотератозооспермия (ОАТ-синдром) [3].
Усовершенствование методов диагностики заболеваний органов мочеполовой системы расширило понимание этиопатогенетической цепи, приводящей к мужскому бесплодию. [1]. В настоящее время существенная роль в развитии как мужского, так и женского бесплодия отводится инфекционному фактору. Доказана широкая вовлеченность микроорганизмов: бактерий, простейших, внутриклеточных паразитов [4].
В последние годы особое внимание уделяется вирусным инфекциям: они рассматриваются в числе возможных деструктивных агентов, которые влияют на мужскую фертильность. Прямые или опосредованные через аутоиммунные процессы токсические эффекты вирусных инфекций человека могут нарушать процессы сперматогенеза, включая метаболическую и двигательную активность сперматозоидов [5–7].
Активно изучается вопрос о причастности папилломавирусной инфекции (ПВИ) к развитию инфертильности, а также степень этого влияния [8].
Хорошо известен вклад ПВИ в развитие онкологических заболеваний мочевыводящих путей и репродуктивных органов как в мужской, так и в женской популяции [9, 10]. Кроме того, ПВИ является широко распространенным заболеванием, передающимся половым путем. Есть немало доказательств взаимосвязи ПВИ и появления генитальных бородавок, рецидивирующей инфекции нижних мочевыводящих путей [11, 12]. Согласно данным крупного метаанализа, среди фертильных мужчин доля инфицированных ВПЧ составила 10%, среди бесплодных мужчин – 16%, что свидетельствуют о причастности ПВИ к развитию инфертильности [13].
В последних мета-анализах сравнение числа бесплодных мужчин в группах мужчин с ПВИ и без таковой подтвердило ранее сформулированные выводы: ПВИ является фактором риска бесплодия с отношением шансов (ОШ) 2,93 и 3,02 соответственно [14, 15]. Авторы указали, что исследований с высококачественным дизайном все еще недостаточно, однако объем выборки, хорошая проработка дизайна обзоров обеспечивают обоснованность их заключений.
Механизм влияния вируса папилломы человека (ВПЧ) на репродуктивную функцию окончательно не установлен. Вероятно влияние на параметры спермы [16, 17]. Возможно, нарушаются процессы бластуляции или имплантации из-за встраивания ДНК вируса в ДНК хозяина и последующего дефектного развития зиготы [18]. Данные противоречивы.
Поскольку полного излечения от ВПЧ достичь невозможно, то целью проводимой терапии является удаление патологического очага поражения. Наиболее перспективным считается комплексное лечение, включающее неспецифическую противовирусную, противорецидивную терапию и местное воздействие на измененные участки генитального тракта.
Выбор методов лечения генитальных бородавок должен основываться на:
особенностях количества, размеров, расположения и морфологии поражений;
возможных нежелательных явлениях от предполагаемой терапии;
клинического опыта врача.
В настоящее время предпочтение отдается цитотоксической терапии (подофиллотоксин), криотерапии, лазерной терапии, хирургическому иссечению. Не рекомендуется использовать 5-фторурацил, так как высока вероятность выраженных локальных побочных эффектов, также он обладает тератогенным действием.
Локальное удаление очагов ПВИ гениталий можно проводить через 2—3 недели после начала системной или местной противовирусной терапии, поскольку клинический опыт свидетельствует о частичной регрессии процесса и снижении вирусной нагрузки.
При ПВИ гениталий обследованию и лечению подлежат оба половых партнера, а во время лечения необходимо использовать презервативы. Хотя с позиций доказательной медицины эффективность применения презервативов при ПВИ не установлена, однако постоянное применение презервативов по сравнению с их нерегулярным использованием снижает риск передачи возбудителя.
Для лечения бородавок аногенитальной области применяют 10—25%-ный раствор подофиллина, который в клетках связывается с аппаратом микротрубочек и ингибирует митозы и транспорт нуклеиновых кислот, в результате чего происходит торможение синтеза ДНК и деления клетки. Препарат наносят 1—2 раза в неделю в количестве не более 0,5 мл за одну процедуру, максимум 5 недель. Частота рецидивирования бородавок варьирует от 0 до 67%, по данным ряда авторов. Примерно у 10—15% женщин развиваются местные побочные реакции в виде мокнущего контактного дерматита. В результате длительного или неправильного применения подофиллина иногда могут возникать побочные реакции, такие как тошнота, рвота, боли в животе, диарея, симптомы нарушения функции почек, миокарда, печени, ЦНС и костного мозга. Применение подофиллина противопоказано при беременности. Многие исследователи считают подофиллин недостаточно изученным и плохо очищенным растительным экстрактом, в связи с чем рекомендуют использовать только высокоочищенные подофиллотоксины в виде раствора или крема. Подофиллотоксин связывается с микротрубочками клеток и подавляет митотическую активность. В результате развивается некроз кондилом, достигающий максимума через 3—5 дней после применения препарата. При этом 50—65% больных отмечают преходящее умеренное жжение, болезненность, эритему и/или образование эрозий в течение нескольких дней, когда происходит некроз кондилом. Частота рецидивов после применения подофиллотоксина составляет от 7 до 38%.
Химические методы лечения
Трихлоруксусная (ТХУ) кислота (80—90% раствор) является деструктивным химическим препаратом, вызывающим некроз клеток. Ее воздействие наиболее эффективно при небольших остроконечных кондиломах. Часто требуются повторные процедуры с интервалом в 1—2 недели, однако женщины иногда их плохо переносят, так как препарат обладает сильным раздражающим действием и может вызвать чувство жжения. При чрезмерном нанесении препарата могут образовываться глубокие язвы и рубцы. При правильном применении ТХУ кислоты образуются неглубокие эрозии, которые не оставляют рубцов. Данный препарат можно осторожно использовать во время беременности. Эффективность препарата при первоначальном использовании составляет 70—81%. Частота рецидивов достигает 36%.
Следует подчеркнуть, что противопоказанием к использованию химических и цитотоксических средств является дисплазия клеток эпителия участка поражения. Так как концентрация химических агентов в ткани постепенно снижается, а методов нанесения этих веществ на ограниченный участок не существует, использование их возможно только после исключения влияния высокоонкогенных типов ВПЧ на возникновение заболевания. Эти методы чаще всего используются для лечения остроконечных кондилом влагалища, вульвы и кожи.
Тем не менее цитотоксический и химический методы наиболее эффективны для лечения нежных, неороговевающих бородавок генитальной области. Если же поражения являются кератинизированными, методом выбора считается лазерное воздействие.
По данным ряда клинических исследований, эффективность криодеструкции достигает 54,8—75% (табл.1). Такая относительно невысокая эффективность является следствием жизнеспособности вируса даже после его замораживания. Лишь после 2 или 3 еженедельных обработок генитальные бородавки обычно исчезают. Криотерапия нетоксична, но может вызывать боль при оттаивании тканей. Из побочных эффектов следует отметить возможность появления пузырей и язв. При проведении криотерапии на ШМ глубокое повреждение тканей может приводить к образованию рубцовой деформации, что впоследствии проявится в виде стеноза, атрезии цервикального канала, дистоции ШМ в родах.
Диатермоконизация также является одной из радикальных процедур удаления очагов поражения. Эффективность этого метода составляет 76,7—93,7%. Однако повышенная травматичность вмешательства, частые осложнения (стенозы ЦК, эндометриоз, последующие нарушения репродуктивной функции) ограничивают ее применение у молодых женщин, планирующих в будущем иметь детей.
При помощи радиохирургического метода также возможно проведение конизации ШМ по показаниям (табл. 3).
Большинство операций проводится под местной анестезией. Достоинствами радиохирургического воздействия являются:
отсутствие обугливания и затруднений при рассечении тканей;
отсутствие кровотечения и болевых ощущений во время операции.
Этот метод лечения не вызывает образования струпа и рубцов, вдвое сокращает сроки эпителизации, сохраняет архитектонику ШМ. Эффективность радиохирургического лечения составляет в среднем 86%.
Достаточно эффективным и безопасным методом лечения является использование лазера. Накопленный практический опыт определил приоритетное направление углекислотного (СО2), а также неодимового лазера (Nd-Yag-лазер).
Главными преимуществами СО2-лазера являются контролируемое выпаривание биоткани без некроза соседних участков ткани, отсутствие распространения опухолевых клеток во время операции и хорошая восстановительная способность краев лазерной раны.
Для достижения такого же режущего или испаряющего эффекта, как у СО2-лазера, для неодимового лазера требуется в несколько раз более высокая мощность излучения. Предпочтительная сфера хирургического применения неодимового лазера — это объемная и глубокая коагуляция, онкологические опухоли, внутренние кровотечения и т.п., как в открытых, так и в эндоскопических операциях.
Противопоказаниями для лазерного воздействия являются острые воспалительные процессы малого таза, в том числе инфекции, передающиеся половым путем, тяжелые заболевания печени, декомпенсированный сахарный диабет, почечная патология, онкологические заболевания. Использование СО2-лазера является методом выбора при лечении ЦИН. Лазерное воздействие успешно используется для лечения остроконечных кондилом у беременных. Из побочных эффектов следует отметить наличие кровотечения в интраоперационном периоде. Заживление лазерных ран происходит первичным натяжением с минимальным рубцеванием. Эффективность использования лазеров при комбинированной терапии ПВИ ШМ составляет 86—96%. При проведении лазерной аблации генитальных бородавок желательно использовать местную анестезию (новокаин, лидокаин и др.).
Фотодинамическая терапия (ФДТ) является еще одной ступенью в поисках новых подходов к лечению гинекологической патологии при помощи комбинации медикаментозного и лазерного воздействия.
Принцип действия ФДТ: взаимодействие фотосенсибилизатора, предварительно введенного в организм пациентки, с излучением определенной длины волны, в результате чего образуется синглентный кислород и другие цитотоксические продукты.
Для ФДТ используют низкоинтенсивные лазеры с мощностью 1—2 Вт, что позволяет проводить лечение, не превышая порог чувствительности к термическому воздействию.
Время проводимой процедуры зависит от диаметра участков поражения и физических параметров воздействия (мощности лазерного воздействия на выходе и плотности энергии).
Метод ФДТ обладает следующими преимуществами:
одновременное проведение диагностического и лечебного воздействия;
избирательность (поражаются только патологические участки);
возможность работы в труднодоступных зонах;
возможность многократного повторения лечебного процесса;
отсутствие тяжелых местных и системных осложнений;
возможность проведения в амбулаторных условиях.
Иммунные препараты для местного применения
Циклоферон — 5% линимент применяют наружно в виде аппликаций на кондиломы 3—6 раз в день или в виде орошения ШМ 1 раз в день.
Гепон — синтетический иммуномодулятор, рекомендуется 0,04% раствора для орошений влагалища через день, курс 3—6 процедур.
Имунофан — синтетический иммуномодулятор, применяется в виде суппозиториев внутривлагалищно и ректально по 0,1 мг 1—2 раза в день, 20 процедур на курс.
Виферон — рекомбинантный — ?-2 интерферон с добавками витаминов Е и С, рекомендуется применять по 1 млн ЕД 2 раза в день во влагалище или в прямую кишку.
Генферон — рекомбинантный ?-2 человеческий интерферон с добавлением таурина и анестезина.
Эпиген-спрей — содержит глицирризиновую кислоту и наносится на генитальные кондиломы или внутривлагалищно 5—6 раз в день в течение 2—3 недель.
В настоящее время особый интерес представляет средство Индинол®, которое является этиопатогенетическим для лечения ПВИ гениталий. Основным действующим веществом препарата является индол-3-карбинол.
Эпителиальные клетки, содержащие встроенные в хромосому копии генома ВПЧ, приобретают способность усиленной конверсии эстрадиола в его агрессивный метаболит — 16-?-гидроксиэстрон. 16-?-гидроксиэстрон индуцирует в клетках повышение уровня мутаций и образует устойчивый длительно живущий комплекс с эстрогеновыми рецепторами. Метаболит является мощным стимулятором синтеза высокоонкогенных типов ВПЧ, которые ответственны за опухолевую трансформацию инфицированных клеток. Кроме того, вырабатываемые вирусами онкобелки Е6 и Е7 вызывают местную иммуносупрессию, а также снижают чувствительность организма к интерферонам, поступающим извне.
Индинол® обладает следующими механизмами :
препятствует образованию 16-?-гидроксиэстрона, обладающего канцерогенными свойствами;
блокирует синтез вирусных белков Е6 и Е7, восстанавливая местный иммунитет;
индуцирует избирательный апоптоз ВПЧ-инфицированных клеток, способствуя элиминации вируса.
По данным ряда клинических исследований, прием 400 мг Индинола® в день (2 капсулы 2 раза) в течение 3—6 месяцев в комплексе с иммуномодуляторами повышает эффективность лечения в 2 раза (индикатор — число ВПЧ-негативных пациентов), а также снижает число рецидивов в 3—4 раза.
Несмотря на существование огромного количества методов лечения ПВИ (рис.), до настоящего времени отсутствуют четкие стандартные рекомендации в отношении выбора метода лечения ПВИ, его адекватности клинико-патогенетическим особенностям заболевания. Кроме того, при выборе метода лечения заболеваний, ассоциированных с ВПЧ, необходимо учитывать не только нозологический фактор, но и особенности гормонального статуса, состояния иммунной системы пациенток. По нашему глубокому убеждению, лечение ПВИ гениталий необходимо проводить в соответствии с принципами доказательной медицины, учитывая распространенность и локализацию, характер процесса, возраст пациентки, паритет и наличие сопутствующих заболеваний.
Ежегодно от РШМ умирает 273 000 женщин, ? — в развивающихся странах. Россия занимает промежуточное положение среди стран с высокой и низкой заболеваемостью. В структуре онкологической заболеваемости женского населения России РШМ занял 6-е место, в мире — 2-е место.
Основные цели скрининга РШМ:
1. Определение популяции, потенциальной по риску развития РШМ;
2. Снижение заболеваемости и смертности.
В странах Европы осуществляется различная скрининговая политика. Скрининговый интервал варьирует от 3-х до 5 лет; в течение жизни у женщин берется от 7 до 16 мазков. Скринингу подлежат женщины в возрасте 23—25 лет, однако у части пациенток регулярные обследования продолжаются и до 60—65 лет. В странах с экономичными скрининговыми программами (Финляндия, Нидерланды) скрининг проводится для женщин с 30 до 60 лет.
По рекомендациям Американского общества по изучению рака (American Cancer Society), скрининг может быть закончен женщинами после 75 лет, которые в течение последних 10 лет подряд имели 3 и более нормальных Рар-мазка.
Для определения наиболее рациональной частоты исследования мазков с ШМ необходимо основываться на данных изучения канцерогенеза и экономической эффективности скринингового обследования. Считается, что средний период прогрессии преинвазивного плоскоклеточного РШМ до I стадии составляет в среднем 4,2 года (по данным IARC, 5—8 лет), аденокарциномы in situ до железистого рака эндоцервикса I стадии — 7,2 года. Межскрининговый интервал, равный половине среднего периода прогрессии рака in situ в рак I стадии, обеспечивает диагностику рака все еще в преинвазивной стадии. Поэтому наиболее оптимальным и эффективным межскрининговым интервалом следует считать период 2—3 года.
Согласно российскому руководству по профилактике РШМ, цитологический скрининг необходимо начинать в возрасте 25 лет и осуществлять с интервалами в 3 года до 50 лет, а затем каждые 5 лет до возраста 65 лет.
1. Вакцинация против ВПЧ
На сегодняшний день существуют 2 вакцины против ВПЧ.
Вакцина Гардасил® представляет собой квадривалентную рекомбинантную (не содержит жизнеспособных вирусов) вакцину против ВПЧ 6, 11, 16 и 18 типов. Она вводится трехкратно, на протяжении полугода по схеме 0—2—6 месяцев. Минимальный допустимый интервал между первой и второй дозами вакцины составляет 4 недели, минимальный интервал между второй и третьей дозами — 12 недель. Поэтому допускается ускоренная схема вакцинации, при которой вторая доза вводится через 1 месяц после первой, а третья — через 3 месяца после второй прививки. При нарушении интервала между прививками курс вакцинации считается завершенным, если 3 дозы введены в течение 1 года.
Вакцина Гардасил® показана к применению детям и подросткам в возрасте от 9 до 17 лет и молодым женщинам в возрасте от 18 до 26 лет для предупреждения заболеваний, вызываемых ВПЧ-типами 6, 11, 16 и 18.
При оценке результатов вакцина показала высокую иммуногенность: 98% женщин были серопозитивны к ВПЧ 16,18 типов. Также была подтверждена высокая эффективность вакцины как против первичных случаев ПВИ (92%), так и против персистирующей инфекции (100%). Анализ результатов обоих этапов исследования показал 100%-ную эффективность вакцины против ЦИН I, вызванной ВПЧ типами 16 и 18, кроме того, вакцина предупреждала развитие неоплазий, вызванной 31 и 45 генотипами ВПЧ на протяжении 5,5 лет.
У всех женщин, получавших Церварикс®, антитела к ВПЧ 16 и 18 типов сохранялись более 6 лет.
Следует подчеркнуть, что вышеперечисленные вакцины не обеспечивают защитного действия в случае, если женщина уже инфицирована ВПЧ.
2. Патогенетическая профилактика РШМ
Патогенетическая профилактика проводится в том случае, если женщина уже инфицирована ВПЧ и у нее диагностирована дисплазия легкой и средней степени тяжести (CIN I — CIN I I). Именно на этом начальном этапе развития цервикального предрака инициируются, а затем все больше усиливаются процессы малигнизации вирус-инфицированных клеток.
В настоящее время для предупреждения развития рака шейки матки большой интерес у специалистов вызвало средство Промисан®.
В его состав входят индол-3-карбинол (I3C), эпигаллокатехин-3-галлат (EGCG) и минеральный премикс: Zn, I, Fe, Se, Mn, Cu. Доказано, что Промисан®, будучи нетоксичным, а следовательно, безопасным для здоровых органов и тканей, обладает множественной противоопухолевой активностью, воздействуя одновременно на несколько ключевых звеньев процесса канцерогенеза.
Уникальность Промисана® обусловлена его способностью блокировать молекулярные механизмы, приводящие к:
повышению инвазивной активности трансформированных клеток.
Прием 2 капсул Промисана® 2 раза в день в течение 6 месяцев приводит к регрессу ЦИН I—II степени тяжести.
Мы глубоко убеждены, что в скрининге и профилактике РШМ ведущая роль отводится принципам доказательной медицины, важным элементом которых является трансформация результатов клинических исследований и знаний врачей в повседневную практику.
Читайте также:

