Паразитарные инфекции у новорожденных
Обновлено: 19.04.2024
В чем заключаются трудности диагностики гельминтозов? Какова терапия гельминтозов? На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов
В чем заключаются трудности диагностики гельминтозов?
Какова терапия гельминтозов?
На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов (болезни адаптации), постоянного стресса, повышения уровня образованности и культуры населения многие давно известные заболевания человека изменили свою клиническую картину. Некоторые симптомы практически перестали встречаться, другие, наоборот, стали выходить на первый план. Это относится и к заболеваниям, вызываемым гельминтами, в частности, круглыми паразитическими червями (нематодами). В умеренном поясе наиболее широко распространенные нематоды — аскарида и острицы.
Гельминты могут вызывать нарушения функции желудочно-кишечного тракта (ЖКТ), быть причиной аллергических (или псевдоаллергических) реакций или усугублять их, вызывать интоксикацию, а также быть фактором, ослабляющим иммунитет [2]. В настоящее время редко встречаются случаи массивной инвазии, когда диагностика не вызывает затруднений, а клубки гельминтов вызывают обтурации кишечника, — значительно чаще гельминты стали являться причиной развития аллергических проблем. При этом гельминтозы относятся к тем заболеваниям, которые трудно диагностировать в связи с объективными и субъективными трудностями (длительные периоды отсутствия яйцекладки, возможность отсутствия среди паразитирующих особей самок, вероятность технических ошибок). Поэтому важно знать клиническую картину данных заболеваний, чтобы иметь возможность назначать углубленное обследование или эффективную терапию по совокупности косвенных признаков, даже не имея прямых доказательств наличия гельминтоза.
С целью оценить клиническую картину при нематодозах проанализированы жалобы, анамнез и результаты осмотра 150 детей, у которых были обнаружены аскариды (116 детей), острицы (27 детей), аскариды и острицы (7 детей). Гельминты выявлены стандартными методами: обнаружение яиц аскарид в фекалиях методом мазка или яиц остриц в соскобе на энтеробиоз, а также визуальное обнаружение аскарид или остриц в фекалиях, рвотных массах или при оперативном или эндоскопическом вмешательстве в брюшной полости или в области прямой кишки [3].
Среди детей было 67 мальчиков, 83 девочки. Распределение по возрасту представлено в табл. 1. Преобладали дети младшего дошкольного возраста (от одного до трех лет), их количество составило 63%. Именно в этом возрасте — наибольшие эпидемиологические предпосылки появления нематодозов.
У 150 детей с доказанными инвазиями аскаридами и/или острицами отмечались следующие клинические проявления.
У 107 детей (71,3%) были аллергические проблемы: кожные высыпания, диатез, атопический дерматит, нейродермит — у 99 (66%), из них у 18 эти проблемы носили периодический характер, у двух детей, кроме кожных высыпаний, отмечались конъюнктивиты; у десяти (6,7%) отмечалась доказанная пищевая аллергия на какие-то продукты с высоким уровнем специфических IgE в сыворотке крови; у шести детей (4%) отмечался астматический компонент или был установлен диагноз бронхиальная астма.
Бруксизм (скрежетание зубами) — симптом, который часто связывается с глистными инвазиями, но фактически является неспецифическим признаком интоксикации центральной нервной системы и может сопровождать любые хронические интоксикации — отмечался у 25 детей (16,7%).
Нарушения ночного сна отмечались у 81 ребенка (54%): беспокойство к вечеру, затруднения засыпания — у 15 детей (10%); беспокойный ночной сон (вскрикивания, постанывания, метания во сне, пробуждения, плач, бессонница, кошмарные сновидения) — у 76 (50,7%). Некоторые родители старших детей затруднялись охарактеризовать ночной сон ребенка, т. к. ребенок спит в другой комнате. Проблемы с засыпанием и ночным сном — важный симптом глистных инвазий, т. к. известно, что кишечные нематоды (в том числе аскариды и острицы) часто активизируются именно ночью.
У 54 детей (36%) отмечались зуд и/или покраснения в области заднего прохода (анальная эскориация) — у 43 детей (28,7%); зуд — у 38 (25,3%); оба симптома — у 27 (18%). Анальная эскориация и зуд считаются симптомами энтеробиоза (острицы), но при этом из 54 детей, у которых отмечались данные симптомы, энтеробиоз был доказан у 17 детей (31,5% от числа детей с этими симптомами). У других 37 детей (68,5% от числа детей с данными симптомами) было доказано наличие аскаридоза, но ни визуально, ни в анализах не были обнаружены острицы. Это может свидетельствовать либо о том, что в данных случаях присутствовали острицы, которые не были диагностированы, т. е. гельминтоз был смешанным, либо о том, что анальная эскориация и зуд — симптомы, характерные не только для энтеробиоза, но и аскаридоза.
У 29 детей (19,3%) отмечались признаки общего ослабления иммунитета: часто или длительно болеющие дети (по общепринятой классификации Monto J. et al., 87) — 18 детей (12%); рецидивирующие стоматиты, гингивиты отмечались у 13 детей (8,7%); кариес зубов — у шести (4%); рецидивирующие гнойные заболевания кожи или слизистых — у трех (2%).
У 15 детей (10%) имелись результаты исследования иммунного статуса по крови: у 13 детей было снижено количество Т-клеток; у всех 15 детей было снижено количество Т-хелперов, причем у шести из них — существенно; у 12 детей было снижено хелперно-супрессорное соотношение; у семи детей отмечалось снижение уровня IgA (секреторный иммуноглобулин), в том числе у трех — существенное, у остальных же восьми детей уровень IgA в сыворотке крови был либо нормальным, либо повышенным; у шести детей отмечалось снижение количества лимфоцитов, в том числе у одного ребенка была выраженная лимфо- и нейтропения. Эти результаты подтверждают известные данные о том, что аскариды и острицы угнетающе влияют на функции иммунитета, а также что у людей с ослабленным иммунитетом большая вероятность появления гельминтоза [1].
У большинства детей отмечалось более одного симптома. Обобщенные данные по клинической картине представлены в табл. 2.
Терапия во всех случаях состояла из двух этапов: сначала — антигельминтная терапия, причем назначались два разных препарата (декарис и вермокс) с интервалом три — пять дней между ними, чтобы максимально охватить различные стадии жизни гельминтов; через некоторое время после антигельминтной терапии — препараты для микробиологической и функциональной коррекции. Соответственно оценивались результаты противоглистной терапии, результаты всего лечения, а также катамнез в течение шести месяцев после терапии. В большинстве случаев улучшение наступало быстро в процессе лечения. У 36 детей только после антигельминтной терапии существенно уменьшились или полностью исчезли аллергические проявления, у 39 детей после первого этапа терапии нормализовалась работа ЖКТ, у 41 ребенка сразу прекратились боли в животе, по остальным симптомам также наступало улучшение после противоглистных препаратов. Это подтверждает то, что симптомы были вызваны наличием гельминтов.
У 92 детей после всего лечения не было никаких жалоб; о 37 нет данных об изменениях состояния в процессе и после лечения; у 16 детей эффект был неполным, т. е. какие-то симптомы сохранялись и после окончания лечения; у четырех детей эффект от терапии оказался нестойким, поскольку возникли рецидивы после окончания лечения; у трех детей эффекта от терапии не было.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Рассмотрены факторы риска паразитозов у детей, действие паразитов на организм ребенка, подходы к диагностике паразитарной инвазии и принципы комплексного лечения паразитозов с тем чтобы предотвратить дальнейшее развитие функциональных нарушений с формиров
Risk factors of parasitosis in children was considered, as well as the influence of parasites on a child's body, approaches to the diagnostics of parasitic invasions and principles of integrated treatment of parasitic diseases in order to prevent the further development of functional disorders of the formation of organic pathology.
.jpg)
Паразитарное заболевание — развитие болезненных симптомов в результате жизнедеятельности гельминта или простейших в организме человека [1]. Основной фактор выживания и распространения паразитов — их необычайно высокая репродуктивная способность, а также постоянно совершенствующиеся механизмы приспособления к обитанию в теле человека. К сожалению, настороженность медицинских работников в отношении паразитарных заболеваний у населения в настоящее время чрезвычайно низка, а профилактика гельминтозов сведена к лечению выявленных инвазированных пациентов [12, 13]. Вместе с тем многие исследователи отмечают связь широкой распространенности паразитозов у детского населения с развитием функциональной патологии органов пищеварения на фоне нарушений регуляции и высокий риск формирования хронических заболеваний даже при условии естественной санации ребенка с течением времени.
Самые распространенные и изученные заболевания — аскаридоз, энтеробиоз (рис. 1) и лямблиоз — регистрируются повсеместно. В России ежегодно выявляется более 2 млн больных нематодозами. При оценке территориального распределения лямблиоза по России установлено, что самый высокий средний уровень показателей заболеваемости в течение многих лет отмечен в Санкт-Петербурге, причем пораженность детей, посещающих детские учреждения, составляет 35% [2].
Каждый человек в течение жизни неоднократно переносит различные паразитарные заболевания [9]. В детском возрасте паразитозы встречаются чаще. У детей раннего возраста (до 5 лет) этому способствует широкая распространенность репродуктивного материала паразитов (цисты, яйца, личинки (рис. 2)) в окружающей среде и недостаточное развитие гигиенических навыков.
.jpg)
Значимость определенных факторов риска меняется в соответствии с возрастом ребенка. Доказано, что для детей младшего возраста более значимы санитарно-гигиенические условия проживания, а для подростков при сборе анамнеза необходимо уделить внимание социально-экономическим и географическим факторам (пребывание в лагере, туристическая поездка, наличие младшего брата или сестры) (рис. 3).
.jpg)
Транзиторное снижение противоинфекционного иммунитета как фактор риска возникновения паразитоза у детей регистрируется также в период реконвалесценции после вирусных заболеваний, вызываемых вирусами герпетической группы (цитомегаловирус, вирус простого герпеса I и II, вирус Эпштейна–Барр), может возникать в результате ятрогении (применение иммуносупрессивной терапии при аллергических и аутоиммунных заболеваниях). В настоящее время значимая доля детей находится в состоянии дезадаптации, которое также сопровождается снижением иммунной защиты.
Иммунную защиту желудочно-кишечного тракта (ЖКТ) ребенка можно условно разделить на специфическую и неспецифическую. К неспецифической защите относят комплекс условий нормального пищеварения: зрелость ферментативных систем, обеспечение кислотно-щелочного градиента в различных отделах ЖКТ, деятельность нормальной микрофлоры, адекватную моторику.
Отдельно необходимо отметить, что для такого заболевания, как лямблиоз, предрасполагающим фактором инвазии является нерегулярное и недостаточное отделение желчи в кишечник при аномалиях развития желчного пузыря (перетяжки, перегибы). Лямблиоз, выявленный у пациентов педиатрического отделения МОНИКИ, в 100% случаев сопровождался дисфункцией билиарного тракта.
.jpg)
У детей в восстановительном периоде после острых кишечных инфекций, после массивной антибиотикотерапии, а также у пациентов с хронической патологией органов пищеварения сопутствующие нарушения ферментного обеспечения, нормофлоры и моторики кишечника также делают ЖКТ более уязвимым для паразитов (рис. 4).
Специфическая защита слизистой оболочки органов пищеварения зависит от возраста ребенка и его зрелости. Механизм специфической иммунной защиты является одной из наиболее древних систем организма, так как гельминтозы сопровождают человечество в течение многих тысячелетий. Этот механизм представлен прежде всего эозинофилами крови и иммуноглобулином Е.
Классический развернутый антипаразитарный ответ может быть сформирован у ребенка не ранее достижения им 4 лет и тесно связан с качеством и количеством IgE, созревающего к этому возрасту. При контакте организма с паразитом в первую очередь выделяются медиаторы воспаления: интерлейкин, лейкотриен С4, D4, простагландины, тромбоксаны. Увеличивается количество лимфоцитов, продуцирующих IgM и IgG. В клиническом анализе крови отмечается рост уровня эозинофилов и базофилов, связанный с увеличением содержания этих клеток в тканях инвазированного органа. Встречаясь с личинками паразита, тканевые базофилы выделяют гепарин и гистамин, которые в сочетании с лейкотриенами и другими медиаторами воспаления вызывают общие проявления: зуд, реактивный отек, гиперемию, а также могут спровоцировать общие проявления: бронхоспазм, проявления крапивницы или диарею. Аллергическое воспаление при паразитозах развивается по классическому пути и призвано создать условия, приводящие к гибели и/или элиминации паразита [5].
Вместе с тем эозинофилы обладают выраженным цитотоксическим потенциалом, превышающим возможности других клеток крови, что объясняет первостепенное значение эозинофилов в антипаразитарных реакциях и их повреждающую роль при аллергии. Основное действие эозинофилы оказывают в барьерных тканях. В очаге инвазии они дегранулируют, оказывая гельминтотоксическое и цитотоксическое действие. Белки эозинофильных гранул (большой основной протеин, эозинофильная пероксидаза, эозинофильный катионный протеин, эозинофил-производный нейротоксин) токсичны не только для паразита, но и для клеток организма ребенка. Еще одной из важных причин системных и органных поражений, сопутствующих паразитозам, является образование иммунных комплексов [9, 10].
Действие паразитов на организм ребенка осуществляется с вовлечением многих систем. Практически все их виды могут вызывать сдвиг соотношения Th1/Th2 клеток в направлении, благоприятном для их выживания. Описаны случаи, когда продукты выделения паразита оказывали гормоноподобное действие на организм хозяина [5].
Местное влияние паразиты осуществляют, вызывая контактное воспаление слизистой оболочки и стимулируя вегетативные реакции. При этом нарушаются процессы кишечного всасывания, адекватная моторика ЖКТ и его микробиоценоз.
Системное влияние оказывается за счет использования паразитом энергетического и пластического потенциала пищи в ущерб организму ребенка, индукции аллергии и аутоиммунных процессов, целенаправленной иммуносупрессии и эндогенной интоксикации. Проведенными исследованиями показано, что аллергический синдром сопутствует аскаридозу и энтеробиозу в 71,3% случаев. Среди детей с атопическим дерматитом паразитозы выявляются у 69,1%, при этом лямблиоз из числа всех инвазий составляет 78,5% [4].
Особенно узнаваемую клиническую картину формирует токсокароз (рис. 5). Клиническими маркерами этой инвазии являются лейкемоидная реакция эозинофилов (от 20% и выше эозинофилов в формуле крови), сопровождающая ярко и упорно протекающий аллергический синдром в виде атопического дерматита с выраженным зудом и резистентностью к традиционной терапии или тяжелую бронхиальную астму с частыми приступами.
В 75,3% случаев паразитозы сопровождаются разнообразными функциональными нарушениями со стороны ЖКТ. Рядом работ доказано, что паразитарная инвазия способна вызывать нарушения углеводного обмена, а также дисахаридазную недостаточность за счет снижения уровня лактазы [7, 9].
У большинства детей нарушения адаптации являются одним из важных звеньев патогенетического процесса при паразитозе. Следует отметить, что состояние дезадаптации затрагивает в первую очередь лимфоцитарное звено иммуногенеза, что не может не сказываться на созревании и дифференцировке специфического иммунитета.
Диагностика паразитозов
До настоящего времени ведется поиск простого, доступного и надежного метода диагностики паразитозов. Разработанные методики прямого визуального обнаружения требуют минимальной экспозиции диагностического материала, многократных повторных исследований. Известные способы диагностики глистных инвазий и протозоозов, такие как метод толстого мазка фекалий по Като, метод формалин-эфирного осаждения, перианальный соскоб, микроскопия пузырной и печеночной желчи, имеют ряд недостатков, связанных как с особенностями развития паразита, так и с состоянием макроорганизма и его реактивностью.
Непрямые методы исследования (определение специфических антител) обладают недостаточной специфичностью и достоверностью. Известно, например, что, проходя сложный цикл развития от яйца до взрослого состояния, гельминты меняют свой антигенный состав. Антитела в организме хозяина вырабатываются в основном в ответ на поступление экскретов и секретов гельминта, тогда как в иммунодиагностических реакциях используются соматические антитела. Возникающая неспецифическая сенсибилизация организма, общность некоторых антигенов трематод, простейших и человека создают высокий удельный вес ложноположительных серологических реакций в титрах ниже достоверно диагностических. Таким образом, исследование методом иммуноферментного анализа (ИФА) на гельминты является высокочувствительным, но низкоспецифичным методом. Определение паразитов методом полимеразной цепной реакции (ПЦР) является высокоспецифичным и высокочувствительным методом, но из-за дороговизны и сложности не может быть скрининговым, когда, например, нужно обследовать группу детей из детского учреждения.
Не теряет своей актуальности клинический осмотр ребенка и внимательный учет косвенных признаков паразитоза. Важно отметить возможность течения паразитоза при аллергическом и астеническом синдроме, полилимфаденопатии неясного генеза, при нарушениях кишечного всасывания, углеводного обмена, при затяжном и хроническом течении болезней пищеварительного тракта, гепатоспленомегалии неясного генеза. Течение паразитарной инвазии имеет клинические особенности: обычно признаки поражения минимизированы, заболевание носит стертый характер, обострения полиморфны и неярки. Особенностью обострений заболеваний данной группы является их цикличность с периодом в 11–15 дней.
Косвенными лабораторными признаками паразитоза могут быть анемия, базофилия, эозинофилия, увеличение уровня аспартатаминотранферазы (АСТ).
Кроме того, признаки возможной паразитарной инвазии следует учитывать при оценке результатов инструментального исследования. При ультразвуковом исследовании органов брюшной полости у ребенка старше 3 лет косвенными признаками паразитоза являются гепатоспленомегалия, неравномерность паренхимы печени и селезенки за счет мелких гиперэхогенных сигналов, увеличенные лимфатические узлы в воротах селезенки.
Лечение гельминтозов
Лечение гельминтозов должно начинаться с применения специфических антигельминтных препаратов. Современный арсенал лекарственных средств, используемых для лечения кишечных паразитозов, включает значительное количество препаратов различных химических классов [11]. Они применяются как в клинической практике для лечения выявленных больных, так и с целью массовой профилактики.
Определяя препарат для специфической противопаразитарной терапии, следует понимать, что спектр действия этих препаратов не особенно широк. Практически все препараты этой группы применяются многие десятки лет и целесообразно предположить, что паразиты выработали системы приспособления и заболевание может быть резистентным к проводимой терапии. По данным Г. В. Кадочниковой (2004), эффективность такого традиционного препарата, как Декарис, в современных условиях не достигает 57%. Кроме того, эта группа противопаразитарных средств, к сожалению, имеет ряд побочных эффектов: тошноту, рвоту, абдоминальный синдром.
Таким образом, в современных условиях следует отдавать предпочтение более современным препаратам, которые, во-первых, являются универсальными для лечения как нематодозов, так и смешанных глистных инвазий и активны в отношении такого распространенного паразита, как лямблия. Во-вторых, использование одного противопаразитарного препарата, а не их комбинации, ощутимо снижает риск неприятных побочных эффектов. На сегодняшний день единственный представитель этой группы в нашей стране — альбендазол (Немозол).
Для лечения аскаридоза у детей старшего возраста или при рецидивировании заболевания в настоящее время под наблюдением врача может быть применен комбинированный прием антигельминтных средств (например, альбендазол в течение трех дней, затем — Вермокс в течение трех дней). Непременным условием успешной дегельминтизации больных энтеробиозом являются одновременное лечение всех членов семьи (коллектива) и строгое соблюдение гигиенического режима для исключения реинвазии. Следует отметить, что важное значение имеет ежедневная влажная уборка, так как были описаны казуистические случаи распространения репродуктивного материала остриц на частичках пыли на высоту до 1,5 метра.
В педиатрической клинике МОНИКИ разработаны принципы терапии паразитозов, учитывающие особенности патогенеза инвазии и позволяющие качественно и надежно вылечить данную группу заболеваний. Благодаря применению разработанной схемы терапии удается эффективно предотвратить реинвазию и развитие функциональных нарушений органов пищеварения у детей.
Принципы терапии больных паразитозами
1. Прием антипаразитарных препаратов проводится с учетом вида возбудителя инвазии.
Препараты, применяемые в лечениии аскаридоза:
- Вермокс (мебендазол) (для детей с 2 лет) — по 100 мг 2 раза в сутки в течение 3 дней;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении энтеробиоза:
- Вермокс (мебендазол) (для детей с 2 лет) — 100 мг однократно;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении лямблиоза:
- орнидазол 25–30 мг/кг (если масса тела больше 35 кг — 1000 мг) в два приема в течение 5 дней, 1 день — 1/2 дозы, повторный курс через 7 дней;
- Макмирор (нифурател) — по 15 мг/кг 2 раза в сутки в течение 7 дней;
- Немозол (альбендазол) — по 15 мг/кг однократно в течение 5–7 дней.
2. Лечение паразитоза предусматривает измененные в результате жизнедеятельности паразитов свойства пищеварительного тракта ребенка (функциональные нарушения органов пищеварения, ферментопатия, изменение микробиоценоза) и их коррекцию курсами ферментных препаратов и синбиотиков (табл. 1).
3. Обязательное применение энтеросорбентов и комплекса поливитаминов с микроэлементами (табл. 2 и 3).
Таким образом, разработанные в клинике педиатрии МОНИКИ принципы комплексной терапии паразитозов у детей предусматривают поэтапное восстановление функционального состояния ЖКТ, нарушенного в результате местного и системного влияния паразитов. Применение комплексной терапии позволяет предотвратить дальнейшее развитие функциональных нарушений с формированием органической патологии, а также избежать реинвазии.
Литература
Л. И. Васечкина 1 , кандидат медицинских наук
Т. К. Тюрина, кандидат медицинских наук
Л. П. Пелепец, кандидат биологических наук
А. В. Акинфиев, кандидат медицинских наук
Протозойные, паразитарные инфекции ЦНС у детей: причины, диагностика, лечение
За исключением токсоплазмоза и, в определенной степени, нейроцистицеркоза, протозойное и паразитарное поражение ликвора в развитых странах встречается редко. Малярия, однако, имеет повышенное значение из-за частых путешествий в зараженные страны и не всегда проводимой или неэффективной профилактике. В таблице ниже перечислены основные клинические особенности и доступное лечение некоторых протозойных и паразитарных заболеваний.

а) Малярия нервной системы у детей. По оценкам, не менее миллиона детей умирает от малярии только в Африке (Snow et al., 2005), и основной причиной смерти является поражение головного мозга, с пиком малярии мозга среди детей в возрасте между двумя и шестью годами. Малярию вызывают четыре разновидности рода Plasmodium-. Р. vivax, Р. falciparum, Р. malariae и Р. ovale, и тяжелым осложнением инвазии Р. falciparum является малярия мозга.
У детей данная патология определяется тремя критериями: расстройства сознания с неспособностью локализовать боль (по шкале комы Блантайра
Отличительными признаками при гистологическом исследовании являются капиллярный и венозный застой в мозге с эритроцитами, содержащими и не содержащими паразитов (MacPherson et al., 1985). Самым ранним признаком обычно является лихорадка, следующая за признаками расстройства дыхания (вторичным по отношению к метаболическому ацидозу и/или анемии), судороги и сниженный уровень сознания. Характерны двигательные расстройства и патологическая поза.
Типичные при любой форме малярии припадки могут быть генерализованными или очаговыми. Некоторые могут быть субклиническими. Они связаны с худшим исходом, особенно при продолжительности. Эпилептический статус возникает в 10-20% случаев. Гипогликемия отмечается у 30% пациентов и имеет тяжелое прогностическое значение (Molyneux et al., 1989).
Повышенное ВЧД наблюдается у большинства детей (Newton et al., 1991) с малярией мозга и считается связанным с повышением объема циркулирующей крови в мозге. Среди детей со значительно повышенным ВЧД имеется наибольший уровень смертности и более частое появление долговременных последствий.
В целом диагноз определяется анамнезом, клиническим исследованием и исследованием толстого и тонкого мазка крови. Результаты исследования ликвора обычно ничем не примечательны, а при наличии плеоцитоза более вероятным диагнозом становится менингит или энцефалит. Лечение необходимо начинать без определенных доказательств в сомнительных случаях у любых пациентов, которые в последние три месяца подвергались укусам или в течение последнего года получали профилактическое лечение (Newton и Warrell, 1998). Парентеральное назначение алкалоидов хины (хинин или хинидин в США) — основной метод лечения.
Все шире используются дериваты артемизинина (артесунат и артеметер); несмотря на более быстрое очищение крови от паразитов, они не продемонстрировали преимуществ по снижению летальных исходов по сравнению с алкалоидами хины. Их преимущество заключается в возможности ректального применения, хотя из-за обнаруженной при испытаниях на животных нейротоксичности их применение остается ограниченным. Рекомендуемая поддерживающая терапия включает жаропонижающие средства, мероприятия для устранения гиповолемии, антиконвульсанты для контроля за припадками, осмотические средства (например, маннитол) для снижения ВЧД, глюкозу при гипогликемии и переливание крови при определенных значениях анемии и, возможно, высокой периферической паразитемии (>10% пораженных эритроцитов).
В прошлом настоятельно рекомендовали применение кортикостероидов, но из-за отсутствия определенной патофизиологической основы они больше не используются. Другие вспомогательные средства, такие как десферриоксамин, малярийный гипериммунный глобулин, анти-TNFa и пентоксифиллин не показали очевидного преимущества, а некоторые из них наносили вред, поэтому до дальнейшего изучения они не должны использоваться (Warrell, 1999). Средний показатель смертности от церебральной малярии варьирует между 15% и 20% (Marsh et al., 1995, Idro и et al., 2005) с наличием остаточной инвалидности у 10-15% выживших. Некоторые последствия носят транзиторный характер, например атаксия, другие частично улучшаются через несколько месяцев (двигательные нарушения, такие как гемипарез и корковая слепота), но отдельные остаются, создавая проблемы (например, припадки). Кроме того, у многих выживших имеются незначительные когнитивные расстройства (Kihara et al., 2006).
б) Приобретенный токсоплазмоз. Инфекция Т. gondii обычно имеет легкое или бессимптомное течение, но в иммунодефицитном организме может поражать ЦНС и вызвать менингоэнцефалит, у новорожденных — энцефалит и хориоретинит, вследствие трансплацентарного инфицирования, хориоретинит в качестве первичной инфекции или внутричерепные новообразования у пациентов с ослабленным иммунитетом.

MPT: интрамуральные узелки одиночного цистицеркоза (слева, стрелка)
и множественные нейроцистицеркозные очаги (справа).
в) Нейроцистицеркоз. Нейроцистицеркоз (НЦЦ) наиболее распространенное гельминтозное заболевание ЦНС и основная проблема здравоохранения во многих развивающихся странах. Болезнь развивается в результате плохой санитарии, когда человек становится промежуточным хозяином в жизненном цикле Taenia solium, проглатывая яйца солитера. Инвазия инкапсулированной формой Т. solium может затем развиваться в пределах паренхимы мозга, базилярной цистерны или редко в спинном мозге, вызывая воспаление, отек и остаточную кальцификацию. Нейроцистицеркоз (НЦЦ) обычно проявляется у детей, когда цисты начинают отмирать и провоцировать воспаление. Среди признаков заболевания отмечают длительные очаговые/генерализованные припадки или иногда признаки повышенного внутричерепного давления, вторичного по отношению к цистицеркозному энцефалиту или гидроцефалии, вызванных кистевидными цистицерками в базилярной цистерне или желудочковой системе.
Диагностическим критерием служит выявление при сканировании мозга одиночного кольцевидного поражения с окружающим отеком или при обнаружении множественных поражений, некоторые из которых кальцифицированны. На МРТ можно обнаружить головку червя. Дифференциальная диагностика одиночных поражений от других единичных гранулем, таких как туберкулема, без биопсии затруднительна. Полезным может быть определение сывороточных антител против цистицерка, хотя в эндемичных районах исследование может привести к высокому уровню ложно-положительных результатов. Del Brutto et al. (2001) разработали набор диагностических критериев для помощи в установлении НЦЦ. Лечение альбендазолом (15 мг/кг/сут. в течение 8 дней) доказало свою эффективность, с добавлением стероидов в тяжелых случаях инвазии или при развитии побочных эффектов от лечения. Поскольку большинство пациентов обращается за медицинской помощью в результате отмирания цист, лечение уже не рекомендовалось; однако недавние исследования показали, что при использовании альбендазола уменьшается долговременный риск развития припадков (Garcia et al., 2004).
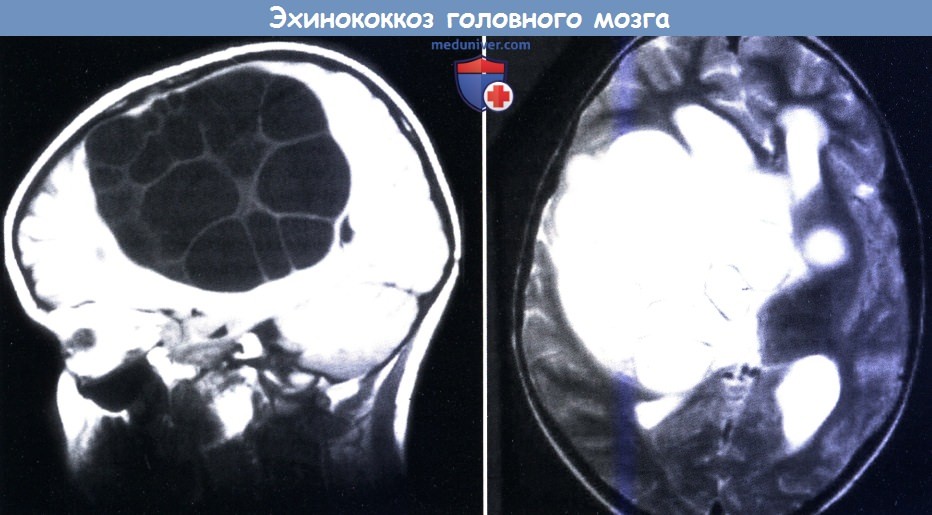
Гидатидный эхинококкоз. МРТ в Т1-режиме (слева) и Т2 (справа):
множественные кистозные повреждения после Echinococcus granulosus.
г) Эхинококкоз нервной системы. Инвазия человека солитером собаки, Echinococcus, называемая также эхинококкозом и распространенная в странах, где разводят овец. Человек заражается при заглатывании яиц, выделяемых собаками (окончательный хозяин). Echinococcus granulosus вызывает кистозный эхинококкоз, и в основном вызывает кисты в печени и легких, хотя в 5% случаев кисты развиваются и в ЦНС. Поскольку пузыри растут медленно, зачастую они остаются бессимптомными до тех пор, пока не достигнут значительных размеров. Клинические проявления в основном связаны с признаками и симптомами внутричерепной гипертензии, тогда как очаговый неврологический дефицит возникает редко.
На КТ и МРТ определяются округлые или овальные кисты с ровными контурами и содержимым, имеющим плотность ликвора. Может выявляться смещение срединных структур и желудочковая деформация (Tuzun et al., 2002). В диагностике можно использовать ИФА или РИГА (непрямая гемагглютинация) с эхинококковым антигеном. Предпочтительным лечением является осторожное хирургическое удаление, чтобы предотвратить разрыв стенки кисты. При больших повреждениях предопреционное лечение альбендазолом, видимо, улучшает исход (Altinors et al., 2000).
д) Эозинофильный менингит. Наиболее частой причиной эозинофильного менингита рассматривают паразитарное или протозойное заболевание; однако высокая доля эозинофилов (>4%) может также наблюдаться в случаях инфекционного или постинфекционного менингита, вторичного по отношению к грибковой, риккетсиозной, микоплазмозной или трепонемной инфекции, подострому склерозирующему панэнцефалиту и лимфоцитарному хориоменингиту. Эозинофилия в ликворе может также быть связана с неинфекционными расстройствами, такими как болезнь Ходжкина, рассеянный склероз, лейкемия, субарахноидальное кровоизлияние и реакция на интратекальное введение антибиотиков (Weller, 1993).
Читайте также:

