Паразиты похожие на кунжутные семечки
Обновлено: 18.04.2024
Синдром недостаточности пищеварения или синдром мальдигестии не является редким явлением в современном мире. Одной из главных причин нарушения пищеварения принято считать недостаточную выработку пищевых ферментов, которые расщепляют компоненты пищи. Это состояние сопровождается выраженными клиническими проявлениями, которые заставляют человека обратиться за медицинской помощью.
Характеристики состояния
Синдром мальдигестии обусловлен функциональной недостаточностью поджелудочной железы, желудка или кишечника. Независимо от степени вовлеченности одного из органов пищеварительной системы, данное состояние приводит к нарушению процесса всасывания нутриентов, включая витамины и минералы. За короткий промежуток времени, расстройства пищеварения вызывают потерю массы тела, ухудшение состояния кожи и волос, негативно отражается на иммунитете человека, и провоцирует обострение любых хронических заболеваний.
Кроме того, остатки непереваренной пищи (химус) являются благоприятной средой для размножения болезнетворных организмов, с последующим развитием тяжелого кишечного дисбактериоза и аллергических реакций.
Несмотря на то, что существует отдельная (инволютная) форма мальдигестии, связанная с возрастными изменениями в организме пожилых людей, чаще всего с этим состоянием сталкиваются люди молодого и среднего возраста.
Причины развития
Одной из главных причин развития данного состояния является нарушение работы желудка или кишечника, а также поджелудочной железы с уменьшением продукции пищеварительных ферментов. К другим потенциальным факторам развития синдрома недостаточности пищеварения, можно отнести:
Нарушение процесса желчеобразования и желчевыделения.
- Замедление кишечной перистальтики.
- Дисбактериоз кишечника.
- Эндокринные патологии.
Синдром недостаточности пищеварения условно делится на полостную, пристеночную и внутриклеточную мальдигестию. Полостная мальдигестия развивается при таких состояниях, как муковисцидоз, хроническое воспаление поджелудочной железы, а также после операций на данном органе. Снижение функциональности ферментов, ответственных за расщепление компонентов пищи, наблюдается при хроническом гастрите. Кроме того, развитию мальдигестии способствует язва желудка и синдром раздраженного кишечника, при котором наблюдается нарушение транзита химуса. Пристеночное пищеварение нарушается в том случае, если наблюдается повреждение клеток эпителия кишечника (энтероцитов). Повреждение эпителия кишечника наблюдается при целиакии, болезни Крона, а также при энтеритах различной этиологии.
Непереваренные остатки пищи, которые остаются длительное время в просвете кишечника провоцируют не только развитие дисбактериоза, но и приводят к образованию токсических компонентов (скатол, аммиак, индол), которые оказывают местнораздражающий эфеект и повреждают слизистую оболочку кишечника.
Клинические симптомы
Распознать расстройства кишечника при мальдигестии можно по таким характерным клиническим признакам:
-
(метеоризм).
- Расстройства стула (диарея).
- Урчание в животе.
- Боль в околопупочной области.
- Тошнота.
- Отрыжка с неприятным запахом.
Кроме того, для мальдигестии характерны такие симптомы, как общая слабость, частичная или полная утрата аппетита, а также снижение массы тела. У пациентов с мальдигестией наблюдается увеличение объема испражнений, при этом меняется их цвет и запах. В испражнениях наблюдается маслянистые включения (стеаторея). Синдром недостаточности пищеварения очень часто протекает в комбинации с непереносимостью лактозы (молочного сахара) или других пищевых компонентов.
При тяжелом течении, у пациентов с синдромом мальдигестией резко ухудшается общее состояние, нарушается процесс всасывания биологически-значимых компонентов и развивается мальабсорбция. На фоне данного состояния снижается масса тела, у женщин могут пропадать менструации, наблюдается ухудшение состояния кожи, волос и ногтей.
Лечение
Одним из главных условий правильного и результативного лечения мальдигестии является коррекция рациона. Из ежедневного меню исключают те продукты, которые плохо переносятся организмом. Питание усиливают продуктами, богатыми белком, углеводами и микроэлементами, при этом жиры урезают до минимума. Также, из меню исключают сырые фрукты и овощи. Стандартная терапия синдрома недостаточности пищеварения включает приём медикаментов, содержащих пищеварительные ферменты. Перестальтика кишечника восстанавливается с помощью приёма медикаментов из группы регуляторов моторики.
Для восстановления структурно-функционального состояния ЖКТ при мальдигестии и лечения дисбактериоза целесообразно использовать метапребиотики, которые бережно и эффективно нормализуют баланс кишечной и желудочной микрофлоры, подавляют рост и развитие болезнетворных микроорганизмов, а также восстанавливает поврежденный эпителий желудочно- кишечного тракта. Метапребиотик Стимбифид Плюс содержит фруктополисахариды и фруктоолигосахариды, которые являются ценным питательным субстратом для кишечной и желудочной микробиоты. Кроме того, Стимбифид Плюс дополнен лактатом кальция, стимулирующим рост и размножение полезных кишечных бактерий.
Комбинация из перечисленных компонентов позволяет добиться эффекта быстрого, безопасного и полного восстановления пищеварительной системы, пострадавшей от мальдигестии. Рациональное питание и приём метапребиотика Стимбифид плюс с профилактической целью, позволит избежать дисбиоза кишечника, расстройств пищеварительной деятельности и тяжелых осложнений, развивающихся на фоне синдрома недостаточности пищеварения. Метапребиотик может быть использован в любом возрасте.
Что такое тениоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Тениоз (Taeniosis) — паразитарное заболевание человека, вызываемое половозрелой стадией ленточного гельминта (свиного цепня), который проникает в организм человека при употреблении плохо приготовленного мяса, паразитирует в тонком кишечнике и вызывает расстройства пищеварения. В некоторых случаях может осложняться цистицеркозом — паразитированием в тканях организма личинок свиного цепня, что приводит к серьёзным последствиям и даже смерти.
Возбудитель
- домен — эукариоты;
- царство — животные;
- тип — плоские черви;
- класс — ленточные черви;
- отряд — циклофиллиды;
- семейство — тенииды;
- род — Taenia;
- вид — свиной цепень (Taenia solium).
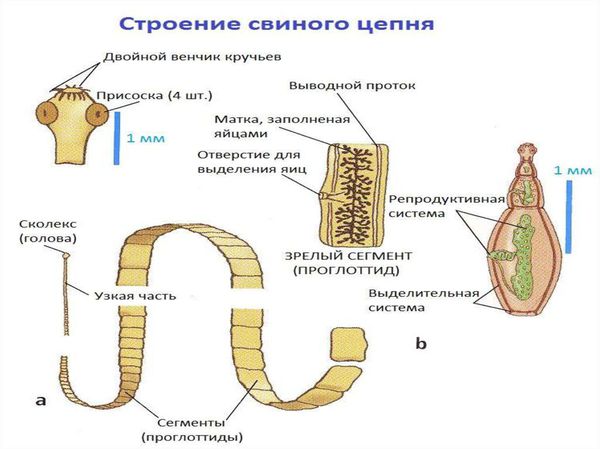
Свиной цепень (устаревшее название "cолитёр") — это плоский (ленточный) паразитический червь, длина которого в кишечнике человека достигает 3 метров, а по данным Ц ентра по контролю и профилактике заболеваний США (CDC) его длина может достигать 7 метров. Как правило, паразитирует только 1 червь. Паразит имеет головку, шейку и тело. Тело червя (стробила) состоит из члеников (п роглоттидов), их число может достигать 1000 . Головка (сколекс) размерами до 2 мм в диаметре имеет хоботок и 4 мышечные присоски (органы прикрепления), расположенные крестообразно. На хоботке есть крючья в количестве от 22 до 32, из-за этого есть второе название паразита — вооружённый цепень.
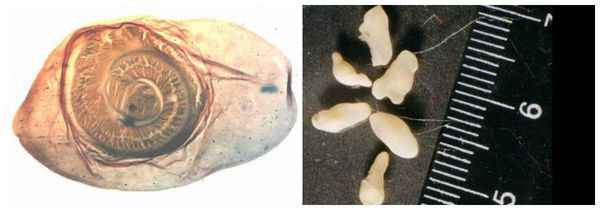
Яйца паразита попадают с калом человека в окружающую среду. Животные (свиньи, собаки, кошки и даже человек при несоблюдении гигиены) поедают яйца, зародыши проходят через кишечную стенку и разносятся кровью по всему организму, после чего оседают в тканях (в основном в соединительной ткани между мышцами). Через пару месяцев яйца превращаются в финны (цистицерки), которые живут до 5 лет, после чего они погибают и обызвествляются (накапливают минеральные вещества, соли кальция). Цистицерки имеют вид полупрозрачных беловатых пузырьков диаметром до 1,5 см, внутри видна мелкая сформированная головка.
Для полноценного развития свиного цепня необходима смена хозяев за его жизнь. Человек является окончательным хозяином. В его кишечнике паразитирует взрослый гельминт, который развивается за 2 месяца из финны (личинки червя в тканях), съеденной с мясом. Паразит прикрепляется к стенке тонкого кишечника и растёт, поглощая пищу и постепенно наращивая членики (от шейки), которые по мере созревания отрываются и выходят в окружающую среду при дефекации. Паразит может жить в кишечнике десятки лет.
Человек может стать и промежуточным хозяином (при поедании яиц). В этом случае для паразита наступит "экологический тупик" — он не сможет развиться до половозрелой стадии и продолжить свой род, потому что мясо человека с финнами никто не ест.
Яйца выживают в окружающей среде в течение нескольких месяцев в зависимости от условий. Высыхание могут выдерживать в течение 10 месяцев, способны зимовать под снегом, в воде живут до 4 месяцев. При кипячении погибают практически мгновенно, при 65 °С сохраняют жизнеспособность в течение 3 минут, при 20-25 °С под воздействием прямых солнечных лучей сохраняются до 2 дней, если они закрыты травой — до полутора месяцев. Раствор хлорной извести 10-20 % убивает яйца за 5-6 часов. Цистицерки в мясе погибают при его замораживании при температуре -12 °С и поддержании в толще мяса температуры не ниже -10 °С в течение 10 дней [1] [2] [9] [10] .
Эпидемиология
Тениоз является одним из древнейших известных заболеваний. Первые упоминания встречаются ещё в 16 веке до нашей эры (Древний Египет), имеются записи Аристотеля и Гиппократа (финноз свиней). В настоящее время ВОЗ относит тениоз и цистицеркоз к группе забытых ("пренебрегаемых") болезней, т. е. тех, о которых мало говорят и обращают внимание развитые страны.
Распространение повсеместное, но наиболее поражены отдельные регионы: Индия, Африка, Южная Америка, Азия, Северный Китай, Восточная Европа, Белоруссия, Украина. Это регионы, где уровень дохода низкий или ниже среднего, где люди едят много плохо приготовленной свинины и недостаточно соблюдается гигиена. Здесь цистицеркоз является причиной эпилепсии в 30 % случаев, а в некоторых областях, где свиньи и люди живут вместе — до 70 %, по данным ВОЗ [3] . В РФ в среднем выявляется до 500 случаев в год [11] . Есть тенденция к повышенной заболеваемости сельских жителей и работников свиноводческих хозяйств.
Механизм передачи фекально-оральный, путь заражения пищевой. Источник инфекции и окончательный хозяин — заражённый человек, выделяющий с фекалиями яйца гельминта. Промежуточные хозяева — иногда человек, но чаще животные, которые поедают корм, загрязнённый фекалиями человека: свиньи (отсюда происходит название вида), кабаны, обезьяны, собаки, кошки.
Факторы передачи:
- При тениозе — недостаточно термически обработанное мясо свиней или диких кабанов. Наиболее опасно мясо, не прошедшее ветеринарный контроль. В этом случае человек заражается, поедая финны, т. е. зародыши червя, с инфицированным мясом.

- При цистицеркозе — загрязнённые яйцами пища и объекты внешней среды при несоблюдении людьми правил гигиены. Фактором передачи также может быть аутоинвазия, когда у человека с паразитом в кишечнике из-за нарушения перистальтики ЖКТ яйца из кишечника попадают в желудок. Т. е. яйца свиного цепня заразны и опасны для человека сразу, как только покидают организм с каловыми массами. Поэтому риск заражения цистицеркозом есть для любого человека, особенно если пренебрегать правилами гигиены и правилами обработки пищевых продуктов (тщательное мытьё) [1][3][5][7][11] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы тениоза
Множество случаев заражения и болезни проходит бессимптомно или малосимптомно. Жалобы таких больных обычно незначительны и связаны в основном с расстройствами пищеварения. Примерно через 1-1,5 месяца от момента заражения (а может и раньше) может наблюдаться лёгкое недомогание, головокружение, слабость, нарушения сна, умеренные головные боли, раздражительность, сниженный или повышенный аппетит, тошнота, дискомфорт и несильные боли в разных отделах живота. Развиваются запоры, чередующиеся с диареей, возможен анальный зуд, больной может умеренно худеть.
Характерной особенностью является периодическое (раз в несколько месяцев) выделение с калом оторвавшихся члеников паразита начиная с 2-3 месяцев паразитирования и так десятки лет. Их хорошо видно невооружённым глазом. Могут быть симптомы гипохромной анемии (недостатка железа): бледность кожи и слизистых, быстрая утомляемость при физической нагрузке, шум в ушах, обмороки, чувство мурашек по коже. Развивается гиповитаминоз В1 (тёмно-красный сухой язык со сглаженными сосочками). В результате отравления организма продуктами жизнедеятельности паразита, а также из-за расстройства пищеварения повышается склонность к необъяснимым высыпаниям токсико-аллергического характера на коже.
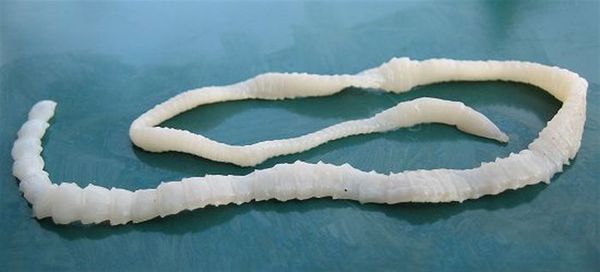
Тениоз у беременных
У беременных заболевание может протекать более тяжело, что обусловлено характерными физиологическими процессами в организме женщины этого периода. Наиболее часто наблюдаются расстройства пищеварения (запоры, диарея), тошнота, рвота, снижение гемоглобина, зуд кожи, перианальный зуд. Может быть плохой набор веса у плода. Вследствие более частого нарушения желудочно-кишечной перистальтики (моторики) повышается риск заброса яиц паразита в желудок и развития цистицеркоза [1] [4] [6] [10] .
Патогенез тениоза
Во время паразитирования свиной цепень повреждает слизистую при помощи крючьев и присосок, что вызывает расстройство пищеварения и нарушает моторику кишечника. Кроме того, гельминт потребляет много важных для человека питательных веществ, микроэлементов и отравляет организм продуктами своей жизнедеятельности, что приводит к токсико-аллергическому отравлению.
При заглатывании яиц паразита извне или при рефлюксной болезни, когда нарушается моторика кишечника и яйца из кишки попадают в желудок, развивается цистицеркоз. В различных органах и тканях развиваются соединительнотканные капсулы, содержащие зародыш — цистицерк. Вокруг наблюдаются воспалительные изменения в виде аллергической реакции и дистрофически-атрофические изменения из-за механического давления на окружающую ткань.
При локализации в головном мозге вокруг капсулы наблюдается воспаление мелких сосудов и инфильтрация окружающей ткани плазматическими клетками, что вызывает расстройство движения спинномозговой жидкости (ликвора), отёк мозговой ткани, развитие менингита и энцефалита. При паразитировании в оболочках мозга у его основания возможно развитие рацемозной (ветвистой) формы цистицеркоза до 25 см в длину.
С течением времени (до 5 лет) цистицерк претерпевает дегенеративные изменения — происходит его набухание и разложение (расплавление), что сопровождается усилением токсического и местного воспалительного воздействия. Исходом гибели личиночной формы паразита является кальцификация и местное рубцевание. Специфичных симптомов при этом процессе нет, после полной гибели цистицерков болезнь заканчивается, если, они не находятся в жизненно важных органах [1] [5] [6] [9] .
Классификация и стадии развития тениоза
По Международной классификации болезней 10-го пересмотра (МКБ 10):
- Тениоз:
- B68.0 Инвазия, вызванная Taenia solium.
- B68.9 Тениоз неуточнённый (при подозрении на болезнь, но отсутствии лабораторного подтверждения).
- Цистицеркоз:
- B69.0 Цистицеркоз центральной нервной системы (судороги, эпилепсия, необъяснимая рвота).
- B69.1 Цистицеркоз глаза (нарушения зрения, слепота).
- B69.8 Цистицеркоз других локализаций.
- B69.9 Цистицеркоз неуточнённый [1][2] .
Осложнения тениоза
Острый аппендицит. В правой половине живота снизу постепенно нарастают боли, появляется тошнота, характерен субфебрилитет (температура тела от 37,1 до 38,0 °С). В анализе крови наблюдается нейтрофильный лейкоцитоз со сдвигом влево — повышенный уровень нейтрофилов с преобладанием незрелых форм, которые не могут в полной мере осуществлять защитную функцию.
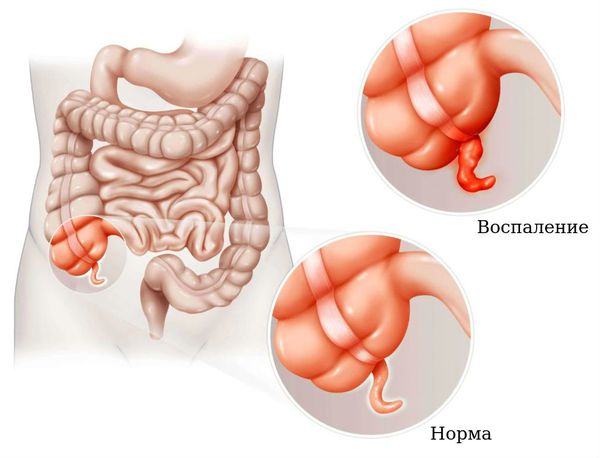
Панкреатит ( воспаление поджелудочной железы) . Характеризуется тошнотой, рвотой, опоясывающими болями в животе.
Кишечная непроходимость. Симптомы — с хваткообразные боли в животе без связи с приёмом пищи, запоры, метеоризм, вздутый живот, учащение пульса, рвота, бледность кожи.
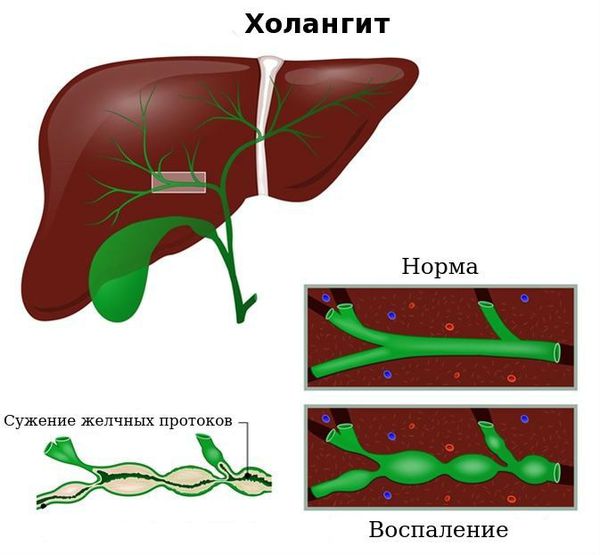
Холангит ( воспаление жёлчных протоков) . Субфебрильная или фебрильная лихорадка, выраженные боли в правом подреберье, озноб, повышенная потливость, тошнота и рвота, желтуха и кожный зуд.
Гипохромная анемия. Бледность кожи и слизистых оболочек, повышенная утомляемость, чувство мурашек и покалывания, головокружения, шум в ушах, обмороки.
Цистицеркоз. Может быть осложнением тениоза, а может быть отдельным заболеванием. В основном симптоматика проявляется при поражении центральной нервной системы (ЦНС) — головного и спинного мозга и глаз. В зависимости от локализации возникают головные боли различной интенсивности, рвота, эпилептические припадки, нарушения речи, расстройства личности, бред и галлюцинации, деменция. При поражении глаз могут наблюдаться воспалительно-дистрофические процессы в различных отделах глаз — рецидивирующие конъюнктивиты, увеиты, отслоение сетчатки, атрофия глазного яблока, что может привести к слепоте. При поражении сердца могут возникать нарушения ритма. При поражении мышц и подкожной клетчатки иногда может наблюдаться некоторая болезненность при ощупывании и приподнятость этого участка в виде подкожного плотного опухолевидного бугорка [1] [5] [5] [8] .
Диагностика тениоза
Тениоз или цистицеркоз может быть заподозрен на основании следующих признаков:
- эпиданамнез — проживание на территории развитого свиноводства, употребление плохо приготовленной свинины, низкий социально-экономический уровень страны или региона;
- расстройства пищеварения;
- астено-невротические проявления — слабость, повышенная утомляемость, эмоциональная нестабильность, раздражительность, повышенная потливость;
- выход с калом неподвижных члеников паразита;
- развитие неврологической симптоматики (эпилепсия), патологии органов зрения.
Дифференциальная диагностика
Основывается на данных анамнеза, типичном виде члеников паразита и их микроскопическом исследовании.
Лабораторная диагностика
Клинический анализ крови — изменений может не быть, иногда наблюдаются гипохромная анемия, умеренное повышение эозинофилов, повышение скорости оседания эритроцитов (СОЭ), редко выявляется небольшое повышение лейкоцитов за счёт сегментоядерных клеток (наиболее большой группы иммунных клеток).
Общий анализ мочи — как правило, без отклонений.
Биохимический анализ крови — возможны отклонения при развитии осложнений:
- При холангитах — повышение маркеров нарушения выработки или оттока желчи: АСТ, ГГТ, ЩФ, общего билирубина.
- При панкреатитах — повышение амилазы.
- При поражении сердца — повышение ЛГД и КФК-МВ.
Серологические специфические исследования:
- Иммуноферментный анализ (ИФА) антител IgG — в основном применяются с целью диагностики внекишечного поражения — цистицеркоза, результаты могут быть ложноположительными;
- Иммунный блоттинг — более точный метод лабораторного исследования сыворотки крови на присутствие антител , который применяют для подтверждения результатов ИФА. Этот метод позволяет снизить число ложных результатов, но в РФ он недоступен.
ПЦР кала — выявление антигенов свиного цепня. Это достаточно чувствительный метод, однако может дать ложноотрицательный результат ввиду ограниченного количества материала в кале.
Копроовоскопия — микроскопическое изучение кала с целью обнаружения яиц и зрелых члеников паразита. По яйцам невозможно установить точный диагноз, т. к. они очень похожи на яйца других представителей этого рода, проводится не менее трёх раз в разные дни. Для определения вида паразита необходимо исследование члеников.
Инструментальная диагностика
Компьютерная (КТ) и магнитно-резонансная томография (МРТ), ультразвуковое исследование (УЗИ), прямая офтальмоскопия — применяются для выявления цистицеркоза. КТ лучше выявляет кальцификаты цистицерков (особенно небольшие). МРТ больше подходит для обнаружения цистицерков в некоторых трудновизуализируемых местах мозга, также МРТ указывает на местные окружающие изменения (отёк) и возможную гибель паразита.
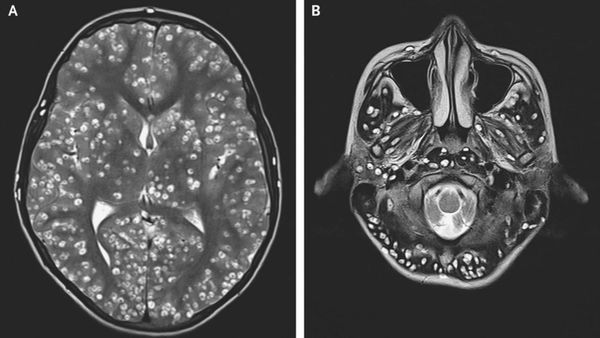
Исследования спинномозговой жидкости при поражении цистицерками ЦНС (лимфоцитарный плеоцитоз, увеличение уровня эозинофилов, белка).
Биопсия — морфологическое исследование биоптатов при оперативном вмешательстве [1] [3] [6] [10] .
Лечение тениоза
Госпитализации подлежат больные с тяжёлыми сопутствующими заболеваниями, а также больные с цистицеркозом ЦНС и глаз. Остальные больные могут лечиться амбулаторно.
В качестве этиотропной терапии (направленной на уничтожение возбудителя) применяется Празиквантел и Никлозамид. Есть данные об эффективности Альбеназола, но они ограничены. Продолжительность лечения — 3 дня.
При лечении цистицеркоза выбор способа уничтожения паразита зависит от его локализации и количества. При локализации под кожей и в тканях (кроме ЦНС и глаз) лечение, как правило, не проводят, так как риск последствий от приёма препарата выше пользы от лечения. Однако, если наличие паразита ведёт к каким-то физическим и эстетическим недостаткам, лечение назначается.
При локализации цистицерков в ЦНС и глазах лечение проводят только в условиях неврологического стационара, применяются Празиквантел и Альбендазол в сочетании с глюкокортикостероидами (т. к. есть риск местного воспаления и повреждения нервной системы и глаз).
В качестве мер патогенетической и симптоматической терапии при тениозе могут назначаться средства нормализации моторики кишечника (прокинетики) и микрофлоры кишечника (пре- и пробиотики).
При цистицеркозе головного мозга применяют противосудорожные препараты.
Возможно хирургическое лечение (удаление цистицерков при поражении головного и спинного мозга).
Контроль излеченности тениоза:
- визуальный — осмотры кала (о выздоровлении говорит отсутствие периодического отделения члеников червя);
- 4 отрицательных анализа кала на яйца гельминтов с интервалом в 1 месяц [2][4][5][8] .
Прогноз. Профилактика
При изолированном тениозе прогноз благоприятный. При развитии осложнений, особенно цистицеркозе ЦНС и глаз, прогноз серьёзный: возможно развитие тяжёлых стойких поражений (эпилепсия, слепота) и летальный исход.
В чем заключаются трудности диагностики гельминтозов? Какова терапия гельминтозов? На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов
В чем заключаются трудности диагностики гельминтозов?
Какова терапия гельминтозов?
На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов (болезни адаптации), постоянного стресса, повышения уровня образованности и культуры населения многие давно известные заболевания человека изменили свою клиническую картину. Некоторые симптомы практически перестали встречаться, другие, наоборот, стали выходить на первый план. Это относится и к заболеваниям, вызываемым гельминтами, в частности, круглыми паразитическими червями (нематодами). В умеренном поясе наиболее широко распространенные нематоды — аскарида и острицы.
Гельминты могут вызывать нарушения функции желудочно-кишечного тракта (ЖКТ), быть причиной аллергических (или псевдоаллергических) реакций или усугублять их, вызывать интоксикацию, а также быть фактором, ослабляющим иммунитет [2]. В настоящее время редко встречаются случаи массивной инвазии, когда диагностика не вызывает затруднений, а клубки гельминтов вызывают обтурации кишечника, — значительно чаще гельминты стали являться причиной развития аллергических проблем. При этом гельминтозы относятся к тем заболеваниям, которые трудно диагностировать в связи с объективными и субъективными трудностями (длительные периоды отсутствия яйцекладки, возможность отсутствия среди паразитирующих особей самок, вероятность технических ошибок). Поэтому важно знать клиническую картину данных заболеваний, чтобы иметь возможность назначать углубленное обследование или эффективную терапию по совокупности косвенных признаков, даже не имея прямых доказательств наличия гельминтоза.
С целью оценить клиническую картину при нематодозах проанализированы жалобы, анамнез и результаты осмотра 150 детей, у которых были обнаружены аскариды (116 детей), острицы (27 детей), аскариды и острицы (7 детей). Гельминты выявлены стандартными методами: обнаружение яиц аскарид в фекалиях методом мазка или яиц остриц в соскобе на энтеробиоз, а также визуальное обнаружение аскарид или остриц в фекалиях, рвотных массах или при оперативном или эндоскопическом вмешательстве в брюшной полости или в области прямой кишки [3].
Среди детей было 67 мальчиков, 83 девочки. Распределение по возрасту представлено в табл. 1. Преобладали дети младшего дошкольного возраста (от одного до трех лет), их количество составило 63%. Именно в этом возрасте — наибольшие эпидемиологические предпосылки появления нематодозов.
У 150 детей с доказанными инвазиями аскаридами и/или острицами отмечались следующие клинические проявления.
У 107 детей (71,3%) были аллергические проблемы: кожные высыпания, диатез, атопический дерматит, нейродермит — у 99 (66%), из них у 18 эти проблемы носили периодический характер, у двух детей, кроме кожных высыпаний, отмечались конъюнктивиты; у десяти (6,7%) отмечалась доказанная пищевая аллергия на какие-то продукты с высоким уровнем специфических IgE в сыворотке крови; у шести детей (4%) отмечался астматический компонент или был установлен диагноз бронхиальная астма.
Бруксизм (скрежетание зубами) — симптом, который часто связывается с глистными инвазиями, но фактически является неспецифическим признаком интоксикации центральной нервной системы и может сопровождать любые хронические интоксикации — отмечался у 25 детей (16,7%).
Нарушения ночного сна отмечались у 81 ребенка (54%): беспокойство к вечеру, затруднения засыпания — у 15 детей (10%); беспокойный ночной сон (вскрикивания, постанывания, метания во сне, пробуждения, плач, бессонница, кошмарные сновидения) — у 76 (50,7%). Некоторые родители старших детей затруднялись охарактеризовать ночной сон ребенка, т. к. ребенок спит в другой комнате. Проблемы с засыпанием и ночным сном — важный симптом глистных инвазий, т. к. известно, что кишечные нематоды (в том числе аскариды и острицы) часто активизируются именно ночью.
У 54 детей (36%) отмечались зуд и/или покраснения в области заднего прохода (анальная эскориация) — у 43 детей (28,7%); зуд — у 38 (25,3%); оба симптома — у 27 (18%). Анальная эскориация и зуд считаются симптомами энтеробиоза (острицы), но при этом из 54 детей, у которых отмечались данные симптомы, энтеробиоз был доказан у 17 детей (31,5% от числа детей с этими симптомами). У других 37 детей (68,5% от числа детей с данными симптомами) было доказано наличие аскаридоза, но ни визуально, ни в анализах не были обнаружены острицы. Это может свидетельствовать либо о том, что в данных случаях присутствовали острицы, которые не были диагностированы, т. е. гельминтоз был смешанным, либо о том, что анальная эскориация и зуд — симптомы, характерные не только для энтеробиоза, но и аскаридоза.
У 29 детей (19,3%) отмечались признаки общего ослабления иммунитета: часто или длительно болеющие дети (по общепринятой классификации Monto J. et al., 87) — 18 детей (12%); рецидивирующие стоматиты, гингивиты отмечались у 13 детей (8,7%); кариес зубов — у шести (4%); рецидивирующие гнойные заболевания кожи или слизистых — у трех (2%).
У 15 детей (10%) имелись результаты исследования иммунного статуса по крови: у 13 детей было снижено количество Т-клеток; у всех 15 детей было снижено количество Т-хелперов, причем у шести из них — существенно; у 12 детей было снижено хелперно-супрессорное соотношение; у семи детей отмечалось снижение уровня IgA (секреторный иммуноглобулин), в том числе у трех — существенное, у остальных же восьми детей уровень IgA в сыворотке крови был либо нормальным, либо повышенным; у шести детей отмечалось снижение количества лимфоцитов, в том числе у одного ребенка была выраженная лимфо- и нейтропения. Эти результаты подтверждают известные данные о том, что аскариды и острицы угнетающе влияют на функции иммунитета, а также что у людей с ослабленным иммунитетом большая вероятность появления гельминтоза [1].
У большинства детей отмечалось более одного симптома. Обобщенные данные по клинической картине представлены в табл. 2.
Терапия во всех случаях состояла из двух этапов: сначала — антигельминтная терапия, причем назначались два разных препарата (декарис и вермокс) с интервалом три — пять дней между ними, чтобы максимально охватить различные стадии жизни гельминтов; через некоторое время после антигельминтной терапии — препараты для микробиологической и функциональной коррекции. Соответственно оценивались результаты противоглистной терапии, результаты всего лечения, а также катамнез в течение шести месяцев после терапии. В большинстве случаев улучшение наступало быстро в процессе лечения. У 36 детей только после антигельминтной терапии существенно уменьшились или полностью исчезли аллергические проявления, у 39 детей после первого этапа терапии нормализовалась работа ЖКТ, у 41 ребенка сразу прекратились боли в животе, по остальным симптомам также наступало улучшение после противоглистных препаратов. Это подтверждает то, что симптомы были вызваны наличием гельминтов.
У 92 детей после всего лечения не было никаких жалоб; о 37 нет данных об изменениях состояния в процессе и после лечения; у 16 детей эффект был неполным, т. е. какие-то симптомы сохранялись и после окончания лечения; у четырех детей эффект от терапии оказался нестойким, поскольку возникли рецидивы после окончания лечения; у трех детей эффекта от терапии не было.
Дирофиляриоз — один из гельминтозов, ранее считавшихся исключительно зооспецифическим и до недавнего времени бытовало мнение, что этому заболеванию подвержены исключительно животные. В первую очередь — собаки. Но в последние годы все чаще стали регистрироваться случаи заражения людей.
Дирофиляриоз: симптомы, подкожный и внутренний дирофиляриоз у человека, лечение и профилактика
Дирофиляриоз — один из гельминтозов, ранее считавшихся исключительно зооспецифическим и до недавнего времени бытовало мнение, что этому заболеванию подвержены исключительно животные. В первую очередь — собаки. Но в последние годы все чаще стали регистрироваться случаи заражения людей.
Дирофиляриоз (Dirofilariasis) — относится к ларвальным гельминтозам. То есть, при этом заболевании паразитирует не взрослая особь нематоды, а ее личинка, не достигшая половой зрелости. Разносчиками заразы являются комары, поэтому наиболее часто этот гельминт встречается в теплом климате: от Австралии, Южной Америки и Африки до Юга России и Средней Азии. На протяжении последних лет наибольшее количество заболевших дирофиляриозом регистрировалось в Иране и Греции. Но в последние годы все чаще регистрируют эту болезнь и в умеренном климате.
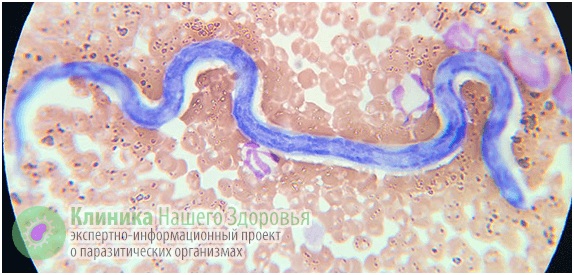
Так, на территории Российской Федерации на протяжении нескольких лет выявляют по 35-40 случаев дирофиляриоза ежегодно. Причем география заражения весьма обширна — от теплого Ростова, умеренных климатических зон Тулы и Рязани, до морозной Сибири. На самом же деле уровень заболеваемости может быть значительно выше. Поскольку этот вид гельминтоза долго считался присущим только животным, то медики его не изучали, и на сегодняшний день о нем мало знают и не сразу могут поставить верный диагноз.
Причины возникновения дирофиляриоза
Как происходит заражение дирофиляриозом?
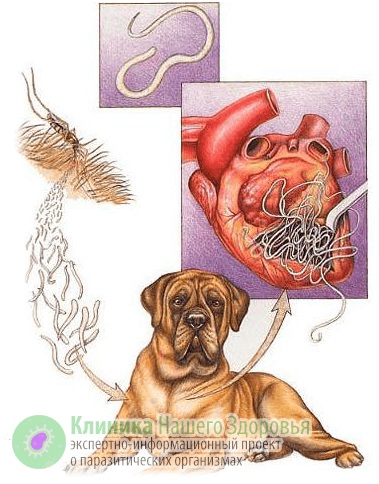
Механизм заражения у людей — трансгемный, то есть инфицирование происходит через кровь. Передается болезнь, зачастую, через укусы комаров. Реже, через укусы блох, слепней и других видов кровососущих насекомых. А источником заразы, как это ни прискорбно, выступают наши домашние животные. В первую очередь собаки, изредка кошки. По данным ветслужбы до 30% собак, живущих в городах, страдают от упомянутой инвазии. В сельской местности этот показатель еще выше. В организме животного взрослые дирофилярии паразитируют в сердце, легких, бронхах и крупных кровеносных сосудах. Самки выделяют в кровь тысячи личинок-микрофилярий, которые имеют микроскопический размер — до 0,3 мм в длину. Именно поэтому они с кровотоком и лимфотоком разносятся по всему организму.
Микрофилярии так микроскопичны, что с кровью и лимфой попадают не только во все органы и ткани человека или животного, но даже преодолевают плацетнарный барьер и внутриутробно инфицируют плод. С кровью животного микрофилярия попадает к промежуточному хозяину — комару. Насекомое, в свою очередь, кусает инвазированное животное, личинки попадают в его брюшную полость, но часть из них остается в хоботке комара. Когда насекомое кусает следующую жертву — часть паразитов из хоботка попадает в кровоток следующего хозяина. Так дифиляриоз передается от животного к животному и к человеку.
У людей тотальная восприимчивость к дирофилриозу – то есть, если человека кусает инфицированный комар, то он заразится со 100% вероятностью. Но в наибольшей зоне риска заражения дирофиляриозом находятся некоторые категории людей, среди которых:
- заводчики собак и кошек;
- люди, проживающие у открытых водоемов;
- те, кто часто бывает на природе — охотники, туристы, огородники, рыбаки.
Этапы развития дирофиляриий
Когда комар (реже другое кровососущее насекомое) заглатывает личинку нематоды с кровью, та около суток остается у него в кишечнике. Затем микрофилярии мигрируют в обратном направлении — к хоботку комара, где дозревают до инвазивной стадии. В этот период, комар, кусает жертву и заражает ее дирофиляриозом.
У нового хозяина около трех месяцев личинки остаются в месте комариного укуса: в коже или в подкожной клетчатке. Именно тут микрофилярии линяет и уже более жизнеспособными попадают в кровоток и разносятся по организму. Паразитировать микрофилярия может около трех лет.
До половозрелости дирофилярия развивается только в организме животных. Человеческий организм для нее тупиковый вариант, так как большинство личинок все же гибнут в крови людей. Это значит, что человек не может быть источник заражения.
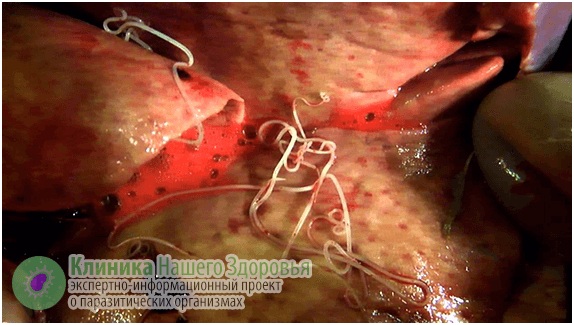
Воздействие дирофилярий на человека
Главная опасность дирофиляриоза — первичные реакции на месте внедрения микрофилярии. Может возникнуть сильная аллергическая реакция. Кроме того, кожа воспаляется, образуются уплотнения (шишки) довольно большого диаметра. Внутри этих уплотнений находится серозная жидкость и/или гной, внутри этого содержимого и обитает какое-то время дирофилярия. Часто паразит погибает, тогда уплотнение постепенно может само рассосаться. Но чаще все же требуется хирургическое вмешательство.
Виды дирофиляриоза
Инвазионное заболевание вызывает червь-паразит. Личинки нитевидной нематоды, вызывающие болезнь, бывают нескольких разновидностей, и поэтому заражение ими приводит к разным формам заболевания.
Dirofilaria repens и Dirofilaria immitis — основные виды, поражающие собак и реже кошек. Именно эти разновидности гельминта являются самыми распространенными среди заболевших людей, ведь в подавляющем большинстве случаев дирофиляриоз у человека появляется при укусе комара-переносчика, контактировавшего до этого с данными животными.
- Dirofilaria repens вызывает подкожную разновидность дирофиляриоза.
- Dirofilaria immitis — висцеральную.
В России и странах ближнего зарубежья встречается в основном подкожный дифиляриоз. Висцеральный дирофиляриоз распространен в жарких странах Азии, Японии, Индии, США, Африке, Канаде, Вьетнаме, Австралии, на юге Европы.
Симптомы и места распространения дирофиляриоза
Скрытая форма дирофиляриоза у человека длится от 1 до 12 месяцев. Основным симптомом является появление под кожей или слизистой, болезненного уплотнения, с покраснением и зудом на месте внедрения. При этом гельминт под кожей может перемещаться (со скоростью до 15 мм в сутки), что может быть заметно для человека, как по ощущениям, так и визуально. Часто, заметив на теле уплотнение похожее на опухоль, пациенты обращаются к хирургу, а тот решает, что это липома, опухоль, фиброма, атерома и т.п., а затем уже в ходе операции обнаруживает гельминта.
У дирофилярий есть любимые места на теле человека — это органы зрения, ноги и руки, шея, лицо, грудь, мошонка. Могут появиться такие симптомы, как слабость, пассивность, тошнота, нервозность, бессонница, повышенная температура, боли в голове и в области поражения паразитом. В 50 % случаев обычно поражаются органы зрения. Человек жалуется на ощущение чего-то ползающего в глазу, у него наблюдается покраснение век и глаз, блефароспазм. При перемещении гельминта возникает боль, слезотечение и зуд. Иногда через конъюнктиву виден сам гельминт.
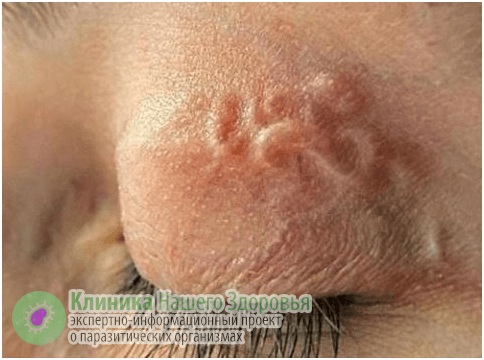
При нахождении дирофилярии в глазу вокруг нее образуется гранулема, что вызывает развитие экзофтальма и диплопии. Поражение глаз приводит к ослаблению зрения. Человек способен увидеть мигрирующего паразита. Наблюдения показали, что его перемещения усиливается под воздействием тепла.
Дифиляриоз обычно носит хронический характер, с рецидивами, характеризующимися периодами вспышек и затихания заболевания. Если вовремя не заняться лечением, вероятны воспаления тканей, и возникновение абсцесса.
Симптомы внутреннего дирофиляриоза
При этой разновидности паразитом поражаются легкие. Личинка живет в левом желудочке сердца и легочных артериях, образуя при этом фиброзную капсулу. Обычно болезнь протекает бессимптомно, реже вызывает боль в груди, кашель и кашель с кровью.
Заболевание часто выявляется случайно, например, при рентгене грудной клетки (видны узелки размером 1-2 см) или при оперировании легких.
Диагностика дирофиляриоза у человека
Диагностика заболевания представляет определенную сложность, так как её симптоматика схожа со многими другими заболеваниями, поэтому врачами часто ставится ложный диагноз и своевременное лечение затягивается. Основными жалобами пациентов являются появление мигрирующих подкожных узлов, ощущения перемещения паразита.
Диагноз дирофиляриоза можно подтвердить, сдав следующие анализы:
- анализ крови;
- после удаления паразита хирургом, проводится его макроскопическое исследование;
- проведение исследования на наличие серологической реакции, позволяющей обнаружить антиген паразита;
- аппаратная диагностика (УЗИ узлов, рентгеновские исследования, эхокардиография и электрокардиография).
Кроме того, перед постановкой диагноза специалист проводит анализ условий проживания больного, времени года, его деятельности. Факторами риска являются наличие домашних и бездомных собак и кошек, комаров, выезд в лес, на рыбалку, на дачу или в сад.
Риск заболевания дирофиляриозом особенно увеличивается в период высокой активности комаров. В связи с чем важны профилактические меры, производимые санитарными службами по ликвидации насекомых на территории водоемов. Известно, что заболевание носит сезонный характер, поэтому основное количество заболевших фиксируется весной и летом. Пики заболеваемости приходятся на периоды июнь-июль и октябрь-ноябрь.
Диагностика дирофиляриоза у животных
Для профилактики заболевания домашним животным необходимо регулярно давать противоглистные препараты. Признаками заболевания паразитами служат различные высыпания, уплотнения, ранки, опухоли на коже.
Больше всего при поражении страдает сердечно-сосудистая система животного. Поведение его становится пассивным, теряется аппетит, отмечается температура, кашель. Собака может прихрамывать и страдать от судорог.
Лечение дирофиляриоза
Форма болезни диктует методы лечения. Обычно у человека паразитирует одна неполовозрелая особь. Основной метод избавления от паразита — хирургический. Чтобы исключить перемещение паразита применяют дитразин. Редко применяется терапия медикаментами с использованием ивермектина или диэтилкарбамазина. Дополнительно при лечении используются успокаивающие и антигистаминные лекарства, нестероидные противовоспалительные средства, глюкокортикостероиды.
При глазном дирофиляриозе основным методом лечения будет удаление гельминта с помощью операции и последующие назначение дезинфицирующих и противовоспалительных препаратов для глаз, иногда также прописываются капли дексаметазона для уменьшения воспаления. Обязательно назначаются антигистаминные средства.
Профилактика дирофиляриоза
В России 4-30% (в зависимости от географии их проживания) домашних и уличных собак являются хозяевами-переносчиками микрофилярий. Самый большой процент зараженных животных в Греции и Иране- 25-60%.
Профилактика заболевания включает в себя истребление комаров и ограничение контакта с ними животных и человека, своевременное выявление дирофилярий животных и их лечение, борьба с бродячими животными, противоглистная профилактика у домашних питомцев.
Так как очагами дирофиляриоза являются водоемы около жилых районов, очевидна эффективность мер, применяемых санитарными органами по борьбе с кровососущими насекомыми. К тому же необходима борьба с комарами в подвалах жилых домов, ведь здесь эти паразиты могут с комфортом обитать весь год. Из подвалов жилых домов комары и другие насекомые попадают по вентиляционной системе в квартиры.
В лесу и около водоемов необходимо использовать репелленты и защищать участки тела с помощью одежды. Животным кроме репеллентов могут быть одеты специальные ошейники. По возможности старайтесь отказаться от прогулок в вечернее и ночное время суток.
Человек сам в ответе за собственное здоровье, а также за здоровье своих детей, родных и близких, поэтому отправляясь в отпуск в теплые страны, будьте бдительны! Легче предотвратить болезнь, соблюдая профилактические меры, чем лечить ее последствия!
Среди всех протозойных заболеваний, лямблиоз у взрослых занимает лидирующие позиции. Заболеваемости лямблиозом в одинаковой степени подвержены все люди, независимо от пола и возраста. Эта патология вызывает тяжелые расстройства пищеварения, влияет на функциональное состояние органов желудочно-кишечного тракта и может провоцировать тяжёлые осложнения.
Характеристики лямблиоза
Лямблиоз относится к группе кишечных инфекций, и развивается при попадании лямблий в просвет тонкой кишки. Это заболевание распространено повсеместно, а в развитых странах заболеваемость лямблиозом составляет от 3 до 5%.В развивающихся странах, распространенность лямблиоза составляет от 10 до 15%. Повышенному риску заболеваемости этой протозойной инфекцией подвержены дети, посещающие дошкольные и школьные учреждения.
Причины развития
По своей природе, лямблии являются простейшими одноклеточными паразитами. Питаются эти микроорганизмы с помощью осмоса. Источником распространения инфекции является больной человек, который выделяет лямблий с испражнениями в окружающую среду. Распространителями лямблиоза, также могут быть животные (морские свинки, кошки, кролики, собаки). Благоприятные условия для распространения инфекции и инфицирования людей создаются районах с низким качеством питьевой воды, при недостаточном уровне навыков личной гигиены среди населения, а также при большой скученности людей.
К предрасполагающим факторам развития лямблиоза, можно отнести:
- физическое истощение;
- детский возраст до 10 лет;
- хронический холецистит и дискинезия желчевыводящих путей;
- врожденные или приобретенные дефекты желчевыводящих путей
- ранее перенесенные операции на желудке
- дефицит белка в рационе.
Попадая в просвет пищеварительного тракта, возбудители лямблиоза мигрируют в сторону двенадцатиперстной кишки, после чего трансформируются в вегетативные формы . Далее, лямблии достигают проксимального отдела тощей кишки и фиксируются к эпителиальным ворсинкам. Этот процесс сопровождается механическим повреждениям клеток кишечного эпителия (энтероцитов) и нарушением процесса всасывания.
Клинические симптомы
С момента проникновения возбудителей лямблиоза во внутреннюю среду организма и до момента появления клинических симптомов проходит от 1 до 3-х недель. К основным симптомам лямблиоза у взрослых можно отнести:
- уменьшение аппетита, ощущение тяжести в желудке;
- тошнота и рвота;
- чередование запоров и диареи;
- водянистый или пенистый стул с вкраплениями жира;
- боль в правом подреберье;
- повышенное газообразование в кишечнике (метеоризм);
- уменьшение массы тела, астенизация.
Острая фаза клинических симптомов поражения тонкой кишки может продолжаться от 5 до 7 дней. После завершения острой фазы, лямблиоз самопроизвольно проходит или переходит в хроническое подострое течение.
От масштабов инвазивного поражения кишечника лямблиями напрямую зависит выраженность интоксикации. Кроме перечисленных симптомов, лямблиоз может сопровождаться увеличением температуры тела до субфебрильных показателей, увеличением регионарных лимфатических узлов, быстрой утомляемостью, бруксизмом и эмоциональной лабильностью. Если данное заболевание развивается в детском возрасте, то оно нередко сопровождается гиперкинезами, снижением артериального давления и обморочными состояниями.
Методы диагностики
Клинические симптомы лямблиоза неспецифичны, поэтому диагностировать данную патологию на основании жалоб невозможно. Для диагностики лямблиоза назначаются такие методы обследования:
- холецистография;
- ультразвуковое исследование органов брюшной полости;
- общий анализ крови;
- биохимическое исследование крови;
- паразитологическое исследование кала;
- анализ кала на дисбактериоз;
- лабораторное исследование дуоденального содержимого.
Лечение
Комплексное лечение лямблиоза включает ряд таких последовательных этапов:
- Подготовительный этап. На данном этапе проводится ряд мероприятий по устранению холестаза и эндотоксикоза. Также, выполняется механическое удаление лямблий. На этапе подготовки назначается специальная диета, цель которой заключается в создании неблагоприятных условий для размножения возбудителей лямблиоза. В состав диеты при лямблиозе входят свежие овощи и фрукты, отруби, растительные масла холодного отжима. В ежедневном меню сокращают количество углеводов и сахаров. Назначается также тюбаж печени с использованием минеральной воды, сорбита или ксилита. Медикаментозная терапия включает прием антигистаминных средств и желчегонных препаратов.
- Антипаразиторное лечение. На данном этапе используются антипротозойные лекарственные медикаменты. Схема лечения лямблиоза включает прием таких препаратов, как Фуразолидон, Альбендазол, Ниморазол, Орнидазол, Тинидазол, Метронидазол. Как правило, данный этап предусматривает 2 курса антипротозойной терапии. Кроме того, пациентам с лямблиозом назначаются поливитаминные комплексы, иммуностимуляторы, адаптогены, энтеросорбенты и ферментативные препараты.
На завершающем этапе комплексного лечения важно позаботиться о восстановлении кишечной микрофлоры. С этой целью используются метапребиотики, которые стимулируют рост и размножение естественной кишечной микрофлоры. Метапребиотик Стимбифид плюс восстанавливает популяцию собственных бифидумбактерий человека, количество которых значительно уменьшается при лямблиозе. Данное средство используется для лечения кишечных инфекций и их профилактики.
Кроме того, Стимбифид Плюс стимулирует иммунитет и ускоряет процесс регенерации кишечного эпителия. Метапребиотик может быть использован для профилактики лямблиоза у детей с 3-х лет. Средство благоприятно воспринимается организмом взрослых и детей, а также помогает ускорить процесс выздоровления при лямблиозе.
Читайте также:

