Паразиты вызывающие рассеянный склероз
Обновлено: 17.04.2024
Гельминтные инфекции ЦНС. Рассеянный склероз и боль
Инфицировать ЦНС могут три гельминта: Trichinella spiralis, Taenia solium и Echninococcus granulosis. Первые два попадают в организм человека при употреблении инфицированной, неадекватно приготовленной свинины или дичи (например, мяса медведя). Е. granulosis заселяют собак, яйца гельминтов выделяются с фекалиями, откуда могут попасть к людям. В какой-то момент паразит из кишечника может транспортироваться кровью в головной мозг, где вызовет большие пространственные повреждения мозга. Эти повреждения выявляют на МРТ или КТ. Неврологические симптомы будут зависеть от локализации повреждений.
Трихиноз с поражением ЦНС считается окончательно диагностированным при выявлении в СМЖ личинок. Заболевание обычно лечат преднизоном для подавления иммунного ответа на нематоды, который часто сопровождается значительной эозинофилией в СМЖ. Для подавления паразита назначают мебендазол.
Личинки Т. solium развиваются в мозге. Окончательный диагноз можно поставить с помощью биопсии одного из цистных повреждений. Лечение: глюкокортикостероиды для подавления иммунного ответа плюс албендазол или празиквантел.
Эхинококковые цисты обычно появляются в печени или легких, но если цисты разрываются, яйца гельминтов могут попасть в мозг, где разовьются новые цистные повреждения. Такие цисты часто обнаруживают при МРТ или КТ.
Хирургическое удаление цисты — радикальная терапия, но ни в коем случае цисту нельзя разрывать, т.к. яйца попадут с кровотоком в другое место в организме человеке. Применение албендазола во время операции может уменьшить риск распространения инфекции.
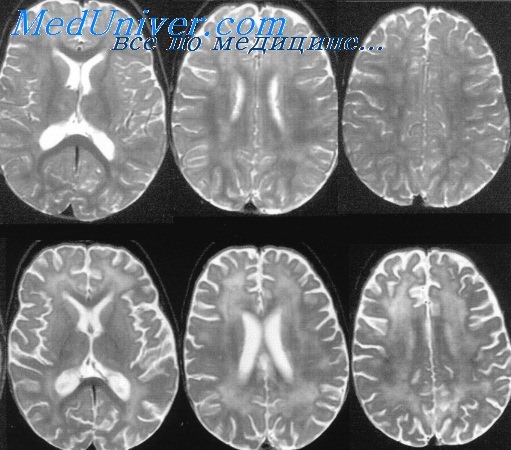
Рассеянный склероз
Рассеянный склероз — хроническое воспалительное состояние ЦНС. Обнаружено, что интерферон уменьшает тяжесть и частоту рецидивов. Его назначают 1 раз в день или через день в виде инъекций, но возможны неблагоприятные гриппоподобные эффекты: боль в мышцах и озноб. Недавно для лечения рецидивов рассеянного склероза стали использовать глатирамера ацетат, который, вероятно, действует как агонист IL-4-, IL-6- и IL-10-peцепторов. В более поздней стадии клинического развития рассеянного склероза для лечения используют множество а4-интегрин-антагонистов типа натализумаба. Однако испытания с натализумабом были остановлены из-за множества летальных исходов от лейкоэнцефалопатии.
Боль — важнейший компонент защитной системы организма, сигнализирующий о повреждении. Интенсивная боль драматично ухудшает качество жизни пациента. Боль часто связана с целым рядом физиологических и центральных нарушений (например, беспокойством, депрессией, бессонницей, анорексией) и глубокими изменениями автономной функции (например, частотой сердечных сокращений, кровяным давлением, непроизвольным мочеиспусканием). Боль имеет две формы:
• острая боль, которая носит кратковременный характер, обычно продолжается только во время повреждения ткани; представляет собой естественную, физиологическую защитную реакцию организма;
• хроническая боль, которая сохраняется даже при нормальных механизмах выздоровления, а также при таких болезнях, как ревматоидный артрит; может длиться в течение нескольких недель, месяцев или даже лет.
Физиологические функции хронической боли, если таковые вообще имеются, неизвестны. Однако ясно, что боль является важным компонентом ответа на различные травмы (например, ожоговые повреждения), хирургические вмешательства (например, послеоперационные боли) и заболевания (например, артрит, рак, болезни сердца, серповидно-клеточный криз).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Протозойные, паразитарные инфекции ЦНС у детей: причины, диагностика, лечение
За исключением токсоплазмоза и, в определенной степени, нейроцистицеркоза, протозойное и паразитарное поражение ликвора в развитых странах встречается редко. Малярия, однако, имеет повышенное значение из-за частых путешествий в зараженные страны и не всегда проводимой или неэффективной профилактике. В таблице ниже перечислены основные клинические особенности и доступное лечение некоторых протозойных и паразитарных заболеваний.

а) Малярия нервной системы у детей. По оценкам, не менее миллиона детей умирает от малярии только в Африке (Snow et al., 2005), и основной причиной смерти является поражение головного мозга, с пиком малярии мозга среди детей в возрасте между двумя и шестью годами. Малярию вызывают четыре разновидности рода Plasmodium-. Р. vivax, Р. falciparum, Р. malariae и Р. ovale, и тяжелым осложнением инвазии Р. falciparum является малярия мозга.
У детей данная патология определяется тремя критериями: расстройства сознания с неспособностью локализовать боль (по шкале комы Блантайра
Отличительными признаками при гистологическом исследовании являются капиллярный и венозный застой в мозге с эритроцитами, содержащими и не содержащими паразитов (MacPherson et al., 1985). Самым ранним признаком обычно является лихорадка, следующая за признаками расстройства дыхания (вторичным по отношению к метаболическому ацидозу и/или анемии), судороги и сниженный уровень сознания. Характерны двигательные расстройства и патологическая поза.
Типичные при любой форме малярии припадки могут быть генерализованными или очаговыми. Некоторые могут быть субклиническими. Они связаны с худшим исходом, особенно при продолжительности. Эпилептический статус возникает в 10-20% случаев. Гипогликемия отмечается у 30% пациентов и имеет тяжелое прогностическое значение (Molyneux et al., 1989).
Повышенное ВЧД наблюдается у большинства детей (Newton et al., 1991) с малярией мозга и считается связанным с повышением объема циркулирующей крови в мозге. Среди детей со значительно повышенным ВЧД имеется наибольший уровень смертности и более частое появление долговременных последствий.
В целом диагноз определяется анамнезом, клиническим исследованием и исследованием толстого и тонкого мазка крови. Результаты исследования ликвора обычно ничем не примечательны, а при наличии плеоцитоза более вероятным диагнозом становится менингит или энцефалит. Лечение необходимо начинать без определенных доказательств в сомнительных случаях у любых пациентов, которые в последние три месяца подвергались укусам или в течение последнего года получали профилактическое лечение (Newton и Warrell, 1998). Парентеральное назначение алкалоидов хины (хинин или хинидин в США) — основной метод лечения.
Все шире используются дериваты артемизинина (артесунат и артеметер); несмотря на более быстрое очищение крови от паразитов, они не продемонстрировали преимуществ по снижению летальных исходов по сравнению с алкалоидами хины. Их преимущество заключается в возможности ректального применения, хотя из-за обнаруженной при испытаниях на животных нейротоксичности их применение остается ограниченным. Рекомендуемая поддерживающая терапия включает жаропонижающие средства, мероприятия для устранения гиповолемии, антиконвульсанты для контроля за припадками, осмотические средства (например, маннитол) для снижения ВЧД, глюкозу при гипогликемии и переливание крови при определенных значениях анемии и, возможно, высокой периферической паразитемии (>10% пораженных эритроцитов).
В прошлом настоятельно рекомендовали применение кортикостероидов, но из-за отсутствия определенной патофизиологической основы они больше не используются. Другие вспомогательные средства, такие как десферриоксамин, малярийный гипериммунный глобулин, анти-TNFa и пентоксифиллин не показали очевидного преимущества, а некоторые из них наносили вред, поэтому до дальнейшего изучения они не должны использоваться (Warrell, 1999). Средний показатель смертности от церебральной малярии варьирует между 15% и 20% (Marsh et al., 1995, Idro и et al., 2005) с наличием остаточной инвалидности у 10-15% выживших. Некоторые последствия носят транзиторный характер, например атаксия, другие частично улучшаются через несколько месяцев (двигательные нарушения, такие как гемипарез и корковая слепота), но отдельные остаются, создавая проблемы (например, припадки). Кроме того, у многих выживших имеются незначительные когнитивные расстройства (Kihara et al., 2006).
б) Приобретенный токсоплазмоз. Инфекция Т. gondii обычно имеет легкое или бессимптомное течение, но в иммунодефицитном организме может поражать ЦНС и вызвать менингоэнцефалит, у новорожденных — энцефалит и хориоретинит, вследствие трансплацентарного инфицирования, хориоретинит в качестве первичной инфекции или внутричерепные новообразования у пациентов с ослабленным иммунитетом.

MPT: интрамуральные узелки одиночного цистицеркоза (слева, стрелка)
и множественные нейроцистицеркозные очаги (справа).
в) Нейроцистицеркоз. Нейроцистицеркоз (НЦЦ) наиболее распространенное гельминтозное заболевание ЦНС и основная проблема здравоохранения во многих развивающихся странах. Болезнь развивается в результате плохой санитарии, когда человек становится промежуточным хозяином в жизненном цикле Taenia solium, проглатывая яйца солитера. Инвазия инкапсулированной формой Т. solium может затем развиваться в пределах паренхимы мозга, базилярной цистерны или редко в спинном мозге, вызывая воспаление, отек и остаточную кальцификацию. Нейроцистицеркоз (НЦЦ) обычно проявляется у детей, когда цисты начинают отмирать и провоцировать воспаление. Среди признаков заболевания отмечают длительные очаговые/генерализованные припадки или иногда признаки повышенного внутричерепного давления, вторичного по отношению к цистицеркозному энцефалиту или гидроцефалии, вызванных кистевидными цистицерками в базилярной цистерне или желудочковой системе.
Диагностическим критерием служит выявление при сканировании мозга одиночного кольцевидного поражения с окружающим отеком или при обнаружении множественных поражений, некоторые из которых кальцифицированны. На МРТ можно обнаружить головку червя. Дифференциальная диагностика одиночных поражений от других единичных гранулем, таких как туберкулема, без биопсии затруднительна. Полезным может быть определение сывороточных антител против цистицерка, хотя в эндемичных районах исследование может привести к высокому уровню ложно-положительных результатов. Del Brutto et al. (2001) разработали набор диагностических критериев для помощи в установлении НЦЦ. Лечение альбендазолом (15 мг/кг/сут. в течение 8 дней) доказало свою эффективность, с добавлением стероидов в тяжелых случаях инвазии или при развитии побочных эффектов от лечения. Поскольку большинство пациентов обращается за медицинской помощью в результате отмирания цист, лечение уже не рекомендовалось; однако недавние исследования показали, что при использовании альбендазола уменьшается долговременный риск развития припадков (Garcia et al., 2004).
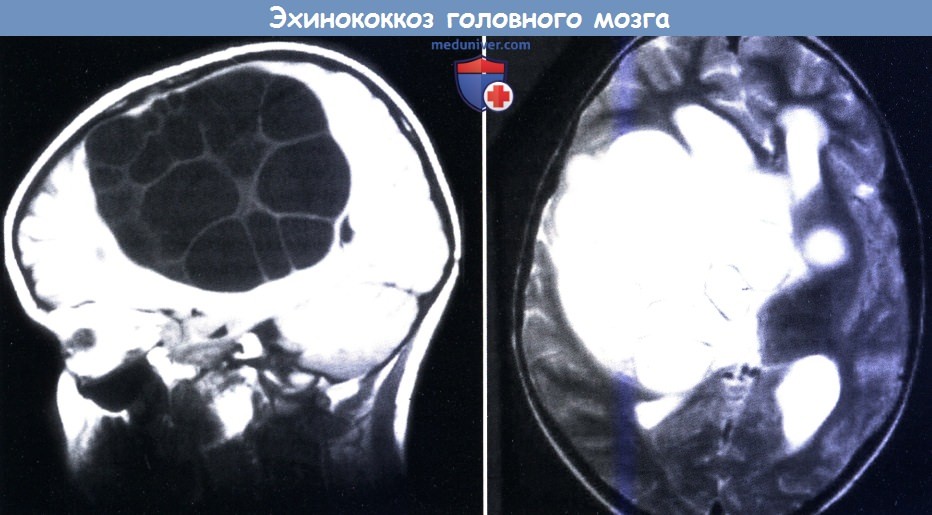
Гидатидный эхинококкоз. МРТ в Т1-режиме (слева) и Т2 (справа):
множественные кистозные повреждения после Echinococcus granulosus.
г) Эхинококкоз нервной системы. Инвазия человека солитером собаки, Echinococcus, называемая также эхинококкозом и распространенная в странах, где разводят овец. Человек заражается при заглатывании яиц, выделяемых собаками (окончательный хозяин). Echinococcus granulosus вызывает кистозный эхинококкоз, и в основном вызывает кисты в печени и легких, хотя в 5% случаев кисты развиваются и в ЦНС. Поскольку пузыри растут медленно, зачастую они остаются бессимптомными до тех пор, пока не достигнут значительных размеров. Клинические проявления в основном связаны с признаками и симптомами внутричерепной гипертензии, тогда как очаговый неврологический дефицит возникает редко.
На КТ и МРТ определяются округлые или овальные кисты с ровными контурами и содержимым, имеющим плотность ликвора. Может выявляться смещение срединных структур и желудочковая деформация (Tuzun et al., 2002). В диагностике можно использовать ИФА или РИГА (непрямая гемагглютинация) с эхинококковым антигеном. Предпочтительным лечением является осторожное хирургическое удаление, чтобы предотвратить разрыв стенки кисты. При больших повреждениях предопреционное лечение альбендазолом, видимо, улучшает исход (Altinors et al., 2000).
д) Эозинофильный менингит. Наиболее частой причиной эозинофильного менингита рассматривают паразитарное или протозойное заболевание; однако высокая доля эозинофилов (>4%) может также наблюдаться в случаях инфекционного или постинфекционного менингита, вторичного по отношению к грибковой, риккетсиозной, микоплазмозной или трепонемной инфекции, подострому склерозирующему панэнцефалиту и лимфоцитарному хориоменингиту. Эозинофилия в ликворе может также быть связана с неинфекционными расстройствами, такими как болезнь Ходжкина, рассеянный склероз, лейкемия, субарахноидальное кровоизлияние и реакция на интратекальное введение антибиотиков (Weller, 1993).
Формы рассеянного склероза. Прогноз при рассеянном склерозе. Диагностика рассеянного склероза.
Выделено несколько форм рассеянного склероза в соответствии с характером течения болезни. Примерно 35% больных имеют ремиттирующее течение заболевания, характеризующееся сменой обострений (экзацербаций) и ремиссий (так называемый рецидивирующе-ремиттирующий PC). При обострении неврологический дефицит нарастает постепенно, в течение нескольких дней — нескольких недель, экзацербация достигает фазы плато, а затем нарушенные функции постепенно восстанавливаются в течение нескольких недель или месяцев.
В некоторых случаях обострение достигает своего максимума в течение нескольких минут или часов.
Следует отметить, что в рамках такого течения заболевания у некоторых больных возникшая симптоматика разрешается не полностью и с годами неврологический дефицит нарастает.

Такая форма рассеянного склероза, характеризующаяся ступенеобразным прогрессированием нарушений с каждым новым обострением обозначается как рецидивирующе-прогрессирующий PC и встречается приблизительно в 45% случаев. Со временем у части больных с рецидивирующе-ремиттирующим и рецидивирующе-прогрессирующим течением PC переходит преимущественно в более линейное прогрессирование (без выраженных обострений).
Эта форма заболевания называется вторично прогрессирующим PC. И, наконец, у оставшейся части больных заболевание изначально течет практически с линейным прогрессированием. Такое течение называется первично прогрессирующий PC. Эта форма болезни обычно начинается позже и неврологические нарушения чаще представлены прогрессирующим нижним спастическим парапарезом, атаксией и расстройствами мочеиспускания. Необходимо подчеркнуть, что даже если заболевание имеет первично прогрессирующее течение, у определенной доли больных оно, тем не менее, через несколько лет может стабилизироваться. К сожалению, многие из пациентов к этому моменту уже имеют выраженную инвалидизацию.
Диагностика рассеянного склероза
Точная диагностика рассеянного склероза крайне важна, т. к. это заболевание часто скрывается под масками другой патологии ЦНС. К сожалению, невозможно точно поставить диагноз PC на основании лишь какого-либо одного метода параклинических исследований. Прежде всего необходимо проведение точной синдромологической диагностики, основанное на данных тщательно собранного анамнеза и анализа клинической картины. Для исключения других заболеваний и подтверждения диагноза PC проводятся инструментальные и лабораторные исследования: МРТ, исследование вызванных потенциалов и цереброспинальной жидкости (ЦСЖ). Клиницист должен понимать значение и специфичность для PC каждой жалобы и симптома, а также уметь интерпретировать данные лабораторных и инструментальных исследований для каждой формы PC, на разных этапах заболевания, с учетом характера его течения. Используя эти параметры, опытный врач во многих случаях может поставить диагноз с высокой вероятностью (95%).
Клинические аспекты рассеянного склероза, представляющие диагностическую значимость
1. Возраст. Чаще всего заболевание начинается в возрасте от 20 до 45 лет. Крайне редко начало приходится на возраст младше 14 и старше 60 лет. Больные с симптоматикой, напоминающей PC, но относящиеся к атипичным возрастным группам, требуют максимально тщательного обследования.
2. Характеристика симптомов
Локализация очага. Симптомы должны указывать на поражение ЦНС. Исключение составляют инфрануклеарные симптомы поражения черепных нервов, а также монорадикулопатия вследствие локализации бляшки в местах выхода черепных нервов или спинальных корешков.

ТАСС, 15 июня. Британские и румынские биологи успешно защитили несколько десятков добровольцев от повторного появления рассеянного склероза с помощью круглых червей-паразитов. Результаты клинических испытаний опубликовал научный журнал JAMA Neurology.

"Мы провели пока самое большое исследование по использованию круглых червей для лечения рассеянного склероза. Мы не только показали, что подобная терапия работает и что она безопасна для пациентов, но и узнали несколько особенностей работы иммунитета, которые помогут воспроизвести этот эффект другими путями", – пишут исследователи.
Рассеянный склероз – это аутоиммунная болезнь нервной системы, при развитии которой иммунные клетки начинают атаковать оболочку нервных волокон, так называемый миелин. В результате нервы начинают хуже проводить сигнал и "замыкать". Сначала из-за этого происходит легкое онемение конечностей, а при прогрессировании болезни может вызвать паралич, слепоту и смерть.
Согласно статистике Всемирной организации здравоохранения (ВОЗ) от рассеянного склероза в мире сейчас страдает около 2,3 млн. При этом в мире нет лекарств, которые могли бы полностью подавить эту болезнь.
Группа британских и румынских исследователей под руководством профессора иммунологии из Ноттингемского университета (Великобритания) Дэвида Притчарда добилась существенного прогресса в этом направлении. При этом они использовали довольно необычное "лекарство" – круглых паразитических червей вида Necator americanus.
Природный регулятор иммунитета
Ученые достаточно давно заметили, что если носители рассеянного склероза и других аутоиммунных болезней заражены паразитическими червями, то болезнь у них проходит гораздо легче, чем у остальных пациентов. Врачи и биологи из самых разных стран мира сейчас проводят сразу несколько клинических испытаний по лечению этой болезни с помощью разных паразитов, в том числе нематод вида Trichuris ovis, которые поражают овец.
Притчард и его коллеги выбрали для подобных опытов другой вид круглых червей – Necator americanus. Они основывались на том, что этот вид паразитирует только на человеке, и поэтому полностью совместим с его жизнедеятельностью. Как правило, заражение этими нематодами крайне редко вызывает малокровие и другие тяжелые последствия, но при этом их присутствие в кишечнике человека значительно снижает количество воспалений и "перепрограммирует" иммунную систему на уменьшение ее аутоиммунной активности.
Подтвердив безопасность Necator americanus в опытах на здоровых добровольцах, британские и румынские биологи несколько лет назад начали вторую фазу клинических испытаний. В них участвовали 73 жителя Англии, которые страдали от повторного появления рассеянного склероза. Во время этих опытов ни сами ученые, ни добровольцы не знали, принимали ли они настоящие яйца нематод или же проглатывали пустышки, не ведущие к появлению паразитов в их кишечнике.
Наблюдения в течение следующих девяти месяцев показали, что у участников исследования с червями в кишечнике крупных повреждений миелиновой оболочки нейронов оказалось гораздо меньше, чем у добровольцев без паразитов. Более того, у половины пациентов, которых заразили Necator americanus, не появилось ни одного нового приступа болезни. Среди участников контрольной группы это произошло лишь у 28% человек.
Эти позитивные изменения биологи связывают с тем, что из-за появления паразитов в кишечнике в организме участников исследования поменялось количество разных типов лимфоцитов и эозинофилов – противопаразитной разновидности клеток иммунной системы. В частности, у всех добровольцев с нематодами эозинофилов стало больше, тогда как у участников контрольной группы количество этих клеток к концу эксперимента значительно упало.
Подобные процессы, как предполагают ученые, можно воспроизвести и без участия червей-паразитов. Благодаря этому можно будет создать лекарства, которые смогут подавлять чрезмерно высокую активность иммунитета как у носителей рассеянного склероза, так и других болезней, заключают авторы статьи.

ТАСС, 27 ноября. Молекулярные биологи проанализировали образцы крови нескольких тысяч носителей рассеянного склероза и выяснили, что эта нейродегенеративная болезнь связана с тем, что в организм всех этих пациентов проник один и тот же штамм вируса герпеса. Выводы ученых опубликовал научный журнал Frontiers in Immunology.
"Это большой прорыв в изучении и рассеянного склероза, и герпеса. С одной стороны, мы подтвердили теорию о том, что штамм HHV-6A связан с развитием первой болезни. Вдобавок мы создали методику, с помощью которой можно отличить этот вирус от другого подвида герпеса, HHV-6B", - прокомментировала исследование Анна Хан, нейрофизиолог из Каролинского института (Швеция).
Вирус герпеса относится к числу самых распространенных человеческих инфекций. Существует несколько различных видов этого вируса, которые поражают разные части тела. К примеру, вирус HHV1 вызывает простуду на губах, HHV2 - проникает в половые органы, а вирусы HHV6 и HHV7 вызывают псевдокраснуху - непродолжительную лихорадку и сыпь. Если человек заражается этими вирусами, они остаются в его организме на всю жизнь.
Достаточно долгое время герпес, в особенности HHV1, считался достаточно безобидным вирусом. Однако недавно ученые начали находить намеки на то, что его присутствие в организме способствует развитию болезни Альцгеймера, энцефалита, некоторых форм рака половых органов и других болезней.
В частности, как рассказала нейрофизиолог, еще в начале 1980 годов медики начали подозревать, что некоторые подтипы вируса герпеса могут быть связаны с рассеянным склерозом - аутоиммунной болезнью, при развитии которой иммунные клетки начинают атаковать миелиновую оболочку периферических нервов, которая изолирует их от окружающей среды.
Без миелина эти нейроны хуже проводят сигнал и начинают "замыкать", в результате чего немеют конечности, развивается частичный паралич, слепота и другие серьезные последствия. По статистике Всемирной организации здравоохранения (ВОЗ), от рассеянного склероза сейчас страдает почти 3 миллиона человек и эффективных средств лечения этой болезни пока не создано.
Вирусные корни рассеянного склероза
Изучая наборы антител, которые организм человека вырабатывает в ответ на появление вирусов в организме, Хан и ее коллеги связали рассеянный склероз с одной конкретной разновидностью герпеса.
Их молекулы, как объясняют биологи, адаптированы для борьбы с конкретными штаммами и разновидностями вируса. Это позволяет использовать их для того, чтобы получать информацию о том, с какими болезнями сталкивался организм того или иного человека в прошлом. В данном случае ученых интересовали антитела, которые соединяются с двумя важнейшими белками вируса герпеса - молекулами IE1A и IE1B. Эти молекулы делают вирус невидимым для защитных систем клетки и запускают процесс его самокопирования.
Структура этих ферментов, а также связанных с ними антител сильно различается даже для близкородственных штаммов вируса. Это позволяет использовать их для того, чтобы идентифицировать те подвиды герпеса, которые сейчас присутствуют в организме пациента. Опираясь на эту идею, ученые собрали образцы крови у восьми тысяч носителей рассеянного склероза и аналогичного числа здоровых людей, извлекли из них антитела и сравнили между собой.
Оказалось, что организм больных примерно в 1,5 раза чаще содержал в себе следы одного конкретного штамма герпеса, HHV-6A. По словам ученых, этот подвид вируса HHV6 не вызывает псевдокраснухи и в целом мало проявляет себя в жизни человека. Однако он может проникать внутрь нервных клеток и заражать их, что нехарактерно для многих других штаммов герпеса.
При этом наличие антител к HHV-6A в организме здоровых людей, как показали дальнейшие наблюдения, почти удваивало шансы на развитие рассеянного склероза в последующие годы их жизни. В особенности это было характерно для тех добровольцев, которые заразились герпесом в детстве или юности. Все это говорит о том, что HHV-6A напрямую связан с развитием рассеянного склероза.
Штамм HHV-6B не вызывал подобных последствий, несмотря на то что он тоже умеет заражать нейроны человека. Это, как заключает Хан, позволит ее команде выяснить, как именно герпес провоцирует рассеянный склероз, проследив за тем, как обе разновидности вируса меняют работу нервных клеток и других компонентов нервной системы.
Читайте также:

