Парвовирус в19 у детей комаровский
Обновлено: 18.04.2024
Сыпь при пятой болезни (инфекционной эритеме) у ребенка
В 1983 г. была установлена связь инфекционной эритемы с парвовирусом человека В19. С этого времени определены клинические признаки и эпидемиология инфекции у пациентов с нормальным иммунитетом и у пациентов с состояниями иммунодефицита.
Хотя экзантема обычно бледнеет в течение 2-3 нед., очаги могут рецидивировать в период до 3 мес, особенно при усилении кровотока в коже и после повышения температуры или активной физической нагрузки.
Распространенность антител к В19 составляет 5-10% у детей младше 5 лет и возрастает до 50% у взрослых. Исследования на добровольцах показывают, что вирус распространяется воздушно-капельным путем. После инкубационного периода длительностью 5-7 дней наступает острозаразный период с пиком виремии, который также равен 5-7 дням.
Окончание виремии отмечается увеличением концентрации IgM-и IgG-антител, а через 2-5 дней появляются высыпания. Следовательно, риск инфицирования при появлении экзантемы низкий, и дети могут посещать школу.
Сопутствующие симптомы, которые включают лихорадку и артралгии, у маленьких детей обычно легкие или отсутствуют. Однако у подростков и взрослых артралгии или манифестный артрит могут быть тяжелыми. Как минимум у четверти пациентов с серологически подтвержденным заболеванием экзантема не развивается, а артропатия может проявляться перед высыпаниями, а также во время или в отсутствие высыпаний.
В ранней стадии инфекции у большинства пациентов отмечается транзиторная ретикулоцитопения в течение 7-10 дней и клинически незначительное падение уровня гемоглобина. Это явление, однако, может спровоцировать апластическии криз у пациентов с тяжелыми гемоглобинопатиями. Данный вирус подозревается также в качестве причины водянки плода у беременных женщин без других признаков клинического заболевания.
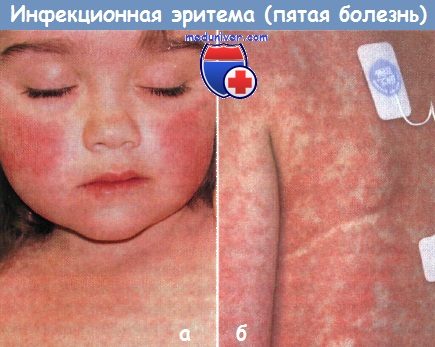
Пятая болезнь (инфекционная эритема):
а - эритема «нашлепанных щек и
б - диффузные, сетчатые, кореподобные высыпания сопровождались у 4-летней девочки высокой температурой, артралгиями и миалгиями
Сетчатую экзантему инфекционной эритемы можно принять за сетчатое ливедо -стойкую кружевную, бледнеющую при нажатии фиолетовую эритему, которая может быть первичной и вторичной. В первичном идиопатическом варианте очаги симметричные и распространенные, с расплывчатыми границами. В отличие от мраморной кожи у новорожденных они не разрешаются при обогревании. Эта картина нередко наблюдается у молодых, в остальном здоровых женщин.
Вторичный вариант чаще встречается у мужчин, о нем сообщалось в связи с узелковым периартериитом, гепатитом, сифилисом и рядом других инфекций, а также в связи с заболеваниями соединительной ткани и злокачественными опухолями.
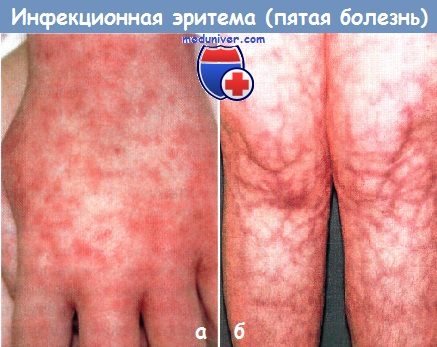
Пятая болезнь (инфекционная эритема):
а - через 4 дня болезни у девочки появились разрозненные, а затем сливающиеся пурпурозные пятна и папулы на кистях и стопах.
Серология на парвовирус В19 показала стадию острой инфекции.
б - распространенное сетчатое ливедо стало особенно заметным на конечностях у этой девочки-подростка после того, как она начала принимать нейролептик по поводу гиперактивности с дефицитом внимания.
Видео этиология, патогенез сыпи у детей - экзантем (кори, краснухи, инфекционной эритемы, розеоле, ветряной оспе)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Идиопатическая тромбоцитопеническая пурпура (ИТП) — заболевание, которое наиболее часто (в 40% случаев) является причиной геморрагического синдрома в гематологической практике. Распространенность ИТП среди детей и взрослых колеблется от 1 до 13% на 100 000 человек.
Определение. ИТП — аутоиммунное заболевание, для которого характерны:
* изолированная тромболитическая тромбоцитопения (менее 150000/мкл) при отсутствии иных отклонений при подсчете форменных элементов и в мазке крови;
* нормальное или повышенное число мегакариоцитов в костном мозге;
* отсутствие у пациентов клинических проявлений других заболеваний или факторов, способных вызвать тромбоцитопению (например, СКВ, ВИЧ-инфекция, лейкоз, миелодисплазии, а-g-глобулинемия, врожденные и наследственные тромбоцитопении, лечение некоторыми препаратами).
Патогенез. Для ИТП характерна повышенная деструкция тромбоцитов вследствие образования антител к их мембранным антигенам, обусловленного анормальным ответом на антигены. Некоторые исследования доказывают связь с HLA-системой, дефицитом IgG-2, анормальными компонентами комплемента, особенно С4.
Генетика. ИТП — заболевание приобретенное, поэтому генетических исследований мало, но генетически детерминирован при этом заболевании иммунный ответ. По данным некоторых авторов (Н. П. Шабалов и др.) в развитии ИТП определенную роль играет наследственная предрасположенность — передаваемая по аутосомно-доминантному типу качественная неполноценность тромбоцитов.
Клиника. История болезни обычна: внезапное появление геморрагического синдрома по микроциркуляторному типу у ребенка, который в других отношениях абсолютно здоров. Геморрагический синдром обычно представлен кожными геморрагиями (петехии, пурпура, экхимозы), кровоизлияниями в слизистые оболочки, кровотечениями из слизистых (носовые, десневые, из лунки удаленного зуба, маточные, реже — мелена, гематурия). Провоцирующие факторы, как правило, следующие: ОРВИ, детские инфекции (ветряная оспа, корь, краснуха), вакцинация, персистенция вирусов CMV, EBV, парвовирус В19. При физикальном обследовании ребенка, кроме геморрагического синдрома, другие синдромы поражения (интоксикация, лимфоаденопатия, гепатоспленомегалия) не выявляются.
Осложнения. В случае значительного снижения числа тромбоцитов возрастает риск профузных кровотечений с развитием тяжелой постгеморрагической анемии, представляющей угрозу для жизни больного. Основная причина смерти, хотя и достаточно редкая (менее 1% при ИТП), внутричерепные кровоизлияния. Факторы риска последнего следующие: крайняя степень выраженности кожного геморрагического синдрома с локализацией петехий на ушах, слизистой полости рта, кровоизлияния в склеру, кровотечения из слизистых при количестве тромбоцитов менее 20 000/мкл; резкое беспокойство и плач ребенка.
Классификация. По течению выделяют острые (продолжающиеся менее 6 месяцев) и хронические формы ИТП. Последние подразделяются на варианты:
* с редкими рецидивами;
* с частыми рецидивами;
* непрерывно рецидивирующее течение.
По периоду болезни выделяют обострение (криз), клиническую ремиссию (отсутствие каких-либо проявлений геморрагического синдрома при сохраняющейся тромбоцитопении) и клинико-гематологическую ремиссию.
Течение заболевания. У большинства детей (80-90%) наблюдается острая форма ИТП со спонтанным выздоровлением в результате терапии или без нее. Выздоровление наступает, как правило, в течение 6 месяцев, поскольку антитромбоцитарные антитела могут циркулировать в крови до 3-6 месяцев. У детей раннего возраста чаще встречается острая форма ИТП, у детей старше 10 лет, как правило, хроническая ИТП, а у детей до 1 года — только острая; хроническая ИТП в грудном возрасте — проявление другого заболевания. Полное выздоровление более вероятно у детей с предшествующей яркой клиникой вирусной инфекции и внезапным развитием на этом фоне тромбоцитопении; у большинства детей признаки заболевания исчезают в течение 1-2 месяцев. Если же в организме больного в течение какого-либо времени отмечалась склонность к повышенному образованию экхимозов, то ремиссия в течение 3 месяцев отмечается не более чем у 19% больных. Летальный исход, как было сказано выше, при ИТП у детей крайне редок и связан исключительно с внутричерепным кровоизлиянием.
Дифференциальный диагноз проводится со следующими заболеваниями: лейкоз, апластическая анемия, гемолитико-уремический синдром, синдром Вискотта — Олдрича, анемия Фанкони, TAR-синдром, тромботическая тромбоцитопеническая пурпура, СКВ, синдром Казабаха — Меррита, аномалии Мэя-Хегглина, Бернара — Сулье, синдром Фишера, миелодиспластический синдром, ВИЧ-инфекция, вирусные инфекции (CMV, EBV, парвовирус В19).
Диагностические тесты. Научно обоснованных данных о точности и достоверности диагностических тестов, применяемых при ИТП, мало. Как правило, для постановки окончательного диагноза необходимо подтвердить наличие изолированной тромбоцитопении и исключить другие возможные ее причины, анализируя данные анамнеза, объективного обследования, результаты клинического анализа крови и мазка периферической крови. Данных о прогностической значимости или эффективности дополнительных методов исследования (например, выявление анти-ДНК, антикардиолипиновых и антитромбоцитарных антител, проба Кумбса, уровни иммуноглобулинов, определение числа тромбоцитов у родителей) в типичных случаях ИТП нет.
В миелограмме при ИТП изменений не отмечается, выявляется нормальное или повышенное количество мегакариоцитов, что доказывает тромболитический характер тромбоцитопении. В связи с этим исследование костного мозга необходимо проводить тогда, когда есть симптомы, указывающие на возможность другого диагноза: потеря веса, боли в костях, гепатоспленомегалия, лимфоаденопатия, хроническое течение болезни в сочетании с анемией, лейкопенией или лейкоцитозом. Аспирация костного мозга является обязательной для тех больных, которым показана терапия глюкокортикоидами (ГК). Если ребенку с острым лейкозом был поставлен ошибочный диагноз и терапия ГК проводится как монотерапия, то это может неблагоприятно сказаться на прогнозе. Во время проведения стернальной пункции нужно постараться успокоить ребенка, так как теоретически повышение интракраниального давления может спровоцировать внутричерепное кровоизлияние. Это достигается путем назначения седативных препаратов перед процедурой, быстрой техникой аспирации, особенно у возбудимых детей; в других случаях вопрос решается индивидуально.
Поскольку вирусы ветряной оспы, кори, краснухи, CMV, EBV, парвовирус В19 могут вызвать ИТП, должно проводиться тестирование на эти инфекции, особенно в случае хронической ИТП.
Лечение острой ИТП. Все больные ИТП с любыми проявлениями геморрагического синдрома должны быть госпитализированы. И в первую очередь нужно решить вопрос: лечить или не лечить больного? У всех больных целью терапии и/или наблюдения является профилактика серьезных (тяжелых) кровотечений (внутричерепного кровоизлияния или кровотечения из слизистых с развитием тяжелой постгеморрагической анемии), угрожающих жизни больного, в течение периода тромбоцитопении. Если любое из этих осложнений присутствует, то терапия показана немедленно, вне зависимости от количества тромбоцитов. При отсутствии таких осложнений врач-гематолог должен решать этот вопрос, полагаясь на здравый смысл. Так как у детей чаще встречается острая ИТП и возможно спонтанное выздоровление, при отсутствии кровотечений целесообразно просто наблюдать за больным. Если кожный геморрагический синдром не нарастает, то терапия ГК не показана. Как правило, в такой ситуации геморрагии на коже исчезают в течение 7-10 дней, количество тромбоцитов нормализуется позже, индивидуально у каждого больного. Длительность тромбоцитопении определяется временем циркуляции в крови антитромбоцитарных антител — от 3-6 недель до 3-6 месяцев. Тромбоцитопения при отсутствии геморрагического синдрома лечения не требует. При нарастании кожного геморрагического синдрома в процессе наблюдения за больным и/или присоединении кровотечения показана иммуносупрессивная терапия ГК. ГК (преднизолон) как начальная терапия назначается в средней суточной дозе 60 мг/м2 (что соответствует 2 мг/кг в сутки) на 3 недели по 3 раза в день (600, 1000, 1400) с учетом суточного биоритма — 2/3 суточной дозы ГК даются в утренние часы. Трехнедельный срок терапии ГК в полной дозе определяется периодом полураспада антитромбоцитарных антител, который и равен 3 неделям.
При достижении полной клинико-лабораторной ремиссии доза преднизолона уменьшается по 5-10 мг в 3 дня до полной отмены. Снижение количества тромбоцитов на фоне уменьшения дозы ГК не является показанием к возврату прежней дозы. В случае достижения только клинической ремиссии продолжение терапии ГК в прежней дозе до нормализации количества тромбоцитов нецелесообразно, так как пролонгированное лечение ГК подавляет продукцию тромбоцитов и способствует развитию осложнений. Необходимо начать снижение дозы ГК, но на прерывистом курсе — 5 мг через день до полной отмены.
При наличии у больного серьезных кровотечений начальная доза ГК может быть 3-5 мг/кг в сутки на 3-5 дней до купирования геморрагического синдрома с переходом затем на дозу 2 мг/кг в сутки. Альтернативным путем может быть пульс-терапия: метилпреднизолон 30мг/кг в сутки в течение трех дней (время инфузии — не менее 20 минут) до купирования геморрагического синдрома и повышения тромбоцитов до безопасного уровня (более 20 000). Пульс-терапия и ГК в дозе 3-5 мг/кг в сутки могут быть использованы при рецидиве тромбоцитопении и геморрагического синдрома после завершения начального курса ГК.
Начальной или альтернативной терапией может быть введение внутривенного иммуноглобулина (IgG в/в). Это наиболее важное достижение в лечении ИТП за последнее десятилетие. Основной механизм действия IgG в/в — обратимая блокада Fc-рецепторов на макрофагальных клетках. В результате уменьшается опсонизация тромбоцитов и таким образом предотвращается их разрушение в кровяном русле. Используемые препараты: октагам, пентаглобин. Доза IgG в/в — 0,4 г/кг в сутки в течение 5 дней. IgG в/в способен очень быстро, через 24-48 часов, повышать количество тромбоцитов у большинства больных ИТП до уровня более 100000. Рандомизированные исследования показали, что курсы терапии IgG в/в и ГК дают примерно одинаковый эффект. Преимущества IgG в/в — отсутствие токсичности, высокая эффективность, не передается ВИЧ; недостатки — длительная инфузия (несколько часов), высокая стоимость (курс — от 3000 до 5000 долл.). Инфузия IgG в/в не проводится при количестве тромбоцитов более 30 000.
Для лечения кровотечений, угрожающих жизни больного, в качестве начальной терапии используются:
* ГК в высоких дозах или пульс-терапия;
* IgG в/в;
* сочетание ГК и IgG в/в;
* экстренная спленэктомия (по витальным показаниям, прежде всего при внутричерепном кровоизлиянии).
Трансфузии тромбомассы не показаны из-за сенсибилизации и резкого повышения образования антитробоцитарных антител.
Также в период тромбоцитопении с проявлениями геморрагического синдрома резко ограничивается двигательный режим. Проводится симптоматическая терапия:
* ангиопротекторы — дицинон per os в/в;
* ингибиторы фибринолиза — аминокапроновая кислота 0,2-0,5 г/кг в сутки per os, в/в;
* местные способы остановки кровотечений.
Рекомендации по начальному лечению больных ИТП представлены в табл. 1.
Таблица 1. Начальное лечение идиопатической тромбоцитопенической пурпуры (рекомендации Американского общества гематологов, 1997 г.)
Предсказать острое или хроническое течение ИТП невозможно. Но можно выделить факторы, способствующие хронизации процесса:
* неадекватная терапия ГК — начальная доза менее 2 мг/кг в сутки, длительность курса ГК в полной дозе менее 3 недель;
* переливание тромбомассы;
* вирусная персистенция;
* хронические очаги инфекции;
* пубертатный период;
* социально-бытовые факторы, определяющие эмоциональный статус больного.
Диспансерное наблюдение при острой ИТП проводится в течение 5 лет. Отвод от прививок также в течение пяти лет, противопоказаны прививки живими вирусными вакцинами. Не рекомендуется смена климата в течение 3-5 лет. Не следует использовать аспирин, нитрофураны, УВЧ, УФО. Противопоказана инсоляция. Следует проводить санацию хронических очагов инфекции, профилактику ОРВИ.
Лечение хронической ИТП. Длительность ИТП более 6 месяцев свидетельствует о хронической форме заболевания, хотя не исключена вероятность спонтанного выздоровления даже через несколько лет, также реальна возможность нового ухудшения (криза) или непрерывно рецидивирующего течения. При хронической ИТП терапия также проводится с целью уменьшения риска серьезных кровотечений. Число тромбоцитов может не коррелировать с риском кровотечений. У всех больных должны быть исключены аспирин и другие антиагреганты и/или антикоагулянты. Не следует делать внутримышечные инъекции. Исключаются вакцинации и аллергены (в том числе пищевые), так как они могут увеличить степень тромбоцитопении. Ребенку с выраженным геморрагическим синдромом и/или количеством тромбоцитов менее 50000 следует резко ограничить двигательный режим, игры на улице. Даже при минимальной выраженности геморрагического синдрома и количестве тромбоцитов менее 100 000 занятия спортом нужно прекратить, чтобы предупредить возможность травмы. Плавание в этом смысле более безопасно. При сохранении тромбоцитопении, но отсутствии геморрагического синдрома лечение не требуется, если двигательный режим ограничен. Если ребенок ведет достаточно активный образ жизни, необходима симптоматическая терапия: чередование курсов фитотерапии (крапива, тысячелистник, шиповник, пастушья сумка, арника и др.) с ангиопротекторами (дицинон — 1 др. x 3 р., магнум С 0,25-0,5 x 1р., траумель 1т. x 3 р.). Симптоматическая терапия постоянно проводится при непрерывно рецидивирующем течении хронической ИТП.
При обострении, то есть резком усилении кожного геморрагического синдрома, кровотечениях из слизистых, с целью купирования геморрагического синдрома показана терапия ГК коротким курсом — преднизолон 2-3 мг/кг в сутки в течение 5-7 дней с полной отменой за 1-3 дня в сочетании с ангиопротекторами и ингибиторами фибринолиза.
При непрерывно рецидивирующем течении хронической ИТП или частых обострениях с кровотечениями из слизистых необходимо решить вопрос о плановой спленэктомии. При этом клинико-лабораторная ремиссия достигается у 70-90% больных. Основная масса антитромбоцитарных антител синтезируется в селезенке, после удаления которой титр антител значительно уменьшается и не определяется. Спленэктомия — это большая операция, риск постспленэктомического сепсиса превышает риск серьезного кровотечения. Поэтому спленэктомия должна проводиться не ранее чем через 12 месяцев после установления диагноза. Принятый возраст для спленэктомии — пять лет и старше, что связано с созреванием иммунной системы к этому возрасту. Показаниями к плановой спленэктомии являются: частые обострения с кровотечениями из слизистых при количестве тромбоцитов менее 30 000. При некупирующемся кровотечении или угрозе кровоизлияния в ЦНС целесообразна спленэктомия по витальным показаниям. Во время операции должны быть удалены все добавочные селезенки, в противном случае тромбоцитопения будет сохраняться. Если симптомы ИТП не исчезают и после спленэктомии, то при активном кровотечении и количестве тромбоцитов менее 30 000 могут использоваться ГК коротким курсом, IgG в/в.
При непрерывно рецидивирующем течении хронической ИТП до и/или после спленэктомии в настоящее время обсуждается использование модуляторов иммунного ответа (особенно у часто болеющих детей) — препаратов интерферона (интрон А, лейкинферон, g-интерферон). Однако достоверные данные об эффективности такой терапии или доказательства, на основе которых можно было бы разработать рекомендации, сегодня отсутствуют. Описаны длительные ремиссии после терапии азатиоприном, винкристином, даназолом. Необходимо подчеркнуть — лечение следует проводить индивидуально! При сохранении ИТП после спленэктомии необходимо исключить аутоиммунные заболевания, иммунодефицитное состояние, синдром Эванса и др.
Литература
1. Арайя Л. С. Внутричерепные кровоизлияния при иммунной тромбоцитопенической пурпуре у детей // Гематол. и трансфузиол. 1998. №3. С. 40.
2. Ващенко Т. Ф., Плахута Т. Г., Цымбал И. Н. и др. Значение иммунокорригирующей терапии препаратами интерферона в лечении идиопатической тромбоцитопенической пурпуры у детей // Гематол. и трансфузиол. 1999. №1. С. 9-14.
3. Имбах П. Диагноз и лечение хронической иммунной тромбоцитопенической пурпуры у детей // Гематол. и трансфузиол. — 1998. №3. С. 27-31.
4. Донюш Е. К. Современное состояние вопроса об идиопатической тромбоцитопенической пурпуре у детей // Педиатрия. 1999. №2. С. 56-77.
5. Мазурин А. В. Тромбоцитопеническая пурпура у детей. М., 1971.
6. Шабалов Н. П. Патогенез, клиника, дифференциальный диагноз и лечение идиопатической тромбоцитопенической пурпуры у детей: Автореф. канд. мед. наук. 1977.
7. Miller D. R. // Blood Diseases of Infancy and Childhood. 1995. P. 877-893.
8. Nathan D. Y., Oski F. A. // Hematology of Infancy and Childhood. 1992. P. 1564-1593.
Статья опубликована в журнале "Лечащий Врач"
Автор: Цымбал И. Н., кандидат медицинских наук
Детская клиническая больница № 38 ФУ Медбиоэкстрем МЗ РФ
опубликовано 12/11/2009 15:18
обновлено 17/07/2011
— Гематология
Как врач общей практики может диагностировать инфекцию, вызванную парвовирусом В19? В чем заключается опасность этой инфекции для детей с гематологическими заболеваниями?
Как врач общей практики может диагностировать инфекцию, вызванную парвовирусом В19?
В чем заключается опасность этой инфекции для детей с гематологическими заболеваниями?
Хотя другие представители данного рода вирусов поражают собак, кошек, лисиц и даже медведей гризли, штамм В19 патогенен только для людей и размножается исключительно в предшественниках эритроцитов человека.
Антитела-IgG к этим вирусам выявляются приблизительно у 50% подростков, достигших 15 лет, и более чем у 90% пожилых людей [2]. Ежегодно вираж серологических проб происходит у 1,5% женщин детородного возраста. Повышение заболеваемости отмечается каждые три-четыре года, обычно в конце зимы, весной и в начале лета.
Большинство специалистов считают, что данная инфекция передается воздушно-капельным путем, хотя, в отличие от других вирусных заболеваний, в данном случае репликации возбудителя в носоглотке не обнаружено. Парвовирус В19 не выделяется ни с мочой, ни с калом.
Подобно тому как выпускаемые в Бордо изысканные вина в 1855 году были разделены на пять сортов, еще в прошлом веке экзантемы у детей были разбиты на пять групп. Инфекционная эритема получила название пятой болезни, корь — первой, скарлатина — второй, краснуха — третьей, болезнь Филатова-Дьюка — четвертой; в настоящее время четвертая болезнь не признается отдельным заболеванием [3]. Впоследствии была описана младенческая розеола (roseola infantum).
Инфекционной эритемой поражаются преимущественно дети в возрасте 4-10 лет. В течение двух-пяти дней и до появления сыпи клинические симптомы неспецифичны и могут включать насморк, фарингит, головную боль, тошноту, понос и общее недомогание, а также лихорадку. В это время ребенок наиболее заразен.
Затем появляются кожные симптомы; это означает, что ребенок уже не заразен. Сначала на обеих щеках появляется ярко-красная сыпь, при этом вокруг рта кожа бледная, что похоже на следы от пощечин. Удивительно то, что у заболевших взрослых кожа щек не изменяется.
Такую сыпь трудно выявлять у детей-негров, для которых своевременная диагностика может иметь особое значение, если у них одновременно наблюдается серповидноклеточная анемия. Установлению диагноза помогают жалобы на зуд в подошвах. Действительно, зуд, особенно на подошвах, может быть самым выраженным симптомом заболевания, хотя неясно, чем объяснить такую связь. У взрослых в результате инфицирования парвовирусом В19 часто наблюдаются боли в суставах и артрит. Эти же явления встречаются приблизительно у 10% детей с инфекционной эритемой.
Хотя артрит обычно вскоре проходит, у небольшой части детей он принимает затяжной характер, при этом его можно спутать с юношеским ревматоидным артритом (с болезнью Стилла [Still]). Как бы то ни было, парвовирус В19 в отдаленные сроки не вызывает деструкции суставов [4].
Во время этих кризов (которые у ребенка часто могут быть первым проявлением гематологической патологии, до этого хорошо компенсированной) быстро развиваются симптомы анемии: бледность, утомляемость, одышка и спутанность сознания. На поздней стадии развиваются застойная сердечная недостаточность и некроз костного мозга, что может привести к смерти. Однако переливание крови в начале криза обычно позволяет добиться полного выздоровления у большинства детей.
Гематологические изменения во время инфекции, вызванной парвовирусом В19, могут наблюдаться и у детей, которые ранее были здоровы.
Как и при многих вирусных инфекциях, часто наблюдаются в разной степени выраженные нейтропения и тромбоцитопения; эти признаки не имеют почти никакого диагностического значения. В литературе сообщалось о возможной связи инфекции, вызываемой вирусом В19, с идиопатической тромбоцитопенической пурпурой [6], а также с пароксизмальной холодовой гемоглобинурией (при которой гемолитическая анемия начинает развиваться под воздействием холода).
Наибольшую тревогу вызывает то, что ребенок с инфекционной эритемой может заразить свою беременную мать при отсутствии у нее специфического иммунитета [7]. Плод весьма подвержен воздействию парвовируса В19, особенно между 20 и 28 неделями внутриутробного развития.
Как и у детей с сопутствующими гематологическими заболеваниями, вирус поражает клетки-предшественники эритроцитов, что ведет к глубокой анемии. Это может вызвать неиммунный отек плода (из-за застойной сердечной недостаточности) и его гибель.
Из всех беременных, впервые заражающихся данной инфекцией на указанном сроке (при этом только у 30% из них выражены клинические симптомы), у 10% женщин наступает гибель плода [8]. Обнадеживает то, что у выживших младенцев, родившихся от матерей, которые были инфицированы парвовирусом В19 во время беременности, не отмечается повышенной частоты врожденных пороков развития, неврологической патологии или задержки развития.
Что же должен предпринять врач общей практики, если есть подозрение, что беременная заразилась парвовирусом? Путем определения специфических противовирусных антител можно подтвердить факт инфицирования только через некоторое время: антитела-IgM появляются через десять дней после попадания вируса в организм, а антитела-IgG — через две недели. У такой беременной необходимо регулярно проводить ультразвуковое исследование, чтобы не пропустить развитие отека плода, при котором следует решать вопрос о раннем фетальном переливании крови [9].
Создать такую вакцину вполне реально. Белок оболочки вируса — это сильный стимулятор гуморальной иммунной реакции, что делает вакцину в высшей степени эффективной [11]. Необходимо использовать конъюгаты и вспомогательные вещества (адъюванты). Может быть применен рекомбинантный белок оболочки вируса.
Вакцинацию целесообразно будет проводить у молодых женщин и детей с гематологическими заболеваниями, однако в настоящее время спорным остается вопрос о введении универсальной вакцины против кори, эпидемического паратита, краснухи и парвовирусной инфекции.
Литература
Парвовирус В19 широко распространен в популяции, ассоциируется с рядом заболеваний, у беременных — с развитием спонтанных абортов, неиммунной водянки, внутриутробной гибели плода. Рассмотрены пути передачи инфекции, клинические проявления, методы диагност
Parvovirus В19 is widely spread in population and it is associated with a number of diseases. With pregnant women it is associated with development of spontaneous abortion, nonimmune hydrops fetalis, pre-natal fetal death. The ways of contagion, clinical manifestations, methods of diagnostics and therapy aimed on prevention of intrauterine infection are analyzed in the article.
Геном парвовируса В19 кодирует: два капсидных протеина VP1 и VP2; неструктурный протеин NS-1; малые неструктурные протеины 11-Da, 9-Da и 7,5-kDa. Протеин NS-1 является трансактиватором вирусного Р6 промотора экспрессии WAF1/CIP1 гена, продукт которого р21WAF ингибирует циклин-Cdk комплексы, блокируя клеточный цикл в G1-фазу, также NS-1 нарушает функцию E2 F-семейства транскрипциональных факторов, блокируя клеточный цикл в G2/M-фазы, что обеспечивает репликацию вирусной ДНК [5–7]. Протеин VP2 обладает способностью к самосборке вирусного капсида в отсутствии вирусной ДНК, с образованием частиц, сходных по антигенным и иммуногенным свойствам с вирионом [8]. Протеин VP1 содержит подобную фосфолипазе А2 область (VP1 u), отвечающую за инвазию вируса в ядро инфицированной клетки [9]. 11-Da протеин играет важную роль в репликации вирусной ДНК и апоптозе инфицированных клеток [10].
Клеточным рецептором для парвовируса В19 является Р-антиген, расположенный на клетках трофобласта, костного мозга, печени, почек, легких, синовиальной оболочки, эпителии, эндотелии, миоцитах, лимфоидной ткани [11, 12]. Люди, у которых отсутствует Р-антиген (1 на 200 000 человек), не восприимчивы к парвовирусной инфекции [13]. Жизненный цикл парвовируса B19 состоит из следующих этапов: связывание с Р-антигеном; интернализация — проникновение внутрь клетки с помощью a5b1-интегринов; переход в ядро клетки, репликация ДНК; транскрипция, сборка капсида; упаковка генома в капсид, лизис клетки-хозяина и выход вирионов [14]. Основные компоненты клеточного и гуморального иммунного ответа на парвовирус В19 представлены на рис. 2 [15].
.jpg)
Парвовирус В19 широко распространен в популяции людей, более чем 80% взрослого населения являются серопозитивными, частота выявления IgG к парвовирусу у детей первых десяти лет жизни составляет от 2% до 21% (рис. 3). В 25–68% случаев парвовирусная инфекция В19 протекает бессимптомно [16]. Во время беременности к парвовирусной инфекции восприимчивы 1–5% женщин, в период подъема заболеваемости до 3–34%, у 50% женщин парвовирусная инфекция протекает бессимптомно [17, 18]. Максимальный уровень Р-антигена на ворсинах трофобласта регистрируется в первом и втором триместре беременности, что определяет трансплацентарную передачу вируса с развитием спонтанных абортов, неиммунной водянки, внутриутробной гибели плода [19, 20].
Основной путь передачи парвовирусной инфекции В19 — воздушно-капельный, также возможны трансплацентарный, трансфузионный, трансплантационный пути заражения [21–23]. Характерна зимне-весенняя сезонность, с максимальным подъемом заболеваемости в весенние месяцы. Эпидемические подъемы заболеваемости парвовирусной инфекцией наблюдаются каждые 3–6 лет. Инкубационный период в среднем составляет от 4 до 14 дней (максимальный до 21 дня), вирусемия развивается приблизительно через 7 дней после инокуляции вируса и продолжается в течение 4–7 суток [24]. Патофизиологические компоненты парвовирусной инфекции В19 представлены на рис. 4.
Парвовирус В19 ассоциируется с разнообразными заболеваниями, развитие которых сопряжено с особенностями иммунологического и гематологического статуса человека (таблица).
Инфекционная эритема
Синдром полиартропатии
Синдром полиартропатии наблюдается у 75% взрослых с инфекционной эритемой, чаще у женщин средних лет. В процесс вовлекаются пястно-фаланговые, лучезапястные, локтевые, коленные, голеностопные суставы. Обычно наблюдается симметричное поражение суставов. Синдром полиартропатии клинически напоминает ревматоидный артрит, может персистировать в течение 3 месяцев, повторяться несколько раз в течение года [29].
Транзиторный апластический криз
Транзиторный апластический криз развивается при парвовирусной инфекции В19 у пациентов с наследственным микросфероцитозом, серповидно-клеточной и железодефицитной анемией, талассемией. Характеризуется не только парциальной гипоплазией эритроидного ростка, но и развитием тромбоцитопении, нейтропении и даже панцитопении [30, 31].
Поражение ЦНС
Неврологическая манифестация парвовирусной инфекции В19 сопровождается развитием: энцефалита, менингоэнцефалита, судорожного синдрома, периферических невропатий, синдрома запястного канала [32].
Поражение печени
Парвовирус В19 может вызывать острый гепатит, фульминантную печеночную недостаточностью, хронический гепатит, гепатит-ассоциированную апластическую анемию, гепатит с гемофагоцитарным лимфогистиоцитозом [33]. При биопсии печени выявляется гепатоцеллюлярный и каналикулярный холестаз, апоптоз и некроз гепатоцитов [34, 35].
Кардит
Энтеровирусы и аденовирусы до недавнего времени считались основными причинами вирусных кардитов, однако с внедрением метода полимеразной цепной реакции с гибридизационно-флюоресцентной детекцией, при проведении эндомиокардиальной биопсии все чаще стали регистрироваться парвовирус В19 и вирус герпеса 6-го типа [36]. Многочисленные копии вирусного генома парвовируса В19 определяются в эндотелии интрамиокардиальных артериол, капилляров и посткапилярных венул, инициируя синтез фактора некроза опухоли альфа (ФНО-a), интерлейкинов (ИЛ): ИЛ-6, ИЛ-8, ИЛ-2, интерферона гамма (ИФН-g), рецепторов ИЛ-2 [37]. Прямое цитопатическое действие парвовируса, апоптоз, активация врожденного и адаптивного иммунного ответа приводят к эндотелиальной дисфункции с последующим вентрикулярным ремоделированием и развитием дилатационной кардиомиопатии [38–40].
.jpg)
Неиммунная водянка плода
Неиммунная водянка плода может развиваться при поражении парвовирусом В19 плода с гестационным возрастом 13–20 недель. Сопровождается анемией, гипоксией, гепатитом (непосредственное повреждение гепатоцитов вирусом и опосредованное — за счет отложения гемосидерина), кардитом, с формированием печеночной и сердечной недостаточности. При проведении ультразвукового исследования плода выявляется: кардиомегалия, отек грудной клетки, асцит, выпот жидкости в плевральные полости и перикард, отек плаценты [41]. При своевременной диагностике и проведении гемотрансфузии плоду внутриутробно, благоприятный исход возможен в 83% случаев [42].
Врожденная парвовирусная инфекция В19
В первые месяцы жизни ребенка врожденная парвовирусная инфекция манифестирует развитием анемии Даймонда–Блекфена, гидроцефалии, полимикрогирии, кардита, гепатита [43, 44].
Диагностика парвовирусной инфекции В19
Гематологические изменения чаще носят преходящий характер в виде анемии, ретикулоцитопении или полного отсутствия ретикулоцитов, нейтропении, эозинофилии, моноцитоза, тромбоцитопении. Возможно повышение печеночных трансаминаз (аланинаминотрансферазы и аспартатаминотрансферазы), С-реактивного белка, скорости оседания эритроцитов.
Методы диагностики парвовирусной инфекции В19:
В случае, если у беременной женщины регистрируются симптомы парвовирусной инфекции В19 (инфекционная эритема, артропатии) или она была в контакте с больным данной инфекцией, рекомендовано проведение ПЦР и/или ИФА сыворотки крови. При выявлении IgM к парвовирусу или положительном результате ПЦР необходимо УЗИ плода каждые 2 недели. При наличии УЗ-признаков неиммунной водянки плода показано проведение кордоцентеза или амниоцентеза (ПЦР крови плода или амниотической жидкости на парвовирус В19) [45]. При положительных данных на парвовирус B19 и ультразвуковых признаках поражения плода ставится вопрос о прерывании беременности.
Терапия парвовирусной инфекции В19
В настоящее время специфической этиотропной терапии парвовирусной инфекции не существует. В зависимости от клинической формы парвовирусной инфекции В19 проводится посиндромная терапия (нестероидные противовоспалительные препараты, глюкокортикостероидные препараты, трансфузия эритромассы и т. д.). При поражении нервной системы, кардите, гепатите — внутривенный человеческий иммуноглобулин. Наиболее эффективны препараты иммуноглобулина, полученные от большого числа доноров: Октагам, Интраглобин, Пентаглобин.
Профилактика парвовирусной инфекции В19
Эффективной профилактики парвовирусной инфекции в настоящее время не существует. Ведется разработка безопасной и иммуногенной вакцины против парвовирусной инфекции В19 [46].
Основные меры профилактики направлены на предотвращение внутриутробного инфицирования плода: введение скрининга до планируемой беременности и во время беременности на наличие IgG к парвовирусу В19; информирование серонегативной беременной женщины о существовании парвовирусной инфекции В19, а также о необходимости ограничения контакта с детьми, особенно с типичными проявлениями парвовирусной инфекции [47].
В заключение необходимо отметить, что в нашей стране не ведется статистика заболеваемости парвовирусной инфекцией В19, а также нет точных данных о случаях врожденной парвовирусной инфекции. Наш опыт свидетельствует, что в ряде случаев, при клинических проявлениях врожденной инфекции, парвовирус B19 может ассоциироваться в частности с герпесвирусами, что существенно затрудняет как диагностику, так и лечение данных пациентов. Учитывая это, следует признать рациональным включение обследования на парвовирус В19 новорожденных детей при подозрении на врожденную инфекцию.
Литература
Ю. Б. Белан 1 , доктор медицинских наук, профессор
М. В. Старикович, кандидат медицинских наук
Читайте также:

