Патогенная стадия американского трипаносомоза
Обновлено: 24.04.2024
Африканский трипаносомоз человека, также известный как сонная болезнь, относится к трансмиссивным паразитарным заболеваниям. Его возбудителям являются паразитирующие простейшие, принадлежащие к роду трипаносом. Они передаются человеку при укусе мухи цеце (род Glossina), инфицированной от людей или животных, выступающих в роли хозяев этих патогенных для человека паразитов.
Муха цеце обитает только в Африке к югу от Сахары, и передавать болезнь могут лишь некоторые ее виды. По неизвестным на сегодняшний день причинам во многих районах ареала обитания мухи цеце случаи сонной болезни не отмечаются. Наиболее подвержены укусам мухи цеце и, следовательно, данной болезни жители эндемичных сельских районов, занимающиеся сельским хозяйством, рыболовством, животноводством и охотой. Случаи болезни могут отмечаться как на территории отдельных деревень, так и в целом регионе. В пределах отдельно взятого инфицированного района интенсивность распространения болезни может сильно варьироваться от одного сельского поселения к другому.
Формы африканского трипаносомоза человека
Африканский трипаносомоз человека имеет две формы в зависимости от вида возбудителя:
Существует еще одна форма трипаносомоза, которая встречается преимущественно в Латинской Америке. Она известна как американский трипаносомоз, или болезнь Шагаса. Возбудитель болезни Шагаса относится к другому подроду Trypanosoma, передается другими переносчиками и вызывает заболевание, клинические проявления которого отличаются от африканского трипаносомоза человека.
Трипаносомоз животных
Другие виды и подвиды паразитов рода Trypanosoma являются патогенными для животных и вызывают трипаносомоз у некоторых видов диких и домашних животных. Трипаносомоз крупного рогатого скота называют нагана. Трипаносомоз домашних животных, особенно крупного рогатого скота, серьезно подрывает экономическое развитие инфицированных сельских районов.
Животные могут быть носителями патогенных для человека паразитов, особенно T.b. rhodesiense, причем домашние и дикие животные являются важным резервуаром последнего. Животные могут быть также инфицированы T.b. gambiense и, вероятно, могут также выступать в качестве его резервуара, хотя и в меньшей степени. Тем не менее реальная роль животного резервуара в эпидемиологии гамбийской формы болезни до сих пор недостаточно изучена.
Крупные эпидемии
За последнее столетие в Африке произошло несколько эпидемий:
- эпидемия 1896-1906 гг., преимущественно затронувшая Уганду и бассейн реки Конго;
- эпидемия 1920 г., затронувшая ряд африканских стран; и
- последняя по времени эпидемия, начавшаяся в 1970 г. и продолжавшаяся до конца 1990-х гг.
В 1920 г. борьба с эпидемией велась силами передвижных бригад, которые выполняли скрининг миллионов людей, проживающих в районах высокого риска. К середине 1960-х гг. распространение болезни было взято под контроль, и на всем континенте регистрировалось менее 5 000 случаев заболевания. После такого успеха эпиднадзор был ослаблен, в связи с чем болезнь вернулась, и к 1970 г. в нескольких регионах ее вспышки разрослись до эпидемии. В 1990-е гг. и в начале XXI века благодаря усилиям ВОЗ, осуществлению национальных программ по борьбе с болезнью, двустороннему сотрудничеству и деятельности неправительственных организаций (НПО) тенденция к росту заболеваемости была остановлена.
Поскольку число новых случаев заболевания африканским трипаносомозом человека за период с 2000 по 2012 г. значительно сократилось в результате международных координированных усилий, в Дорожной карте ВОЗ по борьбе с забытыми тропическими болезнями была поставлена цель по его элиминации как проблемы общественного здравоохранения к 2020 г. и ликвидации передачи инфекции (сведение числа случаев к нулю) к 2030 г.
Бремя болезни
Сонная болезнь угрожает здоровью миллионов людей в 36 странах Африки к югу от Сахары. Многие из них проживают в отдаленных районах с ограниченным доступом к необходимой медицинской помощи, что затрудняет эпиднадзор и, следовательно, диагностику и лечение больных. Кроме того, важными факторами, способствующими передаче инфекции, являются перемещение населения, вооруженные конфликты и нищета.
Текущий ареал распространения заболевания
Показатели распространенности болезни варьируются между странами, а также между районами на территории отдельно взятой страны.
Механизм передачи и симптомы
Болезнь передается главным образом при укусе инфицированной мухи цеце, однако известны и другие механизмы передачи инфекции:
- передача инфекции от матери ребенку: трипаносомы могут проходить через плаценту и инфицировать плод;
- возможна механическая передача через других кровососущих насекомых, однако эпидемиологическая значимость этого пути передачи инфекции неизвестна;
- известны случаи случайного инфицирования персонала лабораторий в результате травмы зараженной иглой;
- есть сведения о передаче паразита половым путем.
На первой стадии инфекции трипаносомы размножаются в подкожных тканях, крови и лимфе. Эта стадия известна как гемолимфатическая фаза болезни, для которой характерны приступы лихорадки, головная боль, увеличение лимфоузлов, боль в суставах и зуд.
На второй стадии паразиты проходят гематоэнцефалический барьер и инфицируют центральную нервную систему. Эта стадия известна как неврологическая, или менингоэнцефалитическая. В целом на этой стадии появляются наиболее очевидные признаки и симптомы болезни: изменение поведения, спутанность сознания, сенсорные расстройства и нарушение координации движений. Важным клиническим признаком на этой стадии является нарушение цикла сна, которое и дало название этой болезни. Без лечения сонная болезнь считается смертельной, хотя известны случаи здорового носительства инфекции.
Ведение болезни: постановка диагноза
Ведение болезни осуществляется в три этапа:
- Скрининг на предмет выявления вероятной инфекции. Он включает серологическое исследование (возможно только в отношении T.b. gambiense) и проверку на наличие клинических признаков, в частности увеличения шейных лимфатических узлов.
- Поиск паразита в биологических жидкостях.
- Определение стадии болезни. Для этого выполняется клиническое обследование пациента и в некоторых случаях исследование спинномозговой жидкости, полученной путем люмбальной пункции.
Во избежание необходимости применения сложных и тяжелых методов лечения диагностика должна выполняться как можно раньше до развития неврологической стадии заболевания.
Ввиду длительного и бессимптомного течения первой стадии сонной болезни, вызванной T. b. gambiense, рекомендуется организация тщательного и активного скрининга групп риска с целью выявления пациентов на ранней стадии заболевания и ограничения дальнейшего распространения инфекции посредством их лечения, после которого они перестают выступать в качестве резервуара. Всесторонний скрининг населения требует серьезных финансовых вложений в кадровые и материальные ресурсы. В Африке, особенно в отдаленных районах с наибольшей распространенностью заболевания, этих ресурсов часто не хватает. В результате часть инфицированных умирает еще до постановки диагноза и получения лечения.
Лечение
Тип лечения зависит от формы и стадии заболевания. Раннее выявление болезни повышает шансы на успешное излечение. Ввиду того что паразит может сохранять жизнеспособность в течение длительного времени и вызывать рецидивы через много месяцев после окончания терапии, для оценки результатов лечения пациенты должны оставаться под наблюдением в течение периода продолжительностью до 24 месяцев, в рамках которого следует проводить клиническое обследование пациентов и выполнять лабораторные исследования физиологических жидкостей, в том числе в некоторых случаях спинномозговой жидкости, полученной путем люмбальной пункции.
Для успешного лечения болезни на второй стадии необходимо применение лекарственных препаратов, способных преодолевать гематоэнцефалический барьер и нейтрализовать паразита в центральной нервной системе.
Препараты для лечения болезни на первой стадии:
- Пентамидин: впервые получен в 1940 г., используется для лечения сонной болезни, вызванной T.b. gambiense, на первой стадии. Несмотря на наличие серьезных побочных эффектов, препарат в целом хорошо переносится.
- Сурамин: впервые получен в 1920 г., используется для лечения болезни, вызванной T.b. rhodesiense, на первой стадии. Препарат имеет ряд нежелательных побочных эффектов, включая нефротоксическое действие и аллергические реакции.
Препараты для лечения болезни на второй стадии:
Препараты для лечения заболевания на обеих стадиях:
Фексинидазол – пероральный препарат для лечения гамбийской формы африканского трипаносомоза человека. В 2019 г. препарат был включен в Перечень основных лекарственных средств ВОЗ и рекомендован в руководстве ВОЗ по лечению африканского трипаносомоза человека. Препарат показан в качестве терапии первой линии на первой и нетяжелой второй стадии заболевания. Он принимается в течение 10 дней через 30 минут после приема твердой пищи под наблюдением квалифицированного медицинского персонала. В настоящее время проводятся клинические испытания этого препарата для лечения родезийской формы трипаносомоза.
Частно-государственные партнерства
В 2000 и 2001 гг. ВОЗ учредила частно-государственное партнерство с компаниями Aventis Pharma (в настоящее время Sanofi) и Bayer HealthCare, в результате чего была создана программа по эпиднадзору и борьбе с данным заболеванием под руководством ВОЗ, в рамках которой эндемичным странам предоставляется поддержка в осуществлении противоэпидемических мероприятий и бесплатно поставляются лекарственные препараты.
Партнерство неоднократно продлевалось в 2006, 2011, 2016 и 2021 г. Успехи в сокращении числа случаев сонной болезни и появление реальной перспективы ее элиминации побудили ряд других партнеров из частного сектора поддержать инициативу ВОЗ по элиминации болезни как проблемы общественного здравоохранения и обеспечению ликвидации передачи инфекции к 2030 г.
Деятельность ВОЗ
ВОЗ оказывает содействие и техническую поддержку национальным программам по борьбе с сонной болезнью.
Для содействия разработке новых и недорогостоящих средств диагностики ВОЗ в 2009 г. создала банк образцов биоматериалов, которыми могут пользоваться исследователи. В банке, размещенном в Институте Пастера в Париже, хранятся образцы крови, сыворотки, спинномозговой жидкости, слюны и мочи, взятые у пациентов, инфицированных обеими формами болезни, а также образцы, взятые у неинфицированных людей из эндемичных районов.
В 2014 г. в целях активизации и поддержки усилий по элиминации болезни по инициативе ВОЗ была создана координационная сеть по африканскому трипаносомозу человека. В число партнеров этой сети вошли национальные программы по борьбе с сонной болезнью, организации, занимающиеся созданием новых лекарственных и диагностических средств, международные и неправительственные организации, а также организации-доноры.
Болезнь Шагаса – трансмиссивная протозойная инфекция, возбудителем которой является патогенная Trypanosoma cruzi, а переносчиком триатомовые клопы. Острая форма болезни Шагаса проявляется лихорадкой, головной и мышечной болью, отеками, сыпью, лимфаденитом, гепатоспленомегалией, кардиомегалией и миокардитом, менингоэнцефалитом; хроническая - сердечной недостаточностью, мегаэзофагусом, мегаколоном. Диагноз болезни Шагаса основан на данных анамнеза, клинической картины, микроскопического, культурального и серологического исследований. В лечении болезни Шагаса применяются антипаразитарные препараты, симптоматические средства, при осложнениях - оперативное вмешательство.
МКБ-10
Общие сведения
Болезнь Шагаса (американский трипаносомоз) – протозооз, вызываемый внутриклеточным простейшим паразитом рода Трипаносома (T. cruzi), приводящий к воспалительно-дегенеративным изменениям со стороны сердца, нервной системы, ЖКТ. Болезнь Шагаса относится к природно-очаговым заболеваниям, широко распространена практически во всех странах Американского континента: эндемичными по трипаносомозу районами являются Центральная и Южная Америка. В сельской местности большинство населения заражается трипаносомозом еще в детском возрасте, часто инвазия протекает бессимптомно. Среди зараженных болезнью Шагаса преобладают лица мужского пола.

Причины болезни Шагаса
Возбудителем болезни Шагаса является жгутиковое простейшее Trypanosoma cruzi, сложный цикл развития которого включает смену хозяев - позвоночных животных и человека, а специфическим переносчиком служат кровососущие клопы подсемейства Triatominae (триатомовые). T. cruzi имеет веретенообразную форму, жгутик и ундулирующую мембрану. Паразит проходит несколько фаз жизненного цикла: амастигота, обитающая в тканевых клетках человека; эпимастигота, растущая в кишечнике переносчиков; и трипомастигота, находящаяся в крови животных и человека. Основным хозяином T. cruzi служит человек, дополнительными - броненосцы, муравьеды, обезьяны и домашние животные (собаки, кошки, свиньи). Инвазионной стадией для переносчиков и хозяев являются трипомастиготные формы.
Заражение клопов происходит в процессе питания кровью человека или животных, содержащей трипомастиготы. В организм человека возбудитель болезни Шагаса заносится вместе с инфицированными фекалиями клопов при расчесывании ранок после их укусов на коже и слизистых губ, носа, конъюнктивы. Характерной особенностью T. cruzi является способность к внутриклеточному паразитизму в макрофагах кожи и слизистых оболочек, в клетках миокарда, эндотелия лимфатических узлов, селезенки, печени, легких, нейроглии. После разрыва пораженных клеток, переполненных размножившимися амастиготами, происходит заражение новых клеток. Паразитирование трипаносом приводит к воспалительно-дистрофическому и дегенеративному поражению внутренних органов. Наиболее распространенный способ заражения болезнью Шагаса – трансмиссивный, возможна передача алиментарным, половым, трансплацентарным, гемотрансфузионным путем и при трансплантации органов. Для T. cruzi характерна персистенция в организме хозяина в течение всей жизни.
Симптомы болезни Шагаса
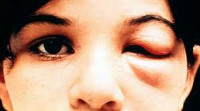
Инкубационный период заболевания продолжается 1-3 недели. Затем в месте проникновения трипаносом может развиться местная воспалительная реакция (шагома) в виде эритематозного узла с припухлостью и покраснением либо одностороннего багрового отека века (симптом Роминьи) с конъюнктивитом, сопровождающиеся увеличением регионарных лимфоузлов. Болезнь Шагаса проходит в 2 стадии: острую (первые 2 месяца) с циркуляцией большого количества паразитов в крови и хроническую - с концентрацией трипаносом во внутренних органах.
В острую стадию болезни Шигаса в большинстве случаев симптомы отсутствуют, у части больных проявляются в легкой форме. У детей до 5 лет развивается наиболее тяжелая форма с системными проявлениями и летальностью до 10-14%. Среди общих симптомов болезни Шагаса может отмечаться недомогание, постоянная или ремитирующая лихорадка (до 39-40°С), головная и мышечная боль, отеки на ногах, одутловатость лица, мелкая макулезная сыпь. Характерен шейный, паховый и подмышечный лимфаденит, гепатоспленомегалия. Могут возникать вторичные шагомы – плотные узлы в подкожной клетчатке. Отмечается преимущественное поражение сердца, ЦНС и периферических ганглиев, органов ретикулоэндотелиальной системы. Развивается острое воспаление и расширение всех камер сердца (кардиомегалия), диффузный миокардит, нарушение сердечной деятельности. У некоторых больных (особенно, у детей раннего возраста) может возникнуть острый специфический менингоэнцефалит, кровоизлияние в мозговые оболочки. Врожденная болезнь Шагаса может приводить к спонтанному аборту или преждевременным родам; у новорожденных сопровождается тяжелой анемией, гепатоспленомегалией, желтухой, судорогами, нередко - летальным исходом.
При хронической форме болезни Шагаса симптомы могут долго отсутствовать, пока не произойдут необратимые повреждения внутренних органов. Чаще всего развивается кардиомиопатия, выражающаяся сердечной недостаточностью, аритмией, тромбоэмболией. Со стороны ЖКТ характерны патологическое расширение пищевода (мегаэзофагус), проявляющееся дисфагией, болью при глотании, и расширение толстой кишки (мегаколон), сопровождающееся кишечной непроходимостью, скоплением каловых камней. Возникают вегетативные нарушения и периферическая нейропатия. С течением времени болезнь Шагаса может приводить к внезапной смерти вследствие прогрессирующего разрушения сердечной мышцы.
Диагностика болезни Шагаса
Диагностика болезни Шагаса включает тщательный сбор анамнеза (с учетом места рождения больного, поездок в эндемичные по заболеванию районы), анализ данных клинической картины и лабораторных исследований (микроскопического и культурального методов, серологических анализов и ПЦР).
В качестве исследуемого материала используется кровь, спинномозговая жидкость, пунктаты из первичных мест поражения, лимфоузлов, селезенки, костного мозга. В острую стадию болезни Шагаса (первые 6-12 недель) паразитов можно обнаружить при микроскопии толстой капли крови или фиксированных окрашенных препаратов. Бактериологический посев крови больного помогает выявить чистую культуру T. cruzi. При болезни Шагаса применяется ксенодиагностика, включающая исследование содержимого кишечника неинвазированного триатомового клопа после насыщения его кровью больного. Возможно проведение биологической пробы с введением крови пациента морским свинкам или белым мышам и последующим изучением образцов тканей.
При хронической болезни Шагаса более эффективна серодиагностика: реакция связывания комплемента, реакция непрямой флюоресценции, реакция непрямой гемагглютинации, ИФА. Наличие специфических IgM говорит об острой стадии болезни Шагаса, при хронической имеются только IgG . Некоторые инфекции, например, малярия, сифилис, лейшманиоз могут давать ложноположительные результаты на трипаносомоз, поэтому рекомендуется применять не менее двух независимых методов серодиагностики. Необходима дифференциальная диагностика патогенных трипаносом от непатогенных видов, способных находится в организме человека, не вызывая развитие заболевания.
Лечение и прогноз болезни Шагаса
На сегодняшний день лечение болезни Шагаса малоэффективно; терапия позволяет снизить летальность среди больных, но не дает уверенности в полной эрадикации внутриклеточных форм T. cruzi. В лечении болезни Шагаса применяются два антипаразитарных препарата: нифуртимокс и бензнидазол, прием которых более эффективен в острую стадию заболевания. В хронической стадии инфекции лечение направлено на облегчение симптомов развившихся осложнений болезни Шагаса. При сердечной недостаточности и аритмии, для профилактики тромбоэмболических состояний назначаются ингибиторы АПФ, сердечные гликозиды, антиаритмические средства, антикоагулянты, в тяжелых случаях показаны аортокоронарное шунтирование, имплантация кардиостимулятора, трансплантация сердца. Лечение менингоэнцефалита – симптоматическое; при поражении ЖКТ могут использоваться кортикостероиды; при мегаколоне возможно хирургическое вмешательство: наложение колостомы, резекция толстой кишки.
Прогноз болезни Шагаса зависит от стадии заболевания, остроты развития и обратимости воспалительно-дегенеративных поражений внутренних органов, возраста больного. Пациенты с поздней стадией болезни Шагаса часто умирают от острой сердечной недостаточности, инфаркта, инсульта, дети раннего возраста - от стремительно развившегося острого менингоэнцефалита. Профилактика болезни Шагаса включает инсектицидную обработку жилья человека, птичников, свинарников – основных мест обитания клопов - переносчиков паразитов, благоустройство жилища; отбор и обследование на трипаносомоз потенциальных доноров крови и органов, санитарное просвещение населения.
Сонная болезнь – протозооз, возбудителем которого выступают простейшие рода Trypanosoma, а переносчиками - кровососущие мухи цеце. Симптоматика сонной болезни характеризуется образованием на месте укуса первичного аффекта (трипаносомного шанкра), волнообразной лихорадкой, лимфаденитом, кожными высыпаниями, местными отеками, нарастающей сонливостью, параличами, психическими расстройствами, комой. Диагностика сонной болезни основана на обнаружении трипаносом в биологическом материале (пунктате шанкра, лимфоузлов, крови, спинномозговой жидкости). Терапия сонной болезни проводится препаратами пентамидин, сурамин, меларсопрол, эфлорнитин.
Общие сведения
Сонная болезнь (африканский трипаносомоз) – заболевание из группы трансмиссивных трипаносомозов, протекающее с лихорадкой, поражением лимфатической и центральной нервной системы. Выделяют 2 формы сонной болезни: гамбийский (западноафриканский) и родезийский (восточноафриканский) трипаносомозы, вызываемые различными видами возбудителей. Сонная болезнь является эндемичной для 36 стран тропической Африки, где водятся переносчики болезни - мухи цеце. Самые крупные эпидемии сонной болезни были зафиксированы в 1896-1906, 1920 и 1970 годах. Ежегодно на Африканском континенте регистрируется 7-10 тыс. новых случаев заболевания сонной болезнью. В наибольшей степени заболевание распространено среди сельских жителей занимающихся земледелием, животноводством, рыболовством или охотой. Кроме африканского трипаносомоза, опасность для человека представляет американский трипаносомоз (болезнь Шагаса).

Причины сонной болезни
Известны два морфологически идентичных вида возбудителя сонной болезни человека: Trypanosoma brucei gambiense, вызывающий гамбийскую форму и Trypanosoma brucei rhodesiense, вызывающий родезийскую форму африканского трипаносомоза. Паразиты имеют продолговато-веретенообразную, плоскую форму, длину 12-35 мкм и ширину 1,5-3,5 мкм. Оба вида трипаносом передаются через слюну во время укуса мухи цеце (Glossina palpalis), которая служит переносчиком заболевания и после заражения способна передавать трипаносомы в течение всей жизни. Для заражения человека сонной болезнью достаточно одного укуса инвазированной мухи, которая выделяет со слюной около 400 тыс. паразитов, в то время как минимальная инвазирующая доза составляет 300-400 трипаносом.
При кровососании инвазированных позвоночных животных или человека в организм насекомого попадают кровяные трипомастиготы, которые размножаются путем бинарного деления в просвете кишечника мухи цеце. К 3-4 дню трипомастиготные формы проникают в слюнные железы, где трансформируются в эпимастиготы. В слюнных железах эпимастиготные формы претерпевают многократное деление и сложные морфологические изменения, в результате чего превращаются в метациклические трипомастиготы, представляющие собой инвазионную стадию трипаносом. При повторном укусе вместе со слюной муха цеце вводит под кожу человека метациклические трипомастиготы, которые через несколько дней проникают в кровь и лимфу, разносятся по организму, превращаясь в кровяные трипомастиготы.
После укуса инфицированной мухи в месте входных ворот развивается местно-воспалительная реакция в виде болезненного зудящего шанкра и регионарный лимфаденит. Через 1-3 недели, после проникновения трипаносом в кровяную и лимфатическую систему развивается гемолимфатическая стадия сонной болезни. Поздняя (менингоэнцефалитическая) стадия африканского трипаносомоза обусловлена проникновением паразита в ЦНС. В ответ на инвазию иммунная система реагирует выработкой специфических антител класса IgM, позволяющих некоторое время сдерживать паразитемию. Однако высокая антигенная изменчивость трипаносом нарушает формирование специфического иммунитета, обусловливая непрерывное прогрессирование и возвратно-рецидивирующий характер сонной болезни.
Симптомы сонной болезни
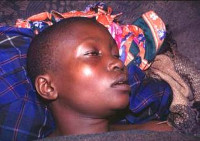
Ранняя (гематолимфатическая) стадия сонной болезни длится около 1 года (иногда от нескольких месяцев до 5 лет). Примерно через неделю после укуса мухи цеце на коже образуется первичный аффект – трипанома, или трипаносомный шанкр, представляющий собой болезненный эритематозный узелок диаметром 1-2 см, напоминающий фурункул. Этот элемент чаще всего локализуется на голове или конечностях, нередко изъязвляется, однако через 2-3 недели обычно спонтанно заживает, оставляя после себя пигментированный рубец. Одновременно с образованием трипаносомного шанкра на туловище и конечностях появляются пятна розового или фиолетового цвета диаметром 5-7 см (трипаниды), а также отеки лица, кистей, стоп.
Дальнейшее развитие сонной болезни связано с выходом паразитов в кровь, что сопровождается возникновением лихорадки неправильного типа. Лихорадочные периоды с температурными пиками до 38,5-40°С чередуются с апирексическими периодами. Характерным признаком сонной болезни служит увеличение регионарных лимфоузлов, особенно заднешейных (симптом Уинтерботтома), которые становятся плотными и могут достигать размеров голубиного яйца. Течение гемолимфатической стадии сонной болезни характеризуется нарастающей слабостью и апатией, тахикардией, артралгиями, потерей массы тела, увеличением печени и селезенки. У 30% пациентов появляются уртикарные высыпания на коже, развивается отек век. Возможно поражение органа зрения в виде кератита, иридоциклита, кровоизлияния в радужку, помутнения или рубцевания роговицы.
Длительность гемолимфатической стадии сонной болезни может составлять несколько месяцев или лет, после чего заболевание переходит в позднюю (менингоэнцефалитическую, или терминальную) стадию. В этот период на первый план в клиническом течении выходят симптомы менингоэнцефалита и лептоменингита, обусловленные проникновением трипаносомы через гематоэнцефалический барьер и поражением головного мозга. Наиболее типичным проявлением африканского трипаносомоза служит нарастающая дневная сонливость, приводящая к тому, что пациент может уснуть, например, во время еды.
Прогрессирование сонной болезни сопровождается развитием атаксической походки, невнятной речи (дизартрии), саливации, тремора языка и конечностей. Больной становится безразличен к происходящему, заторможен, жалуется на головную боль. Отмечается нарушение психического статуса в виде депрессивных или маниакальных состояний. В позднем периоде сонной болезни присоединяются судороги, параличи, эпилептический статус, развивается кома.
Родезийская форма сонной болезни имеет более тяжелое и скоротечное развитие. Лихорадка и интоксикация выражены сильнее, быстрее наступает истощение, часто возникает поражение сердца (аритмия, миокардит). Гибель больного может наступить уже в течение первого года заболевания еще до перехода трипаносомоза в менингоэнцефалитическую стадию. Причиной смерти больных чаще всего служат интеркуррентные инфекции: малярия, дизентерия, пневмония и др.
Диагностика и лечение сонной болезни
Предварительная диагностика сонной болезни осуществляется на основании клинико-эпидемиологических данных, важнейшими из которых служат пребывание в эндемичных районах Африки, наличие длительной, рецидивирующей лихорадки, первичного аффекта, шейного лимфаденита, отеков, сонливости и др. Неопровержимым доказательством заражения африканским трипаносомозом служит обнаружение трипаносом при лабораторных исследованиях нативного и окрашенного по Романовскому-Гимзе биологического материала. С целью обнаружения паразита анализу может подвергаться пунктат трипаносомного шанкра, измененных лимфоузлов, кровь, цереброспинальная жидкость.
В ряде случаев для распознавания сонной болезни проводится биологическая проба с внутрибрюшинным введением крови или спинномозговой жидкости больного морским свинкам. Из иммунологических реакций применяются РИФ, ИФА. Гамбийскую форму сонной болезни следует дифференцировать с малярией, токсоплазмозом, лимфогранулематозом, туберкулезом, менингитом, энцефалитом и др.; родезийскую форму, кроме этого, – с брюшным тифом, септицемией.
Специфическая терапия сонной болезни наиболее эффективна в раннюю стадию, до развития церебральной симптоматики. При гамбийской форме сонной болезни на гемолимфатической стадии назначается сурамин, пентамидин или эфлорнитин; на менингоэнцефалитической стадии эффективен только эфлорнитин. В раннем периоде родезийской формы сонной болезни применяется сурамин; в позднем – меларсопрол. Дополнительно проводится дезинтоксикационная, гипосенсибилизирующая, симптоматическая терапия.
Прогноз и профилактика сонной болезни
Без лечения летальность от сонной болезни близка к 100%. В случае начала специфической терапии в раннюю стадию африканского трипаносомоза возможно полное выздоровление; при поздно начатом лечении прогноз значительно хуже. Кроме сроков начала лечения, на исход влияет форма сонной болезни: при родезийском варианте трипаносомоза прогноз всегда серьезнее.
В профилактике сонной болезни главную роль играет истребление мух цеце с помощью инсектицидных препаратов, вырубки кустарниковых зарослей близ населенных пунктов, использование средств индивидуальной защиты от укусов кровососущих насекомых в эндемичных районах Африки. В периоды эпидемических вспышек сонной болезни среди местных жителей и приезжих проводится массовая химиопрофилактика пентамидином. Иммунопрофилактика африканского трипаносомоза не разработана.
Болезнь Шагаса, известная также как американский трипаносомоз, — потенциально опасное для жизни заболевание, вызываемое простейшим паразитом Trypanosoma cruzi.
Болезнь Шагаса названа именем бразильского врача и ученого Карлуса Рибейру Жустиниану Шагаса, который открыл эту болезнь в 1909 г. В мае 2019 г. по решению семьдесят второй сессии Всемирной ассамблеи здравоохранения был учрежден Всемирный день борьбы с болезнью Шагаса, отмечаемый 14 апреля (в этот день в 1909 г. Карлус Шагас диагностировал первый случай этой болезни у человека — двухлетней девочки по имени Беренис.
Распространение
Ранее распространение болезни Шагаса ограничивалось исключительно сельскими районами континентальной части Региона стран Америки — преимущественно Латинской Америки (за исключением островов Карибского бассейна). Однако в настоящее время, главным образом в результате роста мобильности населения за последние десятилетия, большинство лиц с данной инвазией проживают в городских районах (урбанизация заболевания), в результате чего она все чаще встречается в Соединенных Штатах Америки, Канаде, многих европейских странах, а также в некоторых странах Африки, Восточного Средиземноморья и Западной части Тихого океана.
Передача заболевания
T. cruzi может также передаваться:
- при потреблении пищевых продуктов, загрязненных T. cruzi, например в результате их соприкосновения с продуктами жизнедеятельности триатомовых клопов или сумчатых (такая передача, как правило, вызывает вспышки с одновременным заражением целых групп людей и более высокой заболеваемостью и смертностью);
- от инфицированной матери новорожденному ребенку во время беременности или родов;
- при переливании крови или препаратов крови, полученных у инфицированных доноров;
- при трансплантации некоторых органов, взятых у инфицированных доноров;
- в случае лабораторных инцидентов.
Признаки и симптомы
Болезнь Шагаса протекает в двух стадиях. Первая — острая — стадия длится около двух месяцев после заражения. В острой стадии в крови циркулирует большое количество паразитов, однако в большинстве случаев симптомы болезни отсутствуют или протекают в легкой форме и являются неспецифическими. Менее чем у 50% людей, укушенных триатомовым клопом, характерными первыми видимыми признаками могут быть поражения кожи или багровый отек век на одном глазу. Кроме того, они могут включать лихорадку, головную боль, увеличение лимфатических узлов, бледность, мышечную боль, затрудненное дыхание, отеки и боль в области живота и груди.
На протяжении второй стадии паразиты концентрируются в основном в сердце или мускулатуре пищеварительного тракта. Спустя одно–три десятилетия до 30% пациентов начинают страдать нарушениями сердечной деятельности, а до 10% пациентов — желудочно-кишечными (обычно в виде гипертрофии пищевода или толстой кишки), неврологическими или комбинированными расстройствами. В последующие годы у таких пациентов инвазия может приводить к поражению сердечной мышцы и нервной системы с последующей сердечной аритмией или прогрессирующей сердечной недостаточностью и внезапной смертью.
Лечение
Болезнь Шагаса можно лечить бензнидазолом, а также нифуртимоксом, что позволяет уничтожить паразита. Если лечение обоими препаратами начато вскоре после инфицирования в начале острой стадии, его эффективность составляет почти 100%, в том числе в случаях врожденной инвазии. Однако, чем дольше сохраняется инвазия, тем менее эффективными становятся эти препараты, а в более пожилом возрасте чаще развиваются побочные реакции. Лечение показано также пациентам с реактивированной инфекцией (например, в результате подавления иммунитета) и пациентам в начальной хронической стадии, в том числе девочкам и женщинам детородного возраста (до или после беременности) для профилактики врожденной передачи инвазии.
Лечение следует предлагать взрослым пациентам с инвазией, особенно при отсутствии симптомов, поскольку лечение противопаразитарными препаратами может также предотвращать или сдерживать прогрессирование заболевания. В остальных случаях следует сбалансированно учитывать потенциальные преимущества лекарственного лечения для предотвращения или задержки развития болезни Шагаса и длительность лучения (до двух месяцев), а также возможные побочные реакции (которыми страдают до 40% взрослых пациентов, получающих лечение). Бензнидазол и нифуртимокс не должны принимать беременные женщины или пациенты с почечной или печеночной недостаточностью. Нифуртимокс также противопоказан людям с неврологическими или психиатрическими расстройствами. Дополнительно пациенту может потребоваться специфическое лечение нарушений сердечной деятельности, желудочно-кишечных или неврологических расстройств.
Борьба и профилактика
Изначально (более 9 000 лет назад) T. сruzi поражал только диких животных. Позднее эта инвазия распространилась на домашних животных и людей. Ликвидировать ее не представляется возможным в связи с наличием большого резервуара паразитов T. cruzi среди диких животных в странах Америки. Таким образом, целями борьбы являются элиминация передачи заболевания и своевременное оказание медицинской помощи лицам с инвазией.
Против болезни Шагаса не существует профилактической вакцины. T. cruzi может инфицировать несколько видов триатомовых клопов, большинство из которых встречаются в странах Америки. Самым эффективным способом профилактики болезни Шагаса в Латинской Америке является борьба с переносчиками. Во всех странах для предотвращения инвазий в результате переливания крови или пересадки органов, а также для более эффективной диагностики и оказания помощи затронутым группам населения необходимо проводить скрининг крови.
В зависимости от географического района ВОЗ рекомендует следующие методы профилактики заболевания и борьбы с ним:
- опрыскивание жилых помещений и придомовой территории инсектицидами остаточного действия;
- ремонт домов и поддержание чистоты в быту для предотвращения инфестации переносчиками болезни;
- принятие индивидуальных профилактических мер, таких как использование прикроватных сеток, соблюдение надлежащих мер гигиены при приготовлении, транспортировке, хранении и употреблении пищи;
- организация информационных, просветительских и разъяснительных мероприятий по вопросам принятия профилактических мер и методов эпиднадзора с учетом потребностей различных субъектов и различных сценариев;
- скрининг доноров крови;
- тестирование доноров и реципиентов органов, тканей и клеток;
- обеспечение доступа к диагностике и лечению лиц, которым по медицинским основаниям показано или рекомендовано проведение противопаразитарного лечения, особенно детей и женщин детородного возраста до наступления беременности; и
- скрининг новорожденных и детей более старшего возраста, рожденных инфицированными матерями, которые не получали противопаразитарного лечения, для обеспечения своевременной диагностики и лечения.
Согласно расчетам, расходы на оказание медицинской помощи пациентам с сердечной, желудочно-кишечной, неврологической или комбинированной формой заболевания более чем на 80% превышают стоимость мероприятий по опрыскиванию инсектицидами остаточного действия для борьбы с переносчиками и профилактики инфицирования.
Деятельность ВОЗ
С 1990-х гг. в рамках сотрудничества с Секретариатом Панамериканской организации здравоохранения достигнуты значительные успехи в борьбе с паразитами и переносчиками болезни в Латинской Америке, а именно на территории Южного конуса, Центральной Америки, стран Андского пакта и стран Амазонских межправительственных инициатив. Эти международные инициативы позволили существенно уменьшить масштабы передачи инвазии и повысить доступность средств диагностики и противопаразитарного лечения.
Кроме того, в континентальных странах Латинской Америки благодаря обеспечению всеобщего скрининга всеми банками крови существенно снижен риск передачи инвазии при переливании крови. Всеобщий скрининг крови введен также в банках крови Соединенных Штатов Америки и большинства стран Европы и Западной части Тихого океана, где регистрируются случаи заболевания.
Эти достижения стали возможны благодаря решительным усилиям государств-членов, затронутых болезнью, а также благодаря наращиванию потенциала их организаций в области научных исследований и борьбы с этой болезнью при поддержке со стороны многих международных партнеров.
В 2005 г. Всемирная организация здравоохранения включила болезнь Шагаса в число забытых тропических болезней. Это способствовало более широкому признанию заболевания как проблемы общественного здравоохранения на международной арене и позволило противодействовать дезинформации, укреплять социальный запрос и политический курс на решение проблем, связанных с болезнью Шагаса, и устранять пробелы в научных исследованиях и разработках в области ее профилактики, выявления и комплексного оказания помощи, в том числе для выработки средств диагностики и лечения, информирования о лекарственных препаратах, методов решения социальных вопросов, информационных, просветительских и коммуникационных инструментов.
В принятой в 2020 г. дорожной карте по забытым тропическим болезням на 2021–2030 гг. предусматривается пять целей в области борьбы с болезнью Шагаса:
- верификация ликвидации передачи болезни переносчиками в жилых помещениях;
- верификация ликвидации гемотрансфузионной передачи болезни;
- верификация ликвидации передачи болезни при пересадке органов;
- элиминация врожденной болезни Шагаса;
- повышение уровня охвата противопаразитарным лечением целевых категорий населения до 75%.
В то же время будет необходимо решить ряд дополнительных проблем. К ним относятся:
- трудности в сохранении и закреплении успехов, достигнутых в области профилактики и контроля инфекции, особенно в контексте санитарно-эпидемиологических и социально-экономических последствий пандемии COVID-19;
- появление болезни Шагаса в районах, ранее считавшихся свободными от нее, например в бассейне Амазонки;
- продолжение циркуляции болезни в регионах, где принимаются меры по контролю инфекции, например в регионе Чако в Аргентине или на территории Многонационального Государства Боливия;
- распространение болезни, преимущественно обусловленное растущим перемещением населения между Латинской Америкой и остальным миром;
- наличие контингента лиц с инвазией, проживающих в странах/районах, где учреждения здравоохранения имеют мало информации и опыта в отношении этой болезни;
- предупреждение последствий низкой осведомленности или нехватки знаний, стигматизация и/или дискриминация в связи с болезнью Шагаса;
- низкий уровень регистрации случаев болезни, слабый мониторинг и эпиднадзор и низкий уровень верификации успехов, достигнутых в области борьбы с заболеванием; и
- недостаточная доступность услуг по диагностике и лечению для миллионов лиц с инвазией.
Для достижения цели по элиминации передачи болезни Шагаса и предоставлению медицинской помощи инфицированным и больным людям как в эндемичных, так и в неэндемичных районах ВОЗ намерена расширять сетевое взаимодействие на глобальном уровне и усиливать региональный и национальный потенциал, уделяя основное внимание таким мерам, как:
1 Аргентина, Белиз, Боливия (Многонациональное Государство), Бразилия, Чили, Колумбия, Коста-Рика, Эквадор, Сальвадор, Французская Гайана, Гватемала, Гайана, Гондурас, Мексика, Никарагуа, Панама, Парагвай, Перу, Суринам, Уругвай и Венесуэла (Боливарианская Республика).

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Американский трипаносомоз (болезнь Шагаса, или Чагаса) - трансмиссивная природно-очаговая протозойная болезнь, характеризуется наличием острой и хронической фаз в течении процесса.
В 1907 г. Бразильский врач Чагас обнаружил в триатомовых (поцелуйных) клопах возбудителя, а в 1909 г. выделил его из крови больного и описал вызываемое им заболевание, названное в честь него болезнью Шагаса.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13]
Код по МКБ-10
Цикл развития трипаносом
Цикл развития Тк cruzi проходит со сменой хозяев: а) позвоночные животные (более 100 видов) и человек; б) переносчик возбудителя (клопы подсемейства Triatominae).
Цикл развития в переносчике проходит в триатомовом клопе.
Инвазионной стадией для переносчика, как и для позвоночного животного и человека, являются трипомастиготы. Поскольку колющий ротовой аппарат, в отличие от мухи цеце, у клопов очень слабый и не способен проколоть даже кожу человека, они находят ссадины или слизистые оболочки, конъюнктивы, оболочки носа, губ (за что получили название - поцелуйный клоп).
Заражение клопов происходит при питании кровью человека или животных, содержащих трипомастиготы.
Попадая в организм триатомовых клопов (переносчиков американского трипаносомоза), трипаносомы Т. cruzi также достигают желудка насекомого, превращаются здесь в эпимастиготы и размножаются в течение нескольких дней. Затем они проходят в заднюю и прямую кишки, где возвращаются к трипомастиготной форме. С этого момента клопы становятся заразными. После или во время засасывания крови клопы опорожняют прямую кишку, и возбудители попадают на кожу человека или слизистые оболочки (конъюнктиву, оболочки губ, носа). Возбудитель американского трипаносомоза относится в связи с этим к стеркорарийным трипаносомозам. Продолжительность цикла развития паразитов в переносчике составляет от 5 до 15 дней в зависимости от температуры воздуха. Однократно инвазированный клоп сохраняет паразитов до конца жизни (около 2 лет). Трансовариальная передача отсутствует.
После попадания в организм позвоночного животного (природного резервуара) или человека трипомастиготы некоторое время остаются в периферической крови, но не размножаются.
Затем они проникают в мышечные клетки и клетки эндотелия легких, печени, лимфатических узлов и других органов. Однако преимущественно паразиты скапливаются в клетках сердечной мышцы. Внутри клеток трипомастиготы трансформируются в эпимастиготную и промастиготную формы, и, наконец, в конце трансформации превращаются в округлую безжгутиковую форму - амастиготу, размером 2,5-6,5 мкм, содержащую круглое ядро и маленький овальной формы кинетогиаст. Внутри клетки амастиготы размножаются бинарным делением.
Наполненная амастиготами клетка человека или животного увеличивается в размерах и превращается в псевдоцисту, оболочкой которой служит стенка клетки хозяина. Перед разрывом и сразу после разрыва такой псевдоцисты амастигота (минуя промастиготную эпимастиготную стадию) превращается в трипомастиготу. Последние инвазируют соседние клетки, размножаются в стадии амастигот с образованием новых псевдоцист. Таким образом, амастиготы - сугубо внутриклеточные паразиты. Часть трипомастигот, освободившихся из псевдоцисты и не попавших в соседние клетки, попадают в кровь, где циркулирует, и оттуда могут попадать в организм переносчика.
Эпидемиология американского трипаносомоза (болезни Шагаса)
Основными переносчиками возбудителя американского трипоносомоза являются летающие клопы: Triatoma megistis, Triatoma infestens и др. Эти насекомые отличаются яркой окраской и сравнительно крупными размерами - 15-35 мм в длину, нападают на человека и животных ночью. Трансовариальной передачи трипаносом из поколения в поколение у триатомовых клопов не происходит.
Передача возбудителя болезни Шагаса происходит по типу специфической контаминации. Трипаносомы, выделенные с фекалиями клопов во время кровососания, проникают в организм человека или животных через поврежденную кожу или слизистые оболочки глаз, носа, полости рта вблизи места укуса. Заражение трипаносомозом возможно также алиментарным путем (в том числе, с молоком матери) и при гемотрансфузиях.
В настоящее время установлено, что возможна и трансплацентарная передача Т. cruzi, но уровень ее сравнительно невелик: в среднем у больных матерей рождаются 2-4% инфицированных детей. Механизм протективного действия плаценты полностью не изучен.
Известны синантропные и природные очаги болезни Шагаса. В очагах первого типа клопы обитают в глинобитных домах, хлевах, птичниках, норах домовых грызунов. Особенно много, до нескольких тысяч клопов (зараженность которых достигает 60% и выше), обнаруживается в глинобитных хижинах. В синантропных очагах, кроме человека, резервуарами возбудителя являются собаки, кошки, свиньи и другие домашние животные. По имеющимся данным, инфицированность собак в синантропных очагах в отдельных районах Бразилии составляет 28,2%, в Чили - 9%, кошек - в Бразилии 19,7%, в Чили - 12%.
В природных очагах резервуарами возбудителя служат броненосцы (сами не болеют), опоссумы (наиболее важны, так как имеют высокий индекс паразитемии), муравьеды, лисы, обезьяны и др. В Боливии и некоторых районах Перу определенное значение в качестве резервуара Т. cruzi имеют морские свинки, которых население держит дома для употребления в пищу. Их естественная зараженность достигает 25-60%.
Заражение людей происходит при посещении таких очагов в теплое время года, когда активны переносчики. В природных очагах чаще заражаются мужчины. В целом, болезнь Шагаса регистрируется в течение всего года во всех возрастных группах, но чаще у детей. Более характерны спорадические случаи, но при массовом нападении зараженных триатомовых клопов на людей возможны эпидемические вспышки.
Болезнь Шагаса широко распространена, она выявляется практически во всех странах американского континента от 42° с. ш. до 43° ю. ш. Особенно активные и стойкие природные очаги болезни расположены в латиноамериканских странах к югу от Мексики, за исключением островов Карибского моря, Белиза, Гайяны и Суринама. Описаны единичные случаи американского трипаносомоза в США (штат Техас). Наиболее часто инфекция регистрируется в Бразилии, Аргентине, Венесуэле; также выявляется в Боливии, Гватемале, Гондурасе, Колумбии, Коста-Рике, Панаме, Парагвае, Перу, Сальвадоре, Уругвае, Чили, Эквадоре. В других частях света инфекция не встречается. Возможно, болезнь Шагаса распространена шире, чем принято считать. Под риском заражения Т. cruzi живут более 35 млн человек. По предварительным оценкам среди них инфицировано не менее 7 млн.

[14], [15], [16], [17], [18]
Что вызывает американский трипаносомоз (болезнь Шагаса)?
Американский трипаносомоз, или болезнь Шагаса вызывается Trypanosoma cruzi, которая отличается от возбудителей африканского трипаносомоза меньшей длиной тела (13-20 мкм) и более крупным кинетопластом трипомастиготных форм. В фиксированных препаратах крови Tr. cruzi часто имеет изогнутую форму, наподобие букв С или S (С- и S-формы).
Возбудитель американского трипаносомоза относится к разряду Stercoraria (лат. stercus - кал, oralis - ротовой), а заболевание американский трипаносомоз (болезнь Шагаса) - к стеркорарийным трипаносомозам, таким образом возбудитель передается через фекалии клопа - переносчика. Кроме того, для Tr. cruzi характерны персистенция (лат. persistere - оставаться, упорствовать) - способность паразита сохраняться в организме хозяина в течение всей жизни с развитием резистентности (устойчивости) к реинвазии (повторному заражению). При этом трипаносомы продолжают медленно размножаться в течение всей жизни хозяина в клетках некоторых тканей.
Патогенез американского трипаносомоза (болезни Шагаса)
Паразитируют и размножаются Т. cruzi в организме человека и позвоночного хозяина сначала в макрофагах кожи и подкожной клетчатке, затем в регионарных лимфатических узлах, далее - во всех органах. Таким образом, при внедрении трипаносом развивается местная тканевая реакция в виде деструкции клеток, инфильтрации и отека тканей, затем увеличиваются регионарные лимфатические узлы. Следующим этапом патогенеза является паразитемия и гематогенная диссеминация трипаносом с последующей локализацией в тканях различных органов, где и происходит размножение возбудителей. Наиболее часто и тяжело поражаются сердце, скелетная и гладкая мускулатура, нервная система. В острой стадии заболевания на ранних сроках паразитемия достаточно массивна, но со временем интенсивность ее падает, она выявляется лишь периодически, а на поздних сроках хронической стадии - в редких эпизодах. Существует, однако, мнение, что при отсутствии лечения паразитемия сохраняется пожизненно.
Постепенно на первый план выступает следующий важнейший этап патогенеза американского трипаносомоза - аллергические и аутоиммунные процессы, а также образование иммунных комплексов. В результате патогенного действия трипаносом и продуктов их распада, специфической сенсибилизации и аутоаллергии возникают воспалительные, инфилыративные и дегенеративные изменения клеток внутренних органов, центральной и периферической нервной систем.
Наиболее поражаемым органом при болезни Шагаса является сердце. В острой стадии инфекции в миокарде развивается распространенный интерстициальный воспалительный процесс с отеком и разрушением миофибрилл и инфильтрацией нейтрофильными лейкоцитами, моноцитами и клетками лимфоидного ряда. Соседние с инфильтратом мышечные клетки могут дегенеративно перерождаться. В хронической стадии болезни Шагаса в мышце сердца происходят неуклонный миоцитолиз, фиброзирование, сохраняется или нарастает клеточная инфильтрация.
У некоторых больных, инвазированных Т. cruzi (чаще у младших детей), в головном мозге развивается острый специфический менингоэнцефалит с мононуклеарной инфильтрацией мягких мозговых оболочек, периваскулярными воспалительными реакциями, иногда одновременно с геморрагией и пролиферацией глии.
Серьезно страдают структуры ганглиев вегетативной нервной системы, что приводит к расстройствам иннервации внутренних органов. Поражение периферических элементов вегетативной нервной системы усугубляет нарушение сердечной деятельности и является причиной возникновения мегаорганов в желудочно-кишечном тракте (мегаэзофагус, мегагастриум, мегаколон), мочевыделительной системе и др.
Симптомы американского трипаносомоза (болезни Шагаса)
Общие симптомы американского трипаносомоза (болезни Шагаса): лихорадка постоянного или ремитирующего типа с повышением температуры до 39-40 °С, общая аденопатия, гепатоспленомегалия, отеки, иногда макулезные высыпания. Эти клинические симптомы возникают на фоне острого миокардита и раздражения менингеальной оболочки. Такие симптомы американского трипаносомоза (болезни Шагаса), как правило, наблюдаются в эндемичных районах у детей. При этом тяжесть течения тем выраженнее, чем меньше возраст больного. Примерно 10% случаев заканчиваются летально в результате прогрессирующего менингоэнцефалита или тяжелого миокардита с сердечной недостаточностью.
По прошествии острого периода болезнь Американский трипаносомоз (болезнь Шагаса) переходит в хроническую стадию. Симптомы этой стадии неопределенная. Часто в течение многих лет болезнь протекает бессимптомно. В зависимости от серьезности поражений вегетативной системы и сердца на первый план выходят симптомы сердечной недостаточности, а также развитие мегаэзофагуса, мегадуоденума, мегаколона или мегасигмы с соответствующей симптоматикой
Диагностика американского трипаносомоза (болезни Шагаса)
В острой стадии паразиты легко обнаруживаются путем микроскопии препаратов периферической крови. Наряду с окрашенными фиксированными препаратами можно исследовать раздавленную каплю крови, при этом подвижные паразиты хорошо видны под микроскопом В хронической стадии микроскопия малоэффективна.

[19], [20], [21], [22], [23], [24], [25], [26]
Читайте также:

