Патогномоничным признаком инфекционного эндокардита является тест
Обновлено: 23.04.2024
Как показывают наши примеры, встречаемость инфекционного эндокардита среди наркоманов увеличивается в связи с широким распространением внутривенного употребления наркотиков. Наиболее часто поражается трикуспидальный клапан. По данным литературы, в процесс могут также вовлекаться и другие клапаны [3]. В кантональном госпитале Цюриха было проведено проспективное исследование 22 пациентов с инфекционным эндокардитом (средний возраст 23 года). Период наблюдения составил три года [3]. Трикуспидальный клапан был поражен у 13 человек, митральный клапан — у четырех, комбинированное трикуспидально-митральное поражение наблюдалось у пяти пациентов и аортальный клапан был поражен у одного больного. Золотистый стафилококк оказался наиболее частым возбудителем (у 15 человек). Потенциальными факторами его патогенности, определяющими клиническую картину септического процесса, являются следующие энтеротоксины: SEA, SEB, SEC, SED и токсин синдрома токсического шока (TSST-1). Эти вещества связываются белками интерстицильного матрикса: фибронектином, колллагеном I и II типа и костным сиалопротеином (BSP). Однако эти факторы не являются преобладающими среди больных с инфекционным эндокардитом, вызванным Staphylococcus aureus [2]. BSP преобладает у больных с кожными поражениями, в то время, как у больных с эндокардитом чаще всего выделяются штаммы микроорганизмов, не вырабатывающие энтеротоксины. На наш взгляд, исходя из такой особенности выработки патогенов, можно предположить, что клинические проявления септического процесса, связанные с первичным очагом инфекции в коже (например, фурункулез), являются по своей картине однородными, в то время как при стафилококковом эндокардите факторы патогенности разнородны или вообще отсутствуют. Это может быть причиной отрицательного результата посевов крови.
Streptococci, по данным швейцарских врачей, являлись причиной бактериального эндокардита у четыреx пациентов, Corynebacteria — у двуx и в одном случае имелась смешанная инфекция [3]. Шесть пациентов были ВИЧ-инфицированы и 17 имели хронический вирусный гепатит. Десять пациентов (трое из них ВИЧ-инфицированные) подверглись хирургическому лечению. При кардиохирургическом лечении было проведено: рассечение трикуспидального клапана с заменой (у одного больного) или без замены (у четыреx больных) клапана, удаление вегетаций и замена клапана (у двух больных), замена митрального клапана (у двуx больных), протезирование аортального клапана (у одного больного). В случае эндокардита трехстворчатого клапана тактика оперативного вмешательства (выполнить резекцию, удалить вегетации или осуществить замену клапана) была выбрана с учетом тяжести поражения клапана и состояния психосоциального статуса пациента. В случае если вегетации присутствуют только на одной створке клапана и могут быть легко удалены, используется вегетоэктомия с аннулопластикой аутологичным перикардом. Удаление клапана без его протезирования является средством выбора среди тех пациентов, у которых нельзя исключить употребление наркотиков в будущем. Протезирование биопротезом используется в том случае, когда налицо полное разрушение клапана и доказано, что пациент воздерживался от употребления наркотиков в течение длительного времени до операции.
Литература
1. Медицинская микробиология / Гл. ред. В. И. Покровский, О. К. Поздеев. М.: Гэотар Медицина, 1999. 1200 с.
2. Carrel T., Schaffner A., Pasic M. et al. Surgery of endocarditis in the drug dependent and HIV patient. A prospective comparison with conservative treatment // Helv. Chir. Acta. 1993. Vol. 60. №3. Р. 439-445.
3. Hogevik H., Soderquist B., Tung H. S. et al. Virulence factors of Staphylococcus aureus strains causing infective endocarditis a comparison with strains from skin infections // APMIS. 1998. Vol. 106. № 9. P. 901-908.
Инфекционный эндокардит — название заболевания, которым обозначают поражение миокарда, вызванное микробами или грибками, которое приводит к нарушению функций и деструкции клапанного аппарата.
Если инфекционным процессом поражен артериовенозный шунт, то это инфекционный эндартериит. Типичным признаком являются вегетации, расположенные на створках клапанов или на эндокарде свободных стенок сердца. Это описание врачи начинали описывать еще в 17-м веке.
При остром течении заболевания без правильной терапии происходит поражение сердца, вероятны осложнения и летальный исход. Если течение затяжное (также называется подострым), то диагностика может быть осложнена. Могут быть маски эндокардита в виде анемии, нефрита, тяжелой СН. Тогда влияние эндокардита на организм обнаруживается поздно, и очень важную роль имеет терапия антибактериальными препаратами.
Течение болезни и эффект от терапии зависят от того, что спровоцировало инфекционный процесс, а также от пораженного отдела эндокарда. Болезнь развивается во многих случаях при сердечной патологии, особенно если поражен митральный клапан. Располагающими к рассматриваемой болезни факторами являются предшествующее протезирование клапана и в/в введение определенных веществ.
В развитых странах, по статистике, на 10000 населения эндокардитом болеют от 2,6 до 7 людей. На сегодня болезнь всё чаще встречается у людей зрелого возраста – от 40 лет.
Этиология
Эндокард может воспалиться под влиянием микроорганизмов. Зачастую это грамположительные бактерии, иногда и грамотрицательные. Именно по этой причине инфекционный эндокардит известен также как бактериальный. В 90 случаях из 100 болезнь вызвана стафилококками, стрептококками, энтерококками. Также возбудителями болезни могут быть грибы, хламидии, риккетсии.
Острый инфекционный эндокардит обычно вызван золотистым стафилококком, который поражает нормальные створки, потому возникают метастатические очаги. Причиной подострого ИЭ зачастую является зеленящий стрептококк. Метастатические очаги при этом не формируются.

Патогенез
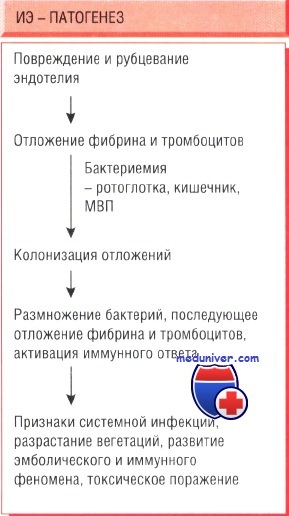
Инфекционный эндокардит возникает вследствие взаимодействия трех факторов:
- бактериемии, возникающей при ряде обстоятельств (преходящей бактериемии);
- состояния организма человека;
- тропности микроорганизма к эндокарду и степени вирулентности.
Если в результате воздействия высокоскоростного и турбулентного потока крови возникло повреждение эндотелия, он известен как первичный. Далее возникает адгезия тромбоцитов. Всё больше откладывается фибрин, в зоне пораженного эндотелия формируется тромб. Циркулирующие микроорганизмы оседают в области небактериального эндокардита и размножаются.
Преходящая бактериемия часто возникает при обычной чистке зубов, сопровождающейся кровотечением, удалении зубов и прочих стоматологических вмешательствах.
Микроорганизмы, которые являются возбудителями эндокардиты, попадают в кровь в основном с поверхности слизистых или из очагов инфекции. В организме может индуцироваться прокоагулянтное состояние. Важную роль в прогрессировании процесса играют цитокины, высвобождающиеся в результате повреждения сердечных структур.
Вегетации чаще расположены в левых отделах сердца — на аортальном и митральном клапанах. В патогенезе имеет важное значение такой фактор как бактериемия, а также метастазы инфекции (в разных органах формируются абсцессы микро размеров).
Симптомы
От пациентов с ИЭ поступают различные жалобы. В основном такие:
- озноб
- лихорадка
- повышенная утомляемость
- потливость в ночные часы
- артралгии
Нужно учитывать, что такие симптомы характерны также для эндартериита артериовенозного шунта.
Симптомы инфекционного эндокардита:
- высыпания на коже
- повышение температуры тела (в основном до субфебрильных значений)
- увеличение селезенки
- изменения дистальных фаланг пальцев и ногтей
- артралгии
- протеинурия
- анемия
- тромбоэмболии и тромбоваскулиты
- повышение уровня у-глобулинов
- увеличение СОЭ
Сердечные проявления ИЭ
- шумы
- диффузный миокардит
- абсцесс фиброзного кольца
- инфаркт миокарда
Внесердечные проявления ИЭ
На сегодняшний день отмечают такие особенности болезни:
- у человека может не быть лихорадки
- может начаться длительная лихорадка, при которой не будет явного поражения клапанов сердца
- чаще всего инфекционный эндокардит фиксируют у людей пожилого возраста, у тех, кто потребляет наркотики, у больных с протезированными клапанами сердца
- может быть длительное течение с поражением одного органа или ткани
- лицам из группы высокого риска часто рекомендована профилактика при помощи антибиотиков
Диагностика
ИЭ подозревают, если у человека есть лихорадка с ознобом, в сердце есть шумы, меняется форма пальцев, увеличивается селезенка, находят изменения в моче, фиксируют эмболию. Важное значение имеет выделение возбудителя заболевания, чтобы подтвердить диагноз и выбрать противомикробные препараты.
Нельзя сказать, что диагностика ИЭ простая. У человека может не быть лихорадки, если есть СН или выраженная почечная недостаточность. Также лихорадки часто не наблюдают у тех, кто принимает антибиотики или антипиретики. Врачи могут не зафиксировать сердечный шум, он отсутствует примерно у 15% лиц с ИЭ.
Анализ крови
Больше чем у 50% пациентов находят умеренно выраженную нормохромную анемию, особенно при подострой форме инфекционного эндокардита. Почти у 100% больных СОЭ выше нормы, значение иногда достигает 70-80 мм/ч. Даже при эффективной терапии СОЭ будет повышена на протяжении от 3 до 6 месяцев. При нормальной СОЭ нельзя отбрасывать диагноз ИЭ. Типичным проявлением болезни является со сдвигом лейкоцитарной формулы влево, при этом хотя количество лейкоцитов может находиться в пределах нормы или быть сниженным. Часто увеличивается концентрация сиаловых кислот и диспротеинемия с увеличением уровня у-глобулинов.
Для ИЭ характерны такие изменения крови как иммунные комплексы. Их концентрация зависит от длительности болезни, выраженности внесердечных признаков, о которых писали выше. Типично обнаружение СРБ. При адекватном лечении он нормализуется раньше СОЭ.
Анализ мочи
При анализе мочи находят протеинурию и микрогематурию, причиной чего может быть повышение температуры или появление тромбоэмболии. Если развивается гломерулонефрит, в моче находят выраженную стойкую протеинурию и гематурию. При инфекционном эндокардите вероятно прогрессирование нефрита с развитием почечной недостаточности.
Гемокультура
При подостром течении ИЭ бактериемия постоянная. Чтобы обнаружить ее, лучше всего 3 раза провести забор крови из вены в объеме 16-20 мл с интервалом 1 ч между первой и последней венепункциями. Когда будет выявлен возбудитель эндокардита, определяют чувствительность его к антибиотикам.
Примерно у 50; больных кровь при терапии антибиотиками бывает стерильной. Такое может быть также, если возбудителями ИЭ являются грибы и хламидии, а также некоторые бактерии. Чтобы получить результаты, иногда увеличивают время инкубации, применяют серологические исследования с реакцией непрямой иммунофлюоресценции.
Электрокардиография
ЭКГ обнаруживает в 4-16 случаях из 100 нарушения проводимости. Они появляются как результат абсцесса миокарда или очагового миокардита на фоне ИЭ. Если есть эмболическое поражение венечных артерий, можно обнаружить на ЭКГ изменения, как при инфаркте миокарда, то есть будет выражен зубец 0.
Эхокардиография
ЭхоКГ выявляет вегетации, размер который от 4-5 мм. Также вегетации можно выявить, причем более успешно, при чреспищеводной ЭхоКГ. ЭхоКГ позволяет обнаружить перфорацию створок, абсцессы, разрыв синуса Вальсальвы. Этот метод актуален за динамикой процесса и эффективностью проводимой терапии.
Лечение
При выявлении инфекционного эндокардита человека госпитализируют. Ему нужно соблюдать постельный режим, пока не пройдет острая фаза воспаления. Человека лечат в стационаре, пока температура тела и выше описанные лабораторные показатели не нормализуются. Также для выписки из стационара нужно бактериологическое исследование крови и анализ динамики регрессирования симптоматики.
Для лечения ИЭ всегда применяют антибиотики. Назначают лекарство с бактерицидным действием. В вегетациях нужно создать высокую концентрацию препарата. Антибиотики вводятся в/в, курсы лечения длительные. В зависимости от выявленного возбудителя инфекционного эндокардита, выбирают определенные антибиотики. Если возбудитель — грамположительные бактерии, применяют полусинтетические пенициллины, бензилпенициллин, ванкомицин или цефалоспорины I и II поколения.
Если возбудителем ИЭ являются грамотрицательные бактерии, проводят лечение аминогликозидами, цефалоспоринами III поколения, карбапенемами, фторхинолонами. При болезни, вызванной грибками, актуально применение амфотерицина В и флуконазола. Образование вегетаций минимизируется при терапии тиклопидином и ацетилсалициловой кислотой. В случаях, когда данные о возбудителе воспалительного процесса нельзя получить, проводится эмпирическая терапия. При острой форме инфекционного эндокардита назначают оксациллин в комбинации с ампициллином (2 г внутривенно каждые 4 часа) и гентамицином (1,5 мг на 1 кг тела внутривенно каждые 8 часов). При подостром инфекционном эндокардите используют следующую комбинацию: ампициллин по 2 г внутривенно каждые 4 часов в сочетании с гентамицином по 1,5 мг/кг внутривенно каждые 8 часов.
Этиотропное лечение не всегда обеспечивает полное выздоровление. В трети случаев приходится применить хирургические методы лечения. Клапаны протезируют, вегетации удаляют. Абсолютные показания к хирургическому лечению инфекционного эндокардита:
- Устойчивость к антибактериальной терапии в течение 3 недель
- Нарастание сердечной недостаточности или ее рефрактерность к лечению
- Грибковая инфекция
- Абсцессы миокарда, фиброзного клапанного кольца
- Деструкция клапана с развитием его выраженной недостаточности
- Эндокардит искусственного клапана
Относительные показания к хирургическому лечению инфекционного эндокардита:
- Сохранение лихорадки, несмотря на проводимое лечение
- Повторные эмболизации вследствие деструкции вегетации
- Увеличение размеров вегетации в течении прохождения терапии
Прогноз
Если не проводить адекватную терапию, острая форма ИЭ заканчивается смертью за срок до 6 недель. При подостром течении без лечения человек умирает за пол года. Прогноз хуже при:
Возбудителями этой формы эндокардита служат зеленящий стрептококк у больных с естественными сердечными клапанами и дифтерийные бактерии или Staphylococcus epidermidis у больных с протезированными сердечными клапанами. Заболевание может также быть вызвано энтерококками и многими другими микроорганизмами. В редких случаях причиной подострого септического эндокардита может стать золотистый стафилококк. Заболевание обычно развивается исподволь, больные затрудняются назвать точное время появления первых его симптомов. У некоторых больных началу болезни предшествуют недавняя экстракция зуба, вмешательства на уретре, тонзиллэктомия, острые респираторные инфекции, проведение аборта.
Слабость, быстрая утомляемость, уменьшение массы тела, лихорадка, потливость по ночам, потеря аппетита, артралгии - обычные проявления подострого септического эндокардита. Эмболии могут вызывать параличи, боль в грудной клетке вследствие миокардита или инфаркта легких, острую сосудистую недостаточность с болями в конечностях, гематурию, острую абдоминальную боль, внезапную потерю зрения. Боли в пальцах конечности, болезненные поражения кожных покровов, озноб также служат важными симптомами заболевания. Развиваются преходящие нарушения мозгового кровообращения в виде ишемии мозга, токсическая энцефалопатия, головная боль, абсцессы мозга, субарахноидальные кровоизлияния как следствие разрыва микотической аневризмы, гнойный менингит.
При физикальном обследовании выявляются самые разнообразные симптомы, ни один из которых, однако, в отдельности не является патогномоничным для подострого септического эндокардита. В ранние сроки заболевания физикальное обследование может вообще не выявить никаких признаков болезни. Тем не менее сочетание различных клинических признаков создает достаточно характерную картину подострого септического эндокардита. Внешний вид больного обычно свидетельствует о наличии хронически протекающего заболевания, выявляются бледность кожных покровов, повышение температуры тела. Лихорадка обычно носит ремиттирующий характер с подъемами в дневные или вечерние часы. Пульс учащен. При наличии сопутствующей сердечной недостаточности частота пульса, как правило, больше, чем можно было бы ожидать при данном повышении температуры тела.
Нередки кожно-слизистые поражения различного характера. Чаще этого петехии небольшого размера, красного цвета, имеющие вид геморрагий, не белеющие при надавливании, ненапряженные и безболезненные. Локализуются петехии на слизистой оболочке полости рта, глотки, конъюнктивы, на других участках туловища, в частности на коже верхней части грудной клетки спереди. Для петехий, локализованных на слизистых оболочках или конъюнктиве, характерна зона побледнения в центре. Петехии имеют некоторое сходство с ангиомами, однако в отличие от последних они постепенно приобретают коричневый оттенок и исчезают. Часто появление петехий отмечают даже в период выздоровления. Под ногтями появляются линейные геморрагии, которые, однако, трудно отличить от травматических повреждений, особенно у людей, занятых физическим трудом. Все эти поражения кожи и слизистых оболочек неспецифичны для септического эндокардита и могут наблюдаться у больных с выраженной анемией, лейкозом, трихинеллезом, сепсисом без эндокардита и другими болезнями. Как следствие эмболий на ладонях, кончиках пальцев рук, пятках, в некоторых других местах появляются эритематозные, болезненные, напряженные узелки (узелки Ослера). Эмболии в более крупные периферические артерии могут вызвать гангрену пальцев конечностей или даже более значительных их частей. При длительно текущем септическом эндокардите наблюдается изменение пальцев рук по типу барабанных палочек. В редких случаях развивается слабовыраженная желтуха.
При обследовании сердца выявляют признаки его заболевания, на фоне которого возник септический эндокардит. Значительные изменения характера сердечных шумов, впервые возникший диастолический шум могут быть следствием изъязвления клапана, дилатации сердца или клапанного кольца, разрыва клапанных хорд или формирования очень больших вегетации. Незначительные изменения характера систолических шумов обычно имеют меньшую диагностическую значимость. Иногда шум в сердце вообще не выслушивается. В таких случаях следует подозревать наличие эндокардита правого сердца, инфицирование пристеночного тромба или наличие артериовенозной фистулы в легочном или периферическом кровотоке.
При подостром течении септического эндокардита часто развивается спленомегалия. Реже селезенка бывает напряженной. При инфаркте селезенки в области ее расположения можно выслушать шум трения. Печень обычно бывает неувеличенной до тех пор, пока не разовьется сердечная недостаточность.
Относительно часто встречаются артралгии и артриты, напоминающие остро протекающий ревматизм.
Эмболии могут поддерживать инфекционный процесс. Внезапное появление гемиплегии, односторонних болей, сопровождающихся гематурией, болей в животе с развитием мелены, плевральных болей с кровохарканьем, болей в верхней левой части живота, сопровождающихся появлением шума трения селезенки, слепоты, моноплегии у больного с лихорадкой и наличием шумов в сердце заставляет подозревать у него септический эндокардит. Легочные эмболии при эндокардитах правого сердца могут быть ошибочно приняты за пневмонию.
Острые бактериальные инфекционные эндокардиты.
Появлению эндокардита обычно предшествует гнойная инфекция. Например, инфицирование сердца может развиться как осложнение пневмококкового менингита, септического тромбофлебита, панникулита, вызванного стрептококком группы А, стафилококкового абсцесса. Можно сказать поэтому, что источник инфицирования сердечно-сосудистой системы обычно достаточно очевиден.
Острый эндокардит чаще развивается у лиц, не страдающих какими-либо заболеваниями сердца. Подострое же его течение свойственно лицам с сопутствующим поражением отделов сердца; лицам, которые часто вводят наркотики внутривенно; лицам, у которых ранее имелись недиагностированные поражения клапана аорты. Острая инфекция характеризуется молниеносным течением, выраженной интермиттирующей лихорадкой, имеющей (как при гонококковом эндокардите) два пика температуры в течение суток, ознобами. Появляются многочисленные петехии. Эмболический синдром достигает большой выраженности. В области сетчатки выявляются небольшие, иногда имеющие форму пламени свечи геморрагии с бледным пятном в центре (пятна Рота). Узелки Ослера встречаются редко, однако на мягких тканях пальцев рук нередко можно обнаружить ненапряженные подкожные эритематозные макулопапулезные поражения (пятна Джейнуэя), склонные к изъязвлению. При эмболическом повреждении почек возникает гематурия. Возможно развитие диффузного гломерулонефрита. Деструкция клапанов сердца может осложниться разрывом клапанных хорд или перфорацией створок, что быстро приводит к прогрессированию сердечной недостаточности. После септической эмболии часто возникают септические абсцессы.
Эндокардиты, поражающие правое сердце.
У лиц, вводящих наркотики парентерально, развиваются панникулиты или септические флебиты, приводящие к возникновению эндокардита правого предсердно-желудочкового клапана, реже - клапана легочного ствола или слизистой аневризмы легочного ствола. Инфекционный эндокардит правого сердца может быть следствием инфицирования в результате использования периферических или центральных катетеров или трансвенозных проводников. При этом источником инфекции служат кожа (золотистый стафилококк, Candida albicans) или инъецируемые растворы (Pseudomonas aeruginosa, Serratia marcescens). В качестве возбудителя чаще всего выделяют золотистый стафилококк. У наркоманов, как правило, поражается правый предсердно-желудочковый клапан. Клинические проявления сходны с таковыми острого эндокардита, сопровождающегося инфарктом легкого и образованием абсцесса. Наиболее частыми симптомами являются выраженная лихорадка, сохраняющаяся в течение нескольких недель, боль в грудной клетке плеврального характера, кровохарканье, отделение мокроты, одышка при физической нагрузке, недомогание, анорексия, слабость. Может выслушиваться шум недостаточности правого предсердно-желудочкового клапана, усиливающийся при вдохе. Одновременно может наблюдаться пульсация шейных вен и печени. Чаще всего, однако, шум не выслушивается или выслушивается с трудом. Подтвердить наличие вегетации на эндокарде поможет секторальная эхокардиография. Вероятность выделения бактерий методом культивирования при эндокардитах правого и левого сердца одинакова. Рентгенография грудной клетки обычно выявляет наличие клиновидной формы инфильтратов с полостями на периферии легких. У больных с эндокардитом правой половины сердца прогноз обычно лучше. Это объясняется тем, что при данной форме эндокардита не наблюдается эмболий сосудов жизненно важных органов, не развивается острая декомпенсация кровообращения вследствие клапанной деструкции. Немаловажную роль играют также более молодой возраст больных и лучшее состояние их здоровья до развития инфекционного эндокардита, а также высокая эффективность антимикробной терапии. При наличии вегетации большого размера (диаметром более 1 см) или в том случае, если антимикробная терапия оказалась безуспешной, могут потребоваться частичная резекция клапана или его полное иссечение.
Эндокардиты протезированных клапанов.
Инфекционное поражение протезированных клапанов сопровождается симптомами, неотличимыми от таковых при поражении естественных клапанов, однако в первом случае относительно часто поражается клапанное кольцо. Это приводит к разрывам клапана или пенетрации инфекции в миокард или окружающие ткани. Следствием этого могут быть развитие абсцесса миокарда, нарушение проводимости, появление аневризмы синуса Вальсальвы или фистулы в правые отделы сердца или в перикард. Удлинение интервала Р-R, впервые возникшая блокада левой ножки пучка Гиса или блокады правой ножки пучка Гиса, сочетающейся с блокадой передней ветви левой ножки пучка Гиса, при инфицировании клапана аорты свидетельствуют о вовлечении в процесс межжелудочковой перегородки. Распространение инфекции из области митрального кольца может сопровождаться появлением непароксизмальной функциональной тахикардии, сердечной блокады 2-й или 3-й степени с узкими комплексами QRS. Стеноз протезированных клапанов, развившийся вследствие сужения клапанного кольца вегетациями или связанный с экскурсией клапана, диагностируют с помощью аускультации или при эхокардиографии. Появление шума регургитации при аускультации или регистрация аномальной позиции клапана или его смещения при рентгеноскопии или эхокардиографии свидетельствуют о частичном разрыве протезированного клапана. Инфицирование протезированного клапана, осложнившееся его стенозом, разрывом, сочетающееся с застойной сердечной недостаточностью, повторными эмболиями, резистентностью к антибактериальной терапии, признаками вовлечения миокарда, требует неотложного хирургического вмешательства. Больным, получающим антикоагулянты для профилактики эмболии, при развитии эндокардита следует продолжать их прием в том случае, если риск эмболизации без назначения антикоагулянтов высок. Риск развития внутричерепного кровоизлияния составляет в таких случаях 36 %, а последующая летальность- 80 %. При рецидивах бактериальной инфекции после адекватного лечения антимикробными препаратами или при наличии грибковой инфекции также требуются неотложное хирургическое вмешательство и удаление инфицированного протеза.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Эндокардит: причины, диагностика, лечение, профилактика
Поражение сердечных клапанов обычно происходит при транзиторной (преходящей) бактериемии. Наиболее высокий риск развития заболевания отмечают при врождённой патологии клапанов и их повреждении в результате различных причин.
Причиной могут быть микроорганизмы из ротовой полости, мочевыводящих путей, а также попадающие в кровоток при неправильном внутривенном введении лекарств или колонизации микроорганизмами внутрисосудистых устройств.
При аускультации выслушивают непостоянные сердечные шумы. На более поздних стадиях заболевания возможно развитие септической эмболии, часто приводящей к инсульту. Если эндокардит обусловлен чрезвычайно вирулентными штаммами (например, Staphylococcus aureus), то болезнь быстро прогрессирует и симптомы острого сепсиса превалируют в клинической картине заболевания.
Диагностика эндокардита. Диагностика основана на выявлении соответствующих данных клинической картины, инструментального и лабораторного обследования (критерии Дьюка) (Duke criteria).

Большие критерии Дьюка включают выделение из крови (гемокультура) микроорганизмов, чаще всего связанных (характерных) с развитием эндокардита (например, зеленящих стрептококков); выделение (неоднократно) из крови любых других микроорганизмов; выявление, по данным эхонарднографии, очевидных признаков поражения эндокарда и появление изменений клапанной регургитации.
Малые критерии Дьюка: выявление предрасполагающих факторов, лихорадка >38 °С, иммунологические признаки (септический инфаркт лёгких и др.) и другие патологические изменения, выявленные при эхокардиографии, данные микробиологического обследования больного, не связанные с большими критериями Дьюка.
Диагноз эндокардита устанавливают при наличии двух основных критериев или одного основного и трёх второстепенных.
Осложнения эндокардита. Прогрессирующее заболевание приводит к образованию прикорневого абсцесса аорты. При разрушении клапана быстро возникает сердечная декомпенсация и тяжёлая сердечная недостаточность. Результатом септической эмболии может быть поражение сосудов конечностей или инсульт. Нефрит — вторичное заболевание, возникающее в результате отложения иммунных комплексов в почечной ткани.
На фоне развивающегося сепсиса или при бесконтрольном применении нефротоксичных антибиотиков (аминогликозидов) отмечают быстрое прогрессирование поражения органа.
Обследование при эндокардите. Эхокардиография (трансторакальная, чреспищеводная — более чувствительная) позволяет обнаружить патологическое разрастание (вегетации) ткани клапана. На рентгенограмме грудной клетки отмечают очевидные признаки сердечной недостаточности. Для бактериологического исследования необходимо отобрать три образца крови с промежутком в один час (на высоте лихорадки). Антибиотикотерапию, если это возможно, следует начинать после получения результатов посевов крови.
В сыворотке крови возможно определение Coxiella и Chlamydia psittaci (например, с помощью полимеразной цепной реакции).
Лечение эндокардита. Идеально антибиотики не должны назначаться, пока не выделен микроорганизм (не выявлен этиологический фактор) и не определена его чувствительность к спектру антибиотиков. Прогноз эмпирической терапии эндокардита при отрицательных результатах микробиологического обследования хуже, чем, когда установлен возбудитель. Помощь в определении исходов заболевания оказывает мониторинг лабораторных показателей воспалительных реакций организма больного (С-реактивный белок др.).
Лечение должно быть основано на результатах определения чувствительности микроорганизмов к антибиотикам, минимальной подавляющей концентрации препарата и минимальной бактерицидной концентрации. При назначении гентамицина необходимо контролировать его содержание в крови, так как пациенты с эндокардитом очень чувствительны к токсическому действию этого препарата (ухудшение функции почек). В зависимости от показателя минимальной бактерицидной концентрации лечение продолжают в течение 2—6 нед.
Типичная схема комплексной терапии обычно включает бензилпенициллин и гентамицин для эрадикации зеленящих стрептококков, флуклоксациллин и гентамицин — для борьбы со стафилококками (ванкомицин и гентамицин — для пациентов с аллергией на препараты пенициллинового ряда). Кроме того, в каждой стране существуют свои рекомендации по лечению эндокардита.
Хирургическое вмешательство может потребоваться для устранения гемодинамических последствий эндокардита (особенно если инфекция вызвана S. aureus и другими микроорганизмами с высокой степенью патогенности), а также при отсутствии эффекта антибактериальной терапии.
Профилактика эндокардита. Для профилактики эндокардита у пациентов с клапанными пороками, которым предстоят различные манипуляции, способствующие повышению риска развития бактериемии (стоматологические операции, другие хирургические вмешательства), применяют антибиотики. При бактериурии выбор антимикробного препарата зависит от чувствительности выделенного микроорганизма. При проведении процедур, требующих общего наркоза, её начинают осуществлять при помощи лекарственных средств, принимаемых внутрь.
Кроме того, существует ряд профилактических схем в разных странах (при аллергии на препараты пенициллинового ряда, протезировании клапанов сердца и др.).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:

