Пдс в инфекции это
Обновлено: 23.04.2024
Эпидемиология
В США и Великобритании диспептические жалобы наблюдают у 26 и 41% населения соответственно. В России распространенность ФД достигает 30–40%. Заболевание чаще наблюдают в молодом возрасте (17–35 лет), в 1,5–2 раза чаще у женщин.
Классификация
В зависимости от клинической картины различают три варианта функциональной диспепсии:
При необходимости более детального определения ФД, с учетом ее патофизиологического механизма, Римский консенсус III выделил два новых варианта: 1) диспепсические симптомы, вызываемые приемом пищи (meal-induced dyspeptic symptoms — MDS), или индуцированные пищей диспепсические симптомы — постпрандиальный дистресс-синдром (ПДС) и 2) epigastric pain syndrome (EPS) — синдром эпигастральной боли, или эпигастральный болевой синдром (ЭБС).
Этиология и патогенез
Считается, что в развитии заболевания могут иметь значение следующие факторы:
нарушение моторики верхних отделов желудочно-кишечного тракта (ЖКТ) (пищеводно-желудочный рефлюкс, замедление эвакуации из желудка, нарушение антродуоденальной координации);
Причиной появления основных симптомов ФД считают нарушение двигательной функции желудка и 12-перстной кишки. Преобладают следующие моторно-эвакуаторные нарушения:
гастропарез — ослабление моторики антрального отдела желудка с замедлением эвакуации содержимого — наблюдают у 50% больных с ФД;
нарушение аккомодации желудка — снижение способности проксимального отдела расслабляться после приема пищи под действием нарастающего давления содержимого на его стенки (при нормальной аккомодации после приема пищи происходит увеличение объема желудка без повышения внутрижелудочного давления);
нарушение ритма перистальтики (желудочная дисритмия) — расстройство антродуоденальной координации, развитие перистальтики желудка по брадигастритическому (чаще), тахигастритическому или смешанному типу.
Существует корреляция между симптомами и двигательными нарушениями желудка и 12-перстной кишки. Тошнота и рвота связаны с гастропарезом, чувство переполнения в эпигастрии — с нарушением чувствительности рецепторного аппарата желудка к растяжению, чувство раннего насыщения — с расстройством аккомодации желудка.
Очевидно, главное звено патогенеза ФД у большинства больных — ослабление двигательной функции желудка и 12-перстной кишки, что приводит к замедлению опорожнения желудка.
У части больных появление диспептических расстройств возможно при нормальной моторике желудка. В подобных случаях растяжение стенки желудка связано с повышенной чувствительностью механорецепторов, располагающихся в подслизистом слое, и/или с изменением тонуса проксимальной части желудка. Висцеральная гиперчувствительность возникает вследствие патологического сокращения желудка и нарушения рецепторного восприятия нормальных раздражителей, включая мышечные сокращения желудка и растяжение его воздухом и пищей.
Снижение тонуса желудка в норме связано с взаимодействием таких рефлексов, как релаксационный (поступление пищи через пищевод в желудок) и аккомодационный (растяжение желудка). Анализ таких симптомов, как боли в подложечной области, послеобеденное переполнение желудка, быстрое насыщение, тошнота, рвота, срыгивание, жжение в эпигастральной области и метеоризм, показывает, что ослабление аккомодации достоверно связано с быстрым насыщением.
При исследовании желудочной гиперчувствительности у больных с неязвенной диспепсией Klatt S. et al. установили, что средний порог чувствительности у них выше, чем у пациентов из контрольной группы, но у 50% больных с ФД порог чувствительности оставался нормальным.
Клиническая картина
При язвенноподобном варианте отмечают постоянные или периодические боли либо ощущение дискомфорта в эпигастральной области, не имеющие четкой связи с приемом пищи.
При дискинетическом варианте пациентов беспокоят чувство переполнения, тяжести в эпигастральной области после еды, вздутие живота, тошнота, рвота, чувство быстрого насыщения (табл.).
При неспецифическом варианте наблюдают сочетание различных симптомов ФД, и выделить ведущий синдром не удается.
Диагностика
Диагноз ФД правомочен лишь после исключения всех органических причин боли и дискомфорта в эпигастрии.
В России, как правило, проводится обязательное обследование больного, впервые обратившегося с этими жалобами. В США и Западной Европе предлагают два подхода: или лабораторно-инструментальное обследование больного, установление диагноза, назначение лечения, или проведение эмпирической терапии без предварительного обследования. В последнем случае диагностические процедуры назначают только при отсутствии эффекта от эмпирического лечения.
Согласно критериям Римского консенсуса III, в процессе диагностики ФД предлагается следовать пунктам, разработанным на основе доказательной медицины.
Следует проанализировать клиническую картину и убедиться, что жалобы пациента, скорее всего, связаны с патологией верхнего отдела ЖКТ.
Необходимо исключить симптомы тревоги (потеря массы тела, повторяющаяся рвота, прогрессирующая дисфагия, кровотечения из ЖКТ).
Исключить прием нестероидных противовоспалительных препаратов (НПВП), которые могут вызвать гастропатию.
Срочная эндоскопия рекомендуется больным с симптомами тревоги или в возрасте старше порогового (установленного органами здравоохранения).
Предпочтение может быть отдано пробной терапии, поскольку ФД широко распространена, и тотальное инструментальное обследование всех обратившихся нецелесообразно.
Диагноз ФД может быть поставлен при наличии трех обязательных условий (Римские критерии):
постоянная или рецидивирующая диспепсия (боли или дискомфорт, локализующиеся в эпигастральной области по средней линии), продолжительность которой составляет не менее 12 недель за последние 12 месяцев;
отсутствие доказательств наличия органического заболевания, подтверждаемое тщательным сбором анамнеза, ФГС и УЗИ органов брюшной полости;
диспепсия не уменьшается после дефекации и не сопровождается изменением частоты или формы стула (эти признаки характерны для синдрома раздраженного кишечника).
Инструментальные и лабораторные исследования:
ФГС — исключает органическую патологию верхних отделов ЖКТ (ГЭРБ, язвенная болезнь (ЯБ), рак желудка).
Электрогастрография — основана на регистрации электрической активности желудка, отражающей сокращение его стенок, с помощью электродов, установленных в эпигастральной области. В норме частота сокращений желудка составляет около 3 волн в минуту (2,4 волны в минуту и менее — брадигастрия, 3,6–9,9 волны в минуту — тахигастрия).
Гастродуоденальная манометрия — оценивает изменение давления при сокращении стенки желудка с помощью датчиков, введенных в полость антрального отдела желудка и 12-перстной кишки.
Рентгенологическое исследование — выявляет стеноз или дилатацию отделов пищеварительного тракта, замедленное опорожнение желудка.
По показаниям проводятся компьютерная и магнитно-резонансная томография, 24-часовое мониторирование внутрипищеводного рН.
Для определения висцеральной гиперчувствительности слизистой оболочки желудка используется желудочный баростат-тест.
Лабораторные методы: проводят клинический (содержание эритроцитов, лейкоцитов, СОЭ) и биохимический (активность аспарагиновой (ACT), аланиновой (АЛТ) трансаминаз, щелочной фосфатазы, гамма-глутамилтранспептидазы (ГГТП) анализы крови, исследование кала на скрытую кровь.
ФД часто приходится дифференцировать с синдромом раздраженной кишки, при котором боли чаще возникают в нижних отделах живота и обычно сопровождаются расстройствами стула (запоры, поносы или их чередование). Эти два заболевания часто сочетаются друг с другом, т. к. имеют общие патогенетические механизмы, связанные с нарушениями двигательной функции ЖКТ (эфферентное звено) и со сниженным порогом восприятия (афферентное звено).
Лечение
Терапия комплексная и включает мероприятия по нормализации образа жизни, режима и характера питания, лекарственную терапию, при необходимости — психотерапевтические методы.
По возможности устраняют физические и эмоциональные перегрузки, отрицательно влияющие на моторику ЖКТ.
Недопустимы длительные перерывы в приеме пищи, обильное употребление жирной и острой пищи, консервантов, маринадов, копченостей, кофе. Исключают курение, употребление алкоголя и газированных напитков.
Отсутствие полных представлений о патогенезе ФД делают лечение этого синдрома непростой задачей. Подходы к лечению ФД более многочисленны, чем обоснованная тактика лечения ЯБ или ГЭРБ.
Наиболее широко изучалась эффективность прокинетиков, эрадикации H. pylori и кислотосупрессивных агентов.
Прокинетики. Оказались более эффективны, чем плацебо, в 16 из 21 проведенного исследования (метоклопрамид — в 2 из 2 исследований, цизаприд — в 7 из 12 и домперидон — в 7 из 7 исследований), в целом на 40–45%.
Домперидон, метоклопрамид, цизаприд, наряду с повышением амплитуды сокращений пищевода и повышения давления в области его нижнего сфинктера, улучшают клиренс кислоты из нижнего отдела пищевода и снижают объем желудочно-пищеводного рефлюкса. Они ускоряют опорожнение желудка благодаря повышению частоты и амплитуды сокращений антрального отдела желудка, снижая время транзита и в 12-перстной кишке путем увеличения амплитуды ее сокращений. Ускорение опорожнения желудка, вызываемое прокинетиками, связано также со способностью этих препаратов синхронизировать антральные и дуоденальные сокращения.
Домперидон — это эффективный селективный антагонист дофамина. Главное действие препарата — блокада рецепторов дофамина, влияющих на моторику верхних отделов ЖКТ. Усиливая перистальтику пищевода, повышая тонус его нижнего сфинктера и регулируя моторную функцию желудка (в том числе увеличивая длительность сокращений его антрального отдела), усиливая перистальтику 12-перстной кишки, домперидон ускоряет опорожнение желудка.
Домперидон противодействует желудочной релаксации, обусловленной введением дофамина, и торможению, вызванному введением секретина; увеличивает амплитуду сокращений антрального отдела желудка, являясь причиной релаксации пилорического сфинктера. Препарат улучшает антродуоденальную координацию, под которой понимают распространение перистальтических волн из антрального отдела желудка через привратник к 12-перстной кишке.
Лечение инфекции H. pylori
В ингибирующем действии H. pylori на моторику желудка участвуют цитокины (IL-1b, IL-6, IL-8) и фактор некроза опухолей-альфа (TNF-альфа). С учетом этого антихеликобактерная терапия может приводить к нормализации желудочной моторики.
Однако полное устранение диспептических жалоб отмечается только у 20–25% пациентов с ФД. Эрадикация H. pylori, согласно результатам только 8 из 16 исследований, оказывала благоприятное влияние на симптомы пациентов с ФД. Согласно заключению Национального института здравоохранения США (1994), лечения хеликобактерной инфекции пациентов с ФД не требуется.
Однако в ряде работ показано, что частота хеликобактерной инфекции среди пациентов с неязвенной диспепсией выше, чем у здоровых лиц. Кроме того, инфицирование H. pylori может вызывать диспептические симптомы.
Другие авторы подвергают сомнению значение эрадикации H. pylori в терапии хеликобактер-ассоциированной ФД с целью устранения симптомов. Не удается выявить существенных различий в уменьшении частоты симптомов диспепсии независимо от того, получали больные антихеликобактерную терапию или нет. Имеются данные, что через год после проведенного лечения симптомы ФД у больных с успешной эрадикацией H. pylori отмечаются чаще, чем у больных, не пролеченных ранее с использованием антихеликобактерной терапии.
Новые факты послужили причиной проведения в марте 2005 года ІІІ Совета ведущих ученых, занимающихся проблемой хеликобактерной инфекции. В результате был выработан ІІІ Маастрихтский консенсус, определяющий подходы к диагностике и уничтожению инфекции Н. рylori.
Согласно новому консенсусу, обязательному обследованию на инфицированность Н. рylori и проведению эрадикационной терапии подлежат пациенты с неисследованной ФД.
В случае одновременной устойчивости Н. рylori к двум препаратам 1-й линии рекомендуется сразу начинать эрадикацию с резервной схемы, т. е. использовать резервную схему лечения в качестве первой линии.
Психотропные средства. Включают в себя антидепрессанты, блокаторы серотониновых рецепторов и обратного захвата серотонина, анксиолитики. В настоящее время нет результатов контролируемых исследований, посвященных применению этих препаратов при ФД. Надо ожидать, что эффект таких средств близок к благоприятному влиянию их на пациентов, страдающих некардиальными торакалгиями или синдромом раздраженной кишки.
Эмпирическая терапия. Если отсутствуют признаки серьезных органических заболеваний или их не было обнаружено при стандартном диагностическом обследовании, оправдано назначение так называемой эмпирической терапии.
У молодых пациентов без признаков органических заболеваний желудка для выявления хеликобактерной инфекции используют серологический тест на IgG-антитела к H. pylori или дыхательный уреазный тест. Пациентам с положительными результатами тестов следует назначить эрадикационную терапию. Если при этом диспептические симптомы проходят, дальнейшего обследования не требуется.
У пациентов, не имеющих хеликобактерной инфекции или имеющих ее, но не отреагировавших на лечение противохеликобактерными средствами, следует начать лечение Н2-блокаторами или ингибиторами протонной помпы и прокинетиками. Если эффекта нет, показаны эндоскопия и другие исследования для выбора дальнейшей тактики лечения.
Антациды. Исследования по снижению кислотности желудочного сока в лечении ФД выявили невысокую эффективность антацидов. Так, в 14 из 24 исследований было показано, что данные препараты в больших дозах вызывают улучшение самочувствия у 35–80% пациентов по сравнению с 30–60% лиц, получающих плацебо.
Антациды хорошо известны и пациентам, и врачам, доказана безопасность их использования, поэтому эта группа препаратов находит применение при ФД.
Наиболее часто используются (как по рекомендациям врачей, так и принимаются больными самостоятельно) такие антациды, как Алмагель Нео, Фосфалюгель, Рутацид, Гелусил лак, основное свойство которых — нейтрализация кислоты, выделенной обкладочными клетками слизистой оболочки. Это позволяет быстро уменьшать интенсивность болей в эпигастральной области и изжогу, у многих больных — и другие диспептические расстройства.
Кислотосупрессивные препараты. Это группа лекарственных препаратов, которую часто используют для лечения ФД. Некоторые авторы считают, что положительный результат от антагонистов Н2-рецепторов гистамина в ряде клинических испытаний получен благодаря группе больных с ГЭРБ, которые были включены в эти испытания из-за несовершенства критериев отбора.
Однако метаанализ G. Dobrilla и соавт. (1989) показал, что при использовании Н2-блокаторов терапевтический эффект на 20% превосходил эффект плацебо.
Существует мнение, что при ФД эффективной является высокая доза антагонистов Н2-рецепторов гистамина, однако для подтверждения этого необходимы серьезные исследования.
ИПП пока мало применялись при ФД. Недавно завершенное исследование с высокой статистической достоверностью показало хороший эффект омепразола при ФД, причем лучший результат был получен в группе больных с язвенноподобным вариантом по сравнению с дискинетическим. В исследовании OCAY монотерапия омепразолом оказалась эффективна в купировании симптомов диспепсии, как и эрадикационная терапия инфекции H. pylori.
Продолжаются дискуссии относительно выбора оптимального ИПП. Российская гастроэнтерологическая ассоциация рекомендует применять рабепразол. Устойчивый эффект от его приема отмечается с 1-го дня. Кроме того, нет необходимости в 2–3-дневном промежутке между назначением рабепразола и антибактериальных компонентов эрадикационной терапии, их можно применять с первых дней в комбинации. Амоксициллин и кларитромицин проявляют антибактериальный эффект по отношению к Н. рylori только при рН 5,0 и выше, поэтому назначение одновременно с этими антибиотиками других ИПП, имеющих более длительный период наступления эффекта, приводит к снижению % эрадикации Н. рylori.
На отечественном фармрынке присутствуют все основные ИПП: омепразол, лансопразол, пантопразол, рабепразол и эзомепразол. Омепразол чаще других используют в российской практике, что вполне оправдано с учетом количества клинических исследований, посвященных этому препарату. Отечественным генериком, по которому проводились исследования биоэквивалентности оригинальному препарату, является Гастрозол.
В процессе лечения было установлено, что в группе использования Омеза значимо более быстро уменьшилась выраженность клинических симптомов, снизился уровень тревожности по шкале Тейлора, депрессии по шкале Цунга, нормализовался вегетативный индекс Кердо, снизилась выраженность болей по визуальной аналоговой шкале (ВАШ), повысилось качество жизни (КЖ) по сравнению с группой сравнения, где применялась монотерапия ранитидином.
Дифференцированная медикаментозная терапия
Резюмируя изложенное для практического врача-терапевта или семейного врача, необходимо иметь в виду следующее:
При язвенноподобном варианте ФД показаны антациды и антисекреторные препараты (Алмагель Нео; блокаторы Н2-рецепторов гистамина: ранитидин по 150 мг 2 раза в сутки, фамотидин по 20 мг 2 раза в сутки; блокаторы Н + -, К + -АТФазы — омепразол, рабепразол по 20 мг 2 раза в сутки, лансопразол по 30 мг 2 раза в сутки).
При дискинетическом варианте главным образом применяют прокинетики: домперидон, метоклопрамид, цизаприд, реже — сульпирид.
При неспецифическом варианте ФД показана комбинированная терапия прокинетиками и антисекреторными препаратами.
При наличии депрессивных или ипохондрических реакций необходима рациональная психотерапия, назначение антидепрессантов.
Литература
Васильев Ю. В., Яшина Н. В., Иванова Н. Г. Синдром диспепсии (диагностика, лечение) // Актуальные вопросы клинической медицины. М., 2001 г. С. 77–82.
Внутренние болезни: учебник в 2-х томах. Под ред. Мухина Н. А., Моисеева В. С., Мартынова А. И. 2-е изд., испр. и доп. М.; ГЭОТАР-Медиа, 2006.
Blum A. L. et al. Lack of effect of treatment Helicobacter pylori infection in parients with nonulcer dyspepsia // New Engl. J. Med. 1998; 339: 1975.
Drossman D. A. The functional gastrointestinal disorders and the Rome II process // Gut. 1999; 45 (Suppl. 2): II1–II5 (September).
Fisher R. S., Parkman H. P. Management of nonulcer dyspepsia // N. Engl. J. Med. 1998; 339 (19): 1376–1381.
В. В. Скворцов, доктор медицинских наук
А. В. Тумаренко, кандидат медицинских наук
В. В. Одинцов
А. И. Елизарова
Е. М. Скворцова
ВолГМУ, Волгоград
Главным в лечении всех форм дифтерии является нейтрализация дифтерийного токсина антитоксической противодифтерийной сывороткой.
Лечение локализованных и распространенных форм ограничивается введением сыворотки.
В комплексном лечении больных токсической дифтерией и крупом, кроме того, необходимо проводить патогенетическую терапию, обеспечить строгое соблюдение режима, тщательный квалифицированный уход и диету.
Тактика врача в решении вопроса о введении противодифтерийной сыворотки по клиническому подозрению на дифтерию зависит от того, какая форма дифтерии предполагается.
При подозрении на локализованную дифтерию и дифтерийный круп сыворотку вводят НЕМЕДЛЕННО
При подозрении на локализованную дифтерию выжидание возможно при условии постоянного наблюдения в стационаре.
При гипертоксической и токсической дифтерии II—III степени тяжести, крупе, тяжелых комбинированных формах положительная реакция на кожные пробы не является противопоказанием к лечению ПДС, которое проводится под защитой кортикостероидов.
Дозы сыворотки для первого введения и на курс лечения определяются клинической формой дифтерии (см. табл. 32).
Лечение крупа проводится в соответствии со стадией: начальные дозы при I стадии — 15—20 тыс. ME, при II — 20—30 тыс. ME, при III — 30—40 тыс. ME; через 24 часа дозу повторяют, в последующие дни ежедневно следует вводить половинную дозу сыворотки.
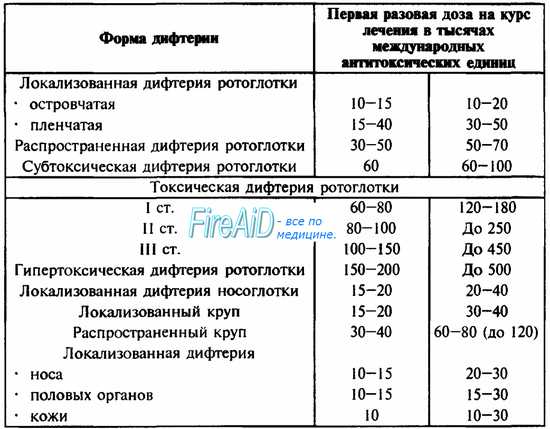
Таблица 32. Схема введения противодифтерийной сыворотки (ПДС) при различных клинических формах дифтерии.
Кратность введения ПДС определяется формой дифтерии: при локализованной и распространенной дифтерии ротоглотки, носа, редких локализаций и ранних сроках начала терапии можно ограничиться однократным введением сыворотки;
• при задержке таяния налетов через сутки сыворотку вводят повторно;
• при токсической дифтерии сыворотку вводят через каждые 12 часов;
• при гипертоксической — через 8 часов.
Лечение сывороткой при токсической дифтерии должно быть энергичным:
• первая доза должна составлять 1/3—1/2 от курсовой;
• в первые двое суток больной получает около 3/4 всей дозы.
В процессе лечения необходима коррекция в соответствии с уточнением формы болезни.
У больных дифтерийным крупом одновременно с введением ПДС и проведением неспецифической дезинтоксикации, оксигенотерапии, коррекции кислотно-шелочного равновесия, гормональной терапии (в соответствии с формой болезни) решается вопрос о необходимости оперативного вмешательства, его экстренности и выборе метода. Необходимо непрерывное наблюдение оперирующего отоларинголога. Показанием к оперативному вмешательству являются признаки затруднения внешнего дыхания. При локализованном и распространенном крупе (дифтерия гортани и трахеи) возможна длительная интубация пластиковыми трубками, при нисходящем крупе и крупе в комбинации с наиболее тяжелыми формами токсической дифтерии показана трахеостомия.
Примечание. В случае развития стеноза и при наличии признаков ОДН II—III ст. показана срочная назотрахеальная интубация, при нисходящем крупе предпочтительна трахеостомия. При тяжелых полиради-кулоневритах — перевод на ИВЛ в плановом порядке.
При тяжелых формах дифтерии наряду с сывороточной терапией показана детоксикационная терапия и введение антибиотиков широкого спектра действия. У больных токсической дифтерией III степени тяжести, тяжелых комбинированных формах при поступлении после третьих суток, а также при гипертоксических формах показан плазмаферез (предпочтителен дискретный метод) с эксфузией плазмы от 70 до 100% объема циркулирующей плазмы. Целесообразно 2—3 кратное проведение плазмафереза.
При адекватной терапии введение сыворотки проводится не более 3—4 дней. Лечение сывороткой заканчивается с момента значительного уменьшения токсикоза, налетов, лимфаденита, отека ротоглотки и подкожной клетчатки шеи.
Примечание. В связи с частым поражением проводящей системы сердца, при дифтерии использование сердечных гликозидов противопоказано.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Дифтерийный круп. Диагностика дифтерии
Дифтерийный круп - клинический синдром, проявляющийся хриплым и сиплым голосом, лающим грубым кашлем, затрудненным стенотическим дыханием, возникает при локализации дифтеритического воспаления в дыхательных путях, а именно: в гортани (локализованный круп); в гортани, трахее, бронхах (распространенный круп) по типу нисходящего ларинготрахеобронхита. Начало болезни в этих случаях не столь бурное и при отсутствии специфического лечения катаральный период (через 1-2-3 суток) постепенно переходит во вторую стенотическую стадию крупа, проявляющуюся стенозом дыхательных путей.
Стенотический период продолжается от нескольких часов до 2-3 суток; без введения противодифтерийной сыворотки заканчивается летальным исходом при явлениях асфиксии (синюшность лица и кожных покровов, дыхательная недостаточность, кома).
Течение дифтерии при других локализациях более легкое, но они также требуют введения противодифтерийной сыворотки. Возникновение дифтерии у привитых возможно, но она отличается более легким течением и редкими осложнениями.
Осложнения дифтерии. 1. Миокардит. Нарушается сердечный ритм, падает АД, тахикардия. На ЭКГ - снижение вольтажа зубцов, смещение ST-интервала, отрицательный зубец Т, AV-блокада. На высоте интоксикации возможно развитие нефротического синдрома, а при нисходящем крупе - поражение легких в виде острой пневмонии.
2. Периферические параличи: ранние (на 2-й неделе болезни) и поздние (на 4-5-й неделе). В раннем периоде поражаются черепные нервы (паралич мягкого неба, аккомодации, иногда наружная офтальмоплегия); поздние параличи характеризуются развитием полирадикулоневрита. Течение параличей длительное, но исход в большинстве случаев благоприятный: через 1-3 мес нарушенные функции восстанавливаются.
Диагноз дифтерии устанавливается клинически, так как нельзя допускать промедления с введением противодифтерийной сыворотки.
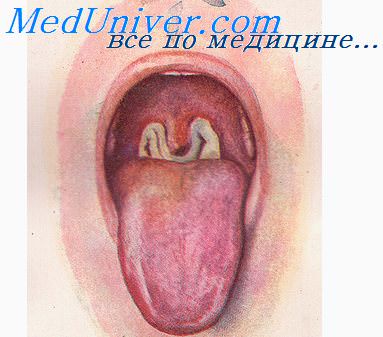
Из лабораторных методов наибольшее значение имеет бактериологическое исследование. Возможно определение антимикробных антител методами РПГА, РИГА: результат считается положительным при нарастании титра антител в динамике заболевания. Дифтерийный токсин в крови можно определить ПЦР.
Для определения наличия и напряженности антитоксического иммунитета при дифтерии применяют внутрикожную реакцию Шика (при наличии иммунитета она отрицательная) и определяют титр антитоксина в сыворотке крови обследуемого.
Главным методом лечения является введение антитоксической противодифтерийной сыворотки (ПДС), которая нейтрализует дифтерийный токсин, циркулирующий в крови. На токсин, связанный с тканями и вызвавший их повреждение, ПДС не оказывает нейтрализующего действия, что подчеркивает необходимость возможно раннего назначения серотерапии. Лечебная эффективность сыворотки столь высока, что при локализованной и распространенной формах дифтерии других средств не требуется.
При токсических формах и дифтерийном крупе кроме ПДС необходимы патогенетическая терапия и правильный уход за больным, а также индивидуальная тактика ведения больного на основе тщательного клинического наблюдения за течением болезни на фоне применяемого лечения, которое может подвергаться этапной коррекции.
За последние годы лечение дифтерии ПДС подверглось серьезному клиническому анализу. Обоснована нецелесообразность введения больших доз ПДС и многократности ее введения (Н.Д. Ющук с соавт. и др.). Сделан еще раз акцент на необходимости раннего введения ПДС в адекватных форме болезни дозах и сокращения продолжительности серотерапии, сведения ее в большинстве случаев к однократному введению сыворотки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Работа посвящена необходимости принятия новой российской классификации дифтерии с учетом обобщенного опыта последней эпидемии дифтерии в России и приведения классификации в соответствие с современными представлениями о дифтерийной инфекции.
The paper is concentrated on the necessity of accepting a new Russian classification of diphtherias considering generalized experience of the latest diphtherial epidemic in Russia and bringing the classification in conformity to modern concepts of diphtherial infection.
Дифтерийная инфекция (ДИ) отличается клиническим многообразием от бессимптомного течения (бактерионосительство) до очень тяжелых форм [1–6].
Актуальность проблемы заключается в постоянной циркуляции штаммов в окружающей человека среде. Классическая дифтерия, вызванная C. diphtheria (КБД), ранее рассматривалась как исключительно антропонозная инфекция. Существование естественного резервуара ДИ проявляется клиническими случаями заболевания повсеместно и наличием эндемичных очагов высокой заболеваемости в Африке к югу от Сахары, в Индии и Индонезии. В 2013 г. дифтерия привела к гибели 3300 человек.
До сих пор остается открытым вопрос о наличии связи между массовым одномоментным выводом советских войск в 1990 г. из эндемичного по ДИ Афганистана и началом эпидемии дифтерии в 90-х годов в России и в республиках СССР. По оценкам Красного Креста в СССР в 1991 г. было 2000 случаев заболевания дифтерией, а в 1998 г. эти цифры выросли в 100 (!) раз и число смертельных исходов превысило 6000 [6, 8–11].
Это не дает повода успокоиться, так как наблюдается постоянная трансформация циркулирующих штаммов с изменением степени их патогенности, с одной стороны [12–14].
С другой стороны, родственная по микробиологическим характеристикам C. ulcerans, постоянно циркулирующая в окружающей среде, вызывает сходное по клинике с классической дифтерией заболевание. Описаны случаи экссудативного фарингита и острых респираторных заболеваний, вызванных Corynebacteruium pseudodiphtheria, Nondiphtheriae Corynebacterium species и нетоксигенными штаммами КБД. Клинические проявления заболеваний, вызванных указанной выше группой возбудителей, могут быть различными: поражения кожи, клапанов сердца, урогенитального тракта, верхних и нижних дыхательных путей [15–20].
В настоящее время заболевания, вызванные различными патогенными коринебактериями, постоянно регистрируются среди животных, находящихся рядом с человеком (зоопарки, фермы, охотоведческие хозяйства) с подтвержденной передачей возбудителя от больного животного к человеку [24–32].
Полученные материалы заставляют ученых пересмотреть точку зрения на дифтерию как на исключительно антропонозное заболевание, особенно после того, как Bonnet и Begg (1999) доказали возможность передачи инфекции от животного к человеку.
Эпидемические подъемы дифтерии в мире регистрируются в среднем каждые 25 лет. Хронологическое описание цикличности эпидемий ДИ внутри и за пределами Российской Федерации подробно представлено в монографиях Л. А. Фаворовой с соавт. (1988) и Н. М. Беляевой с соавт. (1996, переизд. 2012) [1–2].
С момента последней эпидемии 90-х годов XX века врачи утратили бдительность в отношении дифтерийной инфекции, не соблюдается требование обязательного исследования мазков из ротоглотки на наличие C. diphtheria при всех случаях лакунарной ангины [12–13, 35].
Последняя эпидемия дифтерии (90-х годов XX века) побудила международное сообщество к созданию в 2000 г. межгосударственного комитета по изучению ДИ в Европе и к принятию новой международной классификации дифтерийной инфекции, которая приводится ниже [2, 8, 10].
Предложенная классификация Н. Бегга удобна, так как позволяет вести эпидемиологический учет клинических форм дифтерии исходя из локализации первичного очага инфекции. Существенным недостатком международной классификации является полное отсутствие в ней упоминания о специфических дифтерийных поражениях внутренних органов (табл. 1).
Хотя кроме классификации ВОЗ существует еще и МКБ-10, в России врачи продолжают пользоваться классификацией дифтерии, сформулированной профессором С. Н. Розановым еще в 1949 г. (!) (табл. 2).
Даже в скорректированном виде эта классификация сохранила устаревшие нозологические формы — субтоксическая, токсическая (I, II и III степеней) и гипертоксическая дифтерия, тогда как многочисленными работами было доказано, что дифтерийный токсин обнаруживается в крови при любых вариантах, включая субклиническое течение болезни (рис. 1) [2].
Тогда как при дифтерии гортани рыхлый, тестоватой консистенции отек над областью подчелюстных лимфоузлов и на шее может отсутствовать. При дифтерийном крупе отсутствие наружного отека ПКШ часто приводит к диагностическим ошибкам [2]. Аналогичная ситуация имеет место при дифтерии половых органов с развитием выраженного отека половых органов, распространяющегося по наружной поверхности бедер [3].
Таким образом, существующая классификация специфический дифтерийный отек рассматривает как патогномоничный критерий тяжести дифтерии только при респираторном пути инфицирования и не учитывает других клинических вариантов (табл. 2).
В 1996 г. Н. М. Беляевой и сотрудниками кафедры инфекционных болезней РМАПО была предложена российская классификация ДИ, которая предполагала принципиальную замену устаревшей классификации 50-х годов XX века (табл. 3) [2].
Предложенная классификация была более удачной, так как авторы впервые указали в ней, что специфическое поражение сердца, нервной системы и почек, развивающееся при дифтерии, является не осложнениями (!), а ведущими синдромами заболевания (табл. 3).
Слабым звеном существующей классификации остается привязка дозы противодифтерийной сыворотки к форме болезни (к степени отека ПКШ, а не к тяжести состояния больного), что приводило к рассогласованному назначению лечебных доз ПДС. В России в последнюю эпидемию дифтерии курсовые дозы сыворотки колебались в интервале от 100 тысяч единиц до нескольких миллионов (!) [2, 11].
Нами была установлена взаимосвязь между сывороточной болезнью и острым поражением почек (r = 0,229; р = 0,002). Риск развития острого поражения почек на фоне сывороточной болезни у больных дифтерией был выше в 3,6 раза.
Как демонстрирует следующий рисунок, у больных дифтерией без поражения почек средняя курсовая доза ПДС была 142 ± 41 тыс. МЕ, а у больных с поражением почек она была выше в 2 раза — 333,4 ± 20,8 тыс. МЕ (рис. 4).
Сывороточная болезнь не влияла статистически значимо на летальность (r = 0,151; р = 0,15), но усугубляла почечную патологию (рис. 4, 5).
Поэтому при старте сывороточной терапии целесообразно руководствоваться принципом оптимально достаточной дозы ПДС исходя из тяжести состояния больного, а наличие отека ПКШ — вспомогательный инструмент диагностики генерализованной (токсической) дифтерии и определения стартовой дозы ПДС.
Специфические органные поражения как клинические признаки генерализации инфекционного процесса были описаны многими авторами [1–4].
С нашей точки зрения, комбинированную дифтерию, дифтерию носа и дифтерию половых органов правильнее обозначать отдельными кодами, так как анатомическая локализация и площадь дифтерийных пленок влияют на тяжесть заболевания [1–6].
Степень тяжести дифтерии следует определять по совокупности эпидемиологических, клинических и лабораторных данных исходя из:
1) определения числа анатомических областей, вовлеченных в инфекционный процесс (с оценкой размеров фибриновой пленки);
2) обнаружения специфического дифтерийного отека подкожной клетчатки и окружающих тканей в области первичного очага инфицирования;
3) результатов лабораторного исследования на обнаружение возбудителя дифтерии и уровень ДТ-токсинемии;
4) клинической картины поражения органов-мишеней.
Для предварительного диагноза дифтерии и начала сывороточной терапии достаточно первого и второго пунктов.
Окончательный диагноз дифтерии устанавливают по результатам динамического наблюдения с учетом лечебного эффекта введенной ПДС, результатам бактериологического и инструментального исследования (ларингоскопия и др.) и клинической картины поражений органов-мишеней.
Ниже предлагаются варианты формулировки клинического диагноза (табл. 5):
- Локализованная дифтерия носа, легкое течение (КБД gravis tox +).
- Генерализованная дифтерия ротоглотки и гортани, тяжелая форма. Стеноз гортани II–III ст. Дифтерийное поражение сердца (миокардит, неполная AV-блокада, НК I). Дифтерийное поражение нервной системы (парез IX–X пары ЧМН). Дифтерийное поражение почек (протеинурия, гематурия). Диагноз установлен клинически (в мазке со слизистой ротоглотки КБД не обнаружена). Осложнения: левосторонняя нижнедолевая пневмония. ДН I.
Обобщая результаты вышеизложенного материала, можно сделать следующие выводы:
Замена прежней классификации дифтерии на более современный вариант — актуальная задача практического здравоохранения.
Литература
- Фаворова Л. А., Астафьева Н. В., Корженкова М. П. Дифтерия. М.: Медицина, 1988. 208 с.
- Беляева Н. М., Турьянов М. Х., Царегородцев А. Д. и др. Дифтерия. СПб: Нестор-История, 2012. 254 с.
- Ляшенко Ю. И., Финогеев Ю. П., Павлович Д. А. Дифтерия редких локализаций у взрослых // Журнал инфектологии. 2011. Т. 3. № 1. С. 45–52.
- Батаева С. Е., Харченко Г. А., Буркин B. C. Токсические формы дифтерии у привитых детей // Эпидемиология и инфекционные болезни. 2004. № 3. С. 53–55.
- Митрофанов А. В., Овчинникова Т. А., Комарова Т. В., Гасилина Е. С. Сочетание субтоксической дифтерии ротоглотки и острой цитомегаловирусной инфекции на фоне персистенции Эпштейна–Барр вируса у ребенка 5 лет (клиническое наблюдение) // Вестник Российского университета дружбы народов. Серия: Медицина. 2010. № 4. С. 338–341.
За полным списком литературы обращайтесь в редакцию.
Е. Г. Фокина, кандидат медицинских наук
ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Москва
Читайте также:

