Печень и грибковые инфекции
Обновлено: 22.04.2024
Н.В. БЕЛОБОРОДОВА, доктор медицинских наук, профессор, главный научный сотрудник академической группы академика РАМН Ю.Ф. Исакова.
При участии Ж.И. АРХИПОВОЙ, кандидата медицинских наук, НИИ детской гематологии. Серьезные экологических изменения, происходящие на планете в последние десятилетия, не могли не сказаться на состоянии микроэкологии и иммунореактивности современного человека.
В этом - одна из глобальных причин роста грибковых заболеваний, которыми сегодня, по данным Всемирной организации здравоохранения, страдает каждый пятый житель планеты. Чаще проявлениями грибковых заболеваний являются различные локальные поражения кожи, ногтей, слизистых оболочек полости рта, кишечника, уретры и влагалища, однако при серьезных нарушениях иммунореактивности организма может наступить генерализация процесса, и тогда грибковые заболевания приобретают жизнеугрожающий характер.
На фоне достижений современной медицины, увеличения продолжительности жизни наиболее ослабленных больных (глубоконедоношенные дети, пациенты с опухолями и иммунодефицитами) в лечебных учреждениях наблюдается широкое распространение инвазивных микозов, которые составляют до 12% в этиологической структуре внутрибольничных инфекций и до 40% в структуре инфекционной летальности. Ученые из Центра контроля заболеваемости (Атланта, США) называют кандидоз внутрибольничной эпидемией последнего десятилетия, так как заболеваемость им иммунокомпрометированных больных возросла в 11 раз.
Колонизация слизистых грибами Candida у практически здоровых людей колеблется от 15 до 40% и может возрасти до 80% на фоне какой-либо патологии в условиях длительной госпитализации, но инвазивный микоз у них не развивается благодаря большому количеству защитных механизмов против грибковой инфекции. Защитные механизмы, не связанные с иммунной системой, включают барьеры в виде кожи и слизистых, а также конкурентные взаимодействия с нормальными бактериями, которые обеспечивают защиту от кандидоза и других микозов посредством соревнования за пищу и, возможно, посредством локальной продукции веществ с антифунгальной активностью. Само по себе разрушение барьеров химической травмой, ожогом или операцией, как и нарушение нормального биоценоза кишечника после длительного применения антибиотиков широкого спектра действия, крайне редко приводит к развитию системного микоза, но вызывает предпосылки для этого в виде локального избыточного накопления грибов в тех местах, где действие физиологических барьеров нарушено.
Общеизвестными факторами риска возникновения грибковой инфекции являются длительная антибиотикотерапия и снижение защитных сил организма. В нормальном организме нейтрофилы, макрофаги и эозинофилы фагоцитируют и убивают бластоспоры кандид, а альвеолярные макрофаги и нейтрофилы способны блокировать прорастание спор аспергилл. Нейтрофилы и моноциты уничтожают также псевдогифы Candida и гифы Aspergillus. Поэтому первыми кандидатами на развитие диссеминированного кандидоза и аспергиллеза являются больные с количественными и функциональными дефектами нейтрофилов, особенно в условиях депрессии Т-клеточного звена иммунной сиcтемы. К специфическим условиям относится лекарственная нейтропения на фоне лечения цитостатиками, особенно глубокая (14 дней нейтрофилы
У пациентов с онкогематологическими заболеваниями к появлению специфических факторов риска инвазивного микоза приводит терапия. На современном этапе она обязательно включает мощные цитостатики, глюкокортикоиды и антибиотики широкого спектра действия. Помимо возникновения нейтропении цитостатики приводят к разрушению кожных и слизистых барьеров, глюкокортикоиды угнетают Т-лимфоциты и макрофаги, антибиотики нарушают биоценоз кишечника. Неудивительно, что в онкогематологических стационарах инвазивные микозы становятся все возрастающей проблемой.
Барьер №1 - конкурентное взаимодействие грибов с бактериями нормальной микрофлоры хозяина
Барьер №2 - целостность кожи и слизистых
Барьер №3 - фагоцитоз и иммунологические реакции
Основные факторы, способствующие разрушению барьеров
№1 - неадекватная (избыточная) антибиотикотерапия
№2 - повреждение эпителия (механическое, токсическое, воспалительное), замедление регенерации, авитаминоз
№3 - снижение иммунореактивности под влиянием цитостатиков, стероидных гормонов
Еще в 80-е годы грибковые инфекции возникали в основном на фоне длительной госпитализации, продолжительной антибиотикотерапии и повторных курсов химиотерапии. Средняя продолжительность периода от момента установления диагноза онкогематологического заболевания до развития грибкового осложнения составляла 19 месяцев. В настоящее время все чаще грибковые инфекции стали наблюдаться на ранних этапах лечения цитостатиками. Это связано как с агрессивностью режимов полихимиотерапии, так и с широким применением современных супермощных антибиотиков.
Важно отметить, что инвазивные грибковые поражения могут развиваться не только у больных при явнымх дефектах иммунореактивности, но и у пациентов с любыми хирургическими заболеваниями в случае осложненного течения послеоперационного периода, реанимационных мероприятий, интенсивной терапии, длительной искусственной вентиляции легких. Мы наблюдали таких пациентов после тяжелых комбинированных травм, после повторных операций по поводу абдоминального сепсиса, после кардиохирургических, нейрохирургических операций и др. В этих случаях предрасполагающим моментом является совокупность факторов, снижающих барьерную функцию слизистых оболочек (стресс, нарушения гемодинамики, гипоксия, длительная невозможность энтерального питания и др.) в сочетании с массивной комбинированной антибиотикотерапией, к сожалению, необходимой у больных высокого риска по жизненным показаниям. Забегая вперед, следует отметить, что даже при выделении грибов из крови или очагов инфекции при проведении целенаправленной противогрибковой терапии у таких пациентов не представляется возможным отказаться от одновременного введения антибиотиков в связи с высокой опасностью септического шока.
Самым частым видом микоза является кандидоз. В списке возбудителей кандидоза лидирующее место занимает Candida albicans. Этим видом грибов вызывается более 80% кандидозов. Однако инфекция может быть вызвана и другими видами: С. tropicalis, С. parapsilosis, С. krusei, С. lusitaniae, Torulopsis glabrata.
Кандидоз в зависимости от степени поражения может быть классифицирован как поверхностный и глубокий. Поверхностный кандидоз включает кожный, орофарингеальный, мочеполовой и характеризуется поражением соответствующих слизистых. Наиболее опасен глубокий кандидоз, составляющий основной спектр кандидозных инфекций у иммунокомпрометированных больных, который может быть классифицирован как фунгемия, диссеминированный кандидоз и кандидоз отдельных органов.
Инвазивное кандидозное поражение желудочно-кишечного тракта (ЖКТ). Считается общепризнанным, что ЖКТ является основным эндогенным резервуаром Candida, откуда происходит проникновение грибов в кровь (феномен транслокации) и последующее распространение инфекции по организму. Однако у больного с агранулоцитозом локальное поражение ЖКТ грибами рода Candida не ограничивается хорошо описанной в литературе ролью "ворот" для диссеминации, а само по себе может вызвать жизнеугрожающие состояния: прогрессирование поражения быстро приводит к множественной инфильтрации или некрозам всей толщи стенки пищеварительного канала, вызывая такие тяжелые осложнения, как кишечная непроходимость, перитонит, желудочно-кишечное кровотечение, вплоть до летального исхода.
Поражение легких. Грибы рода Candida часто высеваются из респираторных секретов, однако клиническое значение таких высевов в большинстве случаев невелико, так как колонизация ротовой полости и верхних дыхательных путей приводит к контаминации мокроты. Более того, легочная инфекция грибами Candida обычно возникает в результате гематогенного распространения, и мокрота у таких больных не отделяется вовсе. Симптомы кандидозной пневмонии схожи с клиническими проявлениями бактериальной пневмонии, но носят более непостоянный характер. Обращает на себя внимание несоответствие выраженных нарушений дыхания скудным аускультативным и рентгенологическим признакам. Рентгенологические нарушения могут ограничиваться изменениями корня и усилением сосудистого рисунка, почти в половине случаев наблюдается рентгенонегативная кандидозная пневмония. В финале заболевания может развиться диссеминация по обоим легочным полям. Рентгенологически этот процесс характеризуется появлением множественных "мигрирующих" облаковидных теней. Сегодня для диагностики поражения легких у иммунокомпрометированных больных наиболее широко используется бронхоальвеолярный лаваж с последующим микробиологическим исследованием.
Поражение кожи встречается в 5-10% случаев острого диссеминированного кандидоза. Классически оно имеет вид плотных, приподнимающихся над поверхностью узлов 0,5-1 см в диаметре, розово-красного цвета, не исчезающих при надавливании. Однако у большинства больных изменения на коже представляют собой просто папулезную или пятнисто-папулезную сыпь, часто неотличимую от медикаментозной.
Изменения на коже и инфильтраты мягких тканей часто становятся информативным материалом для идентификации возбудителя, так как поверхностное расположение делает их удобными для биопсии. Сочетание посева с гистологическим исследованием значительно увеличивает этот показатель. Следует иметь в виду, что поражения кожи при кандидозе затрагивают дерму, в то время как поверхностный слой эпидермиса остается интактным, поэтому клиницист должен быть очень внимателен при заборе материала. При гистологическом исследовании обычно находят псевдомицелий грибов, фибрин и небольшие геморрагии в сочетании с отеком стенки сосудов и периваскулярной ткани.
Поражение ЦНС. Кандидозный менингит встречается относительно редко, наиболее характерен для новорожденных и недоношенных детей, а также как вторичное осложнение при шунтирующих нейрохирургических вмешательствах. В случае развития у имунокомпрометированных больных имеет исключительно агрессивное течение. Поражение оболочек головного мозга характеризуется достаточно ярко выраженными общемозговыми и менингеальными симптомами, а также нейтрофильным или лимфоцитарным плеоцитозом в ликворе - в зависимости от степени нейтропении. Candida имеет низкую высеваемость из ликвора, при морфологическом исследовании ликвора друзы гриба или псевдомицелий обнаружить, как правило, не удается, клинические симптомы (лихорадка, головная боль) не специфичны, поэтому грибковая природа менингита у больных с нейтропенией редко распознается при жизни. Внутримозговые абсцессы, связанные с Candida, могут вызывать очаговую неврологическую симптоматику, соответствующую их локализации.
Поражение сердца. Клиника кандидозного эндокардита не отличается от клиники бактериального, сопровождается длительной лихорадкой и формированием вегетаций на клапанах сердца. Особенностью этой локализации является частое сочетание с фунгемией: хотя бы однократный высев Candida из крови имеют до 80% больных кандидозным эндокардитом. На фоне иммунодефицита могут развиваться грибковые микроабсцессы в миокарде, что иногда проявляется аритмиями. Возможна закупорка грибковыми тромбоэмболами кардиальных артерий с развитием ишемии и сердечной недостаточности.
Хронический диссеминированный кандидоз (ХДК). Наиболее важный маркер ХДК - поражение печени и селезенки. Именно микроабсцессы в этих органах определяют хронический характер течения болезни. Термины "ХДК" и "гепатолиенальный кандидоз" в литературе являются синонимами. Клинически ХДК проявляется увеличением печени и селезенки на фоне длительной лихорадки. Иногда заболевание сопровождается желтухой или болями в правом подреберье. В крови отмечаются высокий лейкоцитоз и выраженная гипербилирубинемия (в основном за счет прямой фракции) в среднем у половины больных. Уровень трансаминаз повышается непостоянно и не более, чем в 3 раза. Наблюдения позволяют сказать, что в целом у большинства больных поражение печени грибами выглядит как холестатический гепатит. Такая особенность приводит к тому, что ХДК часто ошибочно принимается за токсическое поражение цитостатиками, особенно при отсутствии характерных изменений на УЗИ. Кандидозные микроабсцессы в паренхиматозных органах выглядят при ультразвуковом исследовании и компьютерной томографии как гипоэхогенные очаги, поэтому многие клиницисты считают обнаружение этих характерных изменений диагностическим критерием, подтверждающим инвазивную грибковую инфекцию.
Кандидемия. Многие авторы утверждают, что Candida spp., высеянная из крови, редко является контаминантом и должна быть принята во внимание как патоген практически во всех случаях. Фунгемия обнаруживается примерно в 30% случаев диссеминированного кандидоза и имеет важное диагностическое значение, так как служит основным прижизненным доказательством инвазивного кандидоза. Повторная (стойкая) кандидемия может быть результатом инфицирования центрального венозного катетера или проявлением деструктивного поражения глубоких тканей.
С момента возникновения проблемы грибковых инфекций в 60-70-е гг. огромные усилия медиков всего мира были направлены на разработку методов диагностики этих опасных осложнений, так как ранняя диагностика остается основным критическим моментом, определяющим успех в ведении больного с инвазивной инфекцией. Однако до настоящего времени от 20 до 75% случаев инвазивных микозов диагностируется лишь на аутопсии.
Кроме классических микробиологических методов серьезным подспорьем в лабораторной диагностике сегодня является определение маркеров кандидоза - Д-арабинитола и маннозы - методом газовой хроматографии. Даже при трудной локализации очага, недоступного для биопсии и посева, обнаружение высокого уровня маркеров в крови или спинномозговой жидкости позволяет подтвердить диагноз кандидоза, кроме того, в динамике объективно оценить эффект противогрибковой терапии.
Профилактика и лечение. Широко распространено мнение о необходимости одновременно с антибиотиками принимать нистатин, что гарантирует от грибковых осложнений. Действительно, нистатин препятствует массивному размножению кандид на слизистых ЖКТ. Однако крайне важно учитывать, что этот препарат не всасывается при приеме внутрь, то есть не способен воздействовать на клетки грибов, находящиеся вне просвета кишечника. Поистине революционным событием в этиотропной терапии кандидоза следует считать появление препарата флуконазола, наиболее известного под торговым названием дифлюкан. Хорошая биодоступность препарата обеспечивает высокую эффективность практически при любой локализации процесса - от распространенных кожных поражений до менингита. Почти всегда рекомендуется прием препарата внутрь за исключением редких случаев крайне тяжелого состояния больного, когда препарат вводят внутривенно. Благодаря отсутствию токсичности и низкой частоте побочных реакций флуконазол применяется даже у недоношенных детей. Очень важно правильно соблюдать режимы дозирования (см. табл.).
| Пациенты | Показания и дозы флуконазола | ||
| Новорожденные и дети раннего возраста | кандидоз кожи и слизистых 5-6 мг/кг 1 раз в день 5 дней | грибковый сепсис 10 мг/кг 1 раз в день 10-14 дней | грибковый менингит 15 мг/кг 1 раз в день 10-14 дней |
| Взрослые | кандидоз кожи и слизистых 50 мг 1 раз в день 5 дней | вагинальный кандидоз 150 мг однократно (!) | кандидемия, диссеминированный кандидоз 200-400 мг 1 раз в день 2-4 недели |
Когда терапия флуконазолом не дает эффекта, следует думать о кандидозе, вызванном природно резистентными видами кандид, например C.krusei. В этих случаях рекомендуется противогрибковая терапия эффективным, но потенциально токсичным препаратом амфотерицин В (относительно менее высокой токсичностью характеризуется препарат с торговым названием фунгизон). Лечение проводится только в стационаре под тщательным лабораторным контролем. Дозы амфотерицина В из-за опасности нефротоксических реакций не должны превышать 0,5-1 мг/кг в сутки внутривенно один раз в день или через день. При наличии микроабсцессов в печени, головном мозге и других органах наиболее эффективными являются липосомальные формы амфотерицина В (амфоцил и др.), которые, однако, малодоступны из-за высокой стоимости.
Таким образом, в настоящее время актуальность своевременной диагностики и раннего лечения кандидоза чрезвычайно высока.
КТ, МРТ, УЗИ при туберкулезе печени и грибковой инфекции печени
а) Определение:
• Оппортунистические инфекции печени (возможно, также и других органов), возбудителями которых являются микобактерии или грибы
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Множественные мелкие микроабсцессы в печени, округлой формы, с четкими контурами
3. МРТ при туберкулезе печени и грибковой инфекции печени:
• Т2 ВИ:
о Гиперинтенсивный сигнал
• Т1 ВИ с контрастным усилением:
о Гипоинтенсивный сигнал от очагов, возможно, с контрастным усилением по периферии
• FLASH (быстрое МР-исследование с малым углом отклонения):
о Позволяет обнаружить больше очагов
5. Рекомендации по визуализации:
• Лучший метод диагностики:
о УЗИ, КТ, МРТ
• Выбор протокола:
о МРТ: FLASH
о Контрастное усиление (препараты на основе гадолиния) для обнаружения мельчайших очагов
в) Дифференциальная диагностика туберкулеза печени и грибковой инфекции печени:
2. Поражение печени при лимфоме/лейкозе:
• Очаги не столь четко отграничены, не столь многочисленны, большего размера
• Очаги также определяются в селезенке
3. Билиарные гамартомы:
• Доброкачественная врожденная мальформация желчных протоков
• Контуры гамартом четкие, размер • Протекают бессимптомно, являются случайной находкой
г) Патология. Общая характеристика:
• Этиология:
о Распространение инфекции из кишечника по системе воротной вены
о Наиболее типичный возбудитель - Candida albicans
• Ассоциированные патологические изменения:
о СПИД, лейкоз, лимфома, состояние после трансплантации органов
о Злокачественные опухоли
о Нейтропения, обусловленная другими причинами:
- Химиотерапия
- Лучевая терапия
д) Клинические особенности:
1. Проявления туберкулеза печени и грибковой инфекции печени:
• Клинический профиль:
о Пациенты с дефицитом иммунитета, с разрешающейся нейтропенией
о Высокая заболеваемость наблюдается у реципиентов трансплантатов, колонизированных грибами
2. Течение и прогноз:
• При своевременной диагностике и лечении-благоприятный
3. Лечение туберкулеза печени и грибковой инфекции печени:
• Противогрибковые препараты (амфотерицин Б и флуконазол) в больших дозах при генерализованной форме заболевания:
о Во время антифунгальной терапии очаги на УЗИ и КТ у пациентов с нейтропенией могут исчезать
о Данные лучевых методов диагностики не являются основанием для прерывания лечения
е) Диагностическая памятка. Следует учесть:
• Другие патологические процессы, приводящие к появлению множественных гиподенсных очагов в печени
• Данные гистологического/микробиологического исследования биоптата
ж) Список использованной литературы:
1. Simon J et al: Echinocandins in invasive candidiasis. Mycoses. 56(6):601-9, 2013
2. Yellapu RK et al: Education and Imaging. Hepatobiliary and pancreatic: Candida liver abscesses associated with endocarditis. J Gastroenterol Hepatol. 25(5):1017, 2010
3. Kim HJ etal: Isolated perihepatic tuberculosis: imaging findings. Clin Radiol. 64(2):184-9, 2009
4. Amarapurkar DN et al: Hepatobiliary tuberculosis in western India. Indian J Pathol Microbiol. 51 (2): 175-81, 2008
5. Benedetti NJ etal: Imaging of hepatic infections. Ultrasound Q. 24(4):267-78, 2008
Лекарства для лечения грибковых инфекций
Грибковые инфекции, как правило, ограничены поражением кожи или слизистых оболочек — местный, или поверхностный, микоз. Однако при иммунодефицитных состояниях могут поражаться и внутренние органы — системный, или глубокий, микоз.
Наиболее частой причиной микозов являются дерматофиты, которые поражают кожу, волосы и ногти после наружного инфицирования, и Candida albicans, грибковый организм, который обычно обнаруживается на поверхности тела и вызывает инфекции слизистых оболочек, реже — кожи или внутренних органов при снижении естественных защитных свойств организма (иммуносупрессия или нарушение микрофлоры антибиотиками широкого спектра).
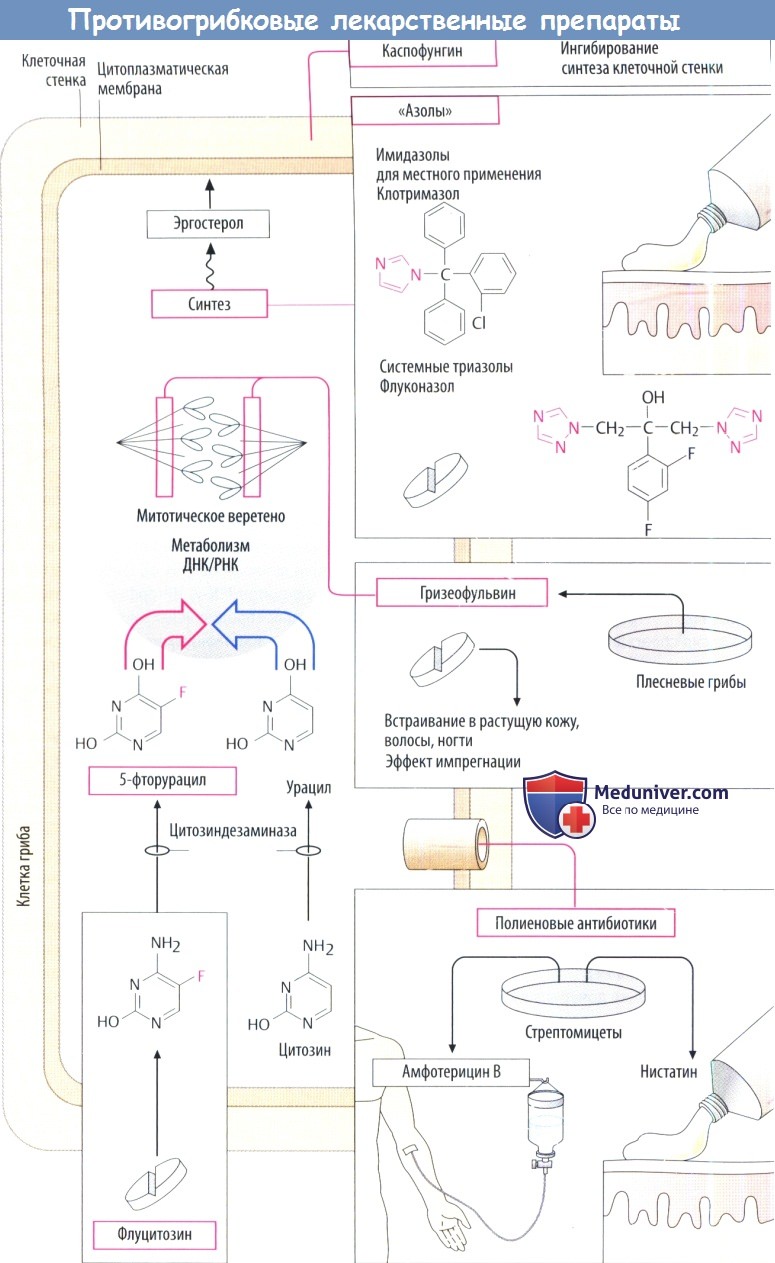
а) Производные имидазола ингибируют синтез эргостерола, интегрального компонента цитоплазматических мембран грибковых клеток. Грибы приостанавливают свой рост (фунгистатический эффект) или погибают (фунгицидный эффект). Спектр противогрибковой активности очень широкий.
Благодаря гидроксильной группе флуконазол достаточно хорошо растворим в воде, что позволяет производить такие лекарственные формы, как, например, инъекционные. Вориконазол по своей структуре очень похож на флуконазол, но имеет более широкий спектр, который включает грибы, резистентные к флуконазолу. Это относится и к посаконазолу, который структурно сходен с итраконазолом.
Активные при местном использовании аллиламин (нафтидин) и морфолин (оморолфин) тоже ингибируют синтез эргостерола, но на другом этапе. Оба препарата предназначены для местного применения.
б) Полиеновые антибиотики амфотерицин В и нистатин имеют бактериальное происхождение. Они встраиваются в грибковые клеточные мембраны (вероятно, рядом с молекулами эргостерола) и вызывают образование гидрофильных каналов. Амфотерицин В активен против большинства организмов, вызывающих системный микоз.
Поскольку полиеновые противогрибковые средства не всасываются, их вводят путем инфузии, которая, к сожалению, плохо переносится (озноб, лихорадка, нарушения со стороны ЦИС, нарушение почечной функции, флебит в месте инъекции). При местном нанесении на кожу или слизистые оболочки амфотерицин В полезен при лечении кандидомикоза. Учитывая низкую скорость всасывания, пероральное введение при кишечном кандидозе может рассматриваться как местное лечение. Нистатин тоже используется против кандидоза, только местно (в полости рта, ЖКТ).
в) Флуцитозин превращается грибами рода Candida в 5-фторурацил за счет активации специфической грибковой цитозиндезаминазы. Будучи антиметаболитом, данное вещество нарушает синтез ДНК и РНК, что приводит к фунгицидному эффекту. Флуцитозин быстро всасывается при введении внутрь. Его часто сочетают с амфотерицином В, чтобы снизить дозу последнего.
д) Каспофунгин — циклический полипептид типа эхинокандина,который ингибирует синтез грибковой стенки за счет блокады 1,3β-гликансинтазы. Каспофунгин назначается при системных микозах, вызванных грибами рода Candida и Aspergillus, в случаях, когда невозможно использовать амфотерицин В или итраконазол. Он вводится инфузион-но и вызывает различные нежелательные реакции. Аналогичным образом действует анидулафунгин.
е) Гризеофульвин (получаемый из плесневых грибов) — токсин, блокирующий митотическое веретено. После приема внутрь он накапливается во вновь образующемся кератине, где ингибирует рост дерма-тофитов. Его нужно принимать в течение нескольких недель. В настоящее время он считается устаревшим препаратом.
Видео фармакологические, побочные эффекты противогрибковых препаратов (антимикотиков)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Весна - время обострения самых многих заболеваний, в том числе, грибковых инфекций. Это обусловлено тем, что в конце зимы многие стараются избавиться от лишнего веса, вернуть себе хорошую физическую форму и начинают посещать бассейны, тренажерные залы и салоны красоты, которые могут стать источником онихомикоза, или грибка стопы. И во многих случаях для полноценного лечения микоза требуется не только длительное применение противогрибковых препаратов, но и назначение гепатопротекторов.
Эффективность vs безопасность
Отличительной особенностью микотических инфекций, и особенно онихомикозов, является затяжное течение и длительный курс лечения с применением системных противогрибковых препаратов. Эффективных средств с широким спектром антимикотической активности сегодня выпускается довольно много, но подобрать препарат, который можно будет без последствий для здоровья пациента использовать в течение 3-6 месяцев, подчас бывает сложно. К сожалению, как показывает практика, противогрибковые препараты могут оказывать гепатотоксическое действие, причем возникать этот побочный эффект может как при длительном приеме, так и в течение первых недель лечения 1 .
Потенциальной гепатотоксичностью обладают многие группы противогрибковых средств, включая такие востребованные сегодня антимикотики, как препараты итраконазола, вориконазола, тербинафина и т. д. 2 Причиной этого является особенность фармакокинетики антимикотических средств: большинство из них метаболизируются в клетках печени с помощью особой группы печеночных ферментов (системы цитохрома Р450). При этом взаимодействие противогрибковых препаратов с данными ферментами приводит к подавлению активности системы цитохрома Р450, и чем дольше они применяются, тем ниже активность цитохрома, выше концентрация противогрибковых препаратов и сильнее их повреждающее действие на печень 3 .
Печеночные ферменты системы цитохрома Р450 играют важную роль в окислительных реакциях, метаболизме стероидных гормонов, желчных кислот, ненасыщенных жирных кислот и холестерина, синтезе простагландинов. От активности этих ферментов напрямую зависит способность печени обезвреживать ксенобиотики (чужеродные для организма вещества, поступающие извне) 4 .
Применение Дибикора в качестве гепатопротектора позволяет комплексно воздействовать на печень. Дибикор ® улучшает кровоснабжение печени, повышает работоспособность гепатоцитов, защищает их от негативного действия свободных радикалов, способствует восстановлению баланса фосфолипидов, входящих в состав клеточной мембраны 5 . Одновременно с этим Дибикор ® улучшает выведение желчи, а главное, препарат восстанавливает активность ферментов системы цитохрома Р450, благодаря чему удается избежать тяжелого лекарственного поражения печени 3 .
Применение Дибикора в качестве гепатопротектора при назначении лекарственных препаратов, негативно влияющих на печень, позволяет предупредить их гепатотоксический эффект, сохранить функциональную активность гепатоцитов и естественных механизмов детоксикации, а также способствует активному выведению лекарственных метаболитов 3,6 .
В качестве гепатопротектора Дибикор ® принимают по 500 мг 2 раза в сутки в течение всего курса приема противогрибковых препаратов. Дибикор ® практически не имеет противопоказаний (в списке противопоказаний только индивидуальная чувствительность и возраст до 18 лет) и побочных эффектов (возможна аллергическая реакция на компоненты препарата). Высокий профиль безопасности в сочетании с безрецептурным статусом позволяют фармацевту обоснованно рекомендовать Дибикор ® посетителям, приобретающим противогрибковые препараты.
1 Курдина М.И., Иваников И.О., Сюткин В.Е. Системные антимикотики при дерматомикозах и патологии гепатобилиарной системы. Пособие для врачей. М., 2004, 156 с.
2 Минушкин О.Н. Некоторые гепатопротекторы в лечение заболеваний печени // Лечащий врач, 2002; № 6: 55-58.
3 Ших Е.В., Сизова О.С., Махова А.А. Возможности применения гепатопротекторов в комбинированной терапии онихомикозов // РМЖ 2014; № 6: 1-6.
4 Danielson P.B. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans. Curr. Drug Metab., 2002; т. 3; № 6: 561-597.
5 Miyata K., Ikawa O., Izumi H. et al. Efficacy of the combined use of taurine for hyperbilirubinemia caused by UFT therapy after surgery for colonic cancer. Gan To Kagaku Ryoho, 2006; 33 (5): 671-73.
6 Горецкая М.В., Шейбак В.М. Гепатопротекторные свойства таурина при интоксикации парацетамолом. Известия Национальной академии наук Белоруссии, 2013; № 3: 96-101.
Читайте также:

