Пептид т при вич
Обновлено: 24.04.2024
Есть немало лекарств, которые применяются для борьбы с ВИЧ. Но такого, чтобы позволяло излечиться от вируса иммунодефицита человека, пока, увы, не изобретено.
Чем сегодня лечат ВИЧ? Какие результаты дает лечение? Об этом мы побеседовали с Наталией Сизовой, кандидатом медицинских наук, заведующей поликлиническим инфекционным отделением городского Центра по профилактике и борьбе со СПИДом и инфекционными заболеваниями.
– Наталия Владимировна, многие годы ученые ищут препарат, который полностью излечит от ВИЧ, от СПИДа. Почему до сих пор не удалось придумать такое лекарство?
– Это связано с тем, что вирус встраивается в геном человеческой клетки, и выбить эту информацию о нем, записанную в геноме клетки, чрезвычайно сложно. Поэтому до сих пор такого радикального средства, которое бы полностью убрало вирус, к сожалению, нет.
– Чудо-вакцины нет, но, тем не менее, ВИЧ-положительные люди могут вести нормальный образ жизни. Благодаря каким лекарствам, какому лечению?
У нас в Санкт-Петербурге есть пациенты, диагноз которым поставили в 1987 году. Столько лет эти люди прожили с ВИЧ-инфекцией, и надо учесть, что в самом начале не было антриретровирусных препаратов. А когда они появились, то были более тяжелые, более токсичные, чем сегодня… Тем не менее, люди живут. На моей памяти много пациентов, которые вырастили своих детей, стали бабушками, дедушками.
– Чтобы так долго жить, какие правила надо соблюдать?
– Есть люди, которым поставили диагноз, к примеру, в 2000 году, а они после этого не наблюдались у врачей. И сегодня они обращаются к нам уже в очень тяжелом состоянии, некоторым мы даже не успеваем помочь. Чудес не бывает. Самое главное для человека, которому поставлен диагноз ВИЧ — обязательно наблюдаться и своевременно лечиться, принимать антиретровирусную терапию. Сейчас большинство медиков склоняются к тому, что терапию надо начинать как можно раньше. Потому что мы знаем и на собственном опыте, и по зарубежной научной информации, что чем дольше человек ходит с иммунодефицитом (хотя он себя, может, неплохо чувствует), тем быстрее у него развивается ВИЧ-инфекция, и не исключено, что у него впоследствии появятся другие болячки, например, онкология…
– Очень важно, чтобы человек обследовался на ВИЧ, особенно если у него есть какие-то к тому показания: клинические или эпидемиологические. Например, если у него были не защищенные половые контакты. Иллюзия, что вирус поражает группу риска.
К нам всё чаще становятся на учет социально адаптированные люди, вполне благополучные. Потому что сейчас начинает превалировать половой путь передачи ВИЧ-инфекции.
Когда мы принимаем решение о начале антиретровирусной терапии, мы смотрим прежде всего на самочувствие пациента. Если человек начинает себя плохо чувствовать, у него есть какие-то клинические проявления (даже если анализы хорошие), то мы ему предлагаем начать терапию. Другой вариант: пациент чувствует себя хорошо. Главными маркерами прогрессирования заболевания являются два анализа: анализ на иммунитет (начинаем предлагать терапию, когда CD-лимфоциты в клетках снижаются ниже 350; раньше планка была 200) и такой показатель, как вирусная нагрузка (это количество вирусов в миллилитре крови). Чем выше вирусная нагрузка, тем быстрее заболевание прогрессирует. И чем выше вирусная нагрузка, тем более человек заразен. Мы предлагаем пациенту начать терапию, если вирусная нагрузка превышает 100 тысяч. Это помогает остановить быстрое прогрессирование заболевания и снизить заразность человека. Как бы там ни было, если у человека есть постоянный половой партнер и высокая вирусная нагрузка, ему обязательно нужно начинать терапию. Это не только сохранит здоровье ВИЧ-положительному, но и убережет от ВИЧ его партнера.
– Говорят, что у антиретровирусных препаратов немало побочных эффектов. Насколько они опасны и в каких случаях?
– Конечно, антиретровирусные препараты — не карамельки. Побочные эффекты можно разделить на ранние и поздние. Ранние возникают в течение первых шести недель приема препаратов. Эти побочные эффекты, как правило, тоже делятся на два вида: те, которые надо переждать, и они пройдут (например, тошнота — первый месяц тошнит, потом проходит; бывает аллергическая сыпь, которая тоже со временем проходит), и тяжелые — когда препарат не подходит человеку. Причем, зачастую побочные эффекты генетически запрограммированы. Например, у некоторых пациентов есть реакция гиперчувствительности на абакавир… Это ранние побочные эффекты. Здесь правило такое: ни в коем случае в начале терапии не отрываться от доктора, никуда не уезжать, чтобы доктор держал, что называется, руку на пульсе. Он сразу определит, не угрожают ли эти побочные эффекты жизни. Тогда можно будет успокоить больного, переждать эти эффекты.
Если же побочные эффекты жизнеугрожающие (например, у пациента резко снижается гемоглобин в крови), то тогда надо менять препараты.
Что касается поздних побочных действий… Здесь тоже самое главное — хорошо наблюдаться. Человек должен вовремя сдавать анализы, инструментально обследоваться. Доктор увидит и предупредит эти побочные действия, поменяет схему приема препаратов.
В любом случае, когда мне люди говорят, что лекарства вредны… Понимаете, мы из двух зол выбираем меньшее. Ничего страшнее вируса нет.
– Наталия Владимировна, а если не принимать терапию, пустить болезнь, как говорится, на самотек…
К сожалению, наши люди… Они полечились немного, у них стало все хорошо (то есть им кажется, что все хорошо) — и они бросают терапию. А в результате все моментально скатывается на прежние позиции. Поэтому мы постоянно объясняет нашим пациентам: надо лечиться, от этого никуда не денешься. И только тогда вы будете жить долго, активно, практически так, как живут здоровые люди.
Оригинал статьи на сайте "Курьер-Медиа"
Вы имеете возможность дать независимую оценку качества оказания медицинских услуг в нашем учреждении, заполнив АНКЕТУ на сайте Министерства здравоохранения Российской Федерации.
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препара
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препарата. Препарат относится к ингибиторам обратной траскриптазы.
Препаратами второго поколения являются дидеоксииназин (ДДИ), дидеоксицитидин (ДДС). В настоящее время спектр препаратов этой группы значительно расширился (ставудин-ДДТ, хивид, фосфозид и другие).
Эта группа лекарственных средств (ЛС) имеет ряд существенных недостатков. Указанные ЛС не подавляют полностью репликацию вируса, который может быть выделен у большинства больных во время терапии.
Как показали исследования, к ЗДВ достаточно быстро развивается устойчивость, в особенности на поздних стадиях болезни с усиленной репликацией ВИЧ, когда, по-видимому, возникает резистентность и к другим аналогам нуклеозидов.
Обычный фактор, существенно ограничивающий применение ЛС этой группы, — их токсичность. Для ЗДВ характерно главным образом токсическое действие на костный мозг, тогда как ДДИ и ДДС обладают нейротоксическим действием. Кроме того, ДДИ может вызывать тяжелый острый геморрагический панкреатит.
Установлена тесная связь между клинической неэффективностью ЗДВ и резистентностью к нему in vitro.
Вторая группа препаратов, открытая сравнительно недавно и уже широко используемая, — это ингибиторы протеаз: индиновир (криксиван), инвираза (саквиновир), вирасепт (нельфиновир) и другие.
В настоящее время речь не идет уже о монотерапии антиретровирусными средствами, а только о ди-, три- и даже тетратерапии. Такие методики позволяют снижать концентрацию вируса до величин, не определяемых с помощью современных тест-систем (< 200 копий/1 мл).
Предпочтительность комбинированной терапии обосновывается следующими положениями (В. В. Покровский).
- Использование многих этиотропных агентов более эффективно подавляет жизнедеятельность вируса, воздействуя на различные болевые точки или синергически воздействуя на одну из них.
- Это позволяет снизить дозы препаратов, что уменьшает частоту и выраженность побочных эффектов.
- Различные лекарства имеют различную способность проникать в ткани (головной мозг и т. д.).
- Комбинация лекарств затрудняет формирование устойчивости, или она появляется позднее.
Все описанные выше подходы к терапии ВИЧ-инфекции предполагали непосредственное воздействие на репликацию вируса. Другая возможная методика лечения ВИЧ-инфекции состоит в усилении защитных сил макроорганизма. Некоторые варианты такого подхода в большинстве случаев неспецифические, изредка специфические и могут воздействовать на защитные свойства клетки-хозяина.
Интерфероны, как природные, так и рекомбинантные, имеют ряд недостатков: антигенность, необходимость многократного введения для поддержания достаточной концентрации в организме, большое количество побочных эффектов и т. д.
Этих недостатков лишены многие индукторы эндогенного интерферона, некоторые из них способны включаться в синтез ИФН в некоторых популяциях клеток, что в ряде случаев имеет определенное преимущество перед поликлональной стимуляцией иммуноцитов интерфероном.
Специфическая активность циклоферона при ВИЧ-инфекции изучена в 1997 году в Институте гриппа РАМН
- Выявлена выраженная ингибирующая активность циклоферона на репродукцию ВИЧ в культуре клеток моноцитов.
- По показателям ингибирующей активности циклоферон значительно превосходит азидотимидин.
- Представленные экспериментальные данные обосновывают клиническое использование циклоферона для лечения больных ВИЧ-инфекцией.
Пятилетний опыт применения циклоферона у ВИЧ-инфицированных позволяет оценить результаты этой работы.
В период 1992 – 1997 годы в Санкт-петербургском городском центре по профилактике и борьбе со СПИД циклоферон получили 40 пациентов с разными стадиями ВИЧ-инфекции. Следует отметить, что 11 больных прошли два курса терапии циклофероном, в связи с чем общее число лиц, получивших один курс лечения циклофероном, составило 29 человек. В основном это были молодые люди в возрасте до 40 лет (20 человек), в том числе трое детей до 14 лет.
Все больные отмечали хорошую переносимость циклоферона, отсутствие пирогенных реакций после его введения.
Пациенты также констатировали улучшение общего состояния, сна и аппетита, повышение жизненного тонуса, работоспособности. 30% из числа получавших препарат и перенесших в осенне-зимний период грипп или ОРВИ отметили, что заболевание протекало непривычно легко и выздоровление наступило быстрее обычного.
Из клинической практики
После курса циклоферона отмечалось существенное снижение вирусной нагрузки (в 3,6 раза). Число CD4+ возросло на 62%. Монотерапия циклофероном оказала положительное стабильное влияние на изученные показатели у пациентов.
Определенный интерес представляют результаты многолетнего наблюдения больных ВИЧ-инфекцией, которые получали длительно циклоферон в своеобразном профилактическом режиме с целью стабилизации процесса и профилактики прогрессирования заболеваний.
В 1998 году на базе Российского научно-методического Центра по профилактике и борьбе со СПИД (руководитель член-корр. АМН В. В. Покровский) была изучена динамика суррогатных маркеров ВИЧ-инфекций (уровень CD4+) и вирусная нагрузка у больных ВИЧ-инфекцией при лечении циклофероном.
Оценка достоверности полученных результатов проводилась с помощью непараметрических критериев (критерий знаков, максимум-критерий, критерий Вилкоксона для сопряженных совокупностей).
В испытуемую группу вошли 10 взрослых больных ВИЧ-инфекцией в стадии первичных проявлений по Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989 г.). Результаты исследования уровня CD4-лимфоцитов представлены в таблице и на рисунке, из которых видно, что после первых четырех недель исследования наметилась тенденция к повышению среднего уровня CD4-лимфоцитов, которое к 12-й неделе стало статистически достоверным. Это повышение сохранилось до конца исследования, несмотря на
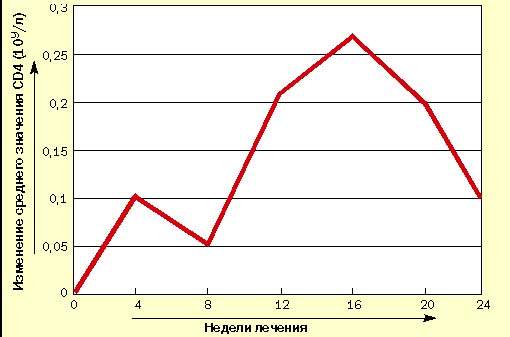 |
| Рисунок 1. Изменение уровня CD4-лимфоцитов у больных ВИЧ-инфекцией при лечении циклофероном (в сравнении с исходным уровнем) |
 |
| Рисунок 2. Средние значения изменения концентрации РНК ВИЧ (log10/мл) |
Таким образом, применение циклоферона в терапии ВИЧ-инфекций сопровождается стабилизацией клинических проявлений заболевания, улучшением состояния, а также гематологических и иммунологических показателей больных.
Циклоферон как монопрепарат оказывает иммуномодулирующее и противовирусное действие при лечении ВИЧ-инфицированных (стадии А1 3Б) в тех случаях, когда нет значительного снижения числа CD4+ клеток (<200). Хорошо зарекомендовало себя назначение циклоферона по следующей схеме.
- По 4 мл препарата в 1, 2, 4, 6, 8, 10, 13, 16, 19 и 22-й дни лечения (у детей по 2 мл). Первые две инъекции могут вводиться внутривенно, остальные внутримышечно. Повторные курсы циклоферона рекомендуется проводить через 6 месяцев под иммунологическим контролем.
- Циклоферон хорошо сочетается со всеми основными лекарственными средствами, его рекомендуется использовать в случае, когда имеются признаки активной репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с обострениями различных оппортунистических заболеваний.
Исчезновение у некоторых больных иммунологических и вирусологических показаний для проведения противоретровирусной терапии может иметь важное значение для разработки новых подходов к проведению лечения больных ВИЧ-инфекцией, для снижения стоимости терапии и отсрочки развития резистентности к ней или преодолению последней.
Циклоферон может оказаться перспективным профилактическим средством при сомнительных контактах и контактах с заведомо ВИЧ-инфицированными партнерами.
Е. Л. Голохваcтова, кандидат медицинских наук Городской центр по профилактике и борьбе со СПИДом, Москва Синдром приобретенного иммунодефицита (СПИД) важнейшая мировая медицинская, социальная и политическая проблема ХХ века. В 1981 г.
Городской центр по профилактике и борьбе со СПИДом, Москва
В настоящее время известны два типа вируса — ВИЧ-1 и ВИЧ-2, различающиеся по своим структурным и антигенным характеристикам. Имеются достоверные различия в течении заболевания, вызываемого этими вирусами. Течение инфекции, вызываемой ВИЧ-2, считается более продолжительным. Среди ВИЧ-1 и ВИЧ-2 выделяют большое число генетически различных групп. Как и все ретровирусы, вирус ВИЧ характеризуется высокой изменчивостью. Считается, что в организме человека по мере прогрессирования инфекции, от бессимптомной до манифестной, происходит эволюция вируса от менее вирулентного к более вирулентному варианту. ВИЧ нестоек во внешней среде, чувствителен к внешним воздействиям, практически полностью инактивируется при нагревании выше 56°С в течение 30 мин, погибает при кипячении через 1-3 мин, а также под воздействием дезинфицирующих средств (3%-ный раствор перекиси водорода, 5%-ный раствор лизола, 70%-ный — этилового спирта). Возможно его сохранение во внешней среде в жидкостях, содержащих вирус в высоких концентрациях, таких как кровь и сперма. Губительны для ВИЧ солнечное и искусственное УФ-излучение, а также все виды ионизирующего излучения. В крови, предназначенной для переливания, вирус живет годы, в замороженной сперме несколько месяцев. Появились данные о том, что ВИЧ теряет активность под воздействием защитных ферментов, содержащихся в слюне и поте. Передачи ВИЧ при укусах кровососущих насекомых не происходит.
ВИЧ-инфекция распространена географически повсеместно. Инфекция ВИЧ-1 — антропоноз. Животные в естественных условиях не заражаются ВИЧ-1. Источником ВИЧ-инфекции является ВИЧ-инфицированный человек на всех стадиях заболевания, как в период бессимптомного вирусоносительства, так и во время развернутых клинических проявлений болезни. Восприимчивость к ВИЧ у людей всеобщая. Причиной невосприимчивости к заражению ВИЧ могут быть специфические иммуноглобулины класса А, обнаруживаемые на слизистых оболочках половых органов.
Пути передачи ВИЧ-инфекции: половой, парентеральный, вертикальный. Половой путь передачи реализуется при гетеросексуальных и гомосексуальных половых контактах. Вероятность заражения повышается при воспалительных заболеваниях половых органов. Парентеральный путь инфицирования встречается в основном среди инъекционных наркоманов. Факторами передачи ВИЧ при этом могут быть общие шприцы и иглы, наркотик, в который добавляется кровь. Инфицирование возможно при переливании зараженной крови, ее препаратов, использовании загрязненных кровью медицинских инструментов, не прошедших соответствующую обработку. Факторами передачи вируса могут быть органы и ткани доноров, используемых для трансплантации. Если женщина заражена ВИЧ, то вероятность инфицирования плода составляет около 50%. Ребенок может инфицироваться до, во время и после родов. Контактно-бытовой и воздушно-капельный пути передачи при ВИЧ-инфекции не встречаются.
ВИЧ-инфекция характеризуется многолетним течением, клинически связанным с прогрессирующим снижением иммунитета и приводящим к развитию тяжелых форм оппортунистических заболеваний. До настоящего времени считалось, что в большинстве случаев ВИЧ-инфекция имеет единственный исход — гибель зараженного ВИЧ организма. Однако теория инфекционного процесса допускает существование как маловирулентных или дефектных штаммов ВИЧ, так и устойчивых к инфекции больных. Среднюю продолжительность жизни инфицированного человека оценивают сейчас в 12 лет, однако продолжительность болезни может быть связана с путями заражения, принадлежностью к различным группам населения, возрастом, расовыми особенностями и доступностью медицинской помощи.
Клиника. После инкубационного периода, продолжительностью от 2 недель до 6 и более месяцев, в 50-70% случаев наступает длящийся от нескольких дней до 2 месяцев период первичных клинических проявлений в виде лихорадочного состояния, которое может сопровождаться увеличением лимфоузлов, стоматитом, пятнистой сыпью, фарингитом, диареей, увеличением селезенки, иногда явлениями энцефалита. Во многих случаях может наблюдаться стертое или малосимптомное начало заболевания, однако у большинства зараженных ВИЧ к 6 месяцам от момента инфицирования появляются антитела к ВИЧ.
Ранние клинические проявления ВИЧ-инфекции, за исключением увеличения лимфоузлов, проходят, и затем в течение нескольких лет у зараженных лиц другие клинические признаки ВИЧ-инфекции не обнаруживаются. В этот период сохраняется активность ВИЧ и происходит медленное снижение количества CD4-клеток. Когда защитные силы организма достаточно ослабевают, у пациента начинают возникать разнообразные оппортунистические заболевания, выраженность которых в дальнейшем нарастает по мере снижения количества CD4-клеток. При значительном снижении количества этих клеток развивающиеся оппортунистические поражения приобретают угрожающий для жизни характер. При отсутствии адекватной терапии больной погибает.
Кроме соматических поражений, у больных ВИЧ-инфекцией развиваются нейропсихические изменения, связанные с известием о заражении вирусом, возникает целая группа стрессов, из-за которых нарушаются или прекращаются социальные и межличностные связи заразившихся, снижается уровень их самооценки, угнетается эмоциональный фон, практически меняется жизнь пациентов. Ни одно инфекционное заболевание до настоящего времени не сопровождалось такой выраженной стигматизацией, как ВИЧ-инфекция. Неблагоприятный прогноз заболевания, особенности передачи возбудителя, молодой возраст заразившихся — все эти факторы усугубляют социально-психологическую ситуацию пациентов. При заражении ВИЧ-2 заболевание прогрессирует несколько медленнее. Своевременно и правильно начатое лечение может на несколько лет увеличить продолжительность жизни инфицированных лиц, а также улучшить качество их жизни.
Течение ВИЧ-инфекции многие исследователи пытались отобразить с помощью клинических классификаций. В нашей стране принята следующая классификация ВИЧ-инфекции (В. И. Покровский, 1989).
I. Стадия инкубации.
II. Стадия первичных проявлений:
А — острая лихорадочная фаза; Б — бессимптомная фаза; В — персистирующая генерализованная лимфоаденопатия.
III. Стадия вторичных заболеваний:
А — потеря массы тела менее 10%, поверхностные грибковые, бактериальные, вирусные поражения кожи и слизистых оболочек, опоясывающий лишай, повторные фарингиты, синуситы;
Б — прогрессирующая потеря массы тела более 10%, необъяснимая диарея или лихорадка более 1 месяца, волосатая лейкоплакия, туберкулез легких, повторные или стойкие бактериальные, грибковые, вирусные, протозойные поражения внутренних органов (без диссеминации) или глубокие поражения кожи и слизистых оболочек, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши;
В — генерализованные бактериальные, вирусные, грибковые, протозойные и паразитарные заболевания, пневмоцистная пневмония, кандидоз пищевода, атипичный микобактериоз, внелегочный туберкулез, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии.
IV. Терминальная стадия.
Выделяют также три иммунологические категории в зависимости от уровня СД4-лимфоцитов:
1) более 0,5 х 109/л СД4-клеток в 1 мм 3 крови; 2) от 0,2 до 0,5 х 109/л в 1 мм 3 ; 3) менее 0,2 х 109/л в 1 мм 3 .
Таким образом, каждый больной может быть отнесен к той или иной категории по клиническим и иммунологическим критериям.
В данной классификации учитываются все проявления болезни от момента заражения до гибели больного, включая и те, которые, возможно, еще неизвестны.
- Нуклеозидные ингибиторы обратной транскриптазы вируса (зидовудин, диданозин, зальцитабин, ставудин, ламивудин, абаковир).
- Ненуклеозидные ингибиторы обратной транскриптазы (ифавиренц, делавирдин, невирапин).
- Ингибиторы протеазы вируса (индинавир, саквинавир, ритонавир, нельфинавир).
Обратная транскриптаза и протеаза — это ферменты вируса, необходимые для его репликации. Соответственно подавление этих ферментов приводит к замедлению размножения ВИЧ. Наиболее эффективной считают комбинацию одного ингибитора протеазы (например, индинавира или ритонавира) и двух нуклеозидных ингибиторов обратной транскриптазы (зидовудина и диданозина, ставудина и диданозина, ставудина и ламивудина, диданозина и ламивудина, зидовудина и зальцитабина, зидовудина и ламивудина). Альтернативой ингибитору протеазы может быть новый ненуклеозидный ингибитор обратной транскриптазы — ифавиренц. Терапия двумя нуклеозидными ингибиторами обратной транскриптазы уступает по эффективности комбинации трех препаратов, а монотерапия любыми антиретровирусными средствами считается неэффективной (за исключением тех случаев, когда альтернативная терапия невозможна, или во время беременности с целью предупреждения перинатальной трансмиссии). Обсуждается возможность одновременного применения трех нуклеозидных ингибиторов обратной транскриптазы, например, абакавира, зидовудина и ламивудина. Однако, по мнению экспертов, в настоящее время все же предпочтительно использование препаратов разных классов. Все антиретровирусные средства следует назначать одновременно в максимальной дозе (исключение составляют ритонавир и невирапин, дозы которых могут быть увеличены). При клинических проявлениях ВИЧ-инфекции антиретровирусная терапия показана всем больным. Необходимо использовать наиболее мощную комбинацию препаратов, обеспечивающих максимальное подавление репликации вируса. Больным СПИД часто приходится назначать не только противовирусные средства, но и препараты для лечения оппортунистических инфекций. В таких случаях необходимо учитывать взаимодействие между ними, а также возможность возникновения сходных нежелательных эффектов. Например, рифампицин, который применяется при лечении активного туберкулеза, снижает уровень ингибиторов протеазы в крови. Последние, в свою очередь, нарушают метаболизм рифампицина. Мощная противовирусная терапия восстанавливает иммунную функцию больного. Усиление иммунологического и/или воспалительного ответа может привести к появлению новых симптомов у больных с субклиническими оппортунистическими инфекциями (например, ЦМВ). Целесообразно продолжить антиретровирусную терапию и провести адекватное лечение оппортунистической инфекции. Иногда по тем или иным причинам приходится прерывать антиретровирусную терапию. Достоверных сведений о том, на сколько дней, недель или месяцев можно без последствий отменить один препарат или всю комбинацию, нет. Если возникает необходимость в прерывании терапии на длительный срок, то теоретически лучше отменить все препараты, чем продолжать терапию одним или двумя антиретровирусными средствами. Такой подход позволяет свести к минимуму риск появления устойчивых штаммов вируса. Зачастую врачи сталкиваются с тем, что выбранная схема терапии не всегда дает достаточный вирусологический и иммунологический эффект, что вынуждает менять лечение. Наиболее важным критерием эффективности терапии является динамика вирусной нагрузки. Подтвержденное клинически значимое повышение концентрации РНК ВИЧ в плазме, которое нельзя объяснить интеркуррентной инфекцией или вакцинацией, указывает на неэффективность лечения (независимо от динамики числа CD4-клеток). При выборе новой схемы лечения необходимо учитывать причины ее изменения. Если терапия давала вирусологический эффект, но вызывала выраженные побочные реакции, то целесообразно отменить препарат, который был причиной нежелательных явлений, и назначить другое средство того же класса, но с иным профилем токсичности и переносимости. Если терапия привела к выраженному подавлению репликации вируса, но является неадекватной с современной точки зрения (например, два нуклеозидных ингибитора обратной транскриптазы или монотерапия), то возникает вопрос: продолжать проводимую терапию или добавить другие средства. Большинство экспертов полагают, что неадекватная терапия в конечном итоге окажется неэффективной, и считают вторую тактику целесообразной. При неэффективности первоначального лечения предпочтительно полностью заменить неадекватную схему. Особое беспокойство вызывает возможность перекрестной устойчивости к различным ингибиторам протеазы. Имеются свидетельства того, что штаммы вируса, которые приобрели резистентность к одному препарату группы, обладают пониженной чувствительностью или устойчивы к большинству или всем ингибиторам протеазы. В связи с этим многие эксперты считают целесообразным включать два ингибитора протеазы в новые схемы лечения. Антиретровирусная терапия у больных острой ВИЧ-инфекцией снижает вирусную нагрузку и благоприятно влияет на иммунную функцию, однако отдаленный клинический эффект подобной терапии изучен недостаточно. Многие эксперты считают целесообразным продолжать лечение неопределенно долгое время, т. к. после прекращения терапии виремия может появиться вновь или возрасти.
В настоящее время существует острая потребность в новых способах лечения, которые были бы эффективны для постоянно растущего числа ВИЧ-инфицированных пациентов, уже леченных вышеупомянутыми препаратами. Получены данные о новом классе противовирусных средств — это ингибитор фузии (препарат Т-20), который применялся в комбинации с традиционными препаратами. В отличие от других препаратов для лечения ВИЧ-инфекции, которые блокируют репликацию однажды попавшего в клетку человека вируса, Т-20 представляет собой пептид, препятствующий проникновению вируса в клетку.

Новость
Структура вириона ВИЧ. Вирус покрыт липидной мембраной, на поверхности которой экспонирован комплекс гликопротеинов gp120 и gp41. Весь генетический материал вируса содержится в двухцепочечной молекуле РНК внутри капсида.
Автор
Редакторы
На основании анализа пептидной библиотеки фильтратов человеческой крови были выделены короткие молекулы (20 аминокислотных остатков), способные связываться с вирусным белком gp41 и препятствовать слиянию вируса с клеткой. Найденные соединения открывают новые перспективы для разработки противовирусных препаратов.
Пептид, ингибирующий действие ВИЧ-1 (VIRUS-INHIBITORY PEPTIDE — VIRIP), выделили в немецком университете в Ульме под руководством Франка Кирхоффа (Frank Kirchhoff). Чтобы выявить потенциальные природные ингибиторы ВИЧ, его группа проанализировала огромную библиотеку веществ, выделенных из 10 тыс. литров фильтрованной человеческой крови. Результаты исследования были опубликованы в последнем номере журнала Cell [1].
Слияния вирусной и клеточных мембран является ключевым механизмом, обеспечивающим последующее попадание генетического материала вируса в ядро клетки. VIRIP предотвращает проникновение в клетку различных штаммов ВИЧ-1, в том числе и ряда устойчивых к современным антиретровирусным препаратам. Выделенный пептид соответствует C-концевому фрагменту белка α1-антитрипсина — ингибитора сериновых протеиназ. Его действие, по-видимому, основано на способности связываться с пептидом слияния белка gp41, экспонированного на поверхности вириона, тем самым, снижая эффективность его встраивания в мембрану будущей клетки-хоязина. Было показано, что введение всего 3 аминокислотных замен в последовательность VIRIP, повышает его противовирусную активность на два порядка. Эти производные исходного пептида могут послужить основой для разработки лекарств нового типа против ВИЧ. Предварительные исследования модифицированных молекул на животных моделях (крысах, собаках), по словам Кирхоффа, дали весьма обнадеживающие результаты, так что уже в конце года планируется начало клинических испытаний [1], [2].

Обзор
Т-клеточный стартап TScan Therapeutics начал коллаборацию с компанией Qiagen для разработки теста на Т-клеточный иммунитет к COVID-19
Автор
Редакторы

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Вакцинация от коронавирусной инфекции SARS-CoV-2 — одна из самых горячих тем на границе 2020 и 2021 гг. Не утихают споры о безопасности вакцин, разработанных в сжатые сроки, о принципах производства и об основных принципах иммуногенности. Много спорят и о том, стоит ли добровольно прививаться тем, кто уже успел переболеть COVID-19, или, по крайней мере, подозревает об этом. Достаточно ли привиться один раз, а если вирус будет мутировать, как действовать дальше? Достаточно ли переболеть один раз или стоит бояться заболеть одной и той же инфекцией раз в сезон?
Увидеть адаптивный иммунитет
Запоминает инфекцию только адаптивный иммунитет: В-клетки и Т-клетки . Врожденный иммунитет имеет очень общие представления о типах инфекций, с которыми приходится бороться организму, и эти абстрактные, туманные представления выражаются в ограниченном наборе рецепторов в иммунных и эпителиальных клетках. Запомнить и различить разные типы вируса гриппа врожденный иммунитет не способен. Напротив, Т- и В-клетки заточены именно под задачу различения похожих молекул и выбора оптимальной реакции. И те, и другие формируют клон потомков после первой встречи с инфекцией. Часть клеток-потомков работает и расходуется сразу, другая часть сохраняется в специальных органах иммунной системы, к примеру, в красном костном мозге. Там клетки редко делятся, но могут быстро активироваться при повторном заражении — именно этот феномен называют иммунной памятью.
Чтобы увидеть Т-клетки и В-клетки разных типов, иммунологи чаще всего используют проточную цитометрию (FACS) [4]. Например, если мы хотим увидеть клетки памяти, то крепим флуоресцентную метку на молекулу, присутствующую только на поверхности клеток иммунной памяти, и подсчитываем клетки, пролетающие по одной через лазер и детектор флуоресценции.
Так можно узнать процент клеток, выполняющих определенную функцию, например, весь объем клеток памяти в крови на все прошлые инфекции. Теперь усложним задачу и выделим только клетки памяти на конкретную инфекцию — например, интересующий всех SARS-CoV-2, — как это сделать? Мы можем увидеть недавно активированные клетки среди клеток памяти. Лимфоциты из образца крови пациента смешиваются и инкубируются с молекулами, принадлежащими вирусу, чаще всего, — с очищенными белками, нарезанными на фрагменты. Т- и В-клетки, способные узнать и связать вирусный антиген, активируются, станут активированными эффекторными клетками, и мы сможем их различить среди всей иммунной памяти на FACS-анализе. Такие тесты проводятся в качестве дополнительных научных исследований.
Тест требует не только несколько часов на выделение клеток и их активацию вирусными белками либо пептидами, но и время дорогостоящего специалиста по проточной цитометрии, у которого прибор для FACS всегда работает и настроен, а не простаивает. Сочетание сразу двух факторов приводит к тому, что метод далеко не массовый. Можно представить метод рутинным в нескольких ведущих медицинских центрах, но сложно распространить: на порядки сложнее, чем внедрить регулярное ПЦР-тестирование.
Антитела или Т-лимфоциты
В качестве гораздо более дешевого и доступного теста, чем FACS, иммунологи смотрят не на сами клетки, а на то, что иммунные клетки производят [5]. Вспомним рецепторы, которые служат для решения задачи точного, прочного и выборочного связывания вирусных белков-антигенов. Т-клетки держат рецепторы на поверхности, на клеточной мембране. А вот В-лимфоциты свои уникальные рецепторы синтезируют как в мембранной, так и в растворимой форме — эти растворимые В-клеточные рецепторы и есть антитела. Получается, что вместо флуоресцентных меток и В-клеток памяти можно просто измерить концентрацию антител? Вдобавок, учебник иммунологии рассказывает, что В-клетки формируют память с помощью Т-клеток. Значит ли это, что если антитела есть, то уже произошло формирование памяти: сначала на уровне Т-клеток, затем на уровне В-клеток?
Да, текущие представления об иммунологии человека говорят: высокий уровень антител подразумевает, что Т-клеточный иммунный ответ тоже есть. Тем не менее известны и неклассические механизмы, при которых В-клетки быстро начинают производить антитела (чаще классов IgD, IgM) вне особых зон лимфоузла и при меньшем контроле со стороны Т-клеток. Обратная логика оказывается неверной: Т-клеточная иммунная память не зависит от наличия антител в крови, формируется независимо и сохраняется дольше.
Интуитивно кажется, что было бы отлично сохранять в крови антитела к коронавирусу после вакцинации или инфекции на всю жизнь. Некоторые инфекции формируют такой иммунный ответ, и это коррелирует с иммунной защитой, то есть вероятностью не заболеть при повторном заражении [6]. Но для других инфекций уровень антител в крови достаточно быстро, за несколько месяцев, снижается. Так происходит потому, что за свою жизнь человек встречает сотни тысяч типов вирусов, и производить антитела на все вирусные антигены просто невозможно. Приходится выбирать, происходит конкуренция с защитой от других инфекций, а также конкуренция с антителами, которые нужны для регуляции собственной физиологии организма. Антитела постепенно снижают концентрацию и пропадают из крови, но сохраняются В-клетки памяти, которые смогут вновь производить нужные антитела при необходимости.
Было бы идеально, чтобы организм производил антитела и держал их в оптимальной концентрации в крови не во время повторной болезни, а чуть заранее: до заражения. Именно для этого существуют сезонные ревакцинации: небольшая бустерная доза антигена поступает заранее и через 9–14 дней иммунитет снова подготовлен к сезонному контакту с большим количеством вирусных частиц вокруг. А постоянное, круглогодичное производство антител на высоком уровне можно оставить тем В-лимфоцитам, которые действительно каждый день сталкиваются с одними и теми же бактериями и вирусами: например, В-лимфоцитам слизистой ЖКТ, работающим с кишечными симбионтами.
ELISPOT: ИФА для Т-клеток?

Рисунок 1. Схема работы теста ELISPOT, определяющего активацию Т-лимфоцитов при взаимодействии с антигенами нового коронавируса SARS-CoV-2
[11], рисунок с изменениями
Поиск коронавирусных Т-клеток. Инновация TScan
ELISPOT используется во всех лабораториях, которые исследуют иммунитет человека. Метод ELISPOT и его модификации на пересекающихся пулах пептидов (наборах фрагментов, на которые нарезается белковый антиген) использовались в исследованиях эффективности вакцин от ВИЧ, и позже медленно распространились на исследования и других вакцин. В диагностических лабораториях метод стал популярен потому, что для более точной диагностики туберкулеза необходимо оценивать Т-клеточный иммунный ответ. Коммерческий тест получил название T-SPOT. Кроме туберкулеза, для других инфекций аналогичная диагностика не применялась — до 2020 года и кризиса, вызванного новой коронавирусной инфекцией SARS-CoV-2. Необходимость широкой диагностики самой инфекции и иммунной памяти к ней подтолкнула одновременно исследователей и производителей диагностических тестов к разработке новых методов и оптимизации старых и привычных. Интерес к быстрому и дешевому измерению Т-клеточной памяти растет параллельно с популярными в медиа опасениями, что у переболевших COVID-19 быстро пропадают антитела в крови.
Очень многие академические коллективы, которые работают на стыке биохимии, иммунологии человека и прикладных биотехнологий, весной 2020 года стали заниматься разработками для борьбы с пандемией, в том числе разрабатывать и налаживать диагностику инфекции. Нельзя не упомянуть пример коллектива Григория Ефимова из НМИЦ гематологии в Москве, активно работающий как над диагностикой Т-клеточного иммунитета к новому коронавирусу на основе FACS, так и в коллаборации по созданию одного из ИФА-тестов для определения антител к антигенам SARS-CoV-2 [9], [10]. Тем не менее вернемся к теме масштабируемого производства быстрых ELISPOT-тестов на Т-клеточный иммунитет: откуда берутся такие разработки, тоже из фундаментальных и клинических академических лабораторий?
Первой ELISPOT-тест на ковид (T-SPOT Discovery SARS-CoV-2 assay) выпустила компания Oxford Immunotec, ранее создавшая одну из самых популярных версий теста на туберкулез [11]. Этот тест использует пул разнообразных антигенов коронавируса и активацию Т-клеток в смеси с другими лейкоцитами периферической крови: иначе говоря, дизайн теста даже несколько упрощен по сравнению с тестом на туберкулез (рис. 1).
Куда более интересную модификацию запустил небольшой биотех-стартап под названием TScan Therapeutics. Этот стартап переориентировался на инфекционную иммунологию во время пандемии. Как и многие другие коллективы, к примеру, BioNTech (разработчик вакцины от коронавируса совместно с Pfizer), до пандемии они занимались онкологией и задачей оптимальной активации противоопухолевого иммунитета.
Осенью 2020 года TScan Therapeutics подписали соглашение о совместной разработке диагностического теста ELISPOT-типа с компанией Qiagen — крупнейшим производителем лабораторных реагентов и универсальных наборов для типовых экспериментов в молекулярной и клеточной биологии [12], [13]. Эта диагностика Т-клеточной памяти во многом отличается от версии Oxford Immunotec, и в первую очередь отличается идеологически: оксфордская компания быстро и практично сделала аналог своего существующего продукта-бестселлера, сохранив всю платформу и протокол метода и изменив только антиген. TScan же демонстрирует почти идеальный инновационный подход: вначале провели исследования Т-клеточного иммунитета, опубликовали выводы в престижном журнале Immunity, затем появилась идея для диагностического теста и, наконец, возможность производства в партнерстве с Qiagen.
Обнаружение важнейших участков вируса, вызывающих долгую Т-клеточную память — это поиск иммунодоминантных эпитопов. Если активировать Т-клетки именно такими пептидами, можно существенно повысить качество диагностического теста. Уникальные данные TScan позволяют вычесть фон иммунной памяти на родственные и далекие коронавирусы и поднять специфичность диагностики иммунной памяти. При этом используется платформа, сходная с ELISPOT, что позволяет объединять много образцов и делать тест быстрым и широко доступным. Сейчас исследования Т-клеточного иммунитета при коронавирусе проводится либо в рамках научных исследований, либо на коммерческой основе, но точность и интерпретация теста затруднена, клиент получает результат через 1–2 неделю после теста. Партнерство TScan с Qiagen вселяет оптимизм по поводу доступности теста: ведь продукцией этой компанией пользуются буквально в каждой молекулярной и биохимической лаборатории на планете.
Читайте также:

