Пересадка печени при отравлении бледной поганкой
Обновлено: 17.04.2024
Патолого-анатомическое отделение 1409-го Военно-морского клинического госпиталя Миноброны России, Калининград, Россия, 236009
111-й Главный государственный центр судебно-медицинских и криминалистических экспертиз, филиал №1 Минобороны России, Калининград, Россия, 236009
Гистопатологическая картина тяжелого отравления аматоксином (бледной поганкой)
Журнал: Судебно-медицинская экспертиза. 2019;62(4): 58‑60
Патолого-анатомическое отделение 1409-го Военно-морского клинического госпиталя Миноброны России, Калининград, Россия, 236009
Патолого-анатомическое отделение 1409-го Военно-морского клинического госпиталя Миноброны России, Калининград, Россия, 236009
111-й Главный государственный центр судебно-медицинских и криминалистических экспертиз, филиал №1 Минобороны России, Калининград, Россия, 236009
Приводим собственное наблюдение, в котором случай тяжелого отравления аматоксином (аманитином, α-аманитином) при употреблении в пищу бледной поганки позволил оценить гистологическую картину поражения внутренних органов.
Острое отравление аматоксином диагностировали у 19-летнего молодого человека через 3 сут после ошибочного употребления в пищу бледной поганки. Последовательно развилась острая сосудистая и дыхательная недостаточность, появились неврологические нарушения, острая почечная и печеночная недостаточность, АВ-блокада I степени. В дальнейшем пациент впал в кому, на ЭКГ — картина острого трансмурального повреждения миокарда на фоне повышения уровня тропонинов-Т/I и массированного ДВС-синдрома. На 6—7-е сутки зафиксировали лабораторные признаки дефицита содержания кислорода в тканях (Ро2 — 33 мм рт.ст. при норме 38—40 мм рт.ст.) — так называемую тканевую гипоксию, со снижением Sо2 до 59% при низких значениях Тсо2 (18 ммоль/л) и Рсо2 (31,9 мм рт. ст.). Количество сывороточного калия (К + ) в течение всего времени наблюдения оставалось в пределах нормы (3,8—3,7 ммоль/л). Смерть пациента наступила на 9-е сутки.

На вскрытии печень на ощупь дрябловатая. Ткань печени на разрезах желтовато-коричневатая, с красным крапом (точечные петехиальные кровоизлияния), полнокровная, с неразличимой структурой строения. Сердце на ощупь слегка дрябловатое. Местами под наружной оболочкой сердца встречаются точечные кровоизлияния темно-красного цвета. Венечные артерии спавшиеся, тонкостенные, просвет их свободен. Мышца сердца на разрезах серовато-красно-коричневая, слегка бледноватая, волокнистого строения. Повреждения почек, печени и надпочечников (рис. 1–3, Рис. 1. Токсическое повреждение печени. Очаги некроза гепатоцитов преимущественно центральной части долек (2) с перифокальной острой лейкоцитарной инфильтрацией (1). Строма оголена, резко расширенные переполненные кровью синусоиды; 3 — гепатоциты расположены хаотично, явления холестаза, выраженный отек, вакуольная дистрофия гепатоцитов. Проводка в аппарате АТ-6; срезы парафиновые; окраска гематоксилином и эозином. Ув. 40. на цв. вклейке).
Гистологическое (морфологическое) заключение: токсическая дистрофия печени; баллонирующий нефроз с некробиотическими изменениями эпителия извитых канальцев, явления пигментного нефроза, отек тканевых структур, расстройство микрогемодинамики в паренхиме почки, диффузный серозно-геморрагический альвеолярный отек, гиперемия сосудов периадвентиции коронарной артерии, отек тканевых структур: стромы, сосудистых стенок, цитоплазмы миоцитов; расстройство микрогемодинамики в миокарде.
Результаты и обсуждение
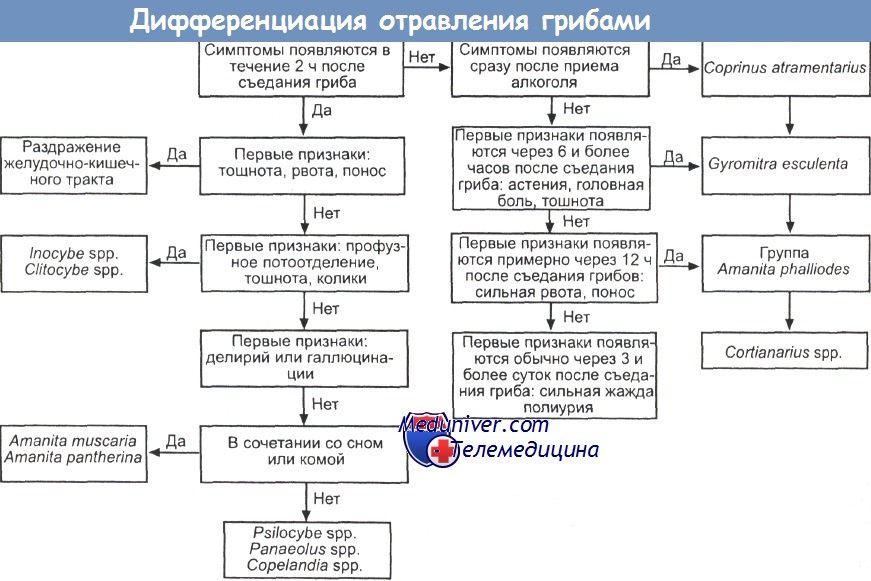
При острых отравлениях врач-клиницист сталкивается с серьезными трудностями при проведении дифференциальной диагностики состояния пациентов. Несоответствие клинической картины и лабораторно-инструментальных данных объясняется разнообразными эффектами грибных токсинов, манифестирующими или как гибель клеток [11], или как преходящая временная дисфункция органа [12—14] и, вероятно, зависит и от дозы токсина [12]. В основе такого поражения — нарушение структуры клеточных мембран и функции митохондрий, метаболические изменения, в том числе вследствие нарушения работы ионных каналов, ацидоз, реализованные целиком посредством блокады РНК-полимеразы-II [15, 16].
Отравление аматокисном следует рассматривать как одну из возможных причин смерти пациентов с острой печеночной недостаточностью или обширным острым гепатоцеллюлярным некрозом [13]. Выявление аманитина в таких случаях возможно с помощью жидкостного хроматографического масс-спектрометра [17]. Аманитин преимущественно накапливается в почках, меньше — в печени, в связи с чем исследование почек (а не мочи) наиболее предпочтительно при проведении посмертного исследования тканей в подобных случаях.

Рис. 2. Токсическое повреждение почек. Некроз эпителия извитых канальцев (1). Гиалиновые тромбы в капиллярах. Кровоизлияния (2). Тромбы в капиллярах клубочков. Распад отдельных клубочков. Во всех полях зрения — резко выраженная белковая гидропическая дистрофия эпителия извитых канальцев с образованием клеток-пузырей (3). Клетки эпителия выступают в просвет извитых канальцев (4), закрывая их просветы. Участки некробиоза эпителия извитых канальцев (5). В просвете части прямых канальцев — мелкозернистые бурые массы (6). Капилляры клубочков со сладжами эритроцитов; в полости капсулы отдельных клубочков — сетчатое содержимое розового цвета; отек мезангия; коллапс единичных клубочков; вены мозгового слоя полнокровны (7). Артерии нередко с сепарацией плазмы, отек стромы (8). Проводка в аппарате АТ-6; срезы парафиновые; окраска гематоксилином и эозином. Ув. 40.

Рис. 3. Токсическое повреждение надпочечников: нарушение гистологической структуры. 1 — множественные кровоизлияния; 2 — некроз клеток. Проводка в аппарате АТ-6; срезы парафиновые; окраска гематоксилином и эозином. Ув. 40.
Заключение
Отравление бледной поганкой (аматоксином) и его лечение
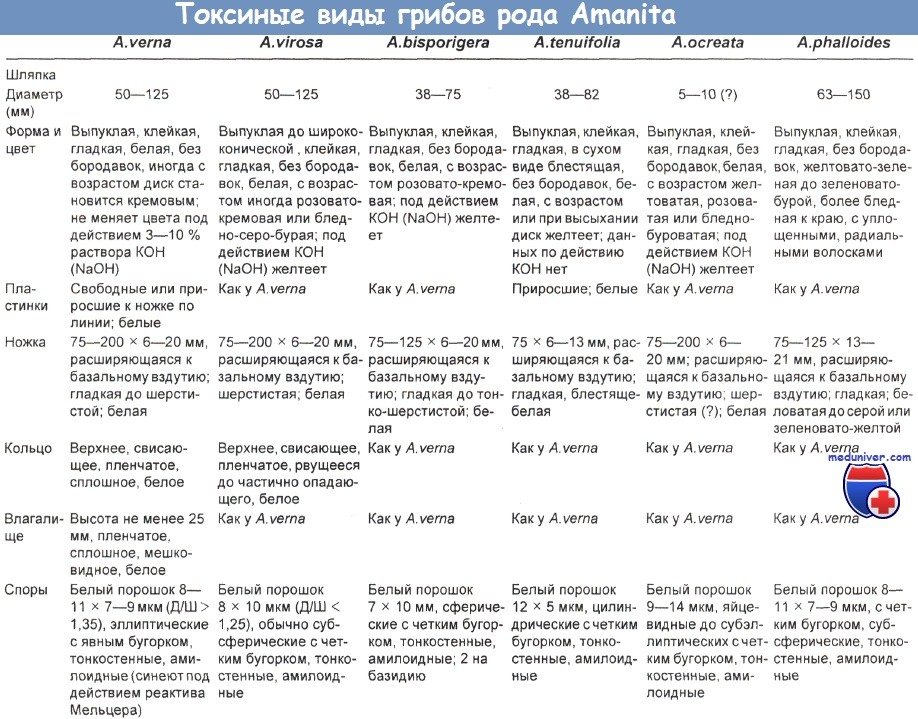
Аматоксины появляются в сыворотке только через 30 ч после потребления содержащего их гриба, и их концентрация составляет 0,5—24 нг/мл, а их экскреция с мочой продолжается до 72 ч с момента поступления в организм. Их высокие концентрации отмечаются в гастродуоденальном соке в течение 100 ч после употребления гриба в пищу. Признаки, позволяющие различать токсичные виды Amanita и виды Galerina в таблицах ниже.
а) Этанол. По-видимому, мыши выживают после отравления бледной поганкой (Amanita phalloides), если перед ее потреблением им введен этанол. Однако клиническое значение этого наблюдения еще не изучено.
б) Беременность. У беременной женщины в возрасте 21 года, отравившейся бледной поганкой, через 10 ч после употребления грибов в пищу отмечались такие симптомы, как тошнота, рвота, боль в животе и понос. Диагноз был подтвержден анализом на альфа-аманитин в крови и амниотической жидкости. Его сывороточная концентрация составляла 18,5 нг/мл (по данным жидкостной хроматографии высокого разрешения), а в амниотической жидкости он не выявлялся. По-видимому, альфа-аманитин с молекулярной массой 900 не проникает через плацентарный барьер даже через 24 ч после употребления в пищу бледной поганки. Из 77 человек, отравившихся содержащими аматоксин видами Lepiota (L.helveola и L.castanea) в Турции, 14 умерли от печеночной недостаточности. Летальные исходы при почечной недостаточности не отмечены.
в) Лабораторные данные отравления бледной поганкой (аматоксином). Альфа- и бета-аманитины в плазме, моче, гастродуоде-нальном соке, фекалиях и тканях можно количественно определять по отдельности методом жидкостной хроматографии высокого разрешения (ЖХВР) с разделением этих веществ на аналитической колонке с обратимой фазой и ультрафиолетовой детекцией. Предел обнаружения составляет 5 нг/мл для обоих соединений. Выявление в плазме их концентрации 2 нг/мл возможно при использовании ЖХВР с амперметрическим детектором.
- Уровни в крови, моче и гастродуоденальном соке. При отравлениях бледной поганкой Jaeger и соавт. определяли в плазме 8—190 нг/мл альфа-аматоксина и 23,5— 162 нг/мл бета-аматоксина. Экскреция с мочой соответствовала 32,18 мкг/ч для первого соединения и 80,15 мкг/ч для второго. Обычно аматоксины выявляются в плазме не дольше 36 ч с момента их приема, однако в моче они сохраняются до четвертого дня. Корреляции между их уровнями в плазме и тяжестью клинической картины или исходом отравления не наблюдается.
Максимальное количество аматоксинов выделяется с мочой в течение 72 ч после потребления грибов, а высокие уровни в гастродуоденальных аспиратах отмечаются в период с 48 по 110 ч после него. Предложен метод ЖХВР для определения альфа- и бета-аманитинов в сыворотке, моче и желудочных промывных водах человека. Чувствительность его составляет до 20 мкг/мл. В исследованиях на животных не наблюдалось корреляции между концентрацией аматоксинов в плазме и клиническим исходом.
- Вспомогательные исследования. В симптоматических случаях проводят рутинные лабораторные исследования, включая клинический анализ крови, определение уровней электролитов, азота мочевины крови, креатинина, протромбинового времени, билирубина в моче и глюкозы в крови. Анализы необходимо делать ежедневно до клинического улучшения.
г) Лечение отравления бледной поганкой (аматоксином):
- Стабилизация состояния. В начале лечения необходимо восстановить водно-электролитный баланс. Пациентам с притупленной чувствительностью сразу же нужно начать внутривенное введение глюкозы, поскольку к обычным осложнениям относится гипогликемия. Больные иногда попадают в отделение неотложной помощи с остановкой сердца из-за потери жидкости и массивного желудочно-кишечного кровотечения. Кроме переливания эритроцитарной массы и введения сбалансированного раствора электролитов, им могут потребоваться свежезамороженная плазма и витамин К.
- Гемоперфузия. Если съедена летальная доза грибов (более 50 г) и с этого момента прошло менее 24 ч, необходима гемоперфузия через активированный уголь.
- Очистка пищеварительного тракта
- Форсированный диурез. Поскольку основная часть токсина выводится в течение первых 24—48 ч, необходимо начать это лечение как можно быстрее. Однако данных, подтверждающих, что так можно уменьшить количество аматоксинов в печени, нет. Судя по накопленному опыту, форсированный диурез (6—9 л/сут) не более эффективен, чем поддержание нормального или слегка увеличенного объема выделяемой мочи.
- Плазмаферез. В двух сериях наблюдений плазмаферез проводили 42 больным с отравлением бледными поганками. Трое из них умерли. Для подтверждения эффективности этого перспективного подхода необходимы дополнительные данные.
- Антидоты бледной поганки - аматоксина. Пенициллин. По-видимому, пенициллин вытесняет аматоксин из мест его связывания с белками плазмы, тем самым способствуя увеличению его почечной экскреции. Возможно, он также препятствует проникновению аматоксина в гепа-тоциты. В одном ретроспективном клиническом исследовании 205 пациентов ежедневное введение 300 000—1 000 000 ME бензилпенициллина чаще сочеталось с выживанием, чем его низкие дозы.
Однако, несмотря на обнадеживающие экспериментальные данные, общая выживаемость пациентов, получавших пенициллин, ненамного выше, чем в выборке в среднем. Результаты опытов на животных наводят на мысль об аналогичной пользе цефалоспорина, но соответствующих клинических исследований не проводилось.
- Лечение острой печеночной недостаточности:
А. Общие принципы:
1. Лица с острой печеночной недостаточностью нуждаются в госпитализации в специализированное отделение, приспособленное для лечения данной патологии.
2. Желательна отработанная методика трансплантации печени.
3. Необходим инвазивный мониторинг для обнаружения осложнений на той стадии, когда они еще не проявились клинически и поддаются лечению.
4. В любых случаях нужно установить монитор центрального венозного давления, ввести артериальный и мочевыводящий катетеры, а также назогастральную трубку.
5. Если у пациента кома III или IV степени, для предупреждения аспирации необходима эндотрахеальная интубация.
6. Требуется также непрерывная импульсная гемоксиметрия.
7. Если развивается гиперкапния (РаСО2 > 6,5 кПа) или гипоксия (РаО2 < 10 кПа), необходима искусственная вентиляция легких. Если имеются асцитная жидкость и раны, регулярно и по клиническим показаниям надо проводить посевы для выявления бактерий.
8. Необходимо регулярно проверять места введения катетеров; последние меняют с интервалом 3— 5 сут, делая посевы с их концов.
9. Гипогликемию предупреждают непрерывным вливанием 5—10 % раствора декстрозы. Это нарушение можно не заметить, если не определять уровень глюкозы у коматозных пациентов в крови через каждые 2—3 ч.
10. Если концентрация глюкозы в крови падает ниже 60 мг/100 мл, ее немедленно корректируют вливанием 50 % раствора декстрозы, соответственно отрегулировав скорость введения.
11. Если с помощью растворов кристаллоидов или коллоидов не удается поддержать кровяное давление, можно ввести дофамин или при очень низком сосудистом сопротивлении дофамин с норадреналином.
12. Почечную недостаточность устраняют, проводя тщательный мониторинг объемов жидкости. Непрерывное вливание дофамина (2—4 мкг/кг в час) может обратить или замедлить поражение почек, увеличив в них кровоток.
13. Диализ или артериовенозная ультрафильтрация требуется, когда уровень креатинина в сыворотке превышает 400 мкмоль/л (4,5 мг/100 мл), а также при обычных показаниях, например при тяжелом метаболическом ацидозе, гиперкалиемии и перегрузке организма.
14. Гастродуоденальное кровотечение можно предупредить регулярными дозами Н2-антагонистов или омепразола, поддерживающими внутрижелу-дочковый рН выше 5.
Б. Печеночная энцефалопатия. Для лечения острой печеночной энцефалопатии обычно применяют лактулозу и отменяют белки в рационе. Из других средств используют метронидазол и неомицин.
В. Отек мозга. Мониторинг внутричерепного давления (ВЧД), по-видимому, помогает ориентировать терапию на профилактику грыжи ствола головного мозга, полезен при отборе пациентов для пересадки печени и проведении анестетического лечения во время последней процедуры.
- Осмотические диуретики. Если ВЧД превышает 30 мм рт.ст. на протяжении более 5 мин или в отсутствие мониторинга ВЧД наблюдаются клинические симптомы, заставляющие подозревать отек мозга, проводят быстрое внутривенное вливание 20 % раствора маннитола в дозе 1 г на 1 кг массы тела. Если осмолярность плазмы не превышает 320 мосм, вливание маннитола можно повторить.
У пациентов с почечной недостаточностью это средство надо применять только в сочетании с гемофильтрацией или ультрафильтрацией, чтобы избежать гиперосмолярности и перегрузки организма жидкостью.
- Барбитураты. Тиопентал (3—5 мг/кг) медленно вливают в течение 15 мин до исчезновения симптомов внутричерепной гипертензии или до достижения максимальной суммарной дозы 500 мг. Затем для поддержания ВЧД ниже 20 мм рт.ст. непрерывно с минимальной скоростью вливают тиопентон. Если клинические отклонения ВЧД не устраняются в течение 4 ч, вливание прекращают.
- Положение тела. В отсутствие мониторинга ВЧД пациенты с острой печеночной недостаточностью должны находиться с приподнятой головой под углом не более 30°. Гемоперфузия через активированный уголь Гемоперфузия через активированный уголь не повышает выживания по сравнению с уровнем, достигаемым при использовании одной лишь интенсивной терапии печени.
- Кортикостероиды. Кортикостероиды в плане как профилактики, так и активного лечения отека мозга при острой печеночной недостаточности бесполезны.
Г. Инфекция. Пациентам с острой печеночной недостаточностью для раннего выявления и адекватного лечения возможной бактериальной или грибковой инфекции необходимо тщательное ежедневное микробиологическое обследование. Полезно также профилактическое антимикробное лечение.
Д. Коагулопатия. При кровотечении или перед инвазивной процедурой рекомендуется свежезамороженная плазма.
Е. Гемодинамические аномалии и тканевая гипоксия. Введение циркулирующих сосудорасширяющих средств, например простациклина и N-ацетилцистеина, может предупредить развитие тканевой гипоксии у пациентов с острой печеночной недостаточностью, получающих сосудосуживающие средства.
Ж. Аппараты для поддержания функции печени. Для определения клинической эффективности экстракорпорального аппарата, поддерживающего функцию печени ("искусственная печень"), нужны дополнительные испытания.
З. Ортотопическая трансплантация печени (ОТП). Каждый пациент с острой печеночной недостаточностью должен как можно раньше, желательно еще при поступлении в больницу, пройти соответствующую оценку и быть внесенным в список на ОТП, даже если необходимость в ней пока вызывает сомнения.
- Трансплантация печени при отравлении бледной поганкой. Когда у пациента, отравившегося грибами рода Amanita, развивается печеночная кома, его шансы на выживание с использованием только терапевтического лечения минимальны. Ортотопическая трансплантация печени (ОТП) показана в следующих случаях:
1) прогрессирование энцефалопатии до II и более стадии;
2) удлинение протромбинового времени более чем в 2 раза по сравнению с нормой, несмотря на массивное вливание свежезамороженной плазмы;
3) уровень билирубина в сыворотке выше 25 мг/100 мл.
Прочим пациентам с такими симптомами, как ацидоз, гипогликемия, желудочно-кишечное кровотечение и гипофибриногенемия после выраженного повышения сывороточного уровня аминотрансфераз, также может быть показана срочная трансплантация печени еще до появления у них далеко зашедшей печеночной энцефалопатии, азотемии или желтухи.
К дополнительным критериям, говорящим о желательности ОТП после отравления грибами рода Amanita, относятся пиковое протромбиновое время менее 10 % (>100 с), концентрация фактора V ниже 10 %, лактат-ацидоз, желудочно-кишечное кровотечение и возраст менее 12 лет. Когда показана ОТП, риск интоксикации, обусловленной пересаженной печенью, по-видимому, отсутствует, поскольку спустя 4 дня циркулирующие аматоксины уже не выявляются.
Наблюдение за больными, которым может потребоваться ОТП, включает повторные клинические обследования, определение протромбинового времени, фактора V, рН, лактозы в крови, ЭЭГ и эхографию печени.
Ребенку в возрасте 4 лет, находящемуся в коме после потребления бледной поганки, через 70 ч с момента приема гриба сделана ОТП; через 24 ч он пришел в сознание.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплантация печени лицам старше пятидесяти лет. Особенности
Показания к трансплантации печени общепризнанны во всем мире и могут быть разделены на 4 больших группы:
- терминальная стадия хронических диффузных заболеваний печени (ХДЗП);
- нарушения метаболизма на фоне врожденных дефектов развития гепа-тоцита, сопровождающиеся поражением различных органов и систем, без нарушения функции печени;
- фульминантная печеночная недостаточность (ФПН);
- нерезектабельные очаговые поражения печени (билобарное поражение или наличие резектабельной опухоли на фоне цирроза печени).
Первая группа заболеваний наиболее многочисленная и представлена в большинстве случаев пациентами, страдающими циррозом печени (ЦП) различной этиологии, в том числе вирусной. Количество больных, оперируемых по поводу цирроза печени вирусной этиологии, постоянно растет, в связи с общим ростом инфицированности населения вирусами парентеральных гепатитов. При этом увеличивается количество пациентов старшей возрастной группы, которым показана трансплантация печени.
Опыт НИИ СП им. Н.В.Склифосовского по трансплантации печени у пациентов старше 50 лет позволяет уточнить некоторые закономерности хирургических вмешательств подобного типа у пожилых.
С начала 2000 по май 2008 гг. в НИИ СП им. Н.В. Склифосовского выполнено 87 ортотопических трупных трансплантаций печени (из них 2 ретрансплантации печени, а также 2 симультантных пересадки печени и почки).
22 (25%) пациента из общего числа оперированных были старше 50 лет (от 51 до 68).
Из них 13 пациентов (45,5%) оперированы по поводу цирроза печени (ЦП) вирусной этиологии, в том числе 7 человек (31,8%) по поводу ЦП HCV-этиологии. Из них 3 человека (13,6%) были с очагами гепатоцеллюлярного рака (ГЦР), 3 (13,6%) оперированы по поводу ЦП HBV-этиологии (из них 2 (9%) были и с очагами ГЦР), 3 (13,6%) — по поводу ЦП HBV + HDV-этиологии (из них 4,5% — с очагом ГЦР).
У 4 (18%) пациентов показанием для операции служил первичный билиарный цирроз, у 3 (13,6%) — криптогенный цирроз, у 1 (4,5%) — фульминантная печеночная недостаточность после расширенной резекции печени, у 1 (4,5%) — алкогольный ЦП.
Как правило, операции выполнялись в условиях общей анестезии (изофлюран/севофлюран-фентанил в режиме low-flow, релаксация осуществлялась цисатракуриумом/атракуриумом бесил атом).

Кровопотеря в интраоперационном периоде составила 2566 + 1900 мл. У 3 (13,6%) пациентов в интраоперационном периоде на этапе гепатэктомии с целью инотропной поддержки потребовалось назначение допмина (4—10 мкг/кг/мин) в сочетании с мезатоном (1—3 мкг/кг/мин). После операции больные были экстубированы в течение 4—6 часов.
У 3 (13,6%) пациентов в послеоперационном периоде на фоне гепаторенального синдрома развилась острая почечная недостаточность (ОПН). В результате заместительной почечной терапии (вено-венозная гемодиафильтрация или гемодиализ) у двух пациентов функция почек восстановилась, и они были успешно выписаны из клиники.
Пять пациентов (22%) погибли после трансплантации печени в различные сроки, из них 4 умерли в ближайшем послеоперационном периоде. Причиной смерти у 2 из них был первично нефункционирующий печеночный трансплантат, у 1 — тромбоз воротной вены, 1 пациент погиб от полиорганной недостаточности на фоне острой почечной недостаточности вследствие гепаторенального синдрома. У всех умерших исходно было крайне тяжелое состояние.
В настоящее время 17 пациентов старше 50 лет выписаны из клиники и наблюдаются амбулаторно.
Из них 9 пациентов находятся на монотерапии препаратом Сандиммун-неорал, 2 получают двухкомпонентную терапию препаратами сандиммун-неорал и селлсепт (MMF), 1 пациент — сандиммун-неорал и преднизолон. В ближайшее время после операции четверо больных получали трехкомпонентную терапию (програф, преднизолон, майфортик), один — монотерапию прографом. Вопрос о модификации терапии у этих пациентов будет решаться в более отдаленные послеоперационные сроки.
Особая роль у рассматриваемой категории пациентов принадлежит противовирусному лечению. 5 (22%) пациентов из общего числа оперированных старше 50 лет по поводу ЦП HCV-этиологии получали в дооперационном периоде противовирусную терапию (ПВТ) препаратами интерферонового ряда. Ни у одного из них добиться прекращения репликации HCV-инфекции не удалось. На момент ОТП уровень репликации HCVy всех пациентов был от 104 до 106 копий/мл.
После трансплантации печени двое из них с генотипом вируса 1 b получили курс ПВТ препаратами пегасис в дозе от 90 до 135 мкг/нед и рибавирин от 600 до 1000 мг/сут. Одна пациентка получила 20-недельный курс ПВТ. Ей пришлось прервать ПВТ в связи с развитием реакции отторжения печеночного трансплантата (пациентка погибла через 6 лет после ОТП от печеночной недостаточности на фоне сформированного цирроза печеночного трансплантата). У второго пациента был отмечен ранний вирусологический ответ на лечение, но он был неустойчив (не наблюдалось устойчивого вирусологического ответа).
Из 6 пациентов, оперированных по поводу заболевания печения HBV (или HBV+HDV-этиологии) 4 человека (1 группа) получили иммунопрофилактику инфицирования трансплантата иммуноглобулином (НВ Ig) в сочетании с аналогами нуклеозидов (ламивудин или энтекавир). У двух из 11 пациентов использовали отечественный НВ Ig (Антигеп), у 2-х больных — немецкий (Неогепатект). Трое пациентов с очагами ГЦР на фоне ЦП НВ Ig не получали. Им проводилась монотерапия препаратом Зеффикс.
У 4 больных (которые получали иммуноглобулин) отмечено быстрое исчезновение HBs-Ag, отсутствие репликации HBV и HDV в крови (наибольший срок наблюдения — 52 месяца после ОТП). У всех троих больных второй группы HBs-Ag не элиминировался после операции, у первой группы продолжалась репликация ДНК вируса гепатита В в крови.
После трансплантации печени по поводу ПБЦ ни в одном случае нами не отмечено рецидива заболевания. Все пациенты чувствуют себя хорошо. Пациенты, перенесшие трансплантацию печени по поводу алкогольного ЦП, продолжают воздерживаться от приема алкоголя, вернулись к прежней работе. У всех пациентов отмечена полная социальная и медицинская реабилитация.
В то же время следует отметить, что результаты трансплантации печени у пациентов старше 50 лет несколько хуже, чем у более молодых пациентов. Несомненно, на результаты влияет тот факт, что в 45,5% трансплантация печени выполнялась по поводу ЦП вирусной этиологии. Связано это с наличием внепеченочных резервуаров инфекции в организме реципиентов и, как следствие, инфицированием печеночного трансплантата в послеоперационном периоде с быстрым прогрессированием морфологических изменений трансплантата на фоне медикаментозной иммуносупрессии, печеночной недостаточности. Это может привести к потере печеночного трансплантата и гибели пациента.
Несмотря на это, трансплантация печени — единственный радикальный метод лечения подобных пациентов. Ежегодно среди всех трансплантаций печени в мире примерно 25% составляют больные с ЦП HCV-этиологии и около 6% — больные с ЦП HBV-этиологии.
Вирус гепатита С менее агрессивен по отношению к печеночному трансплантату, чем вирус гепатита В. В случае успеха трансплантации печени позволяет добиться полной медицинской и социальной реабилитации даже у пациентов старше 50 лет. Улучшения результатов трансплантации печени можно добиться более ранней постановкой пациентов с циррозами печени в Лист ожидания, а также активизации путем работы по органному донорству и своевременному выполнению трансплантации печени и ретрансплантации печени.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Пересадка печени при генетических болезнях. Эффективность
При некоторых метаболических болезнях пересадка печени — единственное известное эффективное лечение. Например, хроническая патология печени при муковисцидозе или недостаточности альфа-1-антитрипсина может быть излечена только трансплантацией печени, и эти два заболевания ответственны за большую долю всех пересадок печени, выполняемых у детей.
Пересадку печени сейчас проводят при более чем 20 генетических болезней. В настоящее время показатель 5-летнего выживания среди детей — реципиентов печени колеблется от 70 до 85%. У почти всех таких пациентов качество жизни обычно значительно улучшается, специфическая метаболическая аномалия, потребовавшая пересадки, корректируется, и в тех же условиях, в которых развилась печеночная недостаточность (например, недостаточность альфа-1-антитрипсина), происходит нормализация роста печеночной ткани и нормальное пубертатное развитие.
Широкое использование трансплантации для лечения генетических болезней ограничивается двумя специфическими проблемами. Во-первых, инвалидизация после пересадки органов остается существенной, так же как и смертность из-за интеркуррентных инфекций, связанных с необходимостью проведения иммуносупрессивной терапии, и развития болезни трансплантат против хозяина.
Стала реальной конечная цель исследований трансплантологов — возможность отказаться от иммуносупрессии после пересадки. Многообещающие достижения в этой области — высокая восприимчивость реципиентов к пересадке клеток плацентарной крови по сравнению с клетками донорского костного мозга. Вторая проблема с пересадкой — ограниченное количество донорских органов, единственное исключение — плацентарная кровь.
Например, по всем показаниям, включая генетические болезни, ежегодно только в Соединенных Штатах необходимо от 4000 до 5000 пересадок печени. Кроме того, пока не доказано, что пересаженные органы способны нормально функционировать в течение всей жизни.
Одно из решений отмеченных проблем — комбинация использования стволовых клеток и генотерапии. При этом собственные стволовые клетки пациента выращивают in vitro, генно-инженерными методами в них переносят интересующий ген, и затем их возвращают пациенту, восстанавливая пораженную ткань.
Идентификация стволовых клеток в ряде зрелых тканей человека и последние достижения в переносе генов дают большие надежды на успешность этой стратегии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Судебно-гистологическое отделение Белгородского бюро судебно-медицинской экспертизы, Белгород, Россия, 308017
ФГБУ "Российский центр судебно-медицинской экспертизы" Минздравсоцразвития России
ФГБУ Российский центр судебно-медицинской экспертизы Минздравсоцразвития России
Особенности морфологических проявлений поражения печени при отравлении бледной поганкой
Журнал: Судебно-медицинская экспертиза. 2017;60(3): 23‑26
Судебно-гистологическое отделение Белгородского бюро судебно-медицинской экспертизы, Белгород, Россия, 308017
Рассмотрены морфологические особенности массивного некроза печени при отравлении ядами бледной поганки (Amanita phalloides) в сравнении с другими его причинами. Показано наличие пролиферации в перипортальных зонах печени и участие механизмов апоптоза при гибели гептоцитов. Уточнен темп умирания при данном отравлении.
Судебно-гистологическое отделение Белгородского бюро судебно-медицинской экспертизы, Белгород, Россия, 308017
ФГБУ "Российский центр судебно-медицинской экспертизы" Минздравсоцразвития России
ФГБУ Российский центр судебно-медицинской экспертизы Минздравсоцразвития России
Использование методов иммуногистохимии (ИГХ) находит все большее применение в современной морфологии [1]. Не исключение и судебная медицина. Причины массивного некроза печени (МНП), его клинические и морфологические проявления, в частности при отравлении грибами, описаны давно [2—5]. Особенности повреждения паренхимы и реакции на него, характерные для различных причин МНП, до сих пор оставались вне внимания исследователей. Между тем их выявление может дать ключ не только к познанию патогенеза МНП, но и к пониманию функциональной морфологии печени в норме. В число функций этого органа входит обезвреживание неиммуногенных ксенобиотиков путем их метаболизма и выделения с желчью либо подготовки к выделению с мочой. Токсическое поражение печени возникает в случае, если происходит срыв ее детоксикационной функции.
В настоящее время исследователи слишком много внимания уделяют исследованиям на молекулярном и ультраструктурном уровнях, пренебрегая светооптическим исследованием. Между тем синтез обнаруженных ими фактов, переход от частностей к целостным теориям изучаемых явлений требуют изучения каждого явления на всех уровнях организации, и светооптические исследования еще далеко не исчерпали своих возможностей. Наблюдаемые при них феномены, являясь интегральными, могут играть эвристическую роль для поиска перспективных путей изучения тех же явлений на молекулярно-биологическом и субклеточном уровнях.
В современной литературе нет подробных данных об иммуногистохимическом или электронно-микроскопическом исследовании печени при отравлении бледной поганкой. По-видимому, это объясняется предпочтением исследователей экспериментального материала секционному и тем, что они не подозревают о возможности существенных различий МНП, вызванных различными этиологическими факторами, и используют для моделирования МНП более доступный тетрахлорметан.
Цель исследования — описание морфологических особенностей реакции печени человека на токсины бледной поганки на органном, тканевом и клеточном уровнях, а также установление темпа умирания при таких отравлениях.
Материал и методы
Исследовали смертельное отравление бледной поганкой (Amаnita phalloides) 9 лиц мужского пола в возрасте от 2 до 44 лет и девочки 4 лет. Некоторые из пострадавших утверждали, что собирали маслята или сыроежки, другие не могли описать грибы; только один пострадавший указал морфологические признаки бледной поганки. Диагноз был установлен на основании клинической картины и не вызывал сомнений. Смерть наступила в стационаре на 5—7-е сутки после употребления грибов. Ведущим клиническим синдромом была печеночная недостаточность, непосредственной причиной смерти служила печеночная кома, которая в ряде случаев развивалась на фоне желудочно-кишечного кровотечения.
Две группы сравнения составили 10 наблюдений смертельного отравления хлорпроизводными углеводородов: дихлорэтаном — 8, сочетанием дихлорэтана и этиленгликоля — 1, тетрахлорметаном — 1 и 9 наблюдений вирусного гепатита В с фульминантным течением, завершившихся смертью.
Отравились хлорпроизводными углеводородов женщина 50 лет и 9 мужчин в возрасте от 23 до 66 лет. Трое приняли яд с целью суицида, 2 — в качестве суррогата алкоголя, 1 — случайно; в остальных случаях обстоятельства отравлений остались неизвестными. Смерть одного пострадавшего наступила на месте происшествия, остальных — в стационаре через 2—7 ч после приема яда; только 2 пострадавших прожили 2 сут с момента отравления, несмотря на интенсивную терапию. Печеночная недостаточность явилась причиной смерти только одного: пострадавший выпил тетрахлорметан. У остальных в плазме крови было повышено содержание билирубина и трансфераз, что указывало на поражение печени, но смерть была связана с токсическим действием дихлорэтана на головной мозг и/или сердце.
Фульминантный вирусный гепатит явился причиной смерти 5 мужчин и 4 женщин в возрасте от 21 года до 40 лет, не злоупотреблявших алкоголем. Их смерть наступила от печеночной комы в стационаре на 5—7-е сутки от начала болезни.
Результаты и обсуждение
Макроскопически при отравлении бледной поганкой и тетрахлорметаном наблюдали классическую картину МНП: размеры и масса печени уменьшены (масса у взрослых 1300—1400 г), ткань дряблая, распластывается на столе, на разрезе пестрого вида, с чередованием участков темно-красного и охряно-желтого, почти оранжевого цвета. В одном случае имелись также серовато-зеленоватые поля. Обнаружили также признаки медленной смерти (белые свертки в полостях сердца), отека мозга и геморрагического синдрома. У большинства умерших от вирусного гепатита масса составляла от 2000 до 2500 г, отмечали увеличение лимфатических узлов воротной вены и селезенки.
Микроскопически при отравлениях бледной поганкой, помимо собственно МНП, обнаружили ряд особенностей.
1. Массивные поля некроза захватывали все гепатоциты, кроме перипортальных. В центрах долек — распад печеночных клеток, их лизис с явлениями коллапса стромы.
Ближе к портальным трактам гепатоциты еще сохраняли форму, хотя многие были лишены ядер и находились чаще всего в состоянии крупнокапельной жировой дистрофии. Признаков холестаза не наблюдалось (рис. 1). Некоторые гибнущие клетки давали положительную ИГХ-реакцию на bcl-2 (рис. 2). В почках пигментных цилиндров немного, они имели не характерный для желчных пигментов зеленоватый цвет, а золотисто-буроватый, указывающий на их гемоглобиновую или миоглобиновую природу.

Рис. 1. Массивный некроз печени без признаков холестаза при отравлении бледной поганкой. Коллапс стромы со сближением центральных вен. Ув. 100. Здесь и на рис. 3—4: окраска гематоксилином и эозином.

Рис. 2. Апоптоз в зонах гибели гепатоцитов. ИГХ с АТ к bcl-2. Ув. 400.
В противоположность этому при фульминантном гепатите отмечали признаки холестаза в виде обесцвечивания кала (клинические и секционные данные), скоплений желчи в ткани печени и пигментных цилиндров с характерным зеленым оттенком в почках. При отравлении тетрахлорметаном все эти признаки также присутствовали, но, кроме того, произошло образование кристаллов оксалатов в канальцах почек, а желчные пигменты окрасили эти кристаллы в необычный зеленовато-коричневый цвет.
2. Среди погибающих и погибших, но еще нелизированных гепатоцитов встречаются клетки, жировая дистрофия в которых еще не достигла степени крупнокапельной (рис. 3). В их цитоплазме множество мелких округлых жировых капель с четкими границами, которые, даже заполнив всю клетку, не сливаются друг с другом, не оттесняют ядро на периферию, из-за чего клетка похожа на ягоду малины. Такая форма жировой дистрофии встречалась нам только при острых отравлениях гепатотропными ядами (токсины бледной поганки, галогенпроизводные углеводородов) и ни разу не наблюдалась при ином происхождении стеатоза печени.

Рис. 3. Жировая дистрофия гепатоцитов с образованием множества мелких округлых жировых капель с четкими границами, не сливающихся друг с другом и не оттесняющих ядро на периферию, при отравлении бледной поганкой. Ув. 400.
При фульминантном вирусном гепатите преобладала баллонная дистрофия, тогда как жировая отсутствовала или имела характер очаговой средне- и мелкокапельной, причем в каждом гепатоците была лишь одна липидная вакуоля, оттесняющая ядро на периферию. Кроме того, наблюдали гиалиново-капельную дистрофию, внутриядерные включения и аномалии формы и размера гепатоцитов и их ядер. Таким образом, донекротические изменения печеночных клеток при различной этиологии МНП имеют совершенно разный характер.
3. При отравлениях бледной поганкой перипортально отмечалась пролиферация базофильных полиморфных гепатоцитов с крупными ядрами с диспергированным хроматином. Эти клетки образовывали примитивные трабекулы, реже тубулы (рис. 4). Высокое ядерно-цитоплазматическое соотношение в клетках пролифератов и их гиперхромия свидетельствуют об их активном размножении. Эти же клетки давали положительную ИГХ-реакцию на маркер пролиферации Ki-67. Все это соответствует данным литературы [6], согласно которым камбиальные предшественники паренхиматозных элементов печени находятся вблизи портальных трактов. Пролиферация желчевыводящих протоков отсутствовала.

Рис. 4. Перипортальная пролиферация гепатоцитов при отравлении бледной поганкой. Ув. 200.
При фульминантном вирсном гепатите, хотя смерть пациентов наступала в те же сроки, признаки пролиферации полностью отсутствовали. В случае отравления тетрахлометаном их также не было, но это могло быть связано с быстрой смертью пострадавшего.
В зонах некроза, особенно по их периферии, отмечали активацию ретикулоэндотелия и лимфомакрофагальную инфильтрацию с примесью сегментоядерных нейтрофилов.
При фульминантном гепатите нейтрофилы обнаруживали в небольшом количестве только в одном наблюдении. В остальных случаях инфильтрат состоял исключительно из лимфоцитов и макрофагов, причем встречались погибшие гепатоциты, окруженные лимфоцитами, а также имеющие дефекты ткани, в которые внедрялись лимфоциты (признаки аутоиммунной реакции). В случаях токсической природы МНП подобные явления не встречались.
5. При отравлениях некроз всегда появлялся раньше и был выражен сильнее в центрах долек, при вирусном поражении нередко начинался перипортально или с мостовидного варианта, т. е. очаги некроза сначала соединяли портальные тракты друг с другом или с центральными венами и только потом распространялись на остальную паренхиму.
Маркеров иных заболеваний печени не обнаружили ни в одном наблюдении.
В других органах выявили признаки синдрома диссеминированного внутрисосудистого свертывания, а в почках — умеренно выраженный некротический нефроз. Клинически им соответствовали снижение протромбинового индекса, содержания общего белка, фибриногена и количества тромбоцитов в крови, гипокоагуляция, повышение концентрации креатинина и мочевины и проявления геморрагического синдрома (тяжелые рецидивирующие желудочно-кишечные кровотечения, макрогематурия и др.). При фульминантном гепатите признаков диссеминированного внутрисосудистого свертывания не наблюдали, а в почках доминировал пигментный нефроз.
Таким образом, отсутствие желчных цилиндров в почечных канальцах при отравлениях бледной поганкой в некоторой степени может быть объяснено патоморфозом отравлений под влиянием современной детоксикационной и инфузионной терапии. В 50-е годы ХХ века больные умирали чаще всего через 2—3 дня после приема грибов [3], а в настоящее время летальный исход наступает на 5—7-е сутки, и продукты распада гепатоцитов успевают удалиться с мочой. Судя по различной степени повреждения и лизиса гепатоцитов, они гибнут не одновременно. Некроз печени при отравлениях бледной поганкой прогрессирует, и смерть от печеночной недостаточности наступает, если он охватывает примерно 90% паренхимы, т. е. когда сохраняются лишь камбиальные элементы и немногочисленные тяжело поврежденные зрелые гепатоциты. Если некроз развивается не одномоментно и продолжает прогрессировать почти до самой смерти, то в почках должно быть хотя бы немного желчных пигментов. Их полное отсутствие можно объяснить только ранним нарушением биосинтетических функций гепатоцитов, предшествующим их некрозу, т. е. влиянием токсинов бледной поганки на органеллы, в которых происходит биосинтез, — эндоплазматический ретикулум.
Этим же объясняется своеобразная форма жировой дистрофии, при которой мелкие капли липидов соприкасаются, но не сливаются. Такая ситуация возможна в случае, если они отграничены друг от друга мембраной, т. е. накопление жира вначале происходит в эндоплазматическом ретикулуме и только при его повреждении липиды выходят в цитоплазму.
В генезе холестаза, наблюдаемого при других вариантах МНП, важную роль играют частичное сохранение паренхиматозных элементов и функционирование некоторых поврежденных гепатоцитов. Отсутствие холестаза при отравлении бледной поганкой должно быть связано с полным прекращением функции гепатоцитов. Это означает, что сохранившие жизнеспособность малодифференцированные камбиальные элементы, образующие перипортальные регенераты, способны пролиферировать, но не могут выполнять биосинтетические функции [7]. Аналогично зрелые гепатоциты, пребывающие в состоянии дистрофии, но сохранившие жизнеспособность, также не способны их осуществлять, что приводит к смерти. Такую функциональную несостоятельность можно объяснить дефицитом энергии и пластических субстанций в условиях глубокой дистрофии и/или интенсивной пролиферации, а также специфическим действием токсинов бледной поганки на процессы биосинтеза.
Общеизвестно, что аманитины — наиболее токсичные вещества из этого гриба — блокируют синтез белка [4, 5]. Это должно вести и к прекращению синтеза небелковых соединений, поскольку осуществляющие его ферменты также являются белками. По мнению ряда исследователей, блокада РНК-полимераз — главный, но не единственный механизм действия токсинов бледной поганки. По-видимому, имеются и иные, пока неизученные механизмы, которые определяют селективную гепатотропность этих ядов и избирательное подавление специализированных функций печеночных клеток при относительном сохранении их способности к пролиферации и самоподдержанию.
В противоположность этому при вирусном гепатите наиболее тяжело поражаются перипортальные зоны, где находятся камбиальные элементы. По-видимому, именно с этим связано отсутствие признаков регенерации при фульминантном гепатите. Возможно, поражение камбиальных элементов играет роль и в развитии нарушений регенерации при выживании больных вирусным гепатитом типа В.
Существенные различия в морфологических изменениях гепатоцитов, предшествующих МНП различной этиологии, указывают на разные механизмы повреждений этих клеток при действии вирусных и токсических факторов.
Учитывая длительный период времени от употребления грибов до развития повреждения печени, можно предположить существование так называемого летального синтеза, т. е. ведущую патогенетическую роль не самих токсинов, а их метаболитов, которые также являются неизученными. Темп умирания в основной группе может быть оценен как замедленный с развитием печеночно-почечной недостаточности и ДВС-синдрома.
Заключение
Исследование позволило выявить различия морфологических проявлений МНП при действии разных этиологических факторов — токсинов бледной поганки и вируса гепатита В; наметить перспективные направления научных исследований в области патофизиологии и патоморфологии печени. Необходимо изучение печени при МНП разного происхождения электронно-микроскопическими, химико-токсикологическими методами для определения последовательности изменений структуры органелл и нарушений различных биосинтетических процессов, а также выявления основных метаболитов аманитинов и их токсичности. Это позволит понять не только патогенез отравлений бледной поганкой, но и особенности детоксикационной функции печени и ее реакций на повреждение в различных условиях.
Полученные результаты могут быть использованы в судебно-медицинской практике для диагностики смертельных отравлений гепатотропными ядами, а также в клинической медицине для разработки патогенетической терапии при этих отравлениях. В частности, при невозможности пересадки печени наиболее перспективны активная детоксикация путем плазмафереза и гемодиализа вплоть до 5—7-х суток после употребления грибов, а также переливание плазмы для замещения белоксинтезирующей функции печени.
Показана роль апоптоза в гибели гепатоцитов при отравлении изученными грибными ядами.
Читайте также:

