Перианальный дерматит при дисбактериозе
Обновлено: 05.05.2024
Клиническая картина многих заболеваний кишечника отягощается появлением внекишечных симптомов и осложнений.
Клиническая картина многих заболеваний кишечника отягощается появлением внекишечных симптомов и осложнений. Нарушенная кишечная флора обладает негативным воздействием на организм: усиливает кишечное брожение, выработку токсинов, канцерогенов, фенолов, аминов (гистамина, тирамина, пиперидина и др.). Высокий уровень экзогенного амина способствует аллергическим заболеваниям.
К внекишечным проявлениям нарушений барьерной функции кишечника относятся атопический дерматит (АД) и атопическая бронхиальная астма.
Нами было обследовано 59 детей в возрасте от 4 месяцев до 14 лет с АД и теми или иными проявлениями кишечной дисфункции. Помимо тщательного клинико-лабораторного обследования, всем детям проводился анализ кала на дисбактериоз до и после лечения, УЗИ органов брюшной полости, а также, по показаниям, ЭГДС и ирригография.
40 детей страдали различными заболеваниями кишечника. У 19 детей органическая патология со стороны кишечника не выявлена. Кишечную симптоматику у этих пациентов мы связывали с функциональными расстройствами и расценивали как синдром раздраженного кишечника (СРК). При этом 40,6% обследованных детей страдали дисбактериозом I степени, 37,2% детей — дисбактериозом II степени и 22,2% детей — дисбактериозом III степени.
В нашей практике для лечения дисбактериоза мы использовали: а) бифи-форм (фирма Ferrosan) — современный комбинированный пробиотик, содержащий натуральные бактерии двух видов: Bifidobacterium longum и Enterococcus faeceum, а также питательную среду для быстрого начального роста бактерий; препарат выпускается в кислотоустойчивых капсулах, благодаря чему без потерь преодолевает кислую среду желудка; б) аципол; в) наринэ в таблетированной форме; г) хилак-форте; д) примадофилус; е) КИП. Содержит иммуноглобулины трех основных классов (IgG, IgM, IgA).
Для оценки эффективности проводимой терапии мы проанализировали динамику клинических симптомов и показателей микрофлоры кишечника до и после лечения в трех группах детей с атопическим дерматитом.
В первую группу вошли 11 детей с СРК и дисбактериозом I-II степени, которые в течение семи дней получали бифи-форм, а затем наринэ от 10 до 14 дней. Вторую группу составили 12 детей с хроническим колитом и энтероколитом с давностью заболевания более года и дисбактериозом II-III степени. Курс бифи-форма у этих детей был продлен до двух недель, а начиная с 5-7 дня в терапию подключался хилак-форте или аципол на срок не менее одного месяца. В третью группу вошли дети с органическими и функциональными изменениями кишечника, дисбактериозом II-III степени и большим сроком заболевания. Первые 5-7 дней они получали комплекс иммунных препаратов, а затем хилак-форте или примадофилус сроком от одного до двух месяцев.
Практически у всех детей первой и второй группы по окончании курса лечения была выявлена отчетливая положительная динамика как со стороны желудочно-кишечной симптоматики, так и со стороны кожных проявлений. Клинический эффект сочетался с полным восстановлением облигатной флоры в 85-90% случаев и вытеснением факультативной флоры у 92% больных.
Сложнее дело обстояло в третьей группе, где нарушения микрофлоры кишечника у детей с атопическим дерматитом выявлялись на фоне длительного хронического воспалительного процесса в кишечнике, порой в сочетании с его аномалией.
Динамика клинических проявлений и показателей микрофлоры кишечника у этих детей имела более торпидный характер и требовала дальнейшего индивидуального подхода к выбору препаратов и сроков их применения.
Таким образом, подводя итоги вышеизложенного, можно сделать следующие выводы.
1. Атопическому дерматиту часто сопутствуют различные заболевания кишечника, сопровождающиеся дисбактериозом.
2. Тактика коррекции нарушений микробиоценоза кишечника зависит от степени дисбактериоза, характера кишечной патологии, возраста, длительности заболевания, выраженности атопических проявлений и сопутствующей патологии.
3. Бифи-форм является эффективным комплексным пробиотиком для лечения кишечных дисбактериозов, хорошо воспринимается, не дает побочных явлений (рвота, запоры, усиление аллергических проявлений), оказывает положительное влияние на баланс кишечной микрофлоры в короткие сроки (от пяти дней до двух недель).
4. Применение КИП при лечении дисбактериоза III степени у детей с АД показало его высокую эффективность как в купировании клинических проявлений, так и в восстановлении нормального состава кишечной флоры.
Поговорим о состоянии, которое встречается регулярно, но часто принимается за совсем другие заболевания и соответственно лечится неправильно. Я сам в свое время наделал много ошибок в отношении этого дерматита.
Сложность в том, что дети с данным заболеванием могут попасть и к педиатру, и к гастроэнтерологу, и к дерматологу (кстати, логичнее всего), и даже к аллергологу.
Само заболевание было впервые описано в 1990 году как перианальный стрептококковый дерматит, но после обнаружения и других причинных микробов его стали называть просто “инфекционный”.
Само слово “инфекционный” предполагает возможность передачи от человека к человеку, в том числе в пределах семьи — от ребенка к ребенку или от родителей к ребенку.
Что увеличивает вероятность заболевания?
- повреждения кожи в перианальной области
- плохая гигиена
- плохие жилищные условия и скученность дома
- атопический дерматит
- плохое питание
- хронический диализ — необходимость в процедурах очистки крови из-за почечной недостаточности
Основная причина — поражение кожи стрептококком группы А (GAS).
Этот микроб также может вызывать острый тонзиллофарингит (ангину), скарлатину, острые отиты, пневмонии, менингиты, другие кожные инфекции (импетиго и т.д.)
ПИД могут вызывать также стрептококки других групп (В, С, G), золотистый стафилококк (Staphylococcus aureus), фекальный энтерококк (Enterococcus faecalis).
Кстати, в норме стрептококком группы А на коже промежности не живет, но легко может попасть туда из других областей с рук. Также возможно заражение через стульчаки, в общей бане, через воздух. Для энтерококка типично заражение кожи непосредственно из кишечника самого ребенка.
Замечено, что ПИД часто возникает, если ребенок или кто-то из его близких недавно перенес стрептококковый фарингит/ангину. Бывает, что фарингит уже прошел, микроб из глотки исчез, а инфекция в промежности сохраняется.
Как проявляется перианальный инфекционный дерматит?
- зуд или боль в анусе (чаще всего)
- болезненность при дефекации, иногда из-за этого задержки стула
- выделение слизи и мокнутие в области ануса
- прожилки крови в стуле из трещинок в поврежденной коже
Общее самочувствие обычно не страдает.
Редко из-за сдерживания стула может быть боль в животе за счет перераздутых петель кишечника или непроизвольное отхождение частиц кала.
Если вы сами или врач осмотрите “больное место”, то в глаза бросается выраженное покраснение кожи вокруг ануса (иногда сравнивают с цветом сырого мяса), обычно в 2-4 см вокруг ануса. Могут быть видны маленькие трещинки на поврежденной коже, слизистые наложения.
Иногда инфекция распространяется у девочек на область вульвы, вызывает её воспаление — вульвовагинит. У мальчиков распространяется на половой член, вызывая баланит.
Инфекция может в виде очаговой сыпи быть и на коже ягодиц или даже на более отдаленных участках, обычно при заражении стафилококком.
Как установить причину?
При характерном внешнем виде помогает дополнительно взятие посева с воспаленной кожи. Этот метод помогает установить микроба, вызвавшего дерматит, а также уточнить его чувствительность к антибиотикам.
Для подтверждения стрептококка группы А существует быстрый антигенный тест.
Возможно, вы уже видели, как его используют педиатры и отоларингологи для того, что экстренно решить вопрос о назначения антибиотика при остром воспалении в горле.
Формально тест по инструкции только для горла, но его активно уже используют многие при ПИД. Для стрептококка группы А чувствительность метода 77.9-98.0%, но помним, что иногда вызывают ПИД и другие микробы.
С чем чаще всего можно спутать перианальный инфекционный дерматит ?
Из-за того, что знание этой патологии пока среди врачей недостаточно, диагноз часто выставляется с задержкой (по зарубежной статистике в среднем на полгода)
Вместо ПИД часто выставляют такие диагнозы как:
- кандидоз — грибковое воспаление кожи
- энтеробиоз (острицы)
- анальная трещина
- псориаз
- экзема/атопический дерматит
- болезнь Крона
- пеленочный дерматит
- геморрой
- перианальная аллергия
- дисбактериоз
Чем опасен перианальный инфекционный дерматит?
При отсутствии лечения он продолжает доставлять дискомфорт ребенку, а также увеличивать риск распространения инфекции на другие участки кожи.
Стрептококк группы А может вызывать также особые иммунологические осложнения в виде острого постстрептококкового гломерулонефрита и ревматизма.
Иногда стрептококк может стать триггером для развития некоторых форм псориаза, поэтому при выставлении диагноза каплевидного псориаза обязателен осмотр перианальной зоны. Излечение дерматита может прервать и псориаз.
Как лечить?
Перианальный инфекционный дерматит почти никогда сам не исчезает.
Смогут помочь только антибиотики.
Обсуждается вопрос о лечение местными кожными антибиотиками, но общепринятым методом в мире сейчас считается курс антибиотиков через рот.
Обычно назначаются пенициллин или амоксициллин на 10-14 дней, иногда в сочетании с местными антибиотиками (мупироцин, фузидин).
Если с первого раза не получается уничтожить инфекцию (бывает редко), то лечат защищенным амоксициллином (с клавулановой кислотой), цефалоспоринами, кларитромицином.
Надо учитывать возможность рецидивов при наличии носительства инфекции у других членов семьи. При положительных посевах у них тоже проводится санация (удаление инфекции).
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Диcбактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Дисбактериоз, или дисбиоз – это качественное и количественное изменение микрофлоры в организме. Для него характерно увеличение или резкое уменьшение бактерий, снижение их разнообразия. Дисбактериоз может возникнуть на любом участке, где присутствуют бактерии, включая кожу, влагалище, ротовую полость и т.д.
Микрофлора играет важную роль в поддержании работы иммунной системы, но существует и обратная связь – при серьезном снижении иммунитета возникает дисбактериоз.
Причины появления дисбактериоза
В кишечнике человека присутствует от 70 до 80% клеток иммунной системы. Поэтому любая нестабильность кишечной микрофлоры может нарушить естественные защитные механизмы организма, настроенные против болезней и недомоганий.
Дисбактериоз кишечника связан не только с кишечными расстройствами, но и с множеством других состояний, на первый взгляд не относящихся к пищеварению, – кожными проблемами (акне, экзема), неврологическими расстройствами и т.д.
Среди причин развития дисбактериоза отмечают:
- Увеличение числа болезнетворных бактерий и дрожжевых грибов (например, кандида) и недостаток полезных микроорганизмов.
- Проникновение микроорганизмов, в норме находящихся в толстом отделе кишечника, в тонкий кишечник. Это происходит при хронических заболеваниях, характеризующихся поражением слизистой оболочки желудочно-кишечного тракта (болезнь Крона или неспецифический язвенный колит).
- К другим факторам врачи относят генетическую предрасположенность, несбалансированное питание с низким содержанием клетчатки, но с высоким содержанием сахара и обработанных продуктов, физический и психологический стресс, чрезмерное потребление алкоголя, частое применение антибактериальных препаратов и средств от изжоги, плохую гигиену полости рта.
- Дисбактериоз у практически здоровых лиц:
- возрастной дисбактериоз – изменения микрофлоры у людей пожилого возраста;
- сезонный дисбактериоз – изменения микрофлоры в холодное время года;
- нутритивный дисбактериоз – связанный с несбалансированным питанием;
- профессиональный дисбактериоз – при различных профессиональных вредностях.
- Дисбактериоз, сопровождающий различные заболевания органов пищеварения (желудка, поджелудочной железы, печени и желчевыводящих путей, кишечника, при синдроме мальабсорбции (нарушенном всасывании питательных веществ)).
- Дисбактериоз при других заболеваниях:
- инфекционных,
- иммунодефицитных,
- при гипо- и авитаминозах (уменьшенном поступлении в организм или плохой усвояемости необходимых витаминов),
- при интоксикациях и воздействии на организм человека радионуклидов (радиоактивных изотопов, которые можно встретить в местах с повышенным радиационным фоном, в ограниченном количестве и под строгим контролем они используются для диагностики и лечения некоторых заболеваний).
- Лекарственный дисбактериоз. Возникает вследствие приема антибиотиков, иммунодепрессантов, антацидов, антисекреторных, слабительных средств, химиотерапии и других лекарственных препаратов.
- Стрессорный дисбактериоз. Возникает как результат длительного эмоционального или физического стресса.
- Бессимптомная форма дисбактериоза.
- Локальная, или местная форма дисбактериоза. Наблюдается при развитии локального воспалительного процесса в кишечнике (у больного появляются симптомы колита или энтерита – воспалительных заболеваний толстого или тонкого кишечника).
- Распространенная форма дисбактериоза. Проявляется выраженными нарушениями пищеварения.
- 1-я степень тяжести;
- 2-я степень тяжести;
- 3-я степень тяжести;
- 4-я степень тяжести.
- искусственное вскармливание, нарушение питания кормящей матери, а также раннее введение прикорма и продуктов, не соответствующих возрасту ребенка;
- нехватка пищеварительных ферментов приводит к тому, что непереваренные остатки пищи подвергаются брожению и служат субстратом для роста болезнетворных микробов;
- снижение тонуса или спазмы гладких мышц кишечника (вегетовисцеральные нарушения, дискинезия, вегетососудистая дистония);
- недостаток веществ в рационе, служащих субстратом для роста полезных микробов или присутствие некоторых продуктов, способствующих их гибели. Дефицит в рационе человека кисломолочных продуктов и растительной клетчатки лишает полезную флору питательной среды;
- присутствие в кишечнике паразитов (глисты, простейшие), губительно влияющих на полезную микрофлору;
- прием современных лекарственных средств, снижающих желудочную секрецию (блокаторы Н2-гистаминовых рецепторов), которые также способны, хотя и косвенно, снизить резистентность естественной кишечной микрофлоры;
- применение цитостатиков, глюкокортикоидов, снижающих имму-норезистентность организма.
Симптомы дисбактериоза зависят от формы и степени тяжести течения заболевания. Пациенты могут предъявлять жалобы на расстройство желудка, тошноту, диарею или запор, повышенное газообразование и вздутие живота, снижение аппетита, необъяснимую усталость и проблемы с концентрацией внимания, неприятный запах изо рта, высыпания на коже.
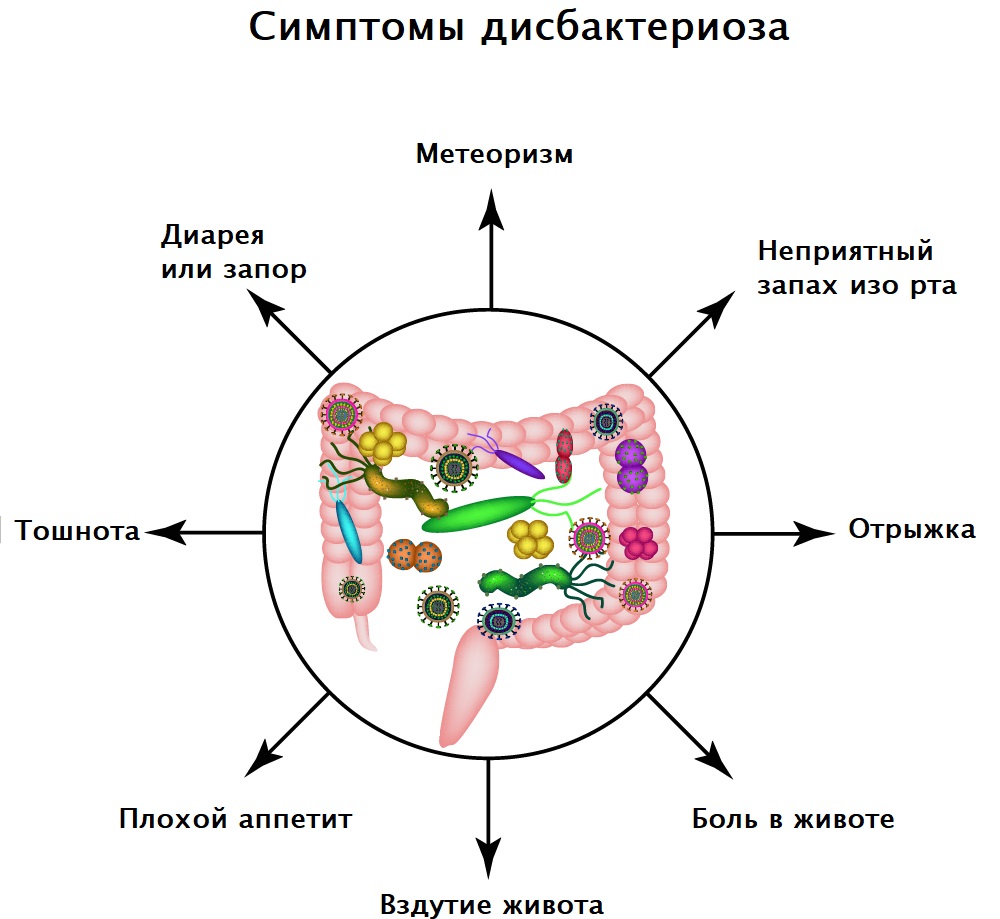
Диагностика заболевания
При постановке диагноза врач обращает внимание на жалобы, симптомы заболевания и результаты осмотра. Но для оценки степени тяжести дисбактериоза обычно требуются лабораторные и инструментальные обследования.
-
Клинический анализ крови с развернутой лейкоцитарной формулой.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Проблема атопического дерматита (АД) приобретает в последние годы все большее медико-социальное значение, так как распространенность заболевания неуклонно растет. По современным представлениям АД — мультифакториальное заболевание, развитие которого тесно
Проблема атопического дерматита (АД) приобретает в последние годы все большее медико-социальное значение, так как распространенность заболевания неуклонно растет. По современным представлениям АД — мультифакториальное заболевание, развитие которого тесно связано с генетическими дефектами иммунного ответа и отрицательными влияниями неблагоприятных воздействий внешней среды. Установлено, что действие этих факторов определяет темпы развития АД, особенно у детей раннего возраста. Значимым фактором риска АД является патология органов желудочно-кишечного тракта, особенно дисбиоз кишечника, который выявляется у 89–94,1% детей, больных АД [2, 3, 11]. Несомненно, кишечная микрофлора, неся большую функциональную нагрузку, не может не участвовать в возникновении и поддержании патологических расстройств при АД.
В первую очередь необходимо в полной мере оценить ту значительную роль, которую играет нормофлора кишечника в организме человека. Масса всех микробов, живущих в кишечнике одного человека, составляет около двух килограммов. В состав флоры содержимого толстого кишечника входят анаэробные и аэробные бактерии. Нормальная микрофлора на 95% состоит из анаэробных видов бактерий, главными из которых являются бифидобактерии и лактобактерии. Аэробные бактерии, представленные кишечными палочками, энтерококками и др., составляют сопутствующую микрофлору. К остаточной микрофлоре относят стафилококки, клостридии, протей, грибы. Самые многочисленные и незаменимые представители полезной микрофлоры — это бифидобактерии.
Бифидобактерии стимулируют перистальтику, предупреждая нарушения стула, повышают иммунитет организма, разлагают некоторые канцерогены и вырабатывают витамины. Типичными продуктами жизнедеятельности бифидобактерий являются молочная, уксусная, муравьиная и янтарная кислоты, аминокислоты и белки, витамины В1, В2, К, никотиновая, пантотеновая и фолиевая кислоты, пиридоксин, цианокобаламин. Производя молочную и уксусную кислоту, они препятствуют размножению патогенных микроорганизмов. Бифидобактерии стимулируют лимфоидный аппарат человека и участвуют в синтезе иммуноглобулинов. В клеточной стенке данных бактерий содержится большое количество мурамил-дипептида, который активирует образование В- и Т-лимфоцитов и макрофагов. Данные бактерии являются естественными биосорбентами и способны накапливать значительное количество соединений тяжелых металлов, фенолы, формальдегиды и другие токсичные вещества, попадающие в организм хозяина из окружающей среды и влияющие на снижение иммунитета [1, 2].
Еще одна группа полезных микроорганизмов — это лактобактерии, без участия которых нельзя представить нормальную жизнедеятельность организма. Лактобациллы заселяют организм новорожденного ребенка в раннем постнатальном периоде. Средой обитания лактобацилл являются различные отделы желудочно-кишечного тракта, начиная с полости рта и кончая толстой кишкой. Например, лактобациллы (Lactobacillus acitophilus) обеспечивают своевременное опорожнение кишечника.
Кишечные палочки и энтерококки можно отнести к нейтральной микрофлоре, поскольку пока нет доказательств их благотворного влияния на организм. Вполне вероятно, что эти микроорганизмы отвечают за противовирусный иммунитет. По мнению некоторых авторов, благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина, микрофлора приобретает способность перехвата и выведения некоторых вирусов [1, 2]. Известен ряд бактерий, имеющих высокую активность нитратредуктазы (пропионибактерии, пептококки, вейлонеллы, грамотрицательные энтеробактерии и другие), которые предотвращают развитие метгемоглобинемии при высоком содержании нитратов. Особенно это важно у детей раннего детского возраста, имеющих высокую долю фетального гемоглобина [9].
Обильно развивается гнилостная или бродильная флора, грибы, преимущественно рода Candida, в кишечнике могут обнаруживаться микроорганизмы, в норме нехарактерные для него. Они не способны выполнять многие физиологические функции, присущие нормальной микрофлоре, и, в частности, утрачивается способность инактивировать токсические продукты кишечного содержимого, нарушается поглощающая способность кишечника [1, 2]. Таким образом, дисбактериоз кишечника у больных АД нарушает ферментный статус пищеварительного тракта, создавая условия для развития патологии полостного, пристеночного и мембранного пищеварения и всасывания. Происходит повышенное поступление бактериальных и инфекционных аллергенов в организм ребенка. Значительно повышенная антигенная стимуляция недорасщепленными макромолекулами пищевых веществ и бактериальными аллергенами, при слабости иммунного ответа и неспособности организма к элиминации комплексов антиген–антитело, приводит к отягощению АД.
До сих пор дискутируется вопрос: что первично — атопический дерматит или дисбактериоз кишечника? Многие исследователи в своих наблюдениях пытались ответить на этот вопрос, однако противоречия существуют до настоящего времени. Например, у младенцев с АД чаще, чем у здоровых детей, обнаруживается повышение содержания бактероидов и пониженный уровень бифидобактерий в фекалиях. Тот факт, что различия в микрофлоре у здорового ребенка и с аллергией определяются еще на доклинической стадии, свидетельствует о том, что изменения микрофлоры являются первичными, а не вторичными по отношению к аллергии [5].
Данное обстоятельство повлекло за собой предположение, что профилактическое назначение пробиотика беременным женщинам могло бы предотвратить развитие атопии в первые два года жизни ребенка. Подтверждение этой теории получили отечественные исследователи, которые установили, что у детей, рожденных от матерей, получивших пробиотики в виде первичной профилактики аллергических заболеваний, отмечается тенденция к более редкой встречаемости аллергических высыпаний на первом году жизни, реже диагностируется АД [5]. Тем не менее, диаметрально противоположное мнение существует у зарубежных авторов. Karla Gale (2010) провел обширное обследование 415 беременных женщин, получивших пробиотическое молоко или плацебо в срок с 36 недель беременности до трех месяцев постнатального периода кормления грудью. В возрасте двух лет дети, рожденные от таких матерей, были обследованы на наличие атопии (АД, бронхиальная астма и аллергический риноконъюктивит). Статистический анализ не выявил достоверной разницы между группами сравнения, следовательно, по мнению автора, употребление пробиотиков беременными и кормящими матерями не имеет никого смысла для предотвращения развития атопии у детей [19].
Большинство исследователей склоны считать, что в реализации дисбактериоза участвуют искусственное вскармливание, нарушение питания кормящей матери, а также раннее введение прикорма и продуктов, не соответствующих возрасту ребенка, которые впоследствии являются триггерными факторами в осуществлении генетического дефекта иммунного ответа при АД [6, 8, 10, 15, 21]. Становление микробного биоценоза ребенка начинается с первых этапов жизни. Во время родов при заглатывании происходит поступление микрофлоры родовых путей матери и колонизация вагинальной флоры в пищеварительной системе ребенка, что обеспечивает предупреждение развития дисбактериоза у новорожденного. Начиная с 4-го дня жизни в толстой кишке новорожденного определяются лактобактерии, эшерихии, стрептококки, стафилококки. Флора ребенка первого года жизни находится в прямой зависимости от характера вскармливания. У детей, получающих искусственное вскармливание, чаще и в более высоких титрах появляются бактероиды и вейлонеллы. При избыточном количестве последних может отмечаться повышенное газообразование, развитие диспепсических проявлений [7].
Резюмируя разнообразные и противоречивые данные литературы, до сих пор остается открытым вопрос о причинно-следственной связи развития дисбактериоза у детей с АД. Можно предположить несколько причин, которые могут быть прямыми или косвенными обстоятельствами гибели полезных бактерий у таких больных:
В первую очередь нельзя гиперболизировать данный синдром, а необходимо верифицировать патологию ЖКТ, приведшую к его нарушениям. Назначение адекватной диагностической программы позволит правильно оценить ситуацию и проводить как этиопатогенетическое лечение основной патологии, так и коррекцию микроэкологических нарушений. Это приведет не только к повышению эффективности лечения, но и позволит снизить стоимость лечения и избежать полипрагмазии [1]. Лабораторная диагностика дисбактериоза чаще всего базируется на микробиологическом анализе фекалий. Микробиологическими критериями служат снижение бифидолактобактерий, снижение или увеличение эшерихий, появление штаммов с измененными свойствами, повышение количества кокков, обнаружение условно-патогенных грамотрицательных палочек, а также грибов и клостридий более 10 3 КОЕ/л. В анализах возможны различные сочетания указанных сдвигов [7].
Современные принципы лечебной коррекции дисбиотических сдвигов и восстановления эубиоза включают более широкий арсенал мероприятий, чем только назначение фармакологических препаратов. Особое внимание следует уделять режиму питания и диете больного ребенка, так как с нормализацией среды обитания активизируется метаболизм и увеличивается численность облигатной микрофлоры. Доказательством этому служит неожиданный результат исследования, проведенного Усовой О. В. (2005). По данным автора, дети, проживающие в условиях строгого режимного и диетологического контроля (детский дом), несмотря на крайне неблагополучный преморбидный фон, значительно реже и в более легкой форме болеют кишечным дисбактериозом, чем социально благополучные дети [15].
Диета, как правило, позволяет восстановить нормальное пищеварение в течение двух месяцев. Учитывая, что АД у детей раннего возраста в 73% случаев развивается за счет сенсибилизации к белкам коровьего молока, перспективным является использование адаптированных диетологических продуктов со сменой источников и структуры белка: белок козьего молока, гидролизованный белок коровьего молока, белок сои и т. д. [10]. У детей постарше диета во время лечения должна содержать минимум углеводистой пищи. Функциональное питание с большим количеством балластных веществ (пищевые волокна, отруби), продукты, обогащенные живыми культурами бактерий (кефир, кисломолочные смеси, йогурты и др.). Для полного преодоления дисбактериоза нужно употреблять больше растительной пищи. Очень полезна диета, в состав которой входят продукты, подавляющие гнилостные процессы в кишечнике: абрикосы, черная смородина, рябина, клюква, тмин, при условии, что у ребенка с АД нет пищевой аллергии к этим продуктам.
При грибковых дисбактериозах необходимо отказаться от всего, что содержит дрожжевые культуры, — винограда, изюма, кваса, свежего хлеба, сыра, грибкового кефира. Неблагоприятно действует на кишечную флору систематическое употребление рафинированных, консервированных продуктов, дрожжей, копченостей. Наибольших успехов в этом направлении достигли японские исследователи, которые считают развитие индустрии функционального питания самым перспективным направлением в решении проблемы ликвидации дисбактериоза. Сейчас в Японии, вышедшей на первое место по средней продолжительности жизни, 30% продуктов питания ферментируется или обогащается живыми бифидобактериями.
Большой интерес представляет развитие нового направления в лечении дисбактериоза — терапия пребиотиками. Препараты этой группы выделены из естественных источников, обладают определенными регулирующими функциями и в скором времени будут конкурировать на рынке с многими лекарственными препаратами. В отличие от пробиотиков, которые вносят пробиотические бактерии извне, пребиотики выступают питательной средой для восстановления собственной полезной микрофлоры организма. Исследования на добровольцах показывают, что аутомикроорганизмы обеспечивают более быстрое восстановление нормального состояния микрофлоры кишечника, чем вводимые извне [20]. Основой пребиотиков явлются препараты, содержащие бифидогенные факторы, стимулирующие рост и развитие полезных бактерий (лактулоза, соевый олигосахарид, ксилобиоза и др.), с практической стороны хорошо зарекомендовали себя препараты, содержащие лактулозу. Идеальным сочетанием являются лекарственные средства, содержащие пребиотики и адсорбенты.
Адсорбенты выводят из организма токсичные вещества и уменьшают метеоризм, как правило, наблюдающийся при дисбактериозе. В частности, таким условиям удовлетворяет лекарственный препарат Лактофильтрум, содержащий пребиотик и сорбент. Лактулоза, входящая в состав препарата Лактофильтрум, является синтетическим стереоизомером молочного сахара — лактозы. Продукты бактериального метаболизма лактулозы сдвигают pH среды в толстой кишке в кислую сторону, угнетая тем самым размножение патогенных микроорганизмов и процессы гниения. Во-вторых, являясь пищевым субстратом для бактерий, лактулоза стимулирует рост бифидобактерий и лактобактерий. Вторая составляющая препарата Лактофильтрум — лигнин, который представляет собой сложное природное органическое соединение, продукт гидролизной переработки древесины. Лигнин за счет большой площади поверхности и развитой системы пор обладает высокой сорбционной емкостью и, таким образом, способен выводить из организма токсины, аллергены и патогенную микрофлору.
Для лечения дисбактериоза используются также препараты, улучшающие пищеварение (например, ферментный препарат Микразим и др.).
Для нормализации сократительной способности кишечной стенки применяется иглорефлексотерапия, специальные системы массажа и самомассажа живота [17]. Одновременно с лечением дисбактериоза лечатся нарушения пищеварения, глистные инвазии.
Несмотря на то, что до настоящего времени существует много нераскрытых вопросов этиологии и патогенеза развития дисбактериоза у больных АД, ясным является то, что кишечная микрофлора, неся большую функциональную нагрузку, участвует в возникновении и поддержании патологических расстройств при АД. Данный факт обязывает врачей корректировать эти нарушения с учетом режима и характера питания, используя современные комбинированные средства (Лактофильтрум), содержащие пребиотики и энтеросорбенты.
Литература
Ю. А. Галлямова, доктор медицинских наук, профессор
РМАПО, Москва
Читайте также:

