Перинатальный путь передачи инфекции это
Обновлено: 23.04.2024
Клиника внутриутробной инфекции. Перинатальные поражения нервной системы у новорожденных
Клинические проявления внутриутробных инфекций полиморфны и зависят не столько от этиологии/сколько от локализации и тяжести процесса. Наиболее типичны задержка внутриутробного развития, гепатомегалия, спленомегалия, желтуха, сыпь, синдром дыхательных расстройств, сердечнососудистая недостаточность и неврологические нарушения. Тяжесть клинических проявлений в большей мере зависит от того, на каких сроках гестации произошло инфицирование.
При развитии инфекции во второй половине беременности заболевание у новорожденного клинически манифестирует как генерализованная инфекция или как поражение отдельных органов. У всех наблюдавшихся больных, госпитализированных в Центр детской гепатогии с перинатальной патологией гепато-билиарной системы, были выражены и поражения центральной нервной системы, по поводу которых они получали специальное обследование и лечение невропатолога.
Последствия перинатальных инфекционных заболеваний ЦНС в плане этиологии и патогенетической основы рассматриваются как:
1) поражения вследствие перенесенного (врожденного) энцефалита, менингита, менингоэнцефалита (TORCH-синдром — цитомегаловирусная инфекция, герпетическая инфекция, токсоплазмоз, врожденная краснуха, ECHO — вирусы и другие, сифилис);
2) поражения ЦНС вследствие перенесенного неонатального сепсиса (менингит, менингоэнцефалит, вентрикулит, энцефалит).
Варианты клинических форм в первой группе — перинатальное постинфекционное (врожденное) органическое поражение мозга с различными клиническими синдромами, исходы которых могут варьировать от легких до тяжелых форм умственной отсталости, ДЦП, симптоматических резистентных эпилепсии. Варианты клинических форм во второй группе — постинфекционная
3) энцефалопатия или постинфекционное поражение ЦНС, проявляющиеся клиническими синдромами гидроцефалии, гиперактивного поведения, нарушений (задержки) моторного развития, очаговых нарушений (парезы и параличи), тяжелых нарушений моторного развития (формирующиеся и сформированные ДЦП) и другими. Исходы поражений ЦНС зависят от ранней диагностики и определяются своевременностью адекватной терапии, могут варьировать от легких функциональных до тяжелых психоневрологигеских нарушений.
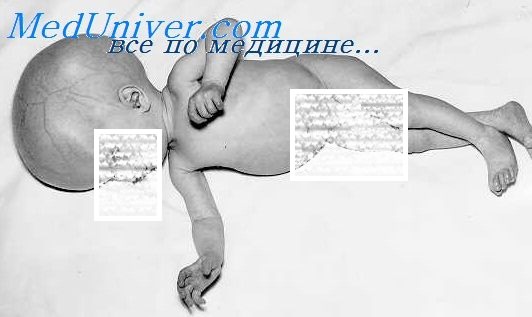
Новорожденный с врожденным токсоплазмозом
Целью исследований К. Е. Скляр с соавторами было выявление клинико-патогенетических закономерностей формирования врожденных пороков развития при внутриутробной инфекции у новорожденных. Проведено обследование 86 новорожденных с врожденными пороками развития различной локализации (у 50 % — врожденные пороки сердца) и клиническими признаками внутриутробной инфекции. Положительные результаты ПЦР получены у 43 (53 %) детей, в том числе РНК краснухи — у 36, ДНК токсоплазмоза — у 2, ДНК хламидий и вируса простого герпеса — в двух случаях, смешанная инфекция — у трех.
Анализ анамнестических данных и клинического течения заболевания не позволил авторам выделить каких-либо симптомов, соответствующих этиологии инфекции. У 30 (34,9%) оперативное лечение проведено в периоде новорожденности, из них — у 8 (9,3 %) в первые сутки после рождения. При морфологическом исследовании интраоперационно полученных биоптатов выявлены нарушения гистоархитектоники, склеротические и дистрофические явления, признаки нарушения локального кровообращения. Развитие указанных процессов в органах, по всей видимости, отражает исход инфекционного процесса.
По мнению авторов, именно склеротические процессы в аномальных тканях могут оказывать влияние на дальнейшее развитие детей и проявляться в различных формах хронических состояний, в том числе хронического гепатита и атрезии желчевыводящих путей при поражении пегени.
Желтуха и поражение печени наряду с поражением центральной нервной системы — ведущие клинические признаки большинства перинатальных инфекций.
В подтверждении диагноза и выяснении этиологии поражения пегени у новорожденных велика ответственность спектра, кагества проведения и клинического толкования результатов лабораторных исследований. Характеристика диагностических методов внутриутробной инфекции, применяемых в повседневной практике, предполагает определение титра специфических антител IgG в динамике (если он не снижается в возрасте от 6 до 12 недель, диагностируется врожденная инфекция). В 6 месяцев титр пассивно приобретенных от матери антител должен быть не выше 1:8.
Однако диагностика иммунохимическими методами у беременных и новорожденных может быть затруднена из-за недостаточной выработки специфических маркеров острой инфекции — антител класса IgM, трансплацентарной передачи антител класса IgG, низкого уровня продукции антигенов. В связи с этим клиническую значимость приобретает метод полимеразной цепной реакции.
Диагностика предполагает использование методов этиологической расшифровки с помощью генодиагностики. В то же время выявление ДНК вируса и тем более микоплазм и хламидий не может служить основанием для верификации этиологии инфекции и назначения лечения. Е. М. Малковой с соавторами из 117 новорожденных с признаками ВУИ у 112 обнаружены ДНК 26 возбудителей. Отмечено значительное количество вирусно-вирусных, микоплазменно-вирусных, вирусно-вирусно-микоплазменных, вирусно-хламидийных и прочих ассоциаций, составивших 22,1% среди положительных результатов исследований.
Клиническая картина не имела специфических признаков, была выраженной дыхательная недостаточность с развитием пневмонии, раннее и затяжное тегение желтухи, неврологические нарушения. Развитие фетального гепатита преобладало при сочетанных инфекциях. Наиболее тяжелое состояние отмечалось у детей при положительных результатах ПЦР сразу в нескольких биоматериалах. Необходимость терапии латентных форм заболеваний у новорожденных при детекции ДНК возбудителей определяется способностью многих из них длительно сохраняться в условиях иммунокомпетентного организма (персистировать с сохранением патогенных свойств).
При изменении иммунного статуса происходит быстрое восстановление вирулентности, которое становится основой рецидивирующего характера хронических инфекций и возможной инвалидизации ребенка. Однако, по данным авторов, результаты ПЦР-иследований у беременных женщин и их детей совпали только в 33,3 % слугаев, поэтому их трактовка, с нашей тогки зрения, должна быть осторожной.
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
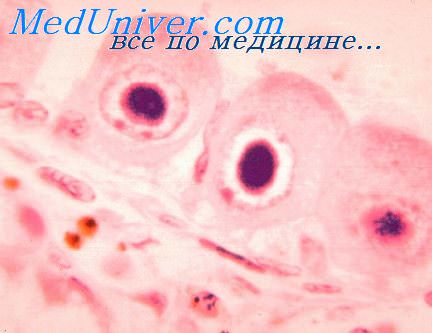
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Перинатальные инфекции: виды, возбудители, клиника, диагностика
Перинатальные инфекции: бактериемия и пневмония. В первые дни жизни новорождённого существует лишь несколько характерных клинических симптомов, указывающих на бактериемию: увеличение количества нейтрофилов (этот показатель не всегда диагностически значим), уменьшение содержания тромбоцитов, брадикардия, повышение концентрации С-реактивного белка.
Развитие менингита не считают характерным признаком инфекции. Для установления окончательного диагноза для анализа отбирают кровь, мочу и спинномозговую жидкость, но лечение необходимо начать до получения результатов. Основное направление медикаментозной терапии — эрадикация Escherichia coli и стрептококка группы В (бензилпенициллин в сочетании с гентамицином или цефотаксимом).
В некоторых странах исследование на стрептококк группы В проводят ещё во время беременности и иногда назначают профилактический интранатальный курс антибиотикотерапии пенициллином. В других регионах обследуют только женщин из группы риска.
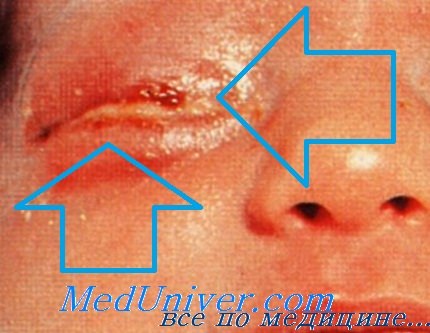
Гонококковая бленнорея у новорожденного
Перинатальные инфекции: гонококковая бленнорея новорождённых. Во время родов может произойти заражение Neisseria gonorrhoeae, вызывающей бленнорею новорождённых (гнойный конъюнктивит). Диагноз устанавливают после микроскопии мазков, окрашенных по Граму. Для лечения системной инфекции применяют пенициллин или цефотаксим (при возникновении устойчивости).
Перинатальные инфекции: хламидиоз. Хламидийная бленнорея новорождённых — тяжелейший конъюнктивит, возникающий в течение первых четырёх дней жизни. На исходе 6-й нед обычно развивается пневмония, характеризующаяся учащением дыхания и кашлем. Для лечения конъюнктивита применяют местные лекарственные средства, содержащие тетрациклин. При хламидийной пневмонии препаратом выбора считают эритромицин.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник ВИЧ-инфекции — зараженный человек, находящийся в любой стадии болезни, в том числе и в периоде инкубации. Наиболее вероятна передача ВИЧ от человека, находящегося в конце инкубационного периода, в периоде первичных проявлений и в поздней стадии инфекции, когда концентрация вируса достигает своего максимума.
Пути передачи (30 ноября 2009) Источник ВИЧ-инфекции — зараженный человек, находящийся в любой стадии болезни, в том числе и в периоде инкубации. Наиболее вероятна передача ВИЧ от человека, находящегося в конце инкубационного периода, в периоде первичных проявлений и в поздней стадии инфекции, когда концентрация вируса достигает своего максимума.
Источник ВИЧ-инфекции — зараженный человек, находящийся в любой стадии болезни, в том числе и в периоде инкубации. Наиболее вероятна передача ВИЧ от человека, находящегося в конце инкубационного периода, в периоде первичных проявлений и в поздней стадии инфекции, когда концентрация вируса достигает своего максимума. ВИЧ-инфекция относится к долго текущим заболеваниям, С момента заражения до момента смерти может пройти от 2-3 до 10-15 лет. Естественно, что это усредненные показатели.
Биологические субстраты человека, содержащие ВИЧ
Биологические субстраты человека, содержащие ВИЧ и имеющие наибольшее эпидемиологическое значение в распространении ВИЧ-инфекции:
- кровь
- сперма и предъэякулят
- вагинальный и цервикальный секрет
- материнское грудное молоко
Вирус может находиться и в других субстратах (но его концентрация в них мала или субстрат недоступен, как, например, ликвор):
- спинномозговая жидкость (ликвор)
- моча
- слюна
- слезная жидкость
- секрет потовых желез
Восприимчивость к ВИЧ
Различное содержание ВИЧ в биологических жидкостях определяет их эпидемиологическое значение в качестве факторов реализующих путь передачи возбудителя. Восприимчивость к ВИЧ у людей всеобщая и определяется гено-, фенотипическим полиморфизмом индивидуумов, что может проявиться как в полном (или неполном) ограничении возможности инфицирования ВИЧ, так и в ускорении либо снижении темпов развития клинических симптомов инфекции. В ходе эпидемиологического анализа глобальной ситуации в отношении ВИЧ-инфекции было установлено, что существуют определенные межрасовые различия в динамике заражения и прогрессирования ВИЧ-инфекции, при этом доминирующая роль принадлежит антигенам главного комплекса гистосовместимости.
Оказалось, что наиболее чувствительными (восприимчивыми) к ВИЧ были представители негроидной расы, менее — европейцы и наименее — монголоиды. В настоящее время описаны три гена (CCR5, CCR2 и SDF1), контролирующих синтез молекул и участвующих в проникновении ВИЧ в клетки хозяина, т.е. люди с гомозиготной формой по этим генам устойчивы к заражению ВИЧ половым путем, а с гетерозиготной — несколько менее устойчивы. Однако этот признак не ассоциируется с невосприимчивостью к ВИЧ при переливании крови и употреблении психоактивных веществ парентерально.
Механизмы передачи ВИЧ
Для передачи ВИЧ необходимо не только наличие источника инфекции и восприимчивого субъекта, но и возникновение соответствующих условий, обеспечивающих эту передачу. С одной стороны, выделение ВИЧ из инфицированного организма в естественных ситуациях происходит ограниченными путями: со спермой, выделениями половых путей, с грудным молоком, а в патологических условиях — с кровью и различными экссудатами. С другой стороны, для заражения ВИЧ с последующим развитием инфекционного процесса необходимо попадание возбудителя во внутренние среды организма. Передача ВИЧ осуществляется следующими механизмами:
- Естественными — контактным
- Вертикальным
- Искусственным (артифициальным)
Пути реализации механизмов передачи возбудителя разнообразны:
- Половой
- Трансплацентарный
- Парентеральный (инъекционный, трансфузионный, трансплантационный)
Доминирующим механизмом передачи возбудителя является контактный, реализуемый половым путем. Ведущая роль полового пути передачи обусловлена высокой концентрацией вируса в сперме и вагинальном секрете инфицированных лиц. Считают, что на долю полового пути передачи вируса приходится 86 % всех случаев заражения, из них 71 % — при гетеросексуальных и 15 % — гомосексуальных контактах. Реальность передачи ВИЧ в направлении мужчина–мужчине, мужчина–женщине и женщина–мужчине общепризнанна. В то же время соотношение инфицированных мужчин и женщин различно. В начале эпидемии это соотношение было 5:1, затем 3:1, сейчас на территории России этот показатель приблизился к 2:1.
Заражение ребенка
Вертикальный механизм передачи ВИЧ реализуется у инфицированных беременных (антенатальный путь). Заражение ребенка может произойти и во время акта родов (интранатальный путь), а затем постнатально, при грудном вскармливании. Основной путь заражения ВИЧ-инфекцией новорожденных — перинатальный. Удельный вес передачи ВИЧ в разные сроки перинатального периода точно не определен, однако внутриутробное инфицирование на ранних сроках беременности происходит в 30-50 %% случаев при отсутствии профилактики перинатальной передачи ВИЧ. Вероятность инфицирования ребенка при грудном вскармливании составляет около 12-20 %%. Причем передача вируса может происходить не только от инфицированной матери ребенку, но и от инфицированного ребенка кормящей женщине в случае, если ребенок, рожденный здоровой женщиной, был инфицирован ВИЧ, как это было описано при эпидемиологическом расследовании внутрибольничной вспышки в г. Элисте.
Другие пути передачи
Вирус иммунодефицита передается при переливании инфицированной цельной крови и изготовленных из нее продуктов (эритроцитарной массы, тромбоцитов, свежей и замороженной плазмы). При переливании крови от ВИЧ-серопозитивных доноров реципиенты инфицируются в 90% случаев. Нормальный человеческий иммуноглобулин, альбумин не представляют опасности, т.к. технология получения этих препаратов и этапы контроля сырья исключают инфицированность ВИЧ. Относительно редким, но возможным вариантом заражения являются трансплантация органов, тканей и искусственное оплодотворение женщин. Передача ВИЧ воздушно-капельным, пищевым, водным, трансмиссивным путями не доказана. "Искусственный" (артифициальный) механизм срабатывает при проведении медицинских манипуляций, сопровождаемых нарушением целостности кожных покровов и слизистых оболочек, т.е. реализуется внутрибольничное инфицирование ВИЧ. Данный механизм имеет разнообразные пути и факторы передачи возбудителя, однако при ВИЧ-инфекции роль этого механизма распространения ВИЧ ничтожно мала. В настоящее время этот путь распространения ВИЧ-инфекции не реализуется в силу того, что введен строгий контроль препаратов крови и проведения всех инвазивных диагностических вмешательств с соблюдением предстерилизационной очистки и стерилизации медицинского инструментария, применения одноразовых медицинских инструментов (например, шприцы). Однако, парентеральная ("шприцевая") передача ВИЧ достаточно широко распространена среди наркоманов, употребляющих психоактивные вещества внутривенно. Степень риска инфицирования ВИЧ неодинакова для различных групп населения, соответственно можно выделить контингенты высокого риска заражения: гомо–, бисексуалы, "инъекционные наркоманы", реципиенты крови и её продуктов, проститутки, бродяги, сторонники свободной любви, персонал гостиниц, воздушных линий международного транспорта, военнослужащие, моряки, иммигранты, беженцы, сезонные рабочие, туристы. Роль и значение этих факторов риска неоднозначны, часто отмечается их сочетанное действие, и вычленить ведущий из единого комплекса факторов риска, действующих на территории в данное время, не представляется возможным.
Читайте также:

