Перивентрикулярная и субкортикальная лейкоэнцефалопатия у новорожденных
Обновлено: 25.04.2024
Лейкоэнцефалопатия — хроническая прогрессирующая патология, обусловленная деструкцией белого вещества головного мозга и приводящая к старческой деменции или слабоумию. Заболевание имеет несколько равнозначных названий: энцефалопатия Бинсвангера или болезнь Бинсвангера. Автор впервые описал патологию в 1894 году и дал ей свое имя. Наряду с сосудистой лейкоэнцефалопатией, в последние годы свое распространение получает прогрессивная мультифокальная лейкоэнцефалопатия (ПМЛ) – заболевание вирусной этиологии.
Гибель нервных клеток, вызванная нарушением кровоснабжения и гипоксией мозга, приводит к развитию микроангиопатии. Лейкоареоз и лакунарные инфаркты изменяют плотность белого вещества и указывают на имеющиеся в организме проблемы с циркуляцией крови.
Клиника лейкоэнцефалопатии зависит от степени тяжести и проявляется различной симптоматикой. Обычно признаки подкорковой и лобной дисфункции сочетаются с эпиприпадками. Течение патологии хроническое, характеризующееся частой сменой периода стабилизации и обострения. Лейкоэнцефалопатия встречается преимущественно у пожилых людей. Прогноз заболевания неблагоприятный: быстро развивается тяжелая инвалидизация.
Формы лейкоэнцефалопатии
Мелкоочаговая лейкоэнцефалопатия
Мелкоочаговая лейкоэнцефалопатия — хроническое заболевание сосудистого происхождения, основной причиной которого является гипертония. Стойкая гипертензия приводит к постепенному поражению белого вещества мозга.
В наибольшей степени развитию лейкоэнцефалопатии сосудистого генеза подвержены мужчины в возрасте 55 лет и старше с наследственной предрасположенностью. Сосудистая лейкоэнцефалопатия – хроническая патология сосудов головного мозга, приводящая к поражению белого вещества и развивающаяся на фоне стойкой гипертензии.
О сосудистых энцефалопатиях рекомендуем подробную информацию по ссылке.
Прогрессирующая мультифокальная лейкоэнцефалопатия
Прогрессирующая мультифокальная энцефалопатия – вирусное поражение ЦНС, приводящее у иммунологически скомпрометированных лиц к разрушению белого вещества. Вирусы еще больше подавляют иммунную защиту, развивается иммунодефицит.

поражение белого вещества мозга при лейкоэнцефалопатии
Эта форма патологии является самой опасной и часто заканчивается смертью больного. Но с созданием и совершенствованием антиретровирусной терапии распространенность заболевания уменьшились в несколько раз.
Прогрессирующая мультифокальная лейкоэнцефалопатия поражает больных врожденным или приобретенным иммунодефицитом. Патологию обнаруживают у 5 % ВИЧ-инфицированных больных и у 50% больных СПИДом.
Симптоматика заболевания многообразна. Когнитивные нарушения варьируются от легкой дисфункции до выраженной деменции. Очаговая неврологическая симптоматика характеризуется нарушением речи и зрения вплоть до слепоты, а отдельные двигательные расстройства быстро прогрессируют и часто приводят к тяжелой инвалидности.
Перивентрикулярная лейкоэнцефалопатия
Перивентрикулярная форма – поражение подкорковых мозговых структур, возникающее на фоне хронической гипоксии и острой сосудистой недостаточности. Очаги ишемии беспорядочно разбросаны в структурах нервной системы и в основном веществе мозга. Заболевание начинается с поражения двигательных ядер продолговатого мозга.
Лейкоэнцефалопатия с исчезающим белым веществом
Лейкоэнцефалопатия с исчезающим белым веществом — генетически обусловленная патология, причиной которой является мутация в генах. Классическая форма заболевания впервые проявляется у детей 2 – 6 лет.
У больных прогрессируют: мозжечковая атаксия, тетрапарезы, мышечная недостаточность, когнитивные расстройства, оптическая атрофия, эпиприступы. У младенцев нарушается процесс вскармливания, возникает рвота, лихорадка, задерживается психомоторное развитие, повышается возбудимость, развивается гипертонус конечностей, судорожный синдром, ночная задержка дыхания, кома.
Причины
В большинстве случаев лейкоэнцефалопатия – следствие стойкой гипертонии. Пациенты – пожилые люди, с сопутствующим атеросклерозом и ангиопатиями.
Другие заболевания, осложняющиеся возникновением лейкоэнцефалопатии:
- Синдром приобретенного иммунодефицита,
- Лейкоз и другие онкологические заболевания крови,
- Лимфогранулематоз,
- Туберкулез легких,
- Саркаидоз,
- Раковые опухоли внутренних органов,
- Длительный прием иммунодепрессантов также провоцирует развитие данной патологии.
Рассмотрим развитие поражения мозга на примере прогрессирующей мультифокальной энцефалопатии.
Вирусы, ставшие причиной ПМЛ тропны к нервных клеткам. Они содержат двухцепочечную кольцевую ДНК и избирательно поражают астроциты и олигодендроциты, синтезирующие миелиновые волокна. В ЦНС появляются очаги демиелинизации, нервные клетки увеличиваются и деформируются. Серое вещество мозга в патологию не вовлекается и остается абсолютно незатронутым. Белое вещество изменяет свою структуру, становится мягким и студенистым, на нем появляются многочисленные маленькие впадины. Олигодендроциты становятся пенистыми, астроциты приобретают неправильную форму.

поражение мозга при прогрессирующей мультифокальной лейкоэнцефалопатии
Полиомавирусы – мелкие микробы, лишенные суперкапсида. Они являются онкогенными, находятся в организме хозяина длительно в латентном состоянии и не вызывают болезнь. При снижении иммунной защиты эти микробы становятся возбудителями смертельно опасного заболевания. Выделение вирусов — сложнейшая процедура, которая проводится только в специализированных лабораториях. С помощью электронной микроскопии в срезах олигодендроцитов вирусологи обнаруживают вирионы полиомавирусов, имеющих форму кристалла.
Полиомавирусы проникают в организм человека и находятся в латентном состоянии во внутренних органах и тканях пожизненно. Персистенция вирусов происходит в почках, костном мозге, селезенке. При снижении иммунной защиты они активизируются и проявляют свое патогенное действие. Они транспортируются лейкоцитами в ЦНС и размножаются в белом веществе головного мозга. Подобные процессы происходят у лиц, страдающих СПИДом, лейкемией или лимфомой, а также перенесших трансплантацию органов. Источником инфекции является больной человек. Вирусы могут передаваться воздушно-капельным или фекально-оральным путем.
Симптоматика
Заболевание развивается постепенно. Сначала больные становятся неловкими, рассеянными, апатичными, слезливыми и неуклюжими, у них снижается умственная работоспособность, нарушается сон и память, затем появляется вялость, общая утомляемость, вязкость мысли, шум в ушах, раздражительность, нистагм, мышечный гипертонус, сужается круг интересов, с трудом произносятся некоторые слова. В запущенных случаях возникают моно- и гемипарезы, неврозы и психозы, поперечный миелит, судороги, нарушение высших мозговых функций, грубая деменция.

Ведущими симптомами болезни являются:
- Дискоординая движений, шаткость походки, двигательная дисфункция, слабость в конечностях,
- Полный односторонний паралич рук и ног,
- Нарушения речи,
- Снижение резкости зрения,
- Скотомы,
- Гипестезия,
- Снижение интеллекта, спутанность сознания, эмоциональная лабильность, слабоумие,
- Гемианопсия,
- Дисфагия,
- Эпиприступы,
- Недержание мочи.
Прогрессирующая мультифокальная лейкоэнцефалопатия проявляется вялыми парезами и параличами, типичной гомонимной гемианопсией, оглушенностью, изменением личности, симптомами поражения черепно-мозговых нервов и экстрапирамидными нарушениями.
Диагностика
Диагностика лейкоэнцефалопатии включает проведение целого ряда процедур:
- Консультацию у врача-невропатолога,
- Клинического анализа крови,
- Выявления уровня алкоголя, кокаина и амфетамина в крови,
- Допплерографию,
- ЭЭГ,
- КТ, МРТ,
- Биопсию головного мозга,
- ПЦР,
- Люмбальную пункцию.
С помощью КТ и МРТ можно обнаружить гиперинтенсивные очаги поражения в белом веществе мозга. При подозрение на инфекционную форму, электронная микроскопия позволяет выявить в мозговой ткани частицы вирусов. Иммуноцитохимический метод – выявление антигена вируса. Люмбальную пункцию проводят при повышении белка в СМЖ. При данной патологии в ней выявляют также лимфоцитарный плеоцитоз.
Подтвердить или опровергнуть диагноз лейкоэнцефалопатия могут результаты тестов на психологическое состояние, память, координацию движений.
Лечение
Лечение лейкоэнцефалопатии длительное, комплексное, индивидуальное, требующее от больного много сил и терпения.
Лейкоэнцефалопатия — заболевание неизлечимое. Общетерапевтические мероприятия направлены на сдерживание дальнейшего прогрессирования патологии и восстановление функций подкорковых структур головного мозга. Лечение лейкоэнцефалопатии симптоматическое и этиотропное.
Дополнительно проводят физиотерапию, рефлексотерапию, назначают дыхательную гимнастику, массаж воротниковой зоны, мануальную терапию, иглоукалывание. Для лечения детей медикаменты обычно заменяют гомеопатическими и фитотерапевтическими препаратами.
Лейкоэнцефалопатия, наряду со старческой формой с прогрессирующей деменцией, в последнее время стала осложнением СПИДа, что связано с сильно ослабленным иммунитетом ВИЧ-инфицированных пациентов. При отсутствии своевременной и адекватной терапии такие пациенты живут не 6 месяцев с момента появления клинических симптомов патологии. Лейкоэнцефалопатия всегда заканчивается смертью больного.
Лейкодистрофия — нейродегенеративное заболевание, обусловленное наследственным нарушением обмена веществ с накоплением в головном и спинном мозге метаболитов, провоцирующих разрушение миелина. Манифестирует в основном в детском возрасте задержкой психомоторного развития, двигательными расстройствами, поражением зрительных и слуховых нервов, гидроцефалией, эпилептическими приступами. Диагностируется лейкодистрофия по данным неврологического статуса, анамнеза, генетических исследований, МРТ или КТ картины головного мозга, биохимических анализов. Лечение симптоматическое. При раннем выявлении и медленном прогрессировании возможна трансплантация пуповинной крови или костного мозга.
МКБ-10
Общие сведения
Лейкодистрофия получила свое название в связи с поражением белого вещества мозга (с греческого leukos — белый). Различают около 60 разновидностей лейкодистрофии, определяющихся видом генной аномалии и возрастом манифестации клинических проявлений. Наряду с отдельными воспалительными поражениями ЦНС (например, лейкоэнцефалитом Шильдера) лейкодистрофия относится к синдрому диффузного склероза мозга. При этом доминирующее поражение миелина сближает ее с демиелинизирующими заболеваниями (рассеянным склерозом, РЭМ и пр.), а отдельные формы можно отнести к липидозам.
К основным формам лейкодистрофии относятся метахроматическая, суданофильная, глобоидно-клеточная, дегенерация Ван-Богарта-Бертрана, болезнь Александера, вариант Галлервордена-Шпатца. Наиболее распространены первые 3 вида лейкодистрофии. Их встречаемость колеблется от 0,4 до 1 случая на 100 тыс. новорожденных. Ряд форм лейкодистрофии являются настолько редкими, что в мировой литературе по неврологии описано всего несколько сотен их клинических наблюдений. В зависимости от возрастного периода, в котором дебютирует лейкодистрофия, каждая ее форма может подразделяться на инфантильный, поздний инфантильный, ювенильный и взрослый вариант.

Причины возникновения лейкодистрофии
В своей основе каждая лейкодистрофия имеет генетическую аномалию определенного фермента. Вид аномалии и локализация генной мутации пока установлены лишь для наиболее встречающихся форм патологии. В большинстве случаев лейкодистрофия имеет аутосомно-рецессивный путь наследственной передачи, однако отдельные ее формы могут наследоваться сцеплено с полом. Кроме того, не одиноки случаи спонтанных мутаций. Генетически детерминированный энзимный дефект ведет к обменным нарушениям (чаще в метаболизме липидов) с отложением определенного метаболита в нервных структурах и отдельных соматических органах, в первую очередь в печени и почках.
Следствием метаболической аномалии является разрушение миелина оболочек нервных стволов и проводящих путей, гибель нейронов с замещением их разрастающейся глиальной тканью. Морфологически лейкодистрофия характеризуется диффузными и симметрично расположенными в полушариях головного мозга зонами гибели миелина, скоплением продуктов миелинового распада, усиленной пролиферацией глии. В отдельных нозологических вариантах лейкодистрофия имеет специфическую морфологическую картину — метахроматическое или суданофильное окрашивание продуктов миелинового распада, скопление в зонах демиелинизации глобоидных клеток и т. п.
Симптомы лейкодистрофии
В большинстве случаев лейкодистрофия дебютирует в раннем детском возрасте. Новорожденные, как правило, выглядят здоровыми. Определенный период они нормально развиваются, а затем постепенно возникают различные неврологические симптомы, отличающиеся неуклонным прогрессированием. Скорость нарастания симптомов тем выше, чем раньше манифестировала лейкодистрофия. Ведущими проявлениями выступают прогрессирующая олигофрения, ухудшение зрения, тугоухость, эписиндром, спастические парезы. Первыми симптомами лейкодистрофии могут быть атаксия, мышечно-тонические расстройства (гипо- или гипертонус, мышечные подергивания), экстрапирамидные проявления, изменения поведения. Затем возникают эпиприступы, бульбарные проявления, снижается слух и зрение, отмечается интеллектуальное снижение с постепенной утратой ранее приобретенных навыков. Сенсорные расстройства не характерны. На поздних этапах развития болезни наблюдаются параличи, выраженная олигофрения, грубое расстройство глотания, амавроз, глухота. В терминальной фазе обычно отмечается децеребрационная ригидность.
Виды лейкодистрофии
Метахроматическая лейкодистрофия в зависимости от манифестации имеет 4 варианта. Врожденный вариант дебютирует в первые 1-3 мес. жизни задержкой развития и судорожным синдромом; дети не достигают возраста 1 года. Позднедетский вариант метахроматической лейкодистрофии начинается в период от 1 до 3 лет с мышечной гипотонии и слабости, атаксии, задержки психического развития (ЗПР). Затем формируется спастическая тетраплегия, афазия, псевдобульбарный синдром. В редких случаях пациенты доживают до 10-летнего возраста. Ювенильный вариант манифестирует в 4-6 лет и длится в среднем 7 лет. Взрослый вариант дебютирует в третьей декаде жизни, иногда позднее, продолжительность жизни пациентов от начала клиники варьирует в пределах 10-20 лет.
Суданофильная лейкодистрофия наследуется сцеплено с Х-хромосомой и имеет несколько разновидностей. Лейкодистрофия Пелицеуса-Мерцбахера может стартовать на 1-ом году жизни или в 3-4 года. Первым признаком является крупноразмашистый нистагм, позже возникает ЗПР, мозжечковая атаксия, гиперкинезы, парезы. Наибольшее прогрессирование происходит в возрасте до 10 лет, затем заболевание принимает замедленное течение с длительными ремиссиями. Пациенты могут жить до зрелого возраста. Адренолейкодистрофия — вариант, при котором лейкодистрофия сочетается с надпочечниковой недостаточностью. Характеризуется прогрессирующим течением с летальным исходом спустя 6-8 лет от начала клиники.
Глобоидно-клеточная лейкодистрофия (болезнь Краббе) — липоидоз с накоплением в очагах демиелинизации галактоцереброзида и образованием больших округлых глобоидных клеток. Раннедетский вариант развивается в первом полугодии жизни с гипервозбудимости и периодической гипертермии, задерживается психомоторное развитие, нарастает тонус мышц, затем развивается спастический тетрапарез, олигофрения, эписиндром, возможен опистотонус. В годовалом возрасте наступает летальный исход. Позднедетский вариант более редкий, манифестирует ухудшением зрения.
Спонгиозная дегенерация Ван-Богарта-Бертрана характеризуется эписиндромом, гиперсомнией, выраженной гидроцефалией с увеличением размеров головы, вызывающей амавроз атрофией зрительных нервов. Резкая внутричерепная гипертензия приводит к расхождению черепных швов, регистрируемому при рентгенографии черепа. Пациенты с этой формой лейкодистрофии погибают до 3-летнего возраста.
Болезнь Александера (лейкодистрофия с волокнистой формацией) обусловлена мутацией гена, ответственного за синтез GFAP белка. В результате происходит накопление в клетках глии аномального GFAP белка, содержащего волокна Розенталя. Неонатальный вариант имеет тяжелое течение с летальным исходом к концу 1-го года. Инфантильный вариант встречается примерно в половине случаев, проявляется в первые 1-2 года жизни ЗПР, затем присоединяются спастические парезы, атаксия, гидроцефалия. Дети погибают спустя несколько лет. Ювенильная лейкодистрофия Александера дебютирует в период от 4-х до 10-летнего возраста, протекает с преимущественно стволовой симптоматикой. Продолжительность жизни колеблется в пределах 10-30 лет. Взрослый вариант отличается поздней манифестацией и относительно медленным течением в пределах 10 и более лет.
Лейкодистрофия Галлервордена-Шпатца чаще всего стартует в 10-летнем возрасте. Проявляется дисфункцией стриопаллидарной системы, затем на фоне гиперкинезов прогрессирует тетрапарез, развивается гемералопия и пигментный ретинит, наблюдается снижение интеллекта, возникают эпиприступы.
Диагностика лейкодистрофии
Диагностический поиск требует привлечения ряда специалистов: невролога, педиатра, медицинского генетика, для диагностики расстройств зрения и слуха — отоларинголога и офтальмолога. Важное значение имеет изучение анамнеза болезни (возраст и симптомы дебюта, последовательность развития клиники) и семейного анамнеза (наличие лейкодистрофии у родственников). Нейросонография через родничок и эхо-энцефалография у пациентов более старшего возраста, как правило, выявляет повышение интракраниального давления. Лейкодистрофия сопровождается существенным увеличением концентрации белка, обусловленным разрушением церебральных клеток, что определяется при исследовании цереброспинальной жидкости.
С целью диагностики вида метаболической аномалии проводится целый ряд биохимических тестов с определением уровня ферментов и накапливающихся метаболитов. Очаги демиелинизации хорошо визуализируются при помощи МРТ, могут быть обнаружены и на КТ головного мозга. Обычно демиелинизация видна на МРТ головного мозга еще до клинической манифестации лейкодистрофии. Благодаря развитию генетики, лейкодистрофия имеет разработанную ДНК-диагностику, а отдельные ее формы (метахроматическая, адренолейкодистрофия, глобоидно-клеточная) — возможность пренатального диагностирования.
Лечение лейкодистрофии
На сегодняшний день лейкодистрофия не имеет эффективных способов терапии, позволяющих купировать прогрессирование симптомов. Проводится симптоматическое лечение — в основном дегидратационная и антиконвульсантная терапия. Единственным методом, способным увеличить продолжительность жизни пациентов с лейкодистрофией и улучшить качество их жизни, является трансплантация пуповинной крови или пересадка костного мозга. Трансплантация приводит к нормализации метаболизма. Однако этот процесс занимает длительное время (от 12 до 24 мес.), в течение которого продолжается прогрессирование лейкодистрофии. Поэтому зачастую тяжелая инвалидизация или гибель пациента наступает даже после успешной трансплантации.
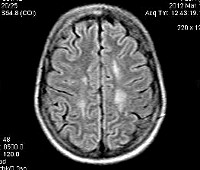
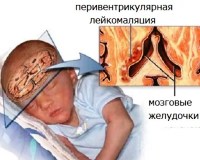
Перивентрикулярная лейкомаляция — это гипоксически-ишемическая энцефалопатия, характеризующаяся поражением белого вещества головного мозга новорожденных. Состояние чаще возникает у недоношенных, провоцируется патологиями течения беременности и родов, неадекватной респираторной поддержкой в постнатальном периоде. Заболевание проявляется мышечной дистонией, судорожным синдромом, задержкой психомоторного развития. Для диагностики болезни назначается КТ или МРТ мозга, ЭЭГ, допплерография церебральных сосудов. Лечение лейкомаляции включает медикаменты (нейропротекторы, инфузионные растворы, антиконвульсанты), индивидуальный комплекс физиотерапии, массажа, ЛФК.
МКБ-10
Общие сведения

Причины
Основной этиологический фактор перивентрикулярной лейкомаляции — внутриутробная гипоксия, которая выступает следствием осложнений протекания беременности, материнских факторов риска либо негативного экзогенного воздействия. Также состояние может возникать при перинатальной гипоксии, которая развивается во время родов, в первые дни жизни младенца (при синдроме дыхательных расстройств, врожденных аномалиях сердца и легких, неонатальном сепсисе).
В группе риска наибольшую по численности категорию составляют недоношенные младенцы. Зачастую лейкомаляция выявляется у детей, которое были рождены от матерей с сахарным диабетом, хронической анемией, гипертиреозом либо страдавших от преэклампсии и эклампсии. Состояние возникает при выполнении экстренного кесарева сечения, неадекватном родовспоможении (травмирующие акушерские пособия). Высокая частота лейкомаляции (до 22%) отмечается при сочетании длительного безводного периода с хориоамнионитом у матери.
Патогенез
Поражение головного мозга связано со снижением кровотока в церебральных сосудах, недостаточным поступлением кислорода и питательных ингредиентов. Перивентрикулярная область наиболее чувствительна к этим изменениям, что обусловлено особенностями кровоснабжения, несовершенством процессов ауторегуляции, нейроонтогенетическими особенностями головного мозга у младенцев.
Недоношенные намного чаще страдают лейкомаляцией, поскольку у них на фоне гипоксии не увеличивается церебральный кровоток, как это бывает у рожденных в срок младенцев. В результате этого резко уменьшается кровоток в зоне между вентрикулофугальными и вентрикулопетальными артериями, быстро формируется гиперкапния и ацидоз. Расстройства микроциркуляции проявляются стазом, тромбозом, вне- и внутриклеточным отеком белого вещества.
Формирование ПВЛ возможно не только при недостатке кислорода, но и при гипероксии — при проведении ИВЛ, оказании других видов респираторной поддержки. При избыточном поступлении кислорода повышается рН крови в мозговой ткани, что вызывает рефлекторный спазм сосудов, затруднение венозного оттока. Также кислород активизирует процессы свободнорадикального церебрального повреждения.
Симптомы
Как правило, перивентрикулярная лейкомаляция формируется антенатально или на протяжении первых часов после рождения ребенка, поэтому начальные признаки заметны уже в родильном доме, особенно если младенец рожден недоношенным. При обширном повреждении белого вещества происходят нарушения сознания по типу летаргии или комы, однако возможна обратная симптоматика — повышенная возбудимость, оживление безусловных рефлексов, судорожный синдром.
Типичным проявлением патологии являются изменения тонуса мышц. На первом месяце жизни преобладает слабость мускулатуры ног в сочетании с нормальным формированием мышц верхних конечностей. У недоношенных новорожденных часто отмечается тотальная мышечная гипотония. Такие нарушения сохраняются в среднем до 6 месяцев, после чего они сменяются спастическими явлениями — повышением тонуса мускулатуры нижних конечностей, оживлением коленных рефлексов.
Осложнения
Перивентрикулярные поражения белого вещества — крайне тяжелое состояние. Недоношенные дети с ПВЛ умирают в 50% случаев еще в период новорожденности, у выживших обычно наступает инвалидность с полной дезадаптацией. Пациенты с длительно сохраняющимся судорожными приступами в 85% случаев имеют грубую задержку психомоторного развития. У перенесших ПВЛ в будущем в 1,5 раза чаще встречаются фебрильные судороги, в 27 раз чаще формируется эпилепсия.
При множественных кистах в перивентрикулярной зоне у 80-97% больных (чаще — недоношенных) возникает детский церебральный паралич (ДЦП), который сопровождается глубоким психоречевым отставанием. Развитие заболевания связано с повреждением центральной части внутренней капсулы, средне- и заднелобных сегментов белого вещества полушарий. Также лейкомаляция вызывает микроцефалию (у 42% пациентов), нейросенсорную тугоухость (у 28% больных).
Диагностика
Постановка правильного диагноза в неонатальном периоде затруднена, что объясняется полиморфностью клинической картины, отсутствием патогномоничных симптомов. При физикальном осмотре выявляется асимметрия мышечного тонуса, патологическое усиление рефлексов, на более поздних этапах — спастическая диплегия. Особую настороженность следует проявлять в отношении детей, родившихся недоношенными. В план обследования новорожденных с подозрением на ПВЛ включаются:
- Нейровизуализация. При КТ и МРТ головного мозга определяются множественные очаги атрофии белого вещества, зачастую визуализируются кисты перивентрикулярной области размером более 4 мм, что коррелирует с тяжелым неврологическим дефицитом.
- Дуплексное сканирование сосудов. Исследование артерий головы и шеи с помощью допплерографии имеет важное значение для уточнения параметров кровотока, исключения сосудистых аномалий, которые могли быть причиной постнатальной гипоксии. По показаниям исследование дополняется реоэнцефалографией.
- ЭЭГ. При судорожном синдроме электроэнцефалография необходима для обнаружения зон мозга с повышенной электрической активностью. Недоношенным новорожденным требуются повторные исследования в разные возрастные периоды для оценки динамики морфофункционального созревания мозга.
- Консультации специалистов. При подозрении на патологию зрения, рекомендуется обследование у офтальмолога с осмотром глазного дна. Больным со сниженным слухом необходима консультация ЛОР-врача. Иногда требуется визит к детскому психологу, психиатру.
Лечение перивентрикулярной лейкомаляции
Терапия перивентрикулярной лейкомаляции представляет собой сложную задачу, учитывая необратимый характер повреждений белого вещества, частое сочетание гипоксически-ишемической энцефалопатии с поражениями других систем организма у недоношенных. Медикаментозное лечение подбирается на основе ведущих синдромов болезни и включает следующие группы препаратов:
- Инфузионная терапия. Растворы глюкозы, электролитов, витаминов оказывают положительное влияние на церебральный метаболизм, повышают устойчивость перивентрикулярных зон к гипоксии.
- Нейрометаболиты. Препараты улучшают кровоток и стимулируют доставку питательных веществ в головной мозг, а также выполняют функцию нейропротекторов, способствуют формированию когнитивных навыков.
- Антиконвульсанты. Для купирования судорог используются медикаменты из группы бензодиазепиновых транквилизаторов, а при их неэффективности применяются барбитураты, препараты для наркоза.
- Глюкокортикоиды. Лекарства показаны в случае осложнения заболевания внутричерепной гипертензией. В таком случае они дополняются осмотическими диуретиками.
Учитывая высокую частоту резидуальных неврологических явлений, рекомендовано восстановительное лечение. Чтобы улучшить двигательные способности, назначаются курсы массажа, физиотерапии, лечебной физкультуры. Для развития речевых навыков требуются коррекционные занятия у логопеда, дефектолога. Детям с поражением органов чувств нужна помощь тифлопедагога, сурдопедагога. Пациентам с ДЦП необходимы специальные ходунки, костыли, инвалидные коляски.
Прогноз и профилактика
В большинстве случаев лейкомаляция отличается неблагоприятным течением, отличается высоким уровнем смертности во время младенчества. Для выживших детей прогноз напрямую зависит от тяжести органического дефекта перивентрикулярной зоны, своевременности и полноты проведенного лечения. Профилактика ПВЛ включает рациональное ведение беременности, предупреждение родового травматизма, соблюдение протоколов при респираторной поддержке в роддоме, усиленный контроль за развитием недоношенных.
2. Перивентрикулярная лейкомаляция: этиология, патогенез, клиника, исходы/ Э.Ф. Юсупова, Д.Д. Гайнетдинова// Вопросы современной педиатрии. — 2010. — №4.
3. Перивентрикулярная лейкомаляция: факторы риска возникновения, выживаемость и мониторинг развития детей. Автореферат диссертации/ Е.П. Ониангет. — 2006.
4. Перивентрикулярная лейкомаляция у новорожденных/ И.Н. Пронин// Медицинская визуализация. — 2005. — №2.

Лейкоэнцефалопатия представляет собой заболевание, характеризующееся поражением белого вещества подкорковых структур головного мозга.
Данная патология с самого начала была описана как сосудистое слабоумие.
Чаще всего подобным недугом страдают люди пожилого возраста.
Среди разновидностей заболевания, можно выделить:

- Мелкоочаговая лейкоэнцефалопатия сосудистого генеза. Являясь по своей природе хроническим патологическим процессом сосудов головного мозга, ведёт к постепенному поражению белого вещества мозговых полушарий. Причиной развития данной патологии является стойкое повышение артериального давления и гипертоническая болезнь. В группу риска по заболеваемости входят мужчины старше 55 лет, а также люди, имеющие наследственную предрасположенность. Со временем, подобная патология может привести к развитию старческого слабоумия.
- Прогрессирующая мультифокальная энцефалопатия. Под данной патологией подразумевают вирусное поражение центральной нервной системы в результате которого идёт стойкое разрешение белого вещества. Толчком к развитию заболевания, может дать иммунодефицит организма. Данная форма лейкоэнцефалопатии, является одной из самых агрессивных, и может повлечь за собой летальный исход.
- Перивентрикулярная форма. Представляет собой поражение подкорковых структур головного мозга, на фоне хронического кислородного голодания и ишемии. Излюбленным местом локализации патологического процесса при сосудистой деменции является ствол головного мозга, мозжечок и отделы полушарий, отвечающие за двигательную функцию. Патологические бляшки располагаются в подкорковых волокнах и иногда в глубоко расположенных слоях серого вещества.
Причины возникновения
Чаще всего, причиной развития лейкоэнцефалопатии может быть состояние острого иммунодефицита либо на фоне инфицирования полиомавирусом человека.
К факторам риска возникновения данного заболевания можно отнести:
- ВИЧ инфекция и СПИД;
- злокачественные заболевания крови (лейкоз);
- гипертоническая болезнь;
- иммунодеффицитные состояния на фоне терапии иммунодепрессантами (после трансплантации);
- злокачественные новообразования лимфатической системы (лимфогранулематоз);
- туберкулёз;
- злокачественные новообразования органов и тканей всего организма;
- саркаидоз.
Основные симптомы
Основная симптоматика заболевания, будет соответствовать клинической картине поражения определённых мозговых структур.
Среди самых характерных симптомов данной патологии можно выделить:
- нарушение координации движений;
- ослабление двигательной функции (гемипарезы);
- нарушение речевой функции (афазия);
- появление сложностей в произношении слов (дизартрия);
- снижение остроты зрения;
- снижение чувствительности;
- снижение интеллектуальных способностей человека с нарастанием деменции (слабоумия);
- помутнение сознания;
- личностные изменения в виде перепадов эмоций;
- нарушение акта глотания;
- постепенное нарастание общей слабости;
- не исключены эпилептические приступы;
- головная боль постоянного характера.
Одним из самых первых признаков заболевания является появление слабости в одной или одновременно всех конечностях.
Диагностика
Для точности постановки диагноза, и определения точной локализации патологического процесса, должен быть осуществлён следующий ряд диагностических мероприятий:
- получение консультации у врача-невропатолога а, также инфекциониста;
- проведение электроэнцефалографии;
- проведение компьютерной томографии головного мозга;
- проведение магнитно-резонансной томографии головного мозга;
- с целью обнаружения вирусного фактора, проводится диагностическая биопсия головного мозга.

Проведение магнитно-резонансной томографии, позволяет с успехом выявлять множественные очаги заболевания в белом веществе головного мозга.
А вот компьютерная томография, несколько уступает МРТ по уровню информативности, и может отобразить очаги заболевания только в виде очагов инфаркта.
На ранних стадиях заболевания, это могут быть единичные очаги или единственный очаг.
Лабораторные исследования
К лабораторным методам диагностики можно отнести ПЦР метод, который позволяет обнаружить вирусный ДНК в клетках головного мозга.
Этот метод зарекомендовал себя только с лучшей стороны, поскольку его информативность составляет без малого 95%.
С помощью ПЦР диагностики, можно избежать непосредственного вмешательства в ткань мозга в виде взятия биопсии.
Биопсия может быть эффективна, в случае, если необходимо точное подтверждение наличия необратимых процессов, и определение степени их прогрессирования.
Ещё одним методом является люмбальная пункция, которая на сегодняшний момент редко используется по причине своей малой информативности.
Единственным показателем может стать незначительно повышение уровня белка в спинномозговой жидкости пациента.

Болезнь Гиппеля-Линдау — тяжелое наследственное заболевание, которое всегда заканчивается летальным исходом. Методы поддерживающей терапии вы найдете в статье.
Лечение рассеянного склероза народными средствами — эффективные советы и рецепты лечения тяжелого заболевания в домашних условиях.
Поддерживающая терапия
Полностью излечится от данной патологии невозможно, поэтому любые лечебные мероприятия будут направлены на сдерживание патологического процесса, и нормализацию функций подкорковых структур головного мозга.
Учитывая, что сосудистое слабоумие в большинстве случаев является результатом вирусного поражения структур головного мозга, лечение в первую очередь должно быть направлено на подавление вирусного очага.
Сложностью на данном этапе, может стать преодоление гематоэнцефалического барьера, через который не могут проникнуть необходимые лекарственные вещества.
Чтобы лекарственное средство могло пройти данный барьер, оно должно быть липофильным по своей структуре (жирорастворимым).
На сегодняшний день, к сожалению, большинство противовирусных препаратов являются водорастворимыми, чем и создают сложности в их применении.
На протяжении многих лет, медицинскими специалистами были опробованы различные лекарственные препараты, которые обладали разной степенью эффективности.
Список этих лекарств включает:
Препарат цидофовир, который вводится внутривенно, способен улучшать мозговую активность.
Хорошо зарекомендовал себя препарат цитарабин. С его помощью удаётся стабилизировать состояние пациента и улучшить его общее самочувствие.
Если заболевание возникло на фоне ВИЧ инфекции, должна проводиться терапия антиретровирусными препаратами (зипразидон, миртазипим, оланзапим).
Прогноз неутешителен
К сожалению, излечится от лейкоэнцефалопатии невозможно, при отсутствии вышеупомянутого лечения, пациенты живут не более полугода с момента появления первых признаков поражения ЦНС.
Антиретровирусная терапия может увеличить сроки жизни от года до полутора лет с момента появления первых признаков поражения мозговых структур.
Были отмечены случаи острого течения заболевания. При таком течении, летальный исход наступал в течение 1 месяца с момента начала заболевания.
В 100% случаев, течение патологического процесса заканчивается летальным исходом.
Вместо вывода
Учитывая, что лейкоэнцефалопатия, возникает на фоне тотального иммунодиффицита, любые меры по её профилактике, должны быть направлены на поддержание защитных сил организма, и предотвращению ВИЧ инфицирования.
К таким мерам можно отнести:
- избирательность при выборе полового партнёра.
- отказ от употребления наркотических препаратов, и от инъекционной их формы в частности.
- использование средств контрацепции во время полового контакта.

Тяжесть течения патологического процесса, зависит от состояния защитных сил организма. Чем сильнее снижен общий иммунитет, тем более остро протекает заболевание.
И напоследок, можно сказать, что в настоящий момент, медицинские специалисты активно работают над созданием эффективных методов лечения различных форм патологии.
Но как показывает практика, лучшим лекарством от данного недуга, является его профилактика. Лейкоэнцефалопатия головного мозга, относится к заболеваниям, которые напоминают запущенный механизм, остановить который не представляется возможным.
Читайте также:

