Персистирующая папилломавирусная инфекция что это
Обновлено: 11.05.2024
Е.В. Файзуллина
Казанский государственный медицинский университет
Генитальная папилломавирусная инфекция является распространенным заболеванием, передающимся половым путем. Вирус папилломы человека (ВПЧ) — высокоспецифичная в отношении человека инфекция, обладающая способностью инфицировать эпителиальные клетки, вызываемая вирусом из семейства Papovaviridea. Инфицирование ВПЧ половых органов, так же как и кожных покровов, происходит при наличии микротравм, при этом резервуаром ВПЧ-инфекции служат уретра, бартолиниевы железы, семенная жидкость. Идентифицировано более ста видов ВПЧ, из которых 35 инфицируют урогенитальный тракт человека, вызывая поражение покровного эпителия кожи и слизистых оболочек половых органов. ВПЧ-инфекция является наиболее распространенной инфекцией, передаваемой половым путем (ИППП), которой инфицирована большая часть сексуально активного населения. Кроме этого, папилломавирусы — единственная группа вирусов, для которых доказана индукция опухолей у человека. Число инфицированных в мире за последнее десятилетие увеличилось в 12 раз (Молочков В.А., 2004).
МКБ X пересмотра, раздел А 63. Аногенитальные бородавки.
Этиология
Вирус, относящийся к роду А семейства Papovaviridea, сохраняется при температуре 50?С в течение 30 минут. В процессе репликационного цикла геном вируса экспрессирует от 8 до 10 белковых продуктов; за онкогенные свойства вируса ответственны онкопротеины Е6 и Е7. По онкогенной активности различают ВПЧ низкой степени риска — HPV6, 11,42,43,44; средней – HPV31,33,35, 51,52, 58 и высокой — HPV16, 18,45,56 степени риска. Одним или более типами ВПЧ инфицировано не менее 50% взрослого населения, живущего активной половой жизнью, в большинстве случаев генитальная ВПЧ-инфекция у них является нераспознанной, протекающей субклинически или асимптомно. Генитальная ВПЧ-инфекция имеет высокую контагиозность; заражение при однократном половом контакте происходит примерно в 60% случаев.
Патогенез
Инвазия вируса происходит через микроповреждения тканей. ВПЧ инфицирует стволовые клетки базального слоя, которые затем являются постоянным источником инфицирования эпителиальных клеток. Вирусы инфицируют делящиеся незрелые клетки базально-клеточного слоя, находящиеся близко к поверхности, что во многом объясняет частоту инфицирования шейки матки и нижней трети влагалища и вульвы.
Вирусная ДНК включается в ядерный материал клетки хозяина. Интегрированная форма ВПЧ способна к злокачественной трансформации, поскольку вирусная ДНК начинает контролировать клеточный генетический материал для воспроизводства ВПЧ-кодированных белков. Интеграция ВПЧ высокого риска в клеточный геном хозяина усиливает продукцию двух онкопротеинов — Е6 и Е7, взаимодействующих с эндогенными клеточными регуляторными белками, ведущими к дерегуляции цикла клеточной прогрессии, что является разрешающим моментом в формировании цервикальной неоплазии, образованию плоских кондилом, невидимых вооруженным глазом (Прилепская В.Н., 1997).
Однако по мнению В.А. Молочкова и соавт. (2004), инфицирование эпителиальных клеток ВПЧ является необходимым, но не достаточным событием для развития рака. Для формирования необратимой неоплазии необходимы следующие факторы: во-первых, активная экспрессия генов Е6 и Е7, причем высокоонкогенных типов ВПЧ-16 и 18; во-вторых, индукция метаболических механизмов конверсии эстрадиола в 16-ОН; в третьих, индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Первая стадия неоплазии CIN I характеризуется активной репликацией вируса и его бессимптомным выделением. Опухолевая трансформация возникает с большей вероятностью при взаимодействии ВПЧ с другими инфекционными агентами (цитомегаловирусы, вирус простого герпеса 2 типа, С. trachomatis, микоплазма и уреаплазма).
Факторы риска
ВПЧ является необходимым, но не достаточным фактором цервикальной неоплазии. Предрасполагающими факторами риска для развития заболевания могут быть: неблагополучный социально-экономический статус и сексуальное поведение, нарушения клеточного и гуморального иммунитета, сопутствующие сексуально-трансмиссивные заболевания (гонорея, сифилис герпес, трихомониаз хламидиоз и т.д.), молодой возраст, курение, беременность, дисбиоз вагинального биотопа, гипо- и авитаминозы (Марченко Л.А., 2001).
Риск ВПЧ-инфекции наиболее высок у гомосексуалистов. Не исключены случаи перинатальной передачи инфекции младенцам, рожденным от инфицированных матерей во время родоразрешения через естественные родовые пути, за счет аспирации околоплодных вод, цервикального или вагинального секрета; случаи папилломатоза гортани, трахеи, бронхов у детей, рожденных с применением операции кесарева сечения, что, по мнению ряда авторов, свидетельствует о возможности трансплацентарной передачи инфекции и нецелесообразности применения кесарева сечения с единственной целью — предупреждения заражения новорожденного ВПЧ (Koutsky L.A., Kiviar N.B.,1999).
Течение заболевания и клинические разновидности
Инкубационный период при аногенитальных бородавках составляет от 1 до 3 месяцев. В большинстве случаев ВПЧ-инфекция не манифестирует сразу, оставаясь некоторое время асимптомной. Прогрессия ВПЧ-инфекции высокого онкогенного риска в цервикальную интраэпителиальную неоплазию и рак in situ обычно происходит в сроки от 5 до 30 лет.
1. Клинические формы (видимые невооруженным взглядом):
1.1. Экзофитные кондиломы (остроконечные типичные, паппилярные, папуловидные);
1.2. Вестибулярный паппиломатоз ( мелкие паппиломовидные образования преддверья влагалища).
2. Субклинические формы (не видимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/ или цитологическом или гистологическом исследовании):
Плоские кондиломы (типичная структура с множеством койлоцитов);
Малые формы (различные поражения метапластического эпителия с единичными койлоцитами);
Кондиломатозный цервицит/вагинит.
3. Латентные формы (отсутствие клинических, морфологических или гистологических изменений при обнаружении ДНК ВПЧ);
4. Цервикальная интраэпителиальная неоплазия (плоскоклеточные интраэпителиальные поражения):
CIN - CIN 1 — слабо выраженная дисплазия +/- койлоцитоз, дискератоз;
4.2 CIN II — выраженная дисплазия +/- койлоцитоз, дискератоз;
4.3 CIN III или CIS - тяжелая дисплазия или карцинома in situ+/- койлоцитоз, дискератоз;
4.4 Микроинвазивная плоскоклеточная карцинома.
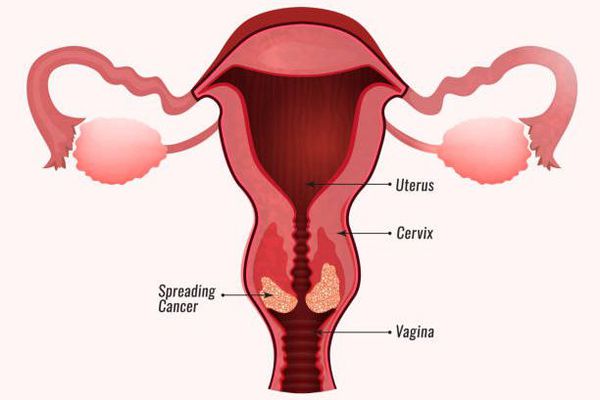
Поверхность покрыта многослойным плоским эпителием по типу дискератоза. В подлежащей строме имеются атипичные сосуды, явления воспаления. Локализация ОК различна, в основном, в местах возможной мацерации: клитор, малые половые губы, устье уретры, влагалище, шейка матки, анус.
Манифестация генитальной ВПЧ-инфекции сопровождается появлением генитальных бородавок. Экзофитные формы остроконечных кондилом представляют из себя типичное проявление инфекции, обусловленной доброкачественными типами вируса ВПЧ6 и ВПЧ11. Эндофитные кондиломы могут быть плоскими и инвертированными, располагаются на шейке матки и имеют вид плоских или слегка возвышающихся бляшек, определяются при расширенной кольпоскопии.
Субклиническая форма болезни обнаруживается только при кольпоскопии в виде мелких плоских бородавок или устанавливается на основании характерной гистологической картины в виде койлоцитоза. Отсутствие клинических и гистологических признаков инфекции при выявлении ДНК ВПЧ свидетельствует о латентной или асимптомной инфекции.
Наружное отверстие уретры у женщин поражается в 4-8% случаев, более глубокое поражение мочеиспускательного канала вызывает явления вялотекущего уретрита.
Анальные бородавки чаще встречаются у лиц, практикующих анальный секс, и редко располагаются выше зубчатой линии прямой кишки. У лиц, практикующих орально-генитальные контакты, генитальные бородавки могут поражать губы, язык, небо.
Генитальные бородавки, как правило, бессимптомны, и часто случайно выявляются при осмотре или на основании Pap-мазка. В связи с этим вначале больные не предъявляют жалоб на связанный с ними дискомфорт. Однако, крупные, травмированные, изъязвленные или подвергшиеся вторичной инфекции бородавки сопровождаются зудом, болью, неприятным запахом. Уретральные бородавки у мужчин могут вызывать раздвоение струи мочи, обструкцию уретрального отверстия.
У больных с нарушением клеточного иммунитета (ВИЧ-инфекция, иммуносупрессивная терапия, беременность), — развиваются очень крупные генитальные бородавки — гигантская кондилома Бушке-Левенштейна, инвазивная и деструирующая опухоль, ассоциирующаяся с ВПЧ 6 и 1 1 типа.
ВПЧ-инфекция, обусловленная типами вируса высокого онкогенного риска (ВПЧ-16 и 18), является этиологическими агентами довольно гетерогенной группы заболеваний: бовеноидный папулез, цервикальная интраэпителиальная неоплазия, рак шейки матки, реже - рак влагалища, вульвы, ануса (Баткаев Э.А. с соавт., 2001; Киселев В.И., Киселев О.И., 2003).
Бовеноидный папулез ассоциируется с ВПЧ-16, а также с другими типами ВПЧ - 1, 6, 11, 18, 31-35, 39, 42, 48, 51-54 и проявляется плоскими папулами и пятнами с гладкой, бархатистой поверхностью. Заболевание обычно развивается у мужчин, имеющих много половых партнеров. У партнерш таких пациентов выявляется инфекция ВПЧ шейки матки и цервикальной интраэпителиальной неоплазии. Течение бовеноидного папулеза обычно доброкачественное. У некоторых больных бовеноидный папулез может персистировать годами, трансформируясь (особенно у лиц пожилого возраста) в плоскоклеточный рак.
Диагностика папилломавирусной инфекции
Лабораторная диагностика ВПЧ-инфекции проводится на основании цитологического, гистологического исследования биоптатов, определения антител к ВПЧ, обнаружения ДНК ВПЧ и онкобелка Е7.
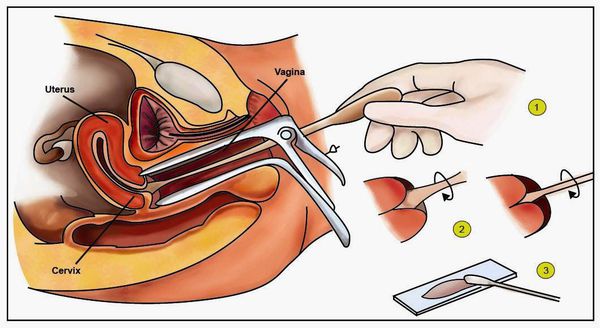
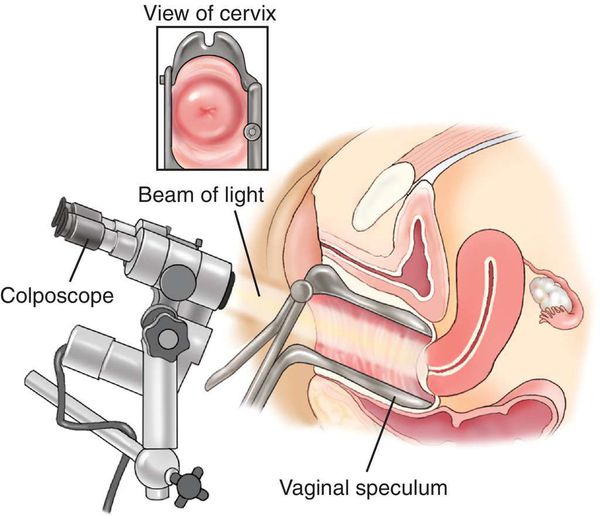
Клинический осмотр наружных половых органов, вульвы, влагалища следует проводить при хорошем освещении. Для выявления субклинической генитальной ВПЧ-инфекции проводится расширенная кольпоскопия. Ложноположительные результаты при этом методе обычно являются следствием воспалительных и дискератических процессов вульвы и влагалища.
Кольпоскопия и биопсия показаны всем женщинам с цервикальной интраэпителиальной неоплазией класса II (CIN II) или класса III (CINIII), независимо от подтверждения у них наличия ВПЧ-инфекции.
Наиболее простые методы для идентификации ВПЧ — иммунологические методы: РСК, ИФА, ПИФ.
Диагностика ВПЧ-инфекции шейки матки включает тестирование по Папониколау (РАР-тест). Молекулярно-биологические методы реакция гибридизации in situ, ПЦР, ДНК-зонд. Гистологическое исследование биоптатов тканей эпителия и эпидермиса используются и при малосимптомных или асимптомных формах вирусных заболеваний гениталий. Использование молекулярно-биологических методов исследования целесообразно для доказательства наличия ВПЧ с его типированием, так как и ДНК-гибридизация, и полимеразная цепная реакция позволяют выявить онкогенные типы вируса 16 и 18.
Основным методом диагностики ВПЧ является цитологический — обнаружение койлоцитарных клеток в биоптате эпителия шейки матки (клетки МПЭ промежуточного и поверхностного типа с многоядерным строением), патогномоничные для ВПЧ.
При гистологическом исследовании генитальных бородавок обнаруживается умеренное утолщение рогового слоя с папилломатозом, паракератозом и акантозом; могут присутствовать фигуры митоза. Диагностически важным считается наличие в глубоких участках мальпигиева слоя койлоцитов — больших эпителиальных клеток с круглыми гиперхромными ядрами и выраженной перинуклеарной вакуолизацией.
Лечение
При выборе метода лечения ВПЧ-инфекции учитывается анамнез, соматический статус, предшествующая противовирусная терапия, локализация, количество, размеры остроконечных и плоских кондилом. Тактика лечения должна быть индивидуальной с учетом переносимости тех или иных методов лечения. Местное лечение АБ направлено на удаление кондилом и атипически измененного эпителия, с применением различных видов химических коагулянтов, цитостатиков и физиохирургических методов лечения. После удаления папилломатозных разрастаний для профилактики рецидива АБ необходима местная и общая терапия противовирусными препаратами, индукторами интерферона, неспецифическими иммуномодуляторами. Больных с папилломавирусной инфекцией следует предупредить, что данное заболевание является сексуально трансмиссивным, поэтому обследование и лечение необходимо проводить обоим партнерам, а на период терапии и ближайшие 6-9 месяцев рекомендовать барьерные методы контрацепции.
Местное лечение ВПЧ (данные приведены по Подзолковой Н.М. с соавт, 2007).
В течение трех лет (2006-2008 гг.) нами были обследованы и пролечены 650 женщин с аногенитальными бородавками (АБ). Данные представлены в таблице 1.
Таблица 1.
Группы пациенток по локализации и распространенности АБ
| Группа | Локализация ОК | Количество пациенток | % |
|---|---|---|---|
| 1. | Влагалище | 17 | 2,6 |
| 2. | Вульва | 173 | 23,6 |
| 3. | Влагалище + вульва | 258 | 39,7 |
| 4. | Влагалище + большие половые губы | 126 | 19,4 |
| 5. | Влагалище + вульва + большие половые губы | 76 | 11,7 |
| Всего | 650 | 100 | |
Таблица 2.
Число сеансов радиоволновой деструкции АБ, требующихся для достижения стойкой ремиссии заболевания у женщин
| Группа | 1 сеанс | 2 сеанс (10-12 дней) | 3 сеанс (14-21 день) | Более 3 сеансов | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Чел. | % | Чел. | % | Чел. | % | Чел. | % | Чел. | % | |
| 1 | 7 | 41,2 | 10 | 58,82352941 | 0 | 0 | 0 | 0 | 17 | 100 |
| 2 | 121 | 69,9 | 41 | 23,69942197 | 11 | 6,4 | 0 | 0 | 173 | 100 |
| 3 | 118 | 45,7 | 112 | 43,41085271 | 25 | 9,7 | 3 | 1,2 | 258 | 100 |
| 4 | 13 | 10,3 | 77 | 61,11111111 | 29 | 23,0 | 7 | 5,6 | 126 | 100 |
| 5 | 0 | 0,0 | 23 | 30,26315789 | 41 | 53,9 | 12 | 15,8 | 76 | 100 |
| Итого: | 650 | |||||||||
- КЛЮЧЕВЫЕ СЛОВА: шейка матки, вирус папилломы человека, скрининг, предраковое поражение, дииндолилметан, Эпигаллат, Индинол Форто, Цервикон-ДИМ
Инфицирование вирусом папилломы человека (ВПЧ) высокого онкогенного риска запускает механизм трансформации клеток слизистой оболочки и приводит к развитию рака шейки матки (РШМ). Ежегодно в мире диагностируется около 570 000 новых случаев этого злокачественного новообразования. Рост заболеваемости за последние десять лет составил 7,8%, смертности – 13,1%. Примерно в 60% случаев РШМ выявляется у женщин старше 45 лет и в 20% – у женщин старше 65 лет.
Последние годы наблюдается тенденция к росту частоты выявления РШМ в молодой популяции (шесть-семь новых случаев) и пожилой популяции – 17 случаев на 100 тыс. женщин 1 . Пик заболеваемости цервикальным раком приходится на возраст 40–49 лет. Не случайно основной целью глобальной стратегии Всемирной организации здравоохранения (ВОЗ) на период 2020–2030 гг. по ликвидации РШМ стало снижение уровня смертности от данного заболевания. В перспективе порог заболеваемости должен составлять четыре случая рака шейки матки на 100 тыс. женщин в год. Перед мировым здравоохранением поставлены задачи, которые необходимо выполнить к 2030 г. 2 :
- 90% девочек должны быть вакцинированы против ВПЧ к 15 годам;
- 70% женщин должны проходить скрининг с помощью высокопроизводительного теста к 35 годам, а затем к 45 годам;
- 90% женщин с заболеваниями шейки матки (предраком и инвазивным раком) должны получать соответствующее лечение.
Эксперты ВОЗ рекомендуют комплексный подход к профилактике РШМ и борьбе с ним. При этом алгоритм действий предусматривает наблюдение за здоровьем женщины на протяжении всей жизни. Так, в целях первичной профилактики РШМ предусмотрено не только проведение вакцинации против ВПЧ, но и информирование детей 9–14 лет о пользе здорового образа жизни, половое воспитание с учетом возраста и культуры, пропаганда использования презервативов. В свою очередь вторичная профилактика – скрининг РШМ у женщин старше 30 лет позволяет выявлять предраковые поражения на стадии, на которой они легко поддаются лечению.
Течение ВПЧ-инфекции зависит от состояния иммунной системы и может быть транзиторным, латентным и персистирующим. Около 90% случаев инфицирования ВПЧ остаются незамеченными в течение двух лет, и лишь у 10% женщин отмечается персистенция инфекции. Для персистирующей ВПЧ-инфекции характерно выявление типоспецифической ДНК ВПЧ при повторном взятии образца через 6–12 месяцев. Риск развития предракового поражения шейки матки повышен именно у женщин с персистирующим ВПЧ.
У женщин в возрасте 30–35 лет опасность персистенции ВПЧ увеличивается в десять раз по сравнению с женщинами более молодого возраста. Наиболее высокий риск персистенции ВПЧ и цервикальной интраэпителиальной неоплазии (cervical intraepithelial neoplasia – CIN) наблюдается у женщин в возрасте старше 50 лет, имеющих сексуальные отношения с молодыми мужчинами 3 .
Транзиторная (эписомальная) форма ВПЧ нередко встречается у молодых женщин. Различают транзиторную форму со стойким отрицательным ответом – вирус исчезает через 12 месяцев и нестойким отрицательным ответом – через 12 месяцев вирус сохраняется в отсутствие поражения шейки матки.
Латентная форма носительства ВПЧ характеризуется персистенцией в течение двух и более лет без изменений шейки матки. Эта форма опасна непрогнозируемым риском трансформации в дисплазию шейки матки. Интегративная форма существования ВПЧ – интеграция клеточной ДНК, сопровождающаяся тяжелым поражением шейки матки.
Транзиторная форма с нестойким отрицательным ответом относится к малым формам поражения шейки. При ВПЧ-инфекции они отличаются длительной персистенцией при нормальных цитологических результатах. Малые формы поражения шейки матки могут реализоваться в появлении атипичных клеток – дисплазии низкой LSIL (low grade SIL) и высокой HSIL степени (hight grade SIL) к концу второго года наблюдения.
У многих молодых женщин возможна самоэлиминация ВПЧ в течение двух лет. Тем не менее в 10% случаев за тот же период может наблюдаться прогрессирование до диспластических изменений цервикального эпителия второй степени (CIN II) и более. Обнаружение ВПЧ в отсутствие клинических или субклинических проявлений инфекции ассоциируется с 250-кратным увеличением риска развития РШМ 4 . В связи с этим необходимо своевременно выявлять носительство онкогенных типов ВПЧ и начинать лечение до развития предраковых поражений шейки матки.
К факторам риска персистенции ВПЧ относят:
- тип и онкогенность вируса;
- раннее начало половой жизни;
- наличие более пяти партнеров;
- паритет (количество рожденных детей) и юный возраст при рождении первого ребенка;
- наличие других инфекций, передаваемых половым путем, бактериальный вагиноз, хронические воспалительные заболевания;
- игнорирование барьерной контрацепции;
- курение;
- альтернативные виды секса;
- частые внутриматочные вмешательства;
- вторичный иммунодефицит.
Может ли CIN, ассоциированная с ВПЧ, регрессировать самостоятельно? Установлено, что дисплазия слабо выраженной степени (CIN I) регрессирует в 57% случаев, в 32% – персистирует, но инвазивный рак развивается в 1% случаев. При CIN II регрессия наблюдается в 43% случаев, персистенция – в 35%. В 22% случаев патологический процесс прогрессирует, причем инвазивный рак формируется у 5% женщин. Даже у женщин с CIN III, которая считается абсолютным предраковым состоянием, в 32% случаев возможна регрессия. HSIL – CIN II и CIN III развивается, как правило, в течение трех лет с момента инфицирования у 27% женщин 5 .
Таким образом, можно выделить два ключевых момента, связанных с ВПЧ и воспалением, – исходное наличие воспалительного процесса в шейке матки и активацию воспалительного процесса на фоне дисплазии. Данные процессы взаимосвязаны: ВПЧ способствует воспалению, воспаление – прогрессированию ВПЧ. Возникает состояние, которое называется ВПЧ-ассоциированным цервицитом. ВПЧ-ассоциированный цервицит характеризуют упорное течение с низкой эффективностью стандартных методов лечения, высокая частота дисбиотических состояний влагалища. В 30% случаев заболевание сопровождается формированием острых кондилом. При ВПЧ-ассоциированном цервиците обнаруживается сочетанная ВПЧ-инфекция из двух-трех вирусов с доминированием ВПЧ 16-го типа, а также нетяжелые атипические изменения эпителия у 19% и умеренные у 4,5% женщин 7 .
В настоящее время хорошо известно, что в развитии неопластических процессов в тканях шейки матки участвуют метаболиты эстрогенов. ВПЧ негативно влияет на обмен эстрадиола в клетках эпителия шейки матки. В норме концентрация метаболита эстрогена 2-гидрокисэстрона (2-ОНЕ1) превышает концентрацию 16-гидроксиэстрона (16-ОНЕ1). При персистенции ВПЧ в цервикальном эпителии образуется аномально высокое количество 16-альфа-ОНЕ1, что усиливает клеточную пролиферацию. Накопление же 4-гидроксиэстрона (4-ОНЕ1) на фоне ВПЧ вызывает перерождение клеток-мишеней, приводя к развитию злокачественных новообразований 8 .
Сегодня активно изучается новая концепция развития РШМ – поражение стволовых клеток в области зоны трансформации, которое приводит к быстрому прогрессированию злокачественного процесса. ВПЧ поражает полипотентные стволовые клетки под цилиндрическим эпителием эктопии, в формирующейся зоне трансформации с ее верхней границей – переходной зоной, а также в расположенном выше канале и эндоцервикальных криптах. Поэтому при поражении ВПЧ стволовых клеток быстро формируется CIN II и III, и в течение одного года или двух лет развивается РШМ.
Для диагностики патологии шейки матки используют:
- цитологическое исследование;
- ВПЧ-тестирование;
- молекулярные маркеры;
- кольпоскопическое исследование.
Биопсия и выскабливание цервикального канала обязательны при наличии цитологических и кольпоскопических признаков атипичного эпителия.
В России рекомендовано проведение скрининга для выявления патологии шейки матки. Цитологическое исследование женщинам в возрасте 21–29 лет выполняется один раз в три года, цитологический скрининг и ВПЧ-тестирование в возрасте 30–65 лет – один раз в пять лет или только цитология – ежегодно после 40 лет.
Согласно рекомендациям Американского общества кольпоскопии и патологии шейки матки и 24 международных сообществ, женщинам с выявленным ВПЧ проводят цитологический скрининг с 21 года. Существует два подхода к наблюдению за пациентками с CIN: консервативное с цитологическим исследованием, обследованием на ВПЧ, выполнением кольпоскопии и биопсии шейки матки и проведение эксцизионных процедур или аблации переходной зоны. Как правило, консервативное наблюдение рекомендуется женщинам до 24 лет, даже при наличии CIN II 10 .
По мнению российских экспертов, у молодых женщин и/или планирующих беременность пациенток с морфологически подтвержденным диагнозом LSIL (признаки ВПЧ-инфекции, койлоцитоз, CIN I) также предпочтительна выжидательная тактика с динамическим наблюдением за состоянием шейки матки в течение 18–24 месяцев в виде цитологического контроля один раз в шесть месяцев и ВПЧ-тестирования один раз в 12 месяцев. Хирургическое лечение проводится в отсутствие регрессии через 18–24 месяца.
У женщин до 25 лет с диагнозом CIN II в биоптате при р16-негативном результате иммуногистохимического исследования допустимо динамическое наблюдение с использованием цитологического контроля, ВПЧ-тестирования и кольпоскопии один раз в шесть месяцев в течение двух лет.
Женщинам старше 40 лет с CIN I в биоптате эктоцервикса целесообразно проводить петлевую эксцизию зоны трансформации 11 .
Таким образом, консервативное лечение показано:
- женщинам с малыми формами поражений ВПЧ – латентной персистирующей инфекцией, которая не исчезает через 12 месяцев персистенции;
- молодым женщинам с выявленными клетками плоского эпителия с атипией неясного значения (ASCUS), CIN I, CIN II шейки матки при p16-негативном или слабоположительном результате;
- пациенткам с хроническим цервицитом бактериальным или ВПЧ-ассоциированным;
- после хирургического лечения CIN II и CIN III для профилактики рецидива.
На сегодняшний день наиболее эффективными в терапии ВПЧ-ассоциированных поражений шейки матки признаны лекарственные средства, регулирующие работу эпигенетических механизмов. К таким препаратам относят дииндолилметан (Цервикон-ДИМ), эпигаллокатехин-3-галлат (Эпигаллат), индолкарбинол (Индинол Форто). Целесообразно также добавление к диете биологически активной добавки (БАД) Промисан, содержащей индол-3-карбинол и эпигаллокатехин-3-галлат.
Указанные препараты обладают уникальными свойствами. Они воздействуют на основные звенья патогенеза диспластических процессов шейки. На фоне эпигенетической терапии препаратами на основе индол-3-карбинола, дииндолилметана, а также БАД, содержащей эпигаллокатехин-3-галлат, при цервиците, ассоциированном с ВПЧ, происходят избирательный апоптоз и элиминация вирус-инфицированных клеток, тормозится образование агрессивных метаболитов эстрадиола, вследствие чего блокируется переход вирус-инфицированных клеток в злокачественные. Кроме того, блокируется синтез вирусного онкобелка Е7, восстанавливается активность эндогенного интерферона и повышается чувствительность к экзогенному интерферону. Восстанавливаются функциональные возможности иммунной системы шейки матки и влагалища. Эпигенетическая терапия также способствует деметилированию генов пролиферации и противоопухолевой защиты, блокаде стволовых опухолевых клеток.
В многочисленных исследованиях доказана прямая противомикробная и противовирусная активность эпигаллокатехин-3-галлата (активного компонента БАД Эпигаллат) в отношении широкого спектра возбудителей, таких как Staphylococcus aureus, Chlamydia trachomatis, Mycoplasma, Escherichia coli, герпесвирусы, аденовирусы, энтеровирусы, вирусы гепатита и гриппа. Кроме того, в последних публикациях сказано, что эпигаллокатехин-3-галлат способствует подавлению пролиферации клеток рака шейки матки, блокированию ангиогенеза 12 .
При ВПЧ-ассоциированном цервиците и CIN рекомендовано использование эпигаллокатехин-3-галлата в качестве БАД в комбинации с препаратом дииндолилметана для интравагинального введения Цервикон-ДИМ.
Лекарственный препарат Цервикон-ДИМ на основе метаболита действующего вещества индол-3-карбинола – дииндолилметана разработан для безопасной и эффективной терапии диспластических заболеваний шейки матки. Цервикон-ДИМ стимулирует апоптоз и ускоряет элиминацию инфицированных ВПЧ и трансформированных клеток, нормализует метаболизм эстрадиола в ВПЧ-инфицированных клетках, усиливает неспецифический иммунный ответ на инфекцию. Цервикон-ДИМ непосредственно воздействует на патогенез CIN и препятствует опухолевой трансформации. Дииндолилметан относится к практически нетоксичным препаратам. При интравагинальном применении Цервикон-ДИМ демонстрирует высокую местную биодоступность, при этом он практически не попадает в системный кровоток. Показанием для применения препарата Цервикон-ДИМ является лечение дисплазии (CIN) шейки матки независимо от результатов выявления папилломавирусной инфекции методом полимеразной цепной реакции. Использование препарата Цервикон-ДИМ оправданно и в случае субклинического течения ВПЧ-инфекции для профилактики развития CIN шейки матки.
Цервикон-ДИМ применяют интравагинально по 100 мг два раза в сутки, длительность курса – 3–6 месяцев. Продолжительность курса лечения определяется динамикой клинико-лабораторных показателей.
Эффективность препарата Цервикон-ДИМ подтверждена в клинических исследованиях. Так, в многоцентровом рандомизированном плацебоконтролируемом двойном слепом исследовании на фоне применения дииндолилметана в виде интравагинальных суппозиториев в дозе 200 мг (100 мг два раза в сутки) у пациенток с CIN I–II в течение 180 дней наблюдалась полная регрессия CIN 13 .
Назначая эпигенетическую терапию женщинам с ВПЧ-инфекцией, врач должен учитывать такой важный момент, как наличие дисбиоза влагалища или бактериального вагиноза. Установлена тесная взаимосвязь между инфекцией ВПЧ и обогащением бактериями. В частности, бактерии рода Sneathia ассоциируются с новообразованиями шейки матки, бактерии рода Prevotella – со стойкой инфекцией ВПЧ 14 .
Дисбиоз и бактериальный вагиноз приводят к увеличению восприимчивости к инфекции ВПЧ шейки матки, вирусной адгезии, инвазии ВПЧ в геном клетки, прогрессированию CIN. Не случайно лечение бактериального вагиноза связывают с лучшим исходом поражений шейки матки 15 .
При бактериальном вагинозе, трихомонадном и кандидозном вагините, смешанных вагинальных инфекциях применяют препарат Нео-Пенотран Форте. Суппозитории препарата Нео-Пенотран Форте содержат метронидазол, характеризующийся антибактериальным и противотрихомонадным эффектами, и миконазол, оказывающий противогрибковое действие.
В исследовании микробиологические показатели излечения на фоне терапии препаратом Нео-Пенотран Форте были получены в 100% случаев для трихомониаза, в 96,2% – для бактериального вагиноза и 90% – для кандидоза. При смешанных инфекциях общий микробиологический показатель излечения достиг 92%.
Применение препарата Нео-Пенотран Форте, содержащего метронидазол и миконазол, считается клинически доказанным медицинским подходом к лечению вагинальных инфекций с точки зрения эффективности и скорости достижения результата.
Итак, терапевтическое действие препарата Цервикон-ДИМ при дисплазии шейки матки можно усилить предварительным лечением бактериального вагиноза, совместным применением БАД Эпигаллат и иммуномодуляторов.
В частности, лечение ВПЧ-ассоциированного цервицита с CIN I на первом этапе предполагает проведение антибактериальной терапии (амоксициллин/клавуланат и джозамицин) и назначение БАД Эпигаллат 270 мг три раза в день. При наличии бактериального вагиноза или кольпита показана терапия препаратами Нео-Пенотран или Гайномакс в сочетании с пробиотиками. На втором этапе лечения к БАД Эпигаллат добавляют интравагинальный препарат Цервикон-ДИМ по одной свече два раза в сутки в течение трех месяцев. При CIN II у молодых женщин терапию препаратом Цервикон-ДИМ целесообразно сочетать с Эпигаллатом и Полиоксидонием. Как известно, Полиоксидоний воздействует на все звенья иммунитета, в том числе эффективен при наличии ВПЧ-инфекции.
Таким образом, тактика ведения пациенток с поражением шейки матки, ассоциированным с ВПЧ, должна быть комплексной с применением средств эпигенетического действия.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
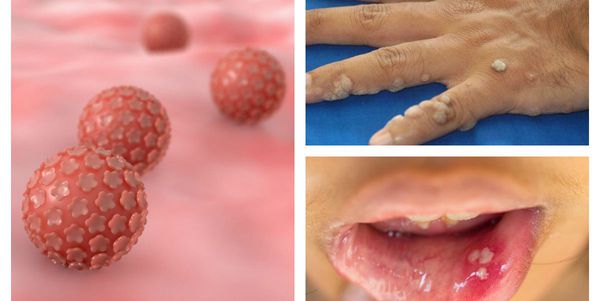
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
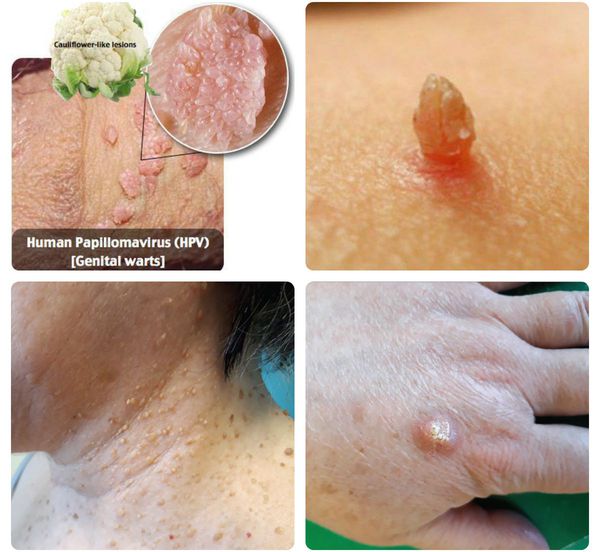
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
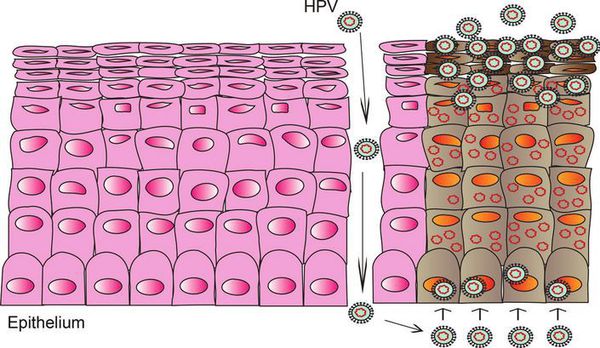
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
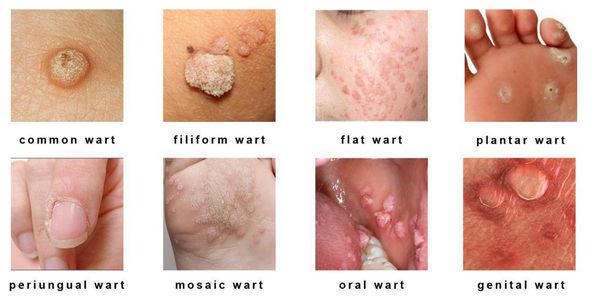
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
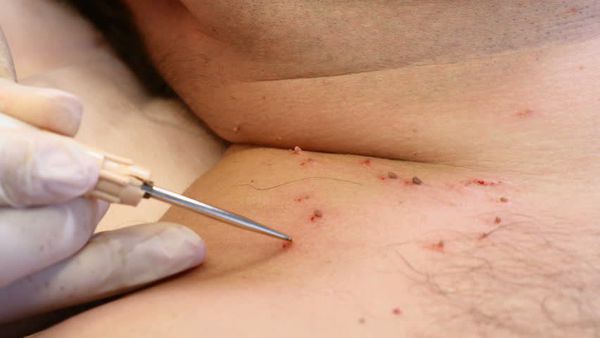
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
В.Н. Прилепская,
заместитель директора, руководитель отделения ФГУ "Научный центр акушерства, гинекологии и перинатологии" Росмедтехнологий, профессор, доктор медицинских наук, заслуженный деятель науки РФ
— Вера Николаевна, каковы особенности и распространенность папилломавирусной инфекции (ПВИ) у женщин?
— Главной особенностью ПВИ сегодня считают ее широкое распространение (до 70% юных женщин, как считают некоторые авторы, инфицированы данным вирусом) и транзиторность, т.е. способность исчезать у некоторых женщин вне зависимости от лечения. Причем ПВИ и обусловленная ею цервикальная неоплазия могут рецидивировать и после лечения, поскольку вирус способен находиться длительное время в организме и активизироваться в любой момент, что заставляет ученых искать методы воздействия на сам вирус.
Еще одной особенностью ПВИ является ее способность активизироваться на фоне сниженного системного и локального иммунитета.
Несомненной представляется ведущая роль вируса папилломы человека (ВПЧ) в генезе рака шейки матки. ВПЧ также может инициировать и поддерживать хронические воспалительные процессы нижнего отдела гениталий, поскольку при ВПЧ-индуцированном изменении структуры эпителия создаются предпосылки для манифестации вирусных, бактериальных, протозойных, грибковых и других инфекций.
— Как проявляется ВПЧ-ассоциированная патология?
— Самыми разнообразными формами. Наиболее часто встречаются следующие из них:
экзофитные формы (генитальные или венерические бородавки) включают разнообразные по внешнему виду и размеру остроконечные, опухолеподобные и папуловидные образования;
эндофитные формы (или субклиническая папилломавирусная инфекция) представляют собой различные морфологические изменения плоского эпителия без наружных разрастаний;
цервикальные интраэпителиальные неоплазии и рак шейки матки также считают следствием инфицирования ВПЧ.
К латентной ПВИ относят бессимптомное ВПЧ-носительство без каких-либо клинических проявлений, выявляемое с помощью молекулярно-биологических методов.
— Влияет ли ВПЧ на плод, если мать заражена?
— Риск передачи ВПЧ плоду, хотя и невелик, но существует. Как следствие, у новорожденного может развиться папилломатоз гортани. Есть данные, что ВПЧ часто обнаруживают в тканях выкидышей
— Как обследовать женщин с ПВИ?
— Существуют специальные методы обследования, которые позволяют определить тип ВПЧ, локализацию процесса, морфологические особенности и т.п. Это кольпоскопия, ВПЧ-Дайджин тест или ПЦР, биопсия тканей при необходимости и гистологическое исследование. Важное значение имеет обследование пациентки с целью выявления факторов риска инфекции и их устранения, а также диагностики у нее сопутствующей патологии и глубины папилломавирусного поражения тканей.
— Могли бы вы подробнее остановиться на существующих современных подходах к терапии ПВИ?
— Лекарственных средств, позволяющих полностью удалить вирус, на сегодняшний день еще не существует.
Ведущим методом продолжает оставаться физиохирургическое лечение, позволяющее удалить атипически измененный эпителий и экзофитные кондиломы.
К сожалению, деструктивное лечение ВПЧ-ассоциированной патологии тоже не всегда эффективно и сопровождается рецидивами и даже резкой манифестацией процесса.
Предлагаются методы комбинированного деструктивного лечения эндофитных и экзофитных папилломавирусных поражений шейки матки с одновременным назначением иммунопрепаратов, снижающих активность вируса и повышающих иммунитет. Разумная иммунокоррекция повышает эффективность терапии и снижает вероятность рецидива, ее принято рекомендовать при обширных рецидивирующих поражениях под контролем иммунограммы за 7—10 дней до деструктивного лечения. В комплекс терапии включают препараты локального действия для стимуляции иммунитета в области очагов поражения и препаратов системного действия (интерферонов и их индукторов, синтетических иммуномодуляторов и др.).
— Какие препараты, представленные на российском рынке, наиболее соответствуют современным подходам к лечению ПВИ?
— На российском аптечном рынке представлено множество препаратов — активаторов иммунитета и противовирусных средств. К сожалению, они не удаляют вирус папилломы и не решают проблему в комплексе. Традиционно применяют подофиллотоксин, имеющий свои преимущества и недостатки. Из отечественных препаратов можно отметить ряд средств для локального и системного применения.
Одним из современных и наиболее хорошо себя зарекомендовавших препаратов является Изопринозин ® компании Teva, сочетающий в себе противовирусное и иммуномодулирующее действие (инозин пранобекс). Как антивирусное средство он подавляет репликацию ДНК- и РНК-вирусов за счет связывания с рибосомой клетки и изменения ее стереохимического строения.
Кроме противовирусного действия Изопринозин ® обладает и иммуномодулирующим свойством за счет комплекса инозина, что повышает его доступность для лимфоцитов. Изопринозин ® стимулирует неспецифический иммунитет, усиливает продукцию интерлейкинов, повышая синтез антител, стимулирует хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфноядерных клеток. Фармакокинетика препарата хорошо изучена.
Изопринозин ® успешно и давно применяется для лечения разных вирусных инфекций у пациентов с нормальной и ослабленной иммунной системой, в т.ч. при заболеваниях, вызванных ВПЧ, вирусами Herpes simplex 1 и 2 типов, цитомегаловирусом, вирусом Эпштейна—Барр; при хронических инфекционных заболеваниях мочевыводящей и дыхательной систем; для профилактики инфекций при стрессовых ситуациях и др. Имеются данные об успешном применении Изопринозина ® при лечении остроконечных кондилом, генитального герпеса, папилломавирусной инфекции шейки матки (Забелев А.В. с соавт., 2005; Роговская С.И. с соавт., 2006), CIN и даже рака шейки матки — cancer in situ (Кедрова А.Г. с соавт., 2005; Российский онкологический научный центр им. Н.Н. Блохина РАМН), т.к. персистенция вируса является ключевым фактором для возникновения рецидива заболевания.
— Как вы оцениваете эффективность использования препарата Изопринозин ® ?
— Мы применяем его для лечения не только ВПЧ-инфекции, но и при других рецидивирующих труднолечимых формах воспалительных заболеваний гениталий. Так, например, эффективность комбинированного лечения (этиотропный препарат, Изопринозин ® и аблация) была изучена нами в поликлиническом отделении центра на группе больных с гистологически подтвержденными субклиническими формами ПВИ, CIN I (цервикальными интраэпителиальными неоплазиями) на фоне хронического цервицита сочетанной этиологии. Кольпоскопическая картина у всех пациенток представляла собой низкоатипическую зону трансформации и хронический цервицит.
Последующее наблюдение за пациентками и полученные данные свидетельствуют, что эффективность комбинированного лечения с применением Изопринозина ® была выше и составила 87,5%, в то время как при монодеструкции — 65,6%. Особенно важно, что частота рецидивирования папилломавирусной инфекции к 6-му месяцу наблюдения в группе женщин, использующих Изопринозин ® , была в 3 раза ниже. При комплексной схеме лечения выявили более высокую частоту очищения от ВПЧ через 6 месяцев (65,6 и 46,9% соответственно) и более качественную эпителизацию.
Изопринозин ® показал себя и как эффективный препарат для монотерапии при субклинических формах ПВИ и мелких остроконечных кондиломах, что позволяет в ряде случаев избежать необходимости их болезненного деструктивного лечения.
Таким образом, двойное действие Изопринозина ® — противовирусное и иммуномодулирующее — определяет его эффективность для терапии папилломавирусной инфекции. Он подавляет персистенцию вирусов и препятствует рецидивированию папилломавирусной инфекции.
— Каковы современные подходы к профилактике ПВИ?
— По-прежнему большое значение имеет широкая санитарно-просветительная работа среди населения, а также целенаправленное консультирование, в первую очередь среди женщин группы риска. Необходимо пересматривать программы скрининга с учетом таких современных возможностей, как, например, жидкостная цитология, ВПЧ-тест и др. Определенные надежды связываются и с вакцинированием основных типов ВПЧ. Сегодня уже делаются первые шаги в этом направлении.
Читайте также:

