Питательные среды для микоза
Обновлено: 19.04.2024
Инфекция с участием грибов рода Candida spp. в настоящее время имеет устойчивый статус актуальной клинической проблемы. В последние годы грибы как возбудители болезней приобретают все больший удельный вес в структуре заболеваемости. Борьба с микозами, их ранняя диагностика и терапия требуют многосторонних знаний о мицелиальных и тканевых формах возбудителей, использования иммунологических методов исследований и целенаправленного эпидемиологического обследования с выявления факторов, определяющих динамику развития микотических поражений [1].
Основная масса грибов относится к условно патогенным микробам (УПМ). Являясь составной частью окружающей среды, некоторые свободно живущие виды грибов, контактируя с организмом в условиях сниженного иммунного статуса, колонизируют биотопы организма, вызывая развитие ГВЗ. Чаще всего микотические поражения человека вызывают дрожжеподобные грибы рода Candida: C. albicans, C. glabrata, C. parapsilosis, C. tropicalis, реже других видов. Возрастание случаев микозов среди населения связано с ухудшением экологических условий, нерациональным использованием антибиотиков, увеличением в популяции доли иммуноком- прометированных лиц. Дифференциацию дрожжеподобных возбудителей проводят по культуральным, морфологическим и тинкториальным, ферментативным и антигенным свойствам. Существуют тест-системы, облегчающие работу микробиологов по идентификации дрожжеподобных грибов, в тоже время необходимость изучения ферментативной и ассимиляционной способности грибов по стандартным методикам, остается актуальной. В ГНЦ ПМБ поставлена задача разработки среды для выделения грибов, содержащей в своем составе глюкозу, утилизируемую всеми грибами рода Candida.
Для выделения и количественного учёта C. albicans при санитарно-микологических исследованиях в среды добавляются антибиотики, 2% раствор теллурита калия, метабисульфит натрия или калия.
Белковой основой классического варианта среды Сабуро является пептон (мясной или казеиновый). В ГНЦ ПМБ белковой основой разрабатываемых сред является панкреатический гидролизат рыбной муки и панкреатический гидролизат казеина, обеспечивающие питательные потребности не только широкого круга бактерий, но и грибов.
Цель исследования
Изучение диагностической ценности (специфическая активность: чувствительность, скорость роста, стабильность основных биологических свойств микроорганизмов, дифференцирующие и ингибирующие свойства), питательной среды для выращивания и подсчёта числа дрожжевых и плесневых грибов № 2 ГРМ (Сабуро) в сравнительных испытаниях с коммерческими препаратами, выпускаемыми в соответствии с нормативной документацией и в период их срока годности.
Проведена сравнительная оценка качества питательной среды Сабуро отечественного (ФГУН ГНЦ ПМБ) и импортного производства (Pronadisa, HiMedia). Отечественная среда Сабуро ГНЦ ПМБ намного дешевле импортных. Состав питательной среды № 2 ГРМ Сабуро обеспечивает чёткие морфологические признаки, являющиеся основой дифференциальной диагностики грибов рода Candida от других дрожжеподобных грибов, плесневых грибов и микробов-ассоциантов. Качество питательной среды Сабуро производства ГНЦ ПМБ не уступает импортным аналогам по всем параметрам, а по некоторым показателям превосходит их.
Материалы и методы
Материалами для исследования служили питательная среда № 2 ГРМ (Сабуро), питательные агары Сабуро различных фирм-производителей: Sabouraud Dextrose Agar (Pronadisa, Испания) и Sabouraud Dextrose Agar (HiMedia, Индия), в качестве ингибитора использовался 2% раствор теллурита калия.
Для определения специфической активности сравниваемых питательных сред использовались следующие музейные тест-штаммы микроорганизмов: Candida albicans, Aspergillus niger, Bacillus cereus, Staphylococcus aureus, Enterobacter cloacae, Enterobacter aerogenes, Escherichia coli, Enterococcus faecalis, Staphylococcus epidermidis, получены из ГИСК им. Л. А. Тарасе- вича, а также отдела коллекционных культур ФГУН ГНЦ ПМБ.
При работе использовали общепринятые физико-химические методы контроля, в том числе регламентируемые в соответствии с ТУ на питательные среды аналогичного назначения, в соответствии с МУК 4.2.2316-08 [3].
- Определение внешнего вида.
- Определение растворимости.
- Определение прозрачности и цветности раствора.
- Определение рН.
- Определение потери в массе при высушивании.
- Определение аминного азота.
- Определение хлоридов (в пересчёте на натрия хлорид).
- Определение прочности студня среды.
Чувствительность, скорость роста, ингибирующие свойства изучали в соответствии с МУК 4.2.2316-08 [3], а также инструкциями по применению на коммерческие питательные среды, инструкцией по применению на питательную среду № 2 ГРМ (Сабуро). Качественное определение общего числа дрожжевых и плесневых грибов проводили по методике, изложенной в ГосФармокопеи XI [4].
Производство питательной среды № 2 ГРМ (Сабуро) основано на применении гидролизата, имеющего низкий рН. Кислотность среды в значительной степени подавляет рост сопутствующей микрофлоры, но при этом не препятствует хорошему росту грибов рода Candida. Поскольку культуральный метод предполагает посев материала на плотные питательные среды с последующим выделением и идентификацией чистой культуры микроорганизма, для придания среде № 2 ГРМ (Сабуро) дополнительных селективных свойств, нами рекомендуется применение 2% раствора теллурита калия [4].
Результаты и обсуждение
На первом этапе исследований изучен компонентный состав ведущих зарубежных фирм (табл. 1), а также химические свойства разработанной питательной среды № 2 ГРМ (Сабуро) в сравнении с аналогами (табл. 2).
Сравнительный анализ физико-химических характеристик показал, что питательные агары Сабуро различных фирм-производителей: Sabouraud Dextrose Agar (Pronadisa, Испания) и Sabouraud Dextrose Agar (HiMedia, Индия) по химическим характеристикам совпадают с питательной средой № 2 ГРМ (Сабуро), за исключением показателя по прочности геля. Уменьшение концентрации агара не повлияло на основные биологические показатели среды.
Приведённые данные являются средними значениями результатов, по меньшей мере, трёх измерений.
Таблица 1: Составы питательных агаров Сабуро различных производителей
Микологический пептон - 10,0
Глюкоза - 40,0
Агар-агар - 15,0 pH 5,6±0,2
Dextrose - 40,0
Mixture of peptic digest of animal tissue and pancreatic digest of casein - 10,0
Bacteriological agar - 15,0 pH 5,6±0,2
ПГРМ - 10,0 ПГК - 10,0
Дрожжевой экстракт - 2,0
Натрия фосфат однозамещенный - 2,0Глюкоза - 40,0
Агар микробиологический - 10,0±3,0 рН 6,0±0,3
Таблица 2: Физико-химические характеристики питательных агаров Сабуро различных фирм
| Наименование сред | рН | Аминный азот, % | Потеря в массе при высушивании, % | Прочность, г (по Валенту) |
|---|---|---|---|---|
| HiMedia | ||||
| Sabouraud Dextrose Agar | 5,9 | 1,2 | 2,1 | 621 |
| Merck | ||||
| Sabouraud Dextrose Agar | 5,65 | 1,0 | 4,2 | 681 |
| ГНЦ ПМБ | ||||
| Среда № 2 ГРМ с. 295 | 6,3 | 1,4 | 2,5 | 380 |
Следующим этапом исследований было сравнение чувствительности агаров Сабуро. Все питательные среды готовились по соответствующим методикам без ингибитора и с применением 2% раствора теллурита калия (5,0 мл на 1 л готовой среды). Чувствительность среды определяли по наибольшему разведению, обеспечивающему формирование колоний Candida spp. на всех засеянных чашках Петри. Для этого из приготовленных разведений (10-5, 10-6, 10-7) брали по 0,1 мл взвеси, содержащей соответственно 1000, 100 и 10 клеток и внесли в хорошо просушенные чашки Петри с агарами Сабуро. Инокулят тщательно распределяли по поверхности среды, используя стерильные шпатели, инкубировали при температуре (33±1)° С. Параллельно делали высевы на ГРМ-агар (для контроля роста). Учёт результатов проводили через 12, 18, 24, 48 ч инкубации с целью определения скорости роста.
Результаты представлены в табл. 3.
Таблица 3: Сравнительная характеристика питательных агаров Сабуро по биологическим показателям
Данные, представленные в табл. 3, получены через 48 ч инкубации, так как через 12 и 24 ч инкубации колонии на агарах Сабуро с теллуритом калия ещё недостаточно сформированы. Оптимальным временем инкубации следует считать 40-48ч ч при температуре (33±1)° С.
Далее определяли показатель ингибиции по отношению к микробам-ассоциантам B. ce- reus, S. aureus, E. cloacae, E. aerogenes, E. coli, E. faecalis, S. epidermidis. При определении показателя ингибиции посевная доза микробов-ассоциантов должна превышать посевную дозу патогенной микрофлоры более чем в 100 раз. Приготовлены взвеси тест-штаммов, содержащие 105, 106, м.к./мл. Для придания агарам Сабуро селективных свойств, в качестве ингибиторов использовали 2% раствора теллурита калия (5 мл на 1 л среды), антибиотики (циклогексимид 0,4 г/мл, пенициллин 20 ЕД, стрептомицин 40 мг/мл), метабисульфит натрия (2 г/л).
Добавление в среду ингибиторов подавляет рост всей сопутствующей микрофлоры. Рост тест-штаммов C.
A. niger на питательных агарах Сабуро имели типичную морфологию:
C. albicans — гладкие, выпуклые белого цвета, в виде полусферы с ровным краем. Aspergillus niger имели разветвлённый, многоядерный мицелий чёрного цвета. Колонии C. albicans в присутствии теллурита калия приобретают чёрную окраску.
Выводы
Анализируя результаты по определению чувствительности разрабатываемой среды и скорости роста можно сделать вывод о высокой чувствительности среды, так как на всех засеянных чашках при посеве тест-штаммов из разведений 10-5, 10-6, 10-7 грибы рода Candida вырастали в виде хорошо сформированных, более крупных, чем на коммерческих средах, колоний (рис.1).
Рис. 1. Рост колоний Candida spp. на среде Сабуро разных производителей.
Интенсивность окрашивания, характерная для Candida в присутствии теллурита калия, ярче выражена на питательной среде № 2 ГРМ (Сабуро), чем на Sabouraud Dextrose Agar (Pron- adisa) и Sabouraud Dextrose Agar (HiMedia) (рис. 2).
Состав питательной среды № 2 ГРМ (Сабуро) обеспечивает чёткие морфологические признаки, являющиеся основой дифференциальной диагностики грибов рода Candida от других дрожжеподобных грибов, плесневых грибов и микробов-ассоциантов.
Рис. 2. Рост колоний Candida spp. на среде Сабуро разных производителей в присутствии теллурита калия.
Изобретение относится к микробиологии и может быть использовано в диагностических целях для выделения и идентификации возбудителей микозов у животных. Способ предусматривает смешивание ферментативного пептона, глюкозы, янтарной кислоты, агара и дистиллированной воды в заданном соотношении компонентов с получением питательной среды. Полученную питательную среду нагревают до кипения. После нагревания и расплавления агара среду фильтруют через ватно-марлевый фильтр. Вновь доводят до кипения и охлаждают до 45-50°С. Изобретение позволяет сократить сроки приготовления питательной среды и повысить ее селективность. 2 ил., 1 табл.


Формула изобретения
Способ приготовления питательной среды для выделения возбудителей микозов у животных, включающий смешивание ферментативного пептона, глюкозы, агара растворение их в дистиллированной воде, нагрев смеси до кипения, отличающийся тем, что добавляют янтарную кислоту при следующем соотношении компонентов, мас.%:
| ферментативный пептон | 9-11 |
| глюкоза | 10-20 |
| янтарная кислота | 1-2 |
| агар | 14-16 |
| дистиллированная вода | остальное, |
затем полученную среду фильтруют, вновь доводят до кипения, охлаждают и фасуют.
Описание изобретения к патенту
Изобретение относится к микробиологии и может быть использовано в диагностических целях для выделения и изучения свойств возбудителей микозов у животных.
Возбудителями микозов у животных могут быть различные совершенные грибы из класса фикомицетов - плесневые грибы, дрожжеподобные грибы, а также дерматомицеты (Ветеринарная микробиология и иммунология. / Под ред. Н.А.Радчука. - М.: Агропромиздат, 1991. - С.341).
По своим физиологическим свойствам они не требовательны к питательным средам, поэтому могут расти на простых искусственных средах, широко используемые в микробиологии - мясо-пептонном бульоне и мясо-пептонном агаре. Однако интенсивность их развития из споровой до вегетативной формы составляет несколько дней, поэтому при посеве патологического материала (пораженные волосы и чешуйки кожи) раньше вырастают различные сапротрофные бактерии (т.к. период деления многих из них составляет 15-30 мин), которые являются конкурентами и антагонистами грибов. Данное обстоятельство побуждает микробиологов использовать специальные среды.
Одной из наиболее близких сред к заявляемому способу (прототип) для выделения и выращивания возбудителей микозов человека и животных является среда Сабуро (Н.И.Розанов Микробиологическая диагностика заболеваний сельскохозяйственных животных / М.: Государственное из-во сельскохозяйственной литературы, 1952. - С.106;
Достоинством известной среды является то, что за счет высокого содержания углевода в ней, а следовательно, высокой осмотичности, сдерживается рост бактериальной микрофлоры, в отличие от грибной, которая хорошо развивается.
Между тем среда Сабуро имеет недостатки, которые заключаются в следующем:
1. Приготовление среды связано со значительными временными затратами, поскольку смешанные ингредиенты сначала кипятятся до расплавления агара, затем среда фильтруется, разливается по флаконам (колбам) и автоклавируется. Весь цикл приготовления среды занимает 3-4 ч.
Техническим решением задачи является обеспечение сокращения времени приготовления среды, повышение ее селективных свойств и экономичности.
Поставленная задача достигается тем, что в способе приготовления питательной среды для выделения возбудителей микозов у животных, включающем смешивание ферментативного пептона, глюкозы, агара, их растворение в дистиллированной воде, нагрев смеси до кипения, согласно изобретению добавляют янтарную кислоту при следующем соотношении компонентов, мас.%:
| ферментативный пептон | 9-11 |
| глюкоза | 10-20 |
| янтарная кислота | 1-2 |
| агар | 14-16 |
| дистиллированная вода | остальное, |
затем полученную среду фильтруют через фильтр, вновь доводят до кипения, охлаждают и фасуют.
Сущность изобретения поясняется фото, где на фото 1 представлен рост грибов на заявляемой питательной среде, где выросли только Aspergillus niger и Trichophyton rubrum; на фото 2 - рост грибов на среде Сабуро: помимо гриба Microsporum на среде выросли колонии бацилл (белого цвета) и микрококков (желтого цвета).
Способ приготовления питательной среды для выделения возбудителей микозов у животных осуществляется следующим образом.
Сухие ингредиенты среды растворяют в теплой воде и доводят до кипения, после расплавления агара среду фильтруют через ватно-марлевый фильтр, повторно доводят до кипения, а затем охлаждают до 45-50°С и разливают в стерильные чашки Петри. Готовая среда прозрачна, светло-желтого цвета.
На данной среде хорошо растут грибы из рода Candida, Microsporum, Trichophyton, Aspergilus, Mucor, Penicillum, Altemaria и др. Результаты сравнительного анализа заявляемого изобретения и аналога представлены в таблице, из которой видно, что заявляемая среда более выгодно отличается от аналога, т.к. на ней микроскопические грибы дают видимый рост и спорообразование в более ранние сроки, на ней полностью подавляется развитие сапротрофных бактерий, время приготовления среды в 5 раз короче, чем аналога. Кроме того, следует отметить, что в предлагаемой среде содержание глюкозы в 2 раза меньше, а следовательно, это также уменьшает стоимость среды. Данные обстоятельства позволяют считать заявляемую питательную среду как патентоспособную.
Количественное значение ввода в среду глюкозы и янтарной кислоты было подобрано экспериментально. При вводе янтарной кислоты в количестве 0,5-0,8 г на среде вырастали не только грибы, но и появлялись колонии бактерий. При увеличении ввода янтарной кислоты в количестве 2,2-2,5 г задерживался рост самих грибов. При уменьшении количества глюкозы до 5-8 г рост грибов замедлялся, а при увеличении ввода до 3-4 г - никак не сказывалось на ростовых характеристиках среды. Готовая для употребления (разлитая в чашки Петри) среда может храниться без изменения своих свойств в условиях холодильника в течение 10-15 дней, а разлитая в стерильные флаконы - до 6 месяцев.
Выделение грибов. Неселективные среды для грибов. Селективные среды для грибов. Выявление противогрибковых антител ( AT ). Выявление грибковых антигенов ( Аг ).
Культуральные условия и потребности роста у патогенных грибов отличаются от таковых у возбудителей бактериальных инфекций. Большинство патогенных грибов не требовательно к питательным средам и хорошо растёт в аэробных условиях.
Для роста грибов среды могут включать какой-либо органический источник углерода, неорганического азота в виде нитратов или аммонийных солей. рН питательных сред кислый (около 4,0—6,5)f большинство бактерий не способно расти в подобных условиях. Среди витаминов большинство грибов нуждется в водорастворимых (например, биотине, рибофлавине, тиамине и др.). Большинство патогенных видов мезофилы и растёт в интервале температур 20-45 °С.
При выделении грибов обычно делают парные посевы, один из которых инкубируют при 25 °С, а второй — при 37 °С; подобная манипуляция позволяет выявить возможный диморфизм. Идентификацию возбудителя проводят по морфологическим и биохимическим признакам. В практической работе обычно используют два типа сред — неселективные и селективные.
Неселективные среды для грибов
Наиболее распространён агар Сабуро — пептонный агар с мальтозой (или глюкозой). Его отличает высокое содержание углеводов, ингибирующее размножение бактерий. Также используют МПА, картофельно-декстрозный агар, агар Чапека-Докса, дрожжевой агар, сусло-агар и др. Нередко среды модифицируют добавлением антибиотиков, циклогексимида или хлоргексидика. Для выделения прихотливых патогенов (например, Blastomyces dermatitidis и Histoplasma capsulatum) в качестве обогащенных сред применяют 5-10% КА, дополненный сердечным и мозговым экстрактом, либо асцитический агар. После образования колоний следу-ет делать пересев на более простые среды, например картофельно-декстрозный агар или среду Сабуро, на которых можно быстрее выявить споруляцию возбудителей.
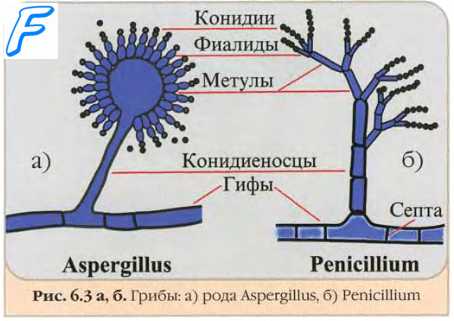
Селективные среды для грибов
Селективные среды для грибов обычно получают на основе неселективных, с добавлением пенициллина (20 ЕД/мл), стрептомицина (40 ЕД/мл) или гентамицина (0,5 мкг/мл), левомицетина (16 мкг/мл). Для ингибирования бурного роста плесеней, подавляющих медленно растущие диморфные грибы, в среды вносят циклогексимид (0,5 мкг/мл). Следует помнить, что препарат подавляет рост некоторых патогенных грибов (например, Cryptococcus neoformans и Aspergillus fumigatus).
Выявление противогрибковых антител ( AT ). Выявление грибковых антигенов ( Аг )
Наиболее часто применяют реакцию латекс-агглютинации (выявляет IgM), PCK (выявляет IgG) и ИФА. Результаты реакций часто могут быть сомнительными вследствие перекрёстного реагирования с Аг различных грибов. Тем не менее идентификация AT или циркулирующих Аг в крови, СМЖ и моче позволяет установить диагноз до получения результатов посевов.
Кожные пробы ранее были одним из популярных методов диагностики микозов, однако их неспецифичность ограничивает диагностическую ценность. В настоящее время их чаще используют для изучения иммунной прослойки в популяции при эпидемиологических исследованиях.
Гибридизация нуклеиновых кислот — новый метод идентификации патогенных грибов, разработанный для определения основных возбудителей системных микозов — бласто-, крипто- и кокцидиоидомикозов, а также гистоплазмоза. Для постановки реакции проводят экстракцию РНК из культуры и вносят одно цепочечные молекулы ДНК, меченные флюоресцеином. При наличии в культуре одного из четырёх указанных возбудителей происходит гибридизация соответствующей ДНК с РНК патогена с образованием легко обнаруживаемого комплекса. Основное достоинство метода — возможность применения на ранних сроках (5 сут) в культурах, содержащих мицелиальные и дрожжевые формы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика микозов - методы исследования, критерии
Прецизионная диагностика инвазивных микозов нелегка. Это объясняется не только трудностями в получении культуры грибов, но и в интерпретации результатов исследований, поскольку грибами, как дрожжевыми, так и мицелиальными, возможны колонизация слизистых оболочек, контаминация исследуемых образцов. В связи с этим диагностика инвазивных микозов базируется на комплексном подходе, включающем не только результаты микологических (культуральных) и серологических (определение антигена грибов) исследований, но и клинические симптомы грибковой инфекции, данные вспомогательных методов исследований (компьютерная или магнитно-резонансная томография, ультразвуковое исследование).
Европейско-американской кооперированной группой по изучению инвазивных микозов у иммунокомпрометированных больных разработаны критерии диагностики инвазивных микозов. Они представлены в 2001 г. на Международной конференции по антимикробным препаратам и химиотерапии (ICAAC, Chicago), а в 2002 г. в печати. Определены критерии доказанного, вероятного и возможного инвазивного микоза, которые рекомендуется использовать при клинических и эпидемиологических исследованиях
Доказанный инвазивный микоз, вызванный мицелиальными грибами: обнаружение мицелия грибов в биоптатах либо аспиратах при гистологическом или цитологическом исследовании или выделение культуры из образцов, полученных в асептических условиях из стерильного в норме очага, который по результатам клинического и радиологического исследований связан с инфекцией, за исключением исследований мочи и со слизистых оболочек.
Доказанный инвазивный микоз, вызванный дрожжевыми грибами: обнаружение дрожжевых клеток (грибы рода Candida могут формировать псевдомицелий или истинный мицелий) в биоптатах или аспиратах, за исключением образцов со слизистых оболочек, или выделение культуры из образцов, полученных в асептических условиях из стерильного в норме очага, который по результатам клинического и радиологического исследований связан с инфекцией, за исключением исследований мочи, образцов из пазух носа и со слизистых оболочек, или обнаружение при микроскопии и специфическом окрашивании (в капле туши, окраска муцикармином) дрожжевых клеток либо положительного антигена Cryptococcus spp. в цереброспинальной жидкости.
Фунгемия, обусловленная мицелиальными грибами: выделение гемокультуры грибов, за исключением Aspergillus spp. и Penicillium spp., включая Penicillium marneffei, в сочетании с клиническими симптомами инфекционного процесса, совместимыми с выделенным возбудителем.
Фунгемия, обусловленная дрожжевыми грибами: выделение гемокультуры грибов рода Candida или иных дрожжевых грибов у пациентов с клиническими признаками инфекции, связанными с данным возбудителем.
Комплекс диагностических исследований при инвазивных микозах
При микологическом исследовании стерильных аспиратов или биоптатов принимают во внимание выделение не только культуры грибов, но и обнаружение при микроскопии мицелия или псевдомицелия. В гистологических препаратах аспергиллы трудно дифференцировать от Fusarium spp., Sceclosporium apiospermum и некоторых других мицелиальных грибов. Для дифференциальной диагностики следует проводить иммуногистохимическое исследование с антителами к аспергиллам.
Иная интерпретация результатов в случае обнаружения мицелиальных грибов в крови. Высокая частота выделения мицелиальных грибов характерна для Fusarium spp. и составляет 40—60 %. Aspergillus обнаруживают крайне редко, в большинстве случаев это рассматривается как контаминация, за исключением Aspergillus terreus.
Выделение Aspergillus terreus из крови больных с гемобластозами может свидетельствовать об истинной аспергиллемии, а при наличии клинических симптомов инфекции является основанием для назначения антимикотиков.
Критерии инвазивного микоза
При выявлении в крови или иных стерильных биосубстратов дрожжевых грибов обязательно следует проводить идентификацию до вида и определять чувствительность к противогрибковым препаратам, при выделении мицелиальных (плесневых) грибов — только идентификацию до вида, чувствительность не определяют.
В клинической практике чувствительность мицелиальных грибов не исследуют по причине несовершенства стандартов по определению чувствительности таких грибов к антимикотикам. Более того, только в одном исследовании продемонстрирована корреляция между чувствительностью Aspergillus spp. и результатами лечения инвазивного аспергиллеза у больных с гемобластозами. Ни в одном из исследований, проведенных в последующем, не получено подобных результатов.
Идентификация грибов до вида, особенно полученных из стерильных локусов, необходима прежде всего для выбора антимикотика и проведения адекватной противогрибковой терапии. Так, Candida krusei устойчивы к флуконазолу и менее чувствительны, чем дрожжевые грибы другого вида, к амфотерицину В; Aspergillus terreus, Scedosporium apiospermum (Pseudallescheria boydii), Trichosporon beigelii, Scopulariopsis spp. резистентны к амфотерицину В; Mucorales резистентны к итраконазолу, вориконазолу, Candida glabrata проявляет дозозависимую чувствительность к флуконазолу, и при выделении этого вида гриба, даже чувствительных штаммов, дозу флуконазола следует увеличить (взрослым назначают 800 мг вместо 400 мг); Candida lusitaniae устойчивы к амфотерицину В.
Идентификация грибов до вида также важна для проведения эпидемиологического анализа в стационаре — определения возбудителей вспышек инфекции и по возможности источника инфекции. Описаны вспышки инфекции, вызванные такими редкими грибами, как С. lusitaniae, С. krusei, С. lipolytica.
На основании видовой идентификации грибов можно предположить инвазивный микоз или колонизацию грибами слизистых оболочек. Например, Aspergillus niger существенно реже, чем Aspergillus fumigatus, являются причиной инвазивного аспергиллеза у больных острыми лейкозами. Выделение из жидкости бронхоальвеолярного лаважа Aspergillus niger чаще всего расценивается как колонизация дыхательных путей, а из мокроты — как контаминация из воздуха и требует дополнительных исследований при подтверждении диагноза инвазивного аспергиллеза.
Выделение Cryptococcus neoformans у иммунокомпрометированных больных из респираторного тракта (смывы, лаваж) является диагностически значимым. Если идентификация дрожжевых грибов из жидкостей, полученных из дыхательных путей (смывы из трахеи, бронхов, бронхоальвеолярный лаваж) иммунокомпрометированных больных, не относится к обязательным исследованиям, то проведение скрининга по выявлению Cryptococcus neoformans из этих образцов является необходимым.
Обнаружение кандид в моче у больных с нейтропенией и лихорадкой, как правило, считается проявлением диссеминированной кандидозной инфекции.
В своевременной диагностике инвазивного аспергиллеза успешно пользуются коммерческим тестом по выявлению циркуляции специфического антигена грибов Aspergillus spp. галактоманна (полисахаридный водорастворимый компонент клеточной стенки гриба).
Галактоманн может быть определен двумя методами: методом латекс-агглютинации (Pastorex Aspergillus, фирмы BioRAD) и методом иммуноферментного анализа (Platelia Aspergillus, фирмы BioRAD).
Преимуществом иммуноферментного метода является более низкий порог чувствительности определения уровня галактоманна в крови — 1 нг/мл и менее, а с помощью латекс-агглютинации — 15 нг/мл. Диагностическое значение имеет определение галактоманна в крови (не менее чем в 2 образцах), цереброспинальной жидкости, бронхоальвеолярном лаваже. Чувствительность метода иммуноферментного анализа составляет около 90 %, специфичность 90—99 %, у реципиентов аллогенного костного мозга данные показатели ниже и равны соответственно 60—70 % и 80—90 % вследствие профилактического применения противогрибковых препаратов (антимикотики снижают пороговый уровень галактоманна).
В 40 % случаев выявление галактоманна в крови опережает проявления инвазивного аспергиллеза, определяемые при компьютерном исследовании легких, а в 70 % опережает клинические симптомы инфекции.
Диагностическую значимость тест по выявлению антигена Aspergillus имеет в том случае, если исследование проводят неоднократно. Определение антигена Aspergillus в крови следует проводить при лихорадке на фоне лечения антибиотиками широкого спектра действия у больных с нейтропенией 2 раза в неделю; при пневмониях, которые возникают или сохраняются на фоне антибактериальной терапии; при обнаружении очагов в легочной ткани (компьютерная томография).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

