Плохо поддающиеся лечению инфекции
Обновлено: 24.04.2024
Инфекции верхних дыхательных путей (ИВДП) включают поражение слизистой оболочки респираторного тракта от полости носа до трахеобронхиального дерева, за исключением терминальных бронхиол и альвеол. В связи с тем, что большинство
Инфекции верхних дыхательных путей (ИВДП) включают поражение слизистой оболочки респираторного тракта от полости носа до трахеобронхиального дерева, за исключением терминальных бронхиол и альвеол. В связи с тем, что большинство ИВДП изначально имеют вирусную природу, потенциал применения антибактериальных препаратов (АП) ограничен. Каждый случай назначения АП должен рассматриваться индивидуально. Подобный подход предполагает выделение случаев заболевания, при которых эффект антибактериальной терапии (АТ) преобладает над еe неблагоприятными последствиями.
Диагностика
Диагностическая значимость признаков риносинусита изучена в исследовании J. Williams и M. Lindbaek таблица. Последний выделил четыре симптома, с высокой степенью достоверности прогнозирующие заболевание. К ним относились: двухфазное течение заболевания, гнойная ринорея, гнойное содержимое в полости носа и скорость оседания эритроцитов (СОЭ) > 10 мм/ч. При наличии трех из четырех симптомов специфичность теста составила 81% при чувствительности 66%. В то же время для такого признака, как перимаксиллярный отeк, характерна специфичность 99%. Большинство же других симптомов, выявляемых при осмотре, характеризуются низкой прогностической ценностью.
Диагностика риносинусита строится преимущественно на клинических, анамнестических и лабораторных данных. В то же время частое выявление рентгенологических признаков риносинусита при ОРВИ ограничивает возможности лучевых методов исследования. Именно поэтому рентгенография исключена из перечня рутинных методов диагностики неосложнeнных форм риносинусита. Применение лучевых методов исследования в подавляющем большинстве нецелесообразно и по причине необоснованного повышения стоимости лечения.
Классификация
Согласно методическим рекомендациям, утверждeнным комиссией по антибиотической политике при Министерстве здравоохранения РФ и Российской академией медицинских наук, Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии, принята классификация, выделяющая:
- Острый синусит ( < 3 мес).
- Рецидивирующий острый синусит (2–4 случая острого синусита за год).
- Хронический синусит (> 3 мес).
- Обострение хронического синусита (усиление имеющихся и/или появление новых симптомов).
В целях оптимизации лечебной тактики можно также предложить выделение следующих форм риносинуситов:
- По месту развития:
A.1. Внебольничный.
A.2. Нозокомиальный. - По длительности сохранения симптомов:
B.1. Острый (длительность < 4 нед).
B.2. Подострый (4–12 нед).
B.3. Хронический (> 12 нед, или ≥ 4 случаев острого рецидивирующего риносинусита длительностью > 7–10 сут при условии сохранения остаточных явлений в синусе через 4 нед после окончания терапии). - По преморбидному фону:
C.1. Риносинусит у лиц с нормальным иммунным статусом.
C.2. Риносинусит у лиц с иммуносупрессией.
C.2.1. Гуморальный иммунодефицит.
C.2.2. Клеточный иммунодефицит.
Вышеприведенные замечания к классификации были представлены в согласительных рекомендациях Американской академии оториноларингологии, Фонда хирургии головы и шеи, а также некоторых других обществ. Синусит подразделяется на четыре категории: острый (бактериальный) риносинусит, хронический риносинусит без полипов, хронический риносинусит с полипами и аллергический грибковый синусит. По мнению зарубежных специалистов, обновлeнная классификация позволяет более прицельно осуществлять лечение заболевания, однако обсуждение еe преимуществ выходит за рамки настоящей статьи.
Тактика АТ риносинусита, как и других инфекций респираторного тракта, зависит от тяжести течения заболевания и осложнений. Степень тяжести оценивается по совокупности симптомов. Например, при подозрении на орбитальные или внутричерепные осложнения течение всегда расценивается как тяжeлое, независимо от выраженности других симптомов.
По тяжести течения выделяют:
- лeгкое течение — заложенность носа, слизистые или слизисто-гнойные выделения из носа и/или в ротоглотку, повышение температуры тела до 37,5 °С, головная боль, слабость, гипосмия; на рентгенограмме околоносовых синусов — толщина слизистой оболочки менее 6 мм;
- среднетяжелое — заложенность носа, гнойные выделения из носа и/или в ротоглотку, температура тела выше 37,5 °С, боль и болезненность при пальпации в проекции синуса, головная боль, гипосмия, недомогание, могут быть иррадиирующие боли в зубы, уши; на рентгенограмме околоносовых синусов — утолщение слизистой оболочки более 6 мм, полное затемнение или уровень жидкости в одном или двух синусах;
- тяжeлое — заложенность, часто обильные гнойные выделения из носа и/или в ротоглотку (но может быть их полное отсутствие), температура тела выше 38 °С, сильная болезненность при пальпации в проекции синуса, головная боль, аносмия, выраженная слабость; на рентгенограмме околоносовых синусов — полное затемнение или уровень жидкости более чем в двух синусах; анализ крови: лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ; орбитальные, внутричерепные осложнения или подозрение на них. Крайне серьeзным осложнением является тромбоз кавернозного синуса, летальность при котором достигает 30% и не зависит от адекватности антибактериальной терапии.
Стандартом этиологической диагностики риносинусита является бактериологическое исследование аспирата, полученного при пункции синуса. Диагностически значимый титр составляет 10 5 КОЕ/мл. Возбудителя удаeтся выделить в 60% случаев; по некоторым данным, в 20–30% случаев определяется полимикробная этиология. Последняя более свойственна подострому и хроническому течению заболевания.
Имеется тесная зависимость роли возбудителей от варианта течения заболевания: при остром риносинусите и обострении хронического риносинусита основное значение имеют Streptococcus (Str.) pneumoniae (20–35%) и aemophilus (H.) influenzae (нетипируемые штаммы, 6–26%). Более тяжeлые случаи заболевания чаще связаны со Str. pneumoniae. Гораздо реже причиной риносинусита являются Moraxella (M.) catarrhalis (и другие грамотрицательные бациллы, 0–24%), Str. pyogenes (1–3%; до 20% у детей), Staphylococcus (S.) аureus (0–8%), анаэробы (0–10%). Роль грамотрицательных бактерий (Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Proteus spp., Enterobacter spp., Citrobacter) при остром синусите минимальна, но возрастает при нозокомиальном инфицировании, а также у лиц с иммуносупрессией (нейтропения, СПИД) и лиц, получавших повторные курсы антибактериальной терапии. Возбудителями одонтогенного (5–10% от всех случаев гайморита) верхнечелюстного синусита являются: H. influenzae, реже Str. pneumoniae, энтеробактерии и неспорообразующие анаэробы.
Терапия
АП в сочетании с назальными и/или системными противоотeчными средствами, в том числе и интраназальными стероидами и орошением слизистой носа физиологическим раствором, занимают основное место в терапии острого, а также при обострении хронического, риносинусита. Применяются антихолинергические препараты: ипратропия бромид; местные деконгестанты: оксиметазолина гидрохлорид; системные деконгестанты: фенилпропаноламина гидрохлорид; комбинация псевдоэфедрина гидрохлорид + ацетаминофен. По показаниям (например, в целях этиологической диагностики, особенно при неэффективности терапии на 3-и сутки, подозрении на микоз; при выраженном болевом синдроме, требующем декомпрессии синуса и т. д.) применяются пункция синусов и другие методы лечения.
Заблуждением является назначение (при отсутствии явных признаков аллергического риносинусита) антигистаминных препаратов, способствующих увеличению вязкости секрета и затруднению дренажа пазух. Ещe одна ошибка заключается в профилактическом назначении АП пациентам с ОРВИ в первые сутки манифестации риносинусита. Попытка предотвращения бактериальных осложнений, в том числе и со стороны синусов, лишена смысла.
Антибактериальная терапия. Главная цель АТ состоит:
- в эрадикации возбудителя и восстановлении стерильности синуса;
- сокращении риска хронизации (на настоящий момент недостаточно данных, доказывающих способность АТ предотвращать переход процесса в хроническую форму или предупреждать развитие серьeзных осложнений);
- предотвращении осложнений;
- облегчении клинической симптоматики.
В первые дни болезни, когда наиболее вероятной причиной заболевания являются вирусы, в частности респираторно-синцитиальный вирус, назначения АП не требуется. При сохранении симптомов риносинусита > 7–10 сут, у 60% пациентов можно предполагать наличие бактериальной инфекции. Именно в пределах данной группы целесообразно проведение АТ. Последняя может начинаться и раньше. Основанием для этого служит лихорадка и цефалгия, плохо поддающиеся действию анальгетиков.
При лeгком и среднетяжeлом течении острого риносинусита терапия одинаковая. Препаратом выбора является амоксициллин. Учитывая вариабельность всасывания препарата, для обеспечения качественного лечения представляется целесообразным применение микроионизированной формы, обеспечивающей постоянство абсорбции на уровне 93% (солютаб). Длительность терапии — 7–14 сут. В случае эпидемиологической значимости (предлагается > 5% от выделяемых штаммов) пенициллиноустойчивых Str. pneumoniae минимальная подавляющая концентрация (МПК) пенициллина — 0,12–2,0 мг/л, доза амоксициллина составляет 3 г/сут. В этом случае преимущество высокоадсорбируемой растворимой формы очевидно.
Если в большинстве случаев амоксициллин является адекватным средством терапии острого риносинусита, то в случае подострого течения, как и при наличии нижеперечисленных признаков, требуется применение ингибиторозащищeнных аминопенициллинов (амоксициллин/клавуланат).
К факторам, требующим применения ингибиторозащищeнных аминопенициллинов, относятся:
- применение АП в предшествующий месяц;
- неблагоприятная эпидемиологическая ситуация (резистентность);
- курение;
- данные анамнеза о неэффективности предыдущего (если было) лечения;
- посещение детских дошкольных учреждений;
- возраст менее 2 лет;
- аллергия к амоксициллину;
- поражение лобных или сфеноидальных синусов;
- осложнeнный этмоидальный синусит;
- длительность симптомов > 30 сут.
К альтернативным, не менее эффективным препаратам, применяемым при непереносимости аминопенициллинов, относят:
- макролиды (азитромицин, кларитромицин);
- цефуроксим аксетил, цефпрозил, цефподоксим проксетил;
- доксициклин (применение ограничено в связи с ростом устойчивости пневмококка в России).
Относительно роли цефалоспоринов необходимо отметить следующее. Накапливается всe больше данных о взаимосвязи между уровнем потребления АП и уровнем резистентности микроорганизмов. В аналитическом обзоре J. Granizo продемонстрировано неблагоприятное влияние оральных цефалоспоринов на распространение резистентных к пенициллину штаммов Str. pneumoniae. Поэтому их применение, при наличии амоксициллина (амоксициллина/клавуланата) и современных макролидов, следует ограничивать случаями неэффективности АТ макролидами и непереносимости амоксициллина.
Препараты, применяемые при тяжелом течении риносинусита, вводятся внутривенно. При появлении признаков улучшения, наблюдаемого на 3–5-е сутки, практикуется переход на пероральную форму того же препарата (или амоксициллина/клавуланата при применении цефалоспоринов III поколения). Ступенчатая терапия эффективна, безопасна и позволяет сократить стоимость лечения.
Основными препаратами для лечения тяжeлых форм риносинусита являются:
- ингибиторозащищенные пенициллины (амоксициллин/клавуланат, предпочтительна микроионизированная растворимая форма солютаб);
- цефалоспорины III поколения (цефтриаксон, цефотаксим);
- при аллергии к β-лактамам — левофлоксацин, моксифлоксацин или хлорамфеникол парентерально.
При развитии осложнений со стороны центральной нервной системы (ЦНС) следует отдавать предпочтение цефтриаксону (2–4 г/сут в 2 приема) или цефотаксиму (12 г/сут в 4 приема). При развитии менингита, вызванного резистентными Str. pneumoniae (МПК ≥ 0,12 мкг/мл), дополнительно вводится ванкомицин (2 г/сут в 4 приема). Не исключено применение моксифлоксацина, однако данных, подтверждающих безопасность его применения, недостаточно.
Препараты, применяемые при неэффективности АТ
- При неэффективности амоксициллина или макролидов — амоксициллин/клавуланат или цефалоспорины III поколения;
- при неэффективности ингибиторозащищeнных аминопенициллинов и цефалоспоринов — респираторные фторхинолоны (левофлоксацин, моксифлоксацин) + компьютерная томография/эндоскопия/пункция придаточных пазух для исключения микоза.
В последнее время большие надежды в лечении синуситов, вызванных пенициллиноустойчивыми (МПК > 4 мг/л) пневмококками, возлагаются на респираторные фторхинолоны (гемифлоксацин, моксифлоксацин). Активность препаратов распространяется на пенициллиноустойчивые штаммы Str. pneumoniae, β-лактамазопродуцирующие штаммы H. influenzae, M. catarrhalis, а также на атипичные и анаэробные микроорганизмы.
Как видно, спектр применяемых в лечении синуситов АП представлен весьма широко, и достаточно сложно найти ту грань, когда оправдано применение аминопенициллинов, а когда следует выбрать их ингибиторозащищeнные формы, цефалоспорины или фторхинолоны. Существенную помощь в разрешении этой проблемы могут оказать выводы контролируемых исследований и метаанализов.
Согласно их данным, при нетяжeлых формах заболевания новые АП демонстрируют незначительное преимущество при сравнении с амоксициллином, тем более с его микроионизированной формой, а также с бензилпенициллином при лечении острых неосложнeнных синуситов. Такой вывод соответствует и результатам ретроспективного фармакоэпидемиологического исследования, выполненного в США. Общая эффективность терапии препаратами первой линии у 17329 пациентов оказалась несколько меньшей и составила 90,1%. В то же время у 11773 пациентов, получавших альтернативную терапию, эффект получен в 90,8% случаев. Разница составила 0,7% (95% доверительный интервал, 0,01%–1,40%; p < 0,05). Причиной такого положения дел является присутствие в исследуемых группах лиц, инфекционный процесс у которых мог бы разрешиться и без АТ, так как в 2/3 случаев острого заболевания наблюдается тенденция к спонтанному разрешению.
Оценка качества проводимой терапии. В период первичного осмотра и назначения терапии пациент должен быть проинформирован о возможных вариантах течения заболевания. В большинстве случаев процесс своевременно разрешается и дополнительных врачебных осмотров не требуется.
В случае отсутствия улучшения в первые 3 сут применения АТ осуществляется переход на ингибиторозащищeнный аминопенициллин (предпочтительнее форма солютаб) или макролид.
В этом же случае, как и при ухудшении состояния в любой момент терапии, ведeтся поиск причин ее неэффективности. Чаще всего к ним относятся: некомплаентность пациента, развитие внутричерепных осложнений, ошибочный диагноз, резистентность возбудителя к применяемому препарату (грибы, продукция β-лактамаз).
Причины неэффективности. При вирусной инфекции основными причинами неэффективности АТ неосложнeнного риносинусита является раннее начало терапии, до момента присоединения бактериальной инфекции (как правило, в первую неделю после появления симптомов ОРВИ).
Неэффективность терапии острых бактериальных риносинуситов при назначении незащищeнных пенициллинов может объясняться продукцией β-лактамаз H. influenzae и M. catarrhalis. Характерной причиной неудач при назначении доксициклина и макролидов является распространение устойчивых штаммов Str. pneumoniae и H. influenzae.
Особого внимания требует неэффективность терапии, связанная с нечeтким следованием пациента предписанному режиму терапии (некомплаентность). Чаще всего это отказ от продолжения терапии при первых признаках улучшения, наблюдаемых к 3-м суткам терапии, а также пропуск очередной дозы и/или сокращение частоты приeма препарата. В результате недооценки этих причин нередко назначается терапия ингибиторозащищeнными аминопенициллинами, цефалоспоринами и фторхинолонами.
Известно, что лучшая комплаентность наблюдается при применении препаратов, принимаемых 1 раз в сутки. Это подтверждено результатом недавно выполненного систематического анализа, показавшего комплаентность при применении препарата 1 раз в сутки в пределах 79 ± 14%, 2 раза в сутки — 69 ± 15%, 3 раза в сутки — 65 ± 16% и 4 раза в сутки — 51 ± 20%. В данном случае различие между первыми двумя режимами было статистически недостоверно. Характерно, что комплаентность при лечении инфекций респираторного тракта гораздо выше и достигает 97% (например, при использовании азитромицина). Применение макролидов, по данным сравнительных исследований, вообще характеризуется наилучшей комплаентностью.
Очень часто АП назначаются без явных показаний. Объяснением в большинстве случаев служит личный опыт, подтверждающий увеличение частоты повторных визитов в случае неприменения АТ. Ряд исследований отрицает подобную точку зрения. Оказалось, что пациенты, имеющие хороший контакт с врачом, уяснившие возможные варианты течения заболевания и не получающие АТ, без необходимости не приходят на прием повторно. Более того, не отмечено и увеличения случаев неудовлетворeнности лечением.
Длительность терапии зависит от формы и степени тяжести течения болезни. При остром синусите лечение продолжается от 1 сут (азитромицин 2 г — микросферическая форма) до 3–10 дней.
Выводы
- Симптомы риносинусита чаще всего обусловлены вирусной инфекцией.
- Основные возбудители бактериального риносинусита — Str. pneumoniae, H. influenzae и M. catarrhalis (чаще у детей).
- Диагностика бактериального риносинусита необходима для ограничения применения АП.
- Диагностика базируется на клинических и лабораторных критериях.
- Вероятность бактериального риносинусита возрастает при длительности симптомов > 10 сут.
- Ошибочно рутинное применение при неосложнeнных формах заболевания лучевых методов исследования.
- Культуральное исследование, цель: получение локальных данных по резистентности возбудителей и оценка возможной причины неэффективности терапии.
- АТ показана при бактериальном риносинусите.
- Амоксициллин — препарат выбора, альтернативное средство — амоксициллин/клавуланат (сульбактам), азитромицин, кларитромицин.
- Применение коротких курсов терапии, препаратов с однократным суточным приeмом и максимальной степенью всасывания активных ингредиентов предпочтительно, так как повышает комплаентность пациента, снижая риск нежелательных реакций.
По вопросам литературы обращайтесь в редакцию.
И. А. Гучев, кандидат медицинских наук
А. А. Колосов
421-й военный госпиталь МВО МО РФ, Смоленск
Для эффективного лечения хронических инфекционнных заболеваний предлагаются инновационные подходы, включающие: диагностику - оценку аутоиммунитета, комплексную терапию, направленную на элиминацию возбудителей, восстановление иммунитета, в том числе иммуни
For effective treatment of chronic infectious diseases some innovative approaches were suggested that include: diagnostic, autoimmunity assessment, complex therapy targeted to eliminate the agents, immunity restoration including intestine immunity and further rehabilitation.
Нерешенные проблемы патогенеза, лечения хронических заболеваний встают все острее. В настоящее время показано, что при большинстве хронических заболеваний, ранее считавшихся неинфекционными, выявляются латентные или активные бактериально-вирусные процессы [1, 2].
Хронические инфекционные заболевания, как правило, являются сочетанными (микст-инфекции). Вcе чаще они трудно поддаются лечению, носят рецидивирующий характер, в ряде случаев отмечается их непрерывное течение.
Многократно проводимая антибактериальная терапия оказывается не всегда эффективной, часто имеет место иммуносупрессивное, выраженнное побочное действие антибиотиков. То есть иммуносупрессивная терапия при хронических инфекционных процессах и хронических заболеваниях патогенетически не всегда обоснована. Есть ли альтернатива?
При проведении вакцинации также могут отмечаться побочные эффекты, в том числе выраженные. Введение вакцин в ряде случаев вызывает развитие слабого специфического иммунного ответа, или, наоборот, выявляется гиперреактивность, при этом могут активироваться очаги хронической инфекции, нарушаться механизмы иммунорегуляции, приводящие к развитию аутоиммунных процессов [3].
К решению данных вопросов можно подойти с позиций современных знаний в области иммунофизиологии и иммунопатологии [1–3, 5–7].
Все болезни являются инфекционными, если не доказано другого [1]
Колонизация микроорганизмами слизистых начинается еще внутриутробно (во время беременности, от матери). После рождения микроорганизмы поступают во внутреннюю среду через дыхательные пути, пищеварительный тракт с пищей, по мере взросления этот процесс ассимиляции увеличивается.
Факторами, усиливающими поступление микроорганизмов, являются вредные привычки (например, курение), поездки в различные страны, заболевания желудочно-кишечного тракта.
Один из механизмов воздействия генов микроорганизмов на геном человека следующий. Гены микроорганизмов участвуют в активации ключевого ядерного фактора транскрипции NF-каппа-би, который запускает продукцию ряда белков, поддерживающих воспалительные процессы (ферменты, медиаторы, цитокины).
T. Marshall в своих исследованиях показал, что при аутоиммунных заболеваниях в клетках различных органов, в крови выявляются геномы вируса Эпштейна–Барр, цитомегаловируса, вируса гепатита С, Chlamydia trachomatis, грибов.
То есть геном микроорганизмов (в настоящее время обнаружено более 1 миллиона генов микроорганизмов по сравнению с 25 тысячами генов человека) при большинстве хронических заболеваний выявляется во многих клетках организма.
Феномен антигенной молекулярной мимикрии
При частых обострениях хронических инфекционных процессов, определенном генотипе (особенности HLA-системы), нарушениях в регуляции иммунного ответа может возникнуть аутоиммуный процесс.
Комплексная оценка аутоиммунитета — инновационный подход к диагностике при хронических заболеваниях
В настоящее время хорошо известно, что все основные события, связанные с воспалительными процессами, развиваются в органах, т. е. местно. Изменения в периферической крови указывают на системность, распространенность, наличие выраженной активности воспалительного процесса.
В течение 20 последних лет активно развивается инновационный подход к диагностике различных заболеваний: появился иммунологический метод, позволяющий оценивать наличие и степень выраженности воспалительного процесса в основных органах и системах [5, 6].
Новые подходы к лечению хронических инфекционных процессов
В клетках человека, в лимфоцитах присутствует ядерный рецептор (VDR-рецептор), который участвует в синтезе Toll-подобных рецепторов, распознающих общие детерминанты многих микроорганизмов. Этот механизм участвует в подавлении активности различных патогенов (бактерий, вирусов).
При хронических инфекционных процессах VDR-рецептор заблокирован, инактивирован микроорганизмами.
В настоящее время обнаружено [1], что препарат олмесартана медоксомил (Кардосал) обладает высокой противовоспалительной активностью при различных заболеваниях, в том числе аутоиммунных, он способен восстанавливать активность VDR-рецептора. При этом прием данного препарата должен осуществляться длительно, практически постоянно. Этот препарат относится к группе сартанов (антагонисты рецепторов ангиотензина II) (Диован, Лозап и др.), которые применяются для лечения артериальной гипертензии.
Противовоспалительным эффектом, основанным на новом механизме действия, обладают экстракты босвеллиевой кислоты (из ладанного дерева), экстракты семян сибирской кедровой сосны. При применении данных препаратов происходит блокада активности ядерного фактора NF-каппа-би [4], при этом подавляется синтез провоспалительных цитокинов и др. (интерлейкина-1, фактор некроза опухолей альфа, бета, ряда металлопротеиназ).
В комплексную терапию включается специфическое лечение активной, преобладающей в данный момент бактериально-вирусной инфекции с последующей длительной реабилитацией, которая может осуществляться в течение нескольких месяцев. При этом показали свою высокую эффективность препараты — Глицирам 2 табл. 3 раза в день, производные бетулина — Суперантитокс 50 мг 1 раз в день, экстракты из босвеллиевой кислоты 10 мг 1 раз в день.
В комплексном лечении и реабилитации пациентов с хроническими инфекционными (воспалительными) процессами нами обязательно применяется коррекция состояния кишечника (важнейшего органа иммунитета) и органов желудочно-кишечного тракта, билиарной системы. В частности, пробиотики рекомендуется применять длительно: 2 и более месяцев.
Немного фактов: более 60% всех иммунокомпетентных клеток находится в кишечнике, площадь которого в 10 раз больше площади кожных покровов и составляет более 300 м 2 , кишечник имеет большую метаболическую активность, чем печень, он синтезирует три четверти всех нейротрансмиттеров, в кишечнике находится клеток в 10 раз больше, чем во всем остальном организме.
Состояние иммунитета кишечника ослабляется наличием дисбиоза (синдрома избыточного бактериального роста, повышенной проницаемости, пищевой непереносимости).
Нарушенное состояние кишечника невозможно восстановить без нормализации работы вышележащих органов — желудка, печени, желчного пузыря, поджелудочной железы. Поэтому в комплексную терапию хронических инфекционных заболеваний входит лечение патологий желудочно-кишечного тракта (ЖКТ).
Вакцинация. Спорные вопросы. Предлагаемые решения
Известные иммунологи (академик РАН Черешнев В. А., Shoenfeld Y., 2012) указывают, что введение комплексных вакцин не всегда согласовывается с основными законами функционирования иммунитета: силы, конкуренции антигенов, интервалов, суммации раздражений.
При использовании вакцин описана еще одна достаточно новая проблема — синдром ASIA [3]. Адъюванты, используемые в вакцинах для усиления действия антигенов, могут вызывать у лиц с особенностями генотипа (HLA) повышенную предрасположенность к развитию аутоиммунных процессов. Подобный эффект могут оказывать латекс, силикон.
В наших работах [8, 9] убедительно показано, что у детей с увеличенной вилочковой железой, регистрируемой в момент вакцинации, или имевших гиперплазию тимуса в анамнезе у 60% не вырабатывался защитный титр антител к дифтерийному компоненту вакцин АКДС и АДС (независимо от фирмы-производителя вакцин и лабораторий, в которых контролировался уровень антител). После проведения иммунотропной терапии содержание специфических антител достигало защитного уровня.
В связи с этим мы рекомендуем перед вакцинациями, прежде всего у детей первых месяцев и первых лет жизни, определять величину тимуса (по УЗИ).
Можно ли избежать осложнений при проведении вакцинаций?
Заключение
Рекомендуется перед проведением первой вакцинации детям первых месяцев жизни проводить УЗИ тимуса (диагностика тимомегалии или гипоплазии тимуса) для определения дальнейшей тактики ведения ребенка.
Литература
А. В. Симонова*, доктор медицинских наук, профессор
Л. Г. Кузьменко**, доктор медицинских наук, профессор
И. С. Лебедева*
И. Д. Баранова*, кандидат медицинских наук
В. В. Арзямова**, кандидат медицинских наук
Мы часто слышим, что половые инфекции — больше не проблема. Нужно всего лишь выпить одну таблетку и/или сделать укол — и можно жить дальше. Но так происходит не всегда: возбудители инфекций, передаваемых половым путем (ИППП), постепенно учатся защищаться от лекарств, и сегодня их не так просто убить. Недолеченные инфекции могут затаиться и какое-то время не вызывать неприятных ощущений, но через годы привести к бесплодию, воспалению внутренних органов и даже стать фоном для развития рака. Растущая устойчивость половых инфекций признана общемировой проблемой, и схемы их лечения сейчас пересматриваются из-за недостаточной эффективности.
А что вообще такое ИППП?
Это инфекции, которыми инфицируются при незащищенном половом контакте (вагинальном, оральном, анальном). Микроорганизмы-возбудители могут также передаваться при переливании крови, пересадке органов, от беременной матери ребенку. Всего описано более 20 патогенов, но наиболее часто встречаются хламидиоз, трихомониаз, гонорея, инфекция, вызванная Mycoplasma genitalium, и сифилис. Они вызываются простейшими или бактериями и потенциально излечимы. К ИППП относят и вирусные патологии: гепатит В, генитальный герпес, ВИЧ и вирус папилломы человека (ВПЧ).

Сифилис. Он есть у всех этих мужчин. Женщины, держитесь подальше от танцплощадок! (Американский плакат середины ХХ века)
Почему некоторые ИППП бывает сложно вылечить?
Причин тому несколько.
1. Устойчивость к антибиотикам
Мы используем антибиотики против бактерий уже почти 75 лет. За это время микроорганизмы эволюционировали и научились использовать хитроумные способы защиты. Устойчивость к антибактериальным препаратам (она же антибиотикорезистентность) связана со сложными биохимическими превращениями, которые можно разделить на 2 группы:
2. Болезнь вызывает вирус
Вылечить вирусные ИППП невозможно — пока не разработано лекарств, полностью уничтожающих вирус. Однако имеющиеся в нашем арсенале препараты могут облегчить или полностью убрать проявления заболевания.
3. Запущенные случаи
Большинство ИППП поначалу причиняют лишь небольшой дискомфорт или вообще протекают бессимптомно (латентно). Они дают о себе знать через несколько лет — на поздних стадиях, например, когда поражаются органы малого таза при хламидиозе или нервная система при сифилисе. Эти повреждения нельзя устранить полностью, а лечение занимает много времени, к тому же оно не всегда эффективно.
Какие инфекции — самые устойчивые?
- гонорея;
- хламидиоз;
- инфекция, вызванная Mycoplasma genitalium,
- сифилис.
Гонорея становится все большей проблемой. Ее возбудитель Neisseria gonorrhoeae (гонококк) стал невосприимчив почти ко всем известным антибиотикам, причем эта устойчивость отличается в разных странах и регионах. Например, в США осталась лишь одно рекомендованное лечение: комбинация двух мощных антибиотиков — азитромицина и цефтриаксона. В России гонококк пока еще остается восприимчив к некоторым цефалоспоринам. Однако уже описано 3 случая гонореи, устойчивой к последним эффективным антибиотикам.
О том, как гонококк развивал устойчивость к антибиотикам, можно посмотреть в этом видео.
Сифилис и хламидиоз тоже научились защищаться от антибиотиков в некоторых частях мира, хотя в большинстве стран они все еще успешно лечатся стандартными препаратами. Так, азитромицин может быть недостаточно эффективным при хламидийной инфекции прямой кишки — частота неудач лечения достигает 22 %.
Mycoplasma genitalium — самая маленькая из существующих бактерий, которую недавно стали относить к ИППП. Этот микроорганизм постепенно становится устойчивым к макролидам и фторхинолонам — антибиотикам, рекомендованным для борьбы с ней.
Ежедневно в мире более одного миллиона человек приобретают ИППП. По оценкам Всемирной организации здравоохранения (ВОЗ), ежегодно 357 миллионов человек приобретают одну из четырех самых распространенных инфекций — хламидиоз (131 миллион), гонорею (78 миллионов), сифилис (5,6 миллиона) или трихомониаз (143 миллиона). Более 500 миллионов человек живут с инфекцией генитального герпеса. Постоянно более 290 миллионов женщин инфицированы ВПЧ, одной из наиболее распространенных ИППП.

Сифилис. Советский довоенный плакат.
Вирусы:
- вирусы папилломы человека;
- генитальный герпес;
- гепатит В;
- ВИЧ.
Вирусные ИППП можно считать устойчивыми по умолчанию, так как у нас попросту нет средств для их полного излечения. Популярные в России и других странах иммуномодуляторы, а также индукторы интерферонов серьезно не изучались, их эффективность не доказана. При ВИЧ единственные препараты — антиретровирусная терапия, которая замедляет развитие болезни и подавляет вирус в организме до неопределяемого уровня, то есть его нельзя никому передать. Для лечения гепатита В используют высокие дозы интерферона и антиретровирусные препараты, которые помогают уменьшать количество вирусных частиц в крови и замедляют разрушение печени.
Почему это важно?
Устойчивые ИППП могут быть поздно обнаружены, и их сложно полностью вылечить (особенно на поздних стадиях).
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей? Какие патогенные факторы играют существенную роль? Как вести больных? Респираторные заболевания являются частой причиной обращения к врачу в Великобритании,
Какие назначения необходимы при подозрении на инфекцию нижних дыхательных путей?
Какие патогенные факторы играют существенную роль?
Как вести больных?
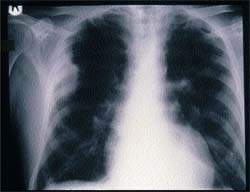 |
Респираторные заболевания являются частой причиной обращения к врачу в Великобритании, причем в большинстве случаев они относятся к инфекционным [1]. Трем четвертям пациентов, обращающихся с признаками острого заболевания нижних дыхательных путей, врач общей практики назначает антибиотики, хотя лишь в немногих случаях удается выделить возбудителя и антибиотики или вообще не влияют, или мало влияют на естественный ход заболевания [2,3].
Назначая антибиотики, врач руководствуется ожиданиями пациента и старается действовать согласно определенной терапевтической стратегии, хотя зачастую, выписывая рецепт, чувствует, что при этом состоянии антибиотики будут неэффективны [4,5].
Причины, по которым пациент первый раз приходит на прием к своему врачу и затем повторно обращается за консультацией, довольно сложны и часто никак не соотносятся с течением болезни. Как правило, они обусловлены обеспокоенностью своим здоровьем или давлением со стороны друзей, семьи и сотрудников.
При необходимости назначить антибиотик для лечения инфекции нижних дыхательных путей обычно выбирают амоксициллин. Пациенты, повторно обращающиеся к врачу, скорее всего, получат другой антибиотик, например эритромицин или новейшее средство из группы макролидов, хинолонов или пероральный цефалоспорин [3,6].
Проведенные нами недавно исследования показали, что повторное обращение пациентов с инфекциями нижних дыхательных путей, уже получивших назначения на первичном приеме, никак не связано с антибиотикотерапией. Только у 4% таких больных сохранялась бактериальная инфекция и ни у одного из них не было устойчивости к амоксициллину [7]. Повторно приходить на прием побуждают пациентов немедицинские факторы, такие как привычка обращаться к врачу.
Таблица 1. Почему пациенты повторно обращаются к врачу при острой инфекции нижних дыхательных путей
- Пациент неверно представляет себе естественное течение болезни
- Пациент продолжает беспокоиться по поводу симптомов болезни
- Пациенту нравится ходить на прием к врачу
- По настоянию членов семьи, друзей, сотрудников
- У пациента появились соображения, касающиеся важности симптомов
- Инфекция хронизируется или к ней присоединяется другая инфекция
- Проявляется серьезное основное заболевание
При повторном обращении по поводу респираторного заболевания врач общей практики прежде всего должен попытаться установить причину такого обращения (табл. 1). Вполне возможно, что оно вызвано необоснованными ожиданиями пациента, и наилучшим средством здесь было бы объяснение нормальных сроков выздоровления от простуды. Или же есть какое-то основное заболевание, не распознанное на первичной консультации, например астма, недолеченное хроническое обструктивное легочное заболевание, рак или бронхоэктазы.
В том случае если врач считает, что причина в продолжающейся инфекции, необходимо определить возможного возбудителя и выбрать соответствующий антибиотик (табл. 2). Ниже мы обсудим некоторые сложные случаи, которые необходимо иметь в виду [8,9]. Однако нужно помнить, что наиболее распространенными возбудителями остаются Streptоcoccus pneumoniae и респираторные вирусы, а сложные случаи составляют скорее исключение, чем правило в ежедневной общей практике.
Пенициллин-резистентный Streptococcus pneumoniae. Хотя число случаев развития лекарственной устойчивости неуклонно возрастает и представляет серьезную проблему для целого ряда европейских стран, в Англии антибиотикорезистентность пока не считается причиной неудачного лечения инфекций дыхательных путей. Нужно убеждать врачей общей практики проводить пневмококковую вакцинацию населения, входящего в группу риска, а антибиотики назначать строго по показаниям и в адекватной дозе.
Амоксициллин-резистентный Haemophilus influenzae. Haemophilus influenza (Hi) является частой бактериальной причиной обострения хронических обструктивых заболеваний легких (ХОЗЛ), а также вызывает персистирующий бронхит у здоровых взрослых людей. Некоторые антибиотики, такие как эритромицин и цефалоспорины первого поколения, недостаточно эффективны в отношении Hi. Наличие b-лактамазы объясняет отсутствие реакции на амоксициллин. Такие штаммы называются амоксициллин-резистентными Hi (АRHi).
Таблица 2. Возможная причина отсутствия цикла терапии острой инфекции нижних отделов дыхательных путей, назначенной на первом приеме*
Заболеваемость, обусловленная АRHi, растет и составляет сегодня в Великобритании 10-25% общего числа респираторных заболеваний в зависимости от региона. В других странах, таких как Испания, Португалия и некоторые районы Франции, уровень лекарственной устойчивости гораздо выше — это нужно иметь в виду в тех случаях, когда пациент мог заразиться зарубежом.
Об этом возбудителе следует помнить, если у пациента с ХОЗЛ после лечения часто повторяющимися курсами амоксициллина сохраняются симптомы заболевания и гнойная мокрота. В данном случае целесообразным будет недельный курс хинолона или коамоксиклава. От назначения ципрофлоксацина следует воздержаться, если пациент принимает теофиллин.
Moraxella catarrhalis. Некоторым название этого микроорганизма может показаться незнакомым, поскольку раньше его относили к роду Neisseria вида Branhamella.
Это грамотрицательный диплококк, входящий в нормальную микрофлору молодых и пожилых людей. Вслед за Haemophilus influenza и Streptococcus pneumoniae он является третьей по распространенности причиной обострения ХОЗЛ и часто поражает пациентов с тяжелыми хроническими легочными заболеваниями или раком легких.
Обнаружение этого микроорганизма служит показателем тяжести процесса. Сообщалось о недавнем наблюдении 42 случаев пневмонии, вызванной M. catarrhalis, когда около половины пациентов погибло от основного заболевания в течение трех месяцев после обнаружения инфекции.
Важно и то обстоятельство, что практически все штаммы сегодня являются b-лактамазопродуцирующими и соответственно амоксициллинорезистентными. Имеется предположение, что b-лактамаза, продуцируемая M. Catarrhalis, обеспечивает устойчивость к амоксициллину в норме чувствительных респираторных возбудителей, таких как S. pneumoniae и H. influenzae. Проводимая терапия не отличается от той, которая применяется в случаях АРHi (см. выше).
Pseudomonas aeruginosa. Об этом возбудителе нужно помнить в связи с возможностью развития бронхоэктазов и кистозной болезни. Стоит один раз заразиться Pseudomonas aeruginosa, и рецидивы могут следовать один за одним. В настоящее время единственным эффективным пероральным средством является ципрофлоксацин, но к нему быстро развивается устойчивость, и пациентов приходится госпитализировать для проведения внутривенной антибиотикотерапии и физиотерапии.
Другие бактериальные возбудители. Изредка выделяют грамотрицательную кишечную палочку, или Staphylococcus aureus. Эти возбудители чаще связаны с больничными пневмониями, но иногда обнаруживаются у пациентов, недавно выписавшихся из больницы.
Под атипичными обычно подразумеваются инфекции, вызываемые Mycoplasma pneumoniae, Chlamydia psittaci, Chlamydia pneumoniae, Coxiella burnetti и Legionella pneumophila. Лихорадка Q, возбудителем которой служит Coxiella burnetti, встречается редко (как правило, в сельской местности), поэтому не будет упоминаться в дальнейшем. Все атипичные инфекции трудно поддаются распознаванию на ранних стадиях; серологические исследования, проведенные как в острый период, так и в период реконвалесценции, редко дают положительный ответ и не представляют клинической ценности.
Ни один из возбудителей атипичных инфекций не поддается воздействию b-лактамных антибиотиков, что объясняет отсутствие эффекта от назначения амоксициллина.
Mycoplasma pneumoniae. Эпидемия, вызванная этим возбудителем, случается каждые три-четыре года, и в такой период может составлять значительную часть всех респираторных заболеваний.
Обычно она охватывает школьников, студентов и людей среднего возраста; маленькие дети и старики страдают редко.
В отличие от бактериальных инфекций, заболевание начинается постепенно, через 10-14 дней после заражения, проявляясь сухим кашлем или выделением скудной чистой мокроты. Общее недомогание и повышение температуры тела обычно умеренные, при исследовании грудной клетки обнаруживаются незначительные изменения. Иногда такие проявления, как сыпь, буллезный мирингит, а также выявление холодовых агглютининов помогают поставить диагноз.
Микоплазменную инфекцию следует заподозрить, если взрослый человек, до этого не жаловавшийся на здоровье, при отсутствии серьезных патологических симптомов и признаков интоксикации не поддается лечению амоксициллином. В этом случае имеет смысл попробовать назначить антибиотик из группы макролидов; альтернативный подход — тетрациклины. Кашель, как правило, медленно поддается лечению.
Хламидии. Большинствo врачей общей практики время от времени сталкиваются со случаями пситаккоза, вызванного длительным контактом с какой-нибудь любимой домашней птичкой. В последние годы установлено, что наиболее распространенным возбудителем инфекций дыхательных путей является Chlamydia pneumoniae, передающаяся от человека к человеку [10]. Эта инфекция проявляется такими же стертыми симптомами, как и микоплазменная, среди которых выделяются кашель и фарингит. Но, в противоположность микоплазменной инфекции, данное заболевание поражает и пожилых людей, часто вследствие реинфекции.
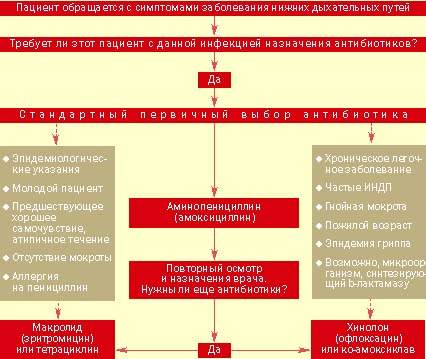 |
| Рисунок 2. Тактика ведения больного с выраженными клиническими показаниями для назначения антибиотиков при остром заболевании нижних дыхательных путей |
В некоторых исследованиях обнаружена связь между Chlamydia pneumoniaе и болезнями коронарных артерий и бронхиальной астмой, возможно обусловленная наличием хламидиального антигена, прикрепляющегося к эндотелию и эпителию. Рекомендуемое лечение — антибиотик из группы макролидов или тетрациклинов.
Legionella pneumophila. Болезнь легионеров все еще находится в центре внимания. Легионелла — редкий возбудитель пневмонии, развивающейся в местах большого скопления людей. Похоже, что легионелла не вызывает такие менее тяжелые заболевания дыхательной системы, как бронхит или инфекции верхних дыхательных путей. Состояние пациентов с болезнью легионеров достаточно тяжелое; обычно им требуется лечение в условиях стационара.
Известна связь этого заболевания с зараженными легионеллами источниками воды, поэтому упоминание пациента о заграничной поездке, пребывании в отеле или больнице, ванне джакузи помогает врачу общей практики правильно поставить диагноз. Нередко встречаются такие осложнения, как дыхательная недостаточность и энцефалит, поэтому все больные, даже в сомнительных случаях, должны быть направлены на госпитальное обследование.
- Практические советы по ведению больных с инфекциями дыхательных путей
Назначение антибиотиков. Подход к ведению больных с острыми инфекциями нижних дыхательных путей представлен на рис. 2. Ключевым моментом является принятие решения о назначении или неназначении антибиотиков. Большинство врачей общей практики считают необходимым применение антибиотиков при серьезных системных нарушениях, постоянном выделении гнойной мокроты, появлении местных признаков поражения легких и отягощенности предшествующими заболеваниями. Если уже решено использовать этот вид лечения, выбор нужного препарата не представляет особого труда.
 |
| Рисунок 3. Пациентам, входящим в группу риска, необходимо провести пневмококковую вакцинацию |
В большинстве случаев назначается амоксициллин. Согласно последним рекомендациям, доза амоксициллина принята равной 500 мг (а не 250 мг, как было раньше), чтобы снизить частоту развития резистентности пневмококков. Однако эта проблема лучше разрешается путем уменьшения общего количества назначений антибиотиков при инфекциях нижних дыхательных путей.
Врач общей практики не должен рекомендовать больному прием антибиотиков просто потому, что это самый легкий способ, или в случае, когда нет четких клинических показаний для их назначения. Проблемы резистентности возбудителей инфекций дыхательных путей решаются при назначении антибиотиков, обусловленном строгими показаниями. Снабжение пациентов простыми информационными листками значительно снижает необходимость повторных консультаций.
Литература
1. Office of Population Censuses and Surveys. Morbidity statistics from general practice: foutrh national study 1992. London: HMSO, 1995 (Series MB5;3).
2. Orr P. H., Scherer K., Macdonald A., Moffatt M. E. Randomosed placebo controlled trials of antibiotics for acute bronchitis: a critical review of the literature. J Fam Pract 1993; 36:507–512.
3. Macfarlane J. T., Holmes W. F., Macfarlane R. M., Lewis S. Contemporary use of antibiotics in 1089 adults presenting with acute lower respiratory tract illness in general practice in the UK: implications for developing managment guidelines. Respiratory Medicine, 1997; 91:427–434.
4. Holmes W. F., Macfarlane J. T., Macfarlane R. M., Lewis S. The influence of antibiotics and other factors on reconsultation for acute lower respiratory tract illness in primary care. Br J Gen Pract (in press).
5. Macfarlane J. T., Holmes W. F., Macfarlane R. M. Acutr lower respiratory tract illness in general practice; a study of the view on 787 patients and their influence on antibiotic prescribing. BMJ, 1997; 315:1211–1214.
6. Macfarlane J. T, Colville A., Guion A., Macfarlane R. M., Rose D. H. Prospective study of aetiology and outcome of adult lower respiratory tract infection in the community. Lancet, 1993; 341:511–514.
7. Macfarlane J., Prewett J., Rose D., Gard P., Guion A., Cunnigham R., Myint S. A prospective, case control study of the aetiology of community acquired lower respiratory tract infections in adult who felt to improve with initial antibiotics. BMJ, 1997; 315:1206–1210.
8. Venkatesan P., Innes J. A. Antibiotic resistance in common acute respiratory pathogenes. Thorax, 1995; 50:481–483.
9. Anon. Lower respiratory tract infections. MeReC Bulletin 1994; 5:5–8.
10. Torres A., ElEbiary M. Relevance of Chlamydia pneumoniae in community acquired respiratory infections. Eur Respir J, 1993; 6:7–8.
11. Macfarlane J. T., Holmes W. F., Macfarlane R. Reducing reconsultations for acute lower respiratory tract illness with an information leaflet. Br J Gen Pract, 1997; 47:710–722.
Читайте также:

