Пневмококк и золотистый стафилококк
Обновлено: 24.04.2024
Именно поэтому врач должен черпать информацию о возбудителях и их чувствительности из изданий другого типа. Примеров природной устойчивости много: грамотрицательные бактерии кишечной группы и туберкулезные микобактерии не чувствительны к природным пенициллинам, гемофильная палочка – к большинству макролидов, листерии – к цефалоспоринам. Помимо природной устойчивости к определенным классам препаратов микроорганизмы обладают приобретенной устойчивостью – способностью вырабатывать резистентность к тому препарату, который против него применяется, или способностью отдельных штаммов бактерий сохранять жизнедеятельность при концентрациях противомикробных средств (ПМС), губительных для остальной популяции. Такие особи при лечении данным препаратом получают селективное преимущество и замещают собой чувствительную флору.
Грам-отрицательные бактерии приобретают резистентность, теряя каналы (порины) в оболочке, через которые β-лактамные антибиотики проникают в клетку. Псевдомонады (синегнойная палочка) приобретает к тому же способность активно выводить проникшие туда антибиотики.
Другой механизм устойчивости пневмококков: они модифицируют пенициллинсвязывающие белки (ПСВ), участвующие в синтезе микробной стенки – основной субстрат, на который действуют β-лактамные препараты. Модификация этих белков снижает их чувствительность к пенициллинам, повышая минимальную подавляющую концентрацию (МПК) с 0,02 мкг/мл (чувствительные) до 1 мкг/мл (умеренно устойчивые) и выше 2 мкг/мл (резистентные). Резистентность золотистых стафилококков к окса- и метициллину (МРЗС) обусловливается появлением особого белка – ПСВ 2а. Многие микробы приобретают способность ферментативно инактивировать макролиды, линкозамиды, аминогликозиды, другие модифицируют мишени действия тех же классов препаратов, а также гликопептидов, фторхинолонов, сульфаниламидов. 14- и 15-членные макролиды активно выводятся из микробной клетки стрептококками и рядом других возбудителей. Существуют и системы множественной устойчивости к антибиотикам, обеспечивающие возбудителям защиту от препаратов нескольких групп. Развитие устойчивости к одному препарату нередко снижает чувствительность к препаратам других групп.
Резистентность к ПМС – явление универсальное, это важнейшая проблема в лечении туберкулеза, грибковой инфекции. Появление хлорохиноустойчивых штаммов возбудителя тропической малярии создало проблемы во многих регионах Африки и Азии. Устойчивость приобретают и вирусы – так, большинство штаммов вируса гриппа приобрело устойчивость к римантадину, появились и штаммы, устойчивые к новому противогриппозному препарату – озельтамивиру. Ее значение особенно чувствительно в лечении ВИЧ-инфекции.
Лекарственная устойчивость возбудителей, циркулирующих в больнице, обычно намного выше, чем циркулирующих среди населения, однако и внебольничные возбудители постепенно становятся все более устойчивыми.
Выбор антибиотиков при болезнях органов дыхания
Среди возбудителей преимущественно респираторных инфекций основное внимание привлекает пневмококк, являющийся наиболее частой причиной отита (35—50%), синусита (20—40%), бактериемии (до 80%), менингита (10—20%) и, особенно, пневмоний (80—90% в раннем возрасте, 40—50% в более старшем). Пневмококк, некогда чувствительный к пенициллинам, приобретает к ним устойчивость. Во Франции, Испании и ряде других стран устойчивость пневмококков к пенициллину достигает 50—70%, к макролидам – 40—60%. Ситуация в России несколько лучше, однако и она постепенно ухудшается: пневмококк в основном сохраняет чувствительность к пенициллину (90—95%) и амоксициллину (99—100%), что позволяет шире использовать эти препараты . Но за период с 1999-го по 2005 год процент штаммов со сниженной чувствительностью повысился с 11,5 до 18,2% в Южном округе, с 8,6 до 10% — в Центральном, с 7,1 до 22,3% — в Уральском, с 4,5 до 14% — в Москве. Много устойчивых штаммов циркулирует в детских дошкольных учреждениях и особенно в детских домах. Около 1/3 устойчивых к пенициллину штаммов имеют сниженную чувствительность к макролидам, 4—8% — к цефтриаксону и цефотаксиму, а также до половины – к ампициллину, однако чувствительность к амоксициллину и амоксициллину/клавуланату, как правило, сохранялась. Устойчивость к хлорамфениколу, клиндамицину, рифампицину сохраняют более 90% штаммов пневмококков, к имипенему и ванкомицину – 100%. Но в Центральном и Северо-Западном округах 12—15% штаммов пневмококков нечувствительны к азитромицину, эритромицину и другим 14-членным макролидам, эта цифра ниже (10%) в отношении мидекамицина и джозамицина (16-членных макролидов).
К ко-тримоксазолу (Бактрим, Бисептол) приобрели устойчивость 35—60% штаммов пневмококков, к тетрациклину — 20—50%, эти препараты больше не применимы при респираторной патологии. Пневмококки полностью резистентны к гентамицину и другим аминогликозидам, так что их использование для монотерапии респираторных инфекций недопустимо.
Гемофильная палочка – второй по частоте бактериальный возбудитель ОРЗ. Бескапсульная ее форма — самый частый возбудитель синусита, отита, конъюнктивита, а также пневмонии (обычно вместе с пневмококком). Она — наиболее частый патоген, высеваемый при хронических заболеваниях легких у детей и хронической обструктивной болезни легких у взрослых. Гемофильная палочка типа b — второй по частоте (20—50%) возбудитель гнойного менингита у детей 0—5 лет, она вызывает осложненные пневмонии, эпиглоттит, а также бактериемию, септический артрит, фасциит и другие гнойные процессы.
Во многих странах гемофильная палочка приобрела устойчивость к аминопенициллинам – на 30—50% и более. В России 95—98% штаммов гемофильной палочки чувствительны к амоксициллину и 100% — к амоксициллину/клавуланату и цефалоспоринам 3—4-го поколений. Из числа макролидов в отношении H. influenzae in vitro активен лишь азитромицин, активность кларитромицина повышает его активный метаболит (14-гидроксикларитромицин), однако их клинический эффект многими оспаривается. Возбудитель чувствителен к аминогликозидам, хлорамфениколу, тетрациклинам и рифампицину. Устойчивость к ко-тримоксазолу достигает 30% и более, что лишает его роли и в отношении этого возбудителя.
Бета-гемолитический стрептококк группы А (БГСА) – основной бактериальный возбудитель острого тонзиллита, а также лимфаденита, отита, импетиго (чаще у детей в возрасте старше 4—5 лет). Пневмония, рожа, сепсис наблюдаются редко. С аутоиммунными воздействиями антител к некоторым белкам БГСА связано развитие ревматизма и острого гломерулонефрита, что заставляет добиваться эрадикации стрептококка у больного. БГСА сохраняют 100%-ную чувствительность к пенициллину, цефалоспоринам, линкозамидам, число устойчивых к макролидам штаммов также невелико, оно колеблется по регионам России от 2 до 8%. Число штаммов, резистентных к трем и более препаратам в 2003 году не превышало 4%. Это позволяет широко использовать указанные выше препараты для лечения стрептококковой инфекции. Но повышение устойчивости к хлорамфениколу (14%) и тетрациклину (14%) ограничивают их использование. БГСА устойчивы к аминогликозидам,
Moraxella catharralis встречается у 5—10% больных отитом и синуситом. Возбудитель выделяет b-лактамазу, инфицируя леченых пенициллинами больных. Он устойчив к амоксициллину, но чувствителен к защищенным пенициллинам, цефалоспоринам второго-третьего поколений, аминогликозидам, хлорамфениколу, макролидам.
Среди других возбудителей ОРЗ следует упомянуть микоплазму пневмонии и хламидию пневмонии. Имеющиеся данные показывают, что большинство их штаммов сохраняют чувствительность к макролидам, тетрациклину, доксициклину.
Группа экспертов, рассмотрев вопросы чувствительности респираторных возбудителей, сделала следующие рекомендации:
- Оральное использование ампициллина и ампициллина/оксациллина нецелесообразно из-за недостаточного всасывания.
- В качестве оральных препаратов первого ряда рекомендованы амоксициллин и амоксициллин/клавуланат, а при атипичных возбудителях — макролиды.
- Целесообразен 2-кратный прием оральных аминопенициллинов в суточной дозе 45 мг/кг/сут в 2 приема.
- В группах риска по лекарственной устойчивости пневмококков доза амоксициллина/ клавуланата может быть удвоена.
Выбор антибиотиков при острых кишечных инфекциях
Положение с чувствительностью к антибактериальным препаратам возбудителей кишечных инфекций более серьезно. Так, большинство шигелл имеют ту или иную степень устойчивости (плазмидной) к ПМС. В большинстве регионов России S. flexnery резистентны (90—100%) к ампициллину, ампициллину/сульбактаму, хлорамфениколу, тетрациклину и ко-тримоксазолу. S. sonnei резистентны к ампициллину, ампициллину/сульбактаму 10—38% штаммов, к хлорамфениколу — 27—66%, к ко-тримоксазолу – 75—96%. Шигеллы чувствительны к цефалоспоринам третьего-четвертого поколений (цефотаксим, цефтриаксон, цефтибутен, цефиксим, цефипим), ципрофлоксацину, азитромицину. Местами шигеллы чувствительны к налидиксовой кислоте.
Сальмонеллы в большинстве своем также чувствительны к цефалоспоринам третьего поколения, фторхинолонам, а также к ко-тримоксазолу, но описаны и устойчивые к ним штаммы. Устойчивость к ампициллину, амоксициллину, не превышающая в ряде регионов 3—6%, может достигать 16%.
В лечении коли-энтерита антибиотики обычно используют лишь в наиболее тяжелых случаях с большой осторожностью (риск развития ГУС). Лекарственная чувствительность возбудителя часто снижена, что затрудняет выбор антибиотика.
Большинство острых водянистых диарей вызывается вирусами, так что лечение антибиотиками не показано. В отношении шигеллеза и сальмонеллеза ВОЗ рекомендует проводить антибактериальное лечение только при тяжелых формах и в группах риска (ВИЧ+, грудной возраст и т.д.) при среднетяжелых формах. В этих случаях терапию оправдано начинать с цефтриаксона или цефатаксима, возможно также назначение оральных цефалоспоринов третьего поколения (цефтибутен, цефиксим). Остальные средства (ампициллин внутримышечно, внутрь амоксициллин или ко-тримокса¬зол, налидиксовая кислота) можно использовать в тех регионах, где есть данные о чувствительности к ним возбудителей. При пищевых токсикоинфекциях, гастроэнтерите и энтерите достаточно регидратации.
Кампилобактер чувствителен к макролидам, тетрациклинам, аминогликозидам; нарастание устойчивости к фторхинолонам связано с их применением в сельском хозяйстве. Устойчивость к пенициллинам и ко-тримоксазолу варьирует.
Холерный вибрион сохраняет чувствительность к тетрациклинам, которые можно применять и у детей моложе 8 лет, поскольку опасность инфекции велика. Возбудитель также часто чувствителен к ко-тримоксазолу и фторхинолонам.
Колонизация хеликобактером обычно бессимптомна, но иногда вызывает признаки хронического гастрита, повышая риск язвы желудка и 12-перстной кишки. Возбудитель чувствителен к амоксициллину, макролидам, нитроимидазолам, но в последние годы чувствительность постепенно снижается, вынуждая искать другие комбинации препаратов (обычно на фоне средств, снижающих кислотность желудочного сока).
Выбор антибиотиков при инфекциях мочевых путей
Основной возбудитель – кишечная палочка – утратила чувствительность к пенициллину и цефазолину, а теперь уже и к амоксициллину и ампициллину, которые еще недавно были основными препаратами выбора при этих инфекциях. Для лечения неосложненных инфекций мочевых путей (ИМП) назначают внутрь амоксициллин/клавуланат 50 мг/кг/сут, цефуроксим аксетил 50—75 мг/кг/сут, цефтибутен 9 мг/кг/сут или цефиксим 8 мг/кг/сут. При подозрении на пиелонефрит используют амоксициллин/клавуланат внутривенно 90 мг/кг/сут, цефалоспорины третьего-четвертого поколения (50—80 мг/кг/сут), цефоперазон/сульбактам (до 100 мг/кг/сут в 2 приема), в том числе с аминогликозидами. При инфицировании клебсиеллой, протеем, псевдомонадами и другой флорой при выборе антибиотика следует опираться на данные о ее чувствительности.
Противорецидивное лечение рекомендуется при пиелонефрите, при наличии рефлюкса 3-й степени и выше, аномалий мочевой системы, а также при рецидивировании ИМП. Чаще используют Фурагин 6 мг/кг/сут, ко-тримоксазол 2 мг/кг (по ТМП) в течение 2—3 недель, затем еще 2—8 недель в половинной дозе. Описана и эффективность цефаклора 5—10 мг/кг/сут, налидиксовой кислоты по 10 дней каждого месяца, 3—4 месяца.
Выбор антибиотиков при бактериемии
Во внебольничных условиях развитие бактериемической инфекции чаще всего связано с пневмококками, гемофильной палочкой, она проявляется сначала высокой лихорадкой без видимого очага инфекции с угрозой развития менингита, остеомиелита (особенно частого при инфекции стафилококками). Инфекция менингококками чревата развитием менигококцемии и менингита. С учетом спектра чувствительности этих возбудителей препаратами выбора являются амоксициллин/клавуланат (90 мг/кг/сут внутривенно) или цефтриаксон (80 мг/кг/сут внутривенно).
В условиях стационара бактериемия и сепсис чаще всего развиваются у детей с центральным венозным катетером, особенно при проведении парентерального питания. Основные возбудители – стафилококки (у новорожденных — эпидермальный, у старших детей – золотистый), энтерококки или грамотрицательная кишечная флора, как правило, с множественной лекарственной устойчивостью.
Оптимальной тактикой является удаление катетера, при необходимости новый катетер ставят в другую вену. Выбор антибиотика должен учитывать данные определения чувствительности выделенного из крови возбудителя, но поскольку лечение начинают незамедлительно то эмпирически выбирают комбинации, действующие как на грамотрицательную флору, так и на стафило- и энтерококков. Эффективна комбинация аминогликозида в максимальной дозе в виде одной инфузии (например, амикацин 15 мг/кг/сут) с ванкомицином (40—50 мг/кг/сут в 2—3 приема); последний может быть заменен ампициллином (250—300 мг/кг/сут), меропенемом (100 мг/кг/сут) или цефепимом (150 мг/кг/сут) – вводимых в 3 приема.
При достижении успеха в течение 1—2 дней после удаления катетера обычно достаточен 5—7-дневный курс антибиотика. В случае оставления катетера длительность терапии (при снижении температуры в течение 2—3 дней) должна быть не менее 2—3 недель. В случае развития очагов инфекции (артрит, эндокардит и т.д.) курс лечения составит 4—8 недель. В случае инфицирования катетера грибами Кандида удаление катетера обязательно, курс терапии – 2 недели после окончания фунгемии.
Факторы развития устойчивости и методы ее преодоления
Лекарственная устойчивость возбудителей имеет огромное медицинское и социально-экономическое значение. Поскольку она связана с использованием ПМС, в борьбе с ней ведущая роль принадлежит тем, кто назначает эти препараты. Конечно, законодательное ограничение отпуска ПМС, регламентация их применения в стационарах, создание стандартов и протоколов лечения отдельных инфекций – важный раздел этой работы, но без активного участия врачей все эти меры не окажут должного эффекта.
Что должен предпринять врач? Прежде всего не назначать антибиотик, не убедившись в наличии бактериального заболевания у больного. Если антибиотик назначается в предположении о бактериальной инфекции, врач обязан подтвердить свое подозрение, в противном случае антибиотик должен быть отменен.
В лечении бактериальной инфекции предпочтительны препараты с более узким спектром и коротким периодом выведения (например, пенициллины), которые создают меньший риск развития устойчивости, чем, например, макролиды; последние накапливаются в клетках и затем медленно выводятся, создавая субингибиторную концентрацию, что способствует выработке устойчивости. Это доказано печальным опытом ряда стран, где неоправданно широкое применение макролидов привело к всплеску устойчивости пневмококков, частота которой снизилась только после сокращения необоснованного применения макролидов.
Сведения об авторах:
Владимир Кириллович Таточенко, главный научный сотрудник НИИ педиатрии ГУ НЦЗД РАМН, заслуженный деятель науки РФ, профессор, д-р мед. наук
Майя Джамаловна Бакрадзе, руководитель отделения диагностики и восстановительного лечения НИИ педиатрии ГУ НЦЗД РАМН, канд. мед. наук
Таблица 1
Наиболее распространенные β-лактамазы и их свойства [Сидоренко С.В. Практическое руководство по антиинфекционной химиотерапии / под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова / 2007]
| Фермент, молекулярный класс (функциональная группа) | Субстрат действия | Чувствительность к ингибиторам |
|---|---|---|
| Пенициллиназа стафилококков класса А (2а) | Пенициллины (кроме оксациллина и метициллина) | + |
| Пенициллиназы грамотрицательных бактерий широкого спектра – классов А и D (2b, 2d) | Пенициллины (природные и полусинтетические) и цефалоспорины (ЦС) первого-второго поколений | +, +/- |
| β-лактамазы грамотрицательных бактерий расширенного спектра (БЛРС) – классов А и D (2be, 2d) | Пенициллины (природные и полусинтетические) и ЦС первого — четвертого поколений | +, +/- |
| Цефалоспориназы (AmpC) грамотрицательных бактерий – класс С (1) | Пенициллины (природные и полусинтетические) и ЦС первого —третьего поколений | - |
| Металло-β-лактамазы (МБЛ) грамотрицательных бактерий – класс В (3) | Практически все β-лактамы, включая карбопенемы | - |
Таблица 2
Частота выделения (%) в России пневмококков со сниженной чувствительностью к пенициллинам [Козлов Р.С., 2004]
Инфекция вызванная пневмококком (Streptococcus pneumoniae): диагностика, лечение, профилактика
Streptococcus pneumoniae (пневмококк) — грамположительный кокк, который при росте на питательных средах образует ланцетовидные пары. Чувствителен к оптохину, подвержен лизису в присутствии солей жёлчи.
При росте на кровяном агаре штаммы пневмококка обычно обладают частичным гемолизом (а-гемолиз), в то же время гемолитическая активность различных штаммов может меняться. Инфекционные заболевания, вызванные пневмококком, — одна из самых распространённых причин смерти пациентов во всём мире. В группу риска входят дети, пожилые пациенты, а также лица с сопутствующими заболеваниями.
Патогенез пневмококковой инфекции (Streptococcus pneumoniae)
Пневмококки окружены полисахаридной капсулой, препятствующей фагоцитозу. Существует более девяноста различных капсульных серотипов возбудителя с различным уровнем патогенности и способностью к инвазии. Полисахарид, входящий в состав капсулы, обладает выраженными антигенными свойствами.
Антитела к капсульным полисахаридам у различных серотипов пневмококка — протективные, в то же время возможны перекрёстные иммунные реакции между различными серотипами. Компоненты клеточной стенки микроорганизма также способны вызывать выраженный воспалительный процесс.
Кроме того, пневмококки имеют несколько факторов адгезии, способствующих прикреплению возбудителя к полисахаридам поверхности клеток, что способствует колонизации организма.
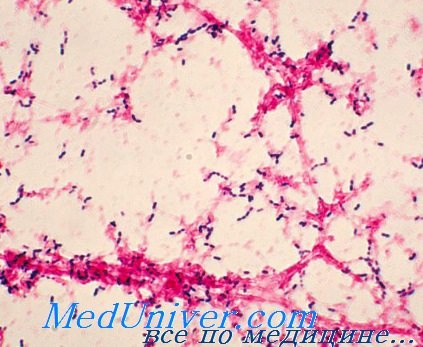
Колонизация пневмококковой инфекции (Streptococcus pneumoniae)
Единственный источник инфекции — человек; носительство обычно протекает бессимптомно. Распределение серотипов зависит от региона, возраста пациента и социальной группы. Наиболее подвержены острой пневмонии дети первого года жизни.
Факторы, предрасполагающие к развитию тяжёлой инфекции: недостаточность комплемента, агаммаглобулинемия, ВИЧ-инфекция, алкоголизм и спленэктомия (удаление селезёнки). Немаловажную роль в развитии инфекционного процесса играют пневмококковые токсины: пневмолизин, нейраминидаза, гиалуронидаза и адгезины (например, пневмококковый поверхностный белок типа А).
Бактерии способны прикрепляться к пневмоцитам и проникать в кровоток, связываясь с рецепторами фактора агрегации тромбоцитов и активируя выработку пневмолизина или комплемент-индуцированного повреждения альвеол.
Клинические признаки инфекции вызванной пневмококком (Streptococcus pneumoniae)
Чаще всего Streptococcus pneumoniae вызывает острые отиты, синуситы и пневмонию. В 50—70% случаев причиной возникновения внебольничной пневмонии становятся пневмококки, при этом у 25—30% пациентов развивается бактериемия.
Прямое или гематогенное распространение инфекции приводит к развитию менингита и реже к целлюлиту, абсцессам, перитониту и эндокардиту. Бактериемия — тяжелейшее осложнение пневмококковой инфекции с высокой летальностью даже при соответствующем лечении.
Пневмококк считают второй из наиболее распространённых причин развития внебольничного менингита у детей, вакци-низированных против Haemophilus influenzae типа В, и основной причиной менингита у пациентов старше сорока лет. При этом отмечают достаточно высокий уровень смертности и вероятности развития осложнений.
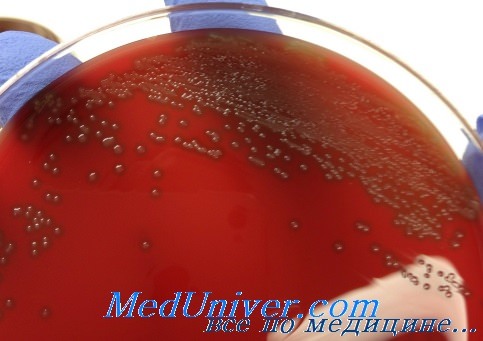
Чувствительность пневмококка (Streptococcus pneumoniae) к антибиотикам
Ранее при лечении пневмококковых инфекций самым эффективным препаратом был пенициллин, но позднее благодаря генетической модификации пенициллинсвязывающего белка большинство штаммов приобрело к нему устойчивость. В настоящее время в клинической практике используют эритромицин, цефалоспорины, тетрациклин, рифампицин и хлорамфеникол, но всё чаще сталкиваются с мультирезистентными штаммами.
Препаратом выбора продолжает оставаться пенициллин, а при менингите, вызванном менее чувствительными штаммами, применяют цефотаксим или цефтриаксон. В случае высокой устойчивости к пенициллину дополнительно назначают гликопептидные препараты (ванкомицин).
Профилактика заболевания вызванной пневмококком (Streptococcus pneumoniae)
Для профилактики пневмококковой инфекции применяют поливалентную капсульную полисахаридную вакцину для профилактики пневмококковых инфекций, эффективную при назначении пациентам в зрелом возрасте и менее действенную у лиц со сниженным иммунитетом и детей младше двух лет.
Недавно созданная конъюгированная вакцина обладает достаточно высокой иммуностимулирующей способностью у детей младшего возраста.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Вернуться в раздел "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекции золотистого стафилококка (Staphylococcus aureus): диагностика, лечение, профилактика
Представители этого рода — неспорообразующие неподвижные грамположительные кокки, формирующие при росте колонии в виде виноградной грозди (кластера) и входящие в состав нормальной микрофлоры кожного покрова животных и человека.
Стафилококки — представители семейства Micrococcaceae. Существует свыше 26 видов стафилококков, но лишь некоторые из них представляют угрозу для здоровья человека. Самым опасным считают золотистый стафилококк (Staphylococcus aureus), отличающийся от остальных наличием фермента коагулазы.
Staphylococcus aureus
Этот вид долгое время считали единственным патогенным микроорганизмом в своём роде. Носительство S. aureus у человека обычно протекает бессимптомно; его обнаруживают у 40% здорового населения.
Обычно он локализуется на слизистой оболочке носа, коже подмышечной области и промежности.
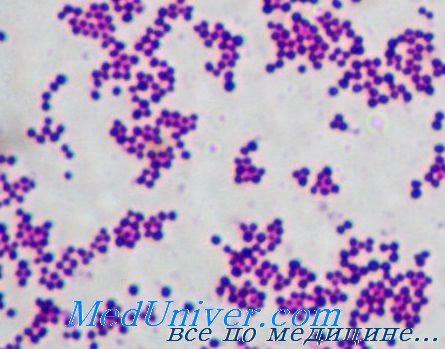
Патогенез инфекции золотистого стафилококка (Staphylococcus aureus)
Коагулаза, продуцируемая Staphylococcus aureus, катализирует реакцию превращения фибриногена в фибрин и помогает микроорганизму образовывать защитный барьер. Кроме того, наличие рецепторов к поверхностным структурам клеток хозяина и матричным белкам (например, фибронектину, коллагену) обусловливает возможность адгезии возбудителя.
Он вырабатывает экстрацеллюлярные лизирующие ферменты (липазу), разрушающие ткани и способствующие инвазии. Некоторые штаммы продуцируют сильнейший экзотоксин, вызывающий синдром токсического шока. Выделяемые бактерией энтеротоксины могут быть причиной диареи.
Клиническая значимость золотистого стафилококка (Staphylococcus aureus)
Staphylococcus aureus вызывает различные заболевания. Кожные инфекции возникают в условиях повышенной температуры и влажности, а также в связи с нарушением целостности кожного покрова при некоторых заболеваниях (экзема и др.), хирургических операциях, инъекциях или внутривенной катетеризации. Даже на здоровой коже может развиться поверхностная пиодермия (импетиго), которая затем передаётся от человека к человеку.
Пневмонию, вызванную S. aureus, наблюдают достаточно редко (в большинстве случаев в качестве осложнения гриппа). Инфекция быстро профессирует (часто наблюдают образование полостей или каверн); характерен высокий уровень смертности. Быстрое течение свойственно и стафилококковому эндокардиту, возникающему при неправильном подборе антибиотиков или вследствие микробной колонизации внутривенных устройств. Заболевание часто приводит к смерти пациента. Кроме того, S. aureus — наиболее распространённая причина остеомиелита и септического артрита.
Лабораторная диагностика золотистого стафилококка (Staphylococcus aureus)
• Бактериологическое исследование: S. aureus — грамположительные кокки, располагающиеся в микропрепарате в виде виноградной грозди. Быстро растут на большинстве питательных сред. Выдерживают высокие концентрации солей, поэтому диагностическая среда может быть приготовлена с учётом этой особенности микроорганизма.
• Изучение биохимических свойств: большинство штаммов S. aureus разлагают маннитол, поэтому добавление его и характерного красителя помогает идентифицировать субкультуру бактерий. Продуцируют коагулазу, ДНКазу, каталазу.
• Типирование S. aureus с помощью набора типовых стафилококковых бактериофагов или методом рестрицирования ДНК.
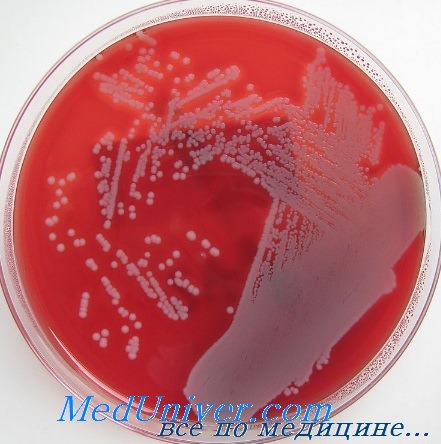
Чувствительность золотистого стафилококка (Staphylococcus aureus) к антибиотикам
Изменение чувствительности S. aureus к антибиотикам можно считать настоящим пособием по антимикробной химиотерапии. Сначала против золотистого стафилококка был в полной мере эффективен бензилпенициллин, но затем возникли штаммы, способные вырабатывать бета-лактамазы. Со временем они стали преобладать над всеми остальными. С внедрением в клиническую практику метициллина и родственных ему лекарственных средств (флуклоксациллина) именно они стали препаратами выбора и в настоящее время остаются таковыми при наличии чувствительных штаммов.
Позже возникли штаммы золотистого стафилококка, устойчивые к действию метициллина. Их резистентность обусловлена геном тесА+, кодирующим белки со сниженным сродством к пенициллинам. Некоторые из устойчивых штаммов способны вызвать эпидемические вспышки заболевания, для борьбы с которыми применяют ванкомицин и тейкопланин.
В настоящее время обнаруживают всё больше микроорганизмов со средней устойчивостью (или гетерорезистентностью) к гликопептидам. Описаны случаи полной гликопептидной резистентности у некоторых штаммов, обусловленной наличием генов vanA+ и vanB+ заимствованных у энтерококков.
Другими эффективными препаратами считают линезолид, аминогликозиды, эритромицин, клиндамицин, производные фузидовая кислота, хлорамфеникол и тетрациклин.
В отношении метициллинчувствительных штаммов активны цефалоспорины первого и второго поколения. Производные фузидовой кислоты применяют при комбинированной терапии инфекционных заболеваний костей и суставов. Лечение должно сопровождаться обязательным проведением теста на чувствительность к антимикробным препаратам.
Профилактика заболеваний вызванного золотистым стафилококком (Staphylococcus aureus)
Передача инфекций, вызываемых Staphylococcus aureus, происходит посредством аэрозольного и контактного механизма. Носителей или лиц, заражённых штаммами, устойчивыми к метициллину и гликопептидам, необходимо изолировать в отдельные боксы и соблюдать меры предосторожности во избежание раневого или энтерального проникновения бактерий.
Следует помнить, что медперсонал может стать носителем инфекции и способствовать её распространению в лечебном учреждении. Именно поэтому всем работникам больницы рекомендовано применение местных растворов мупироцина и хлоргексидина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В.К. ТАТОЧЕНКО, докор медицинских наук, профессор, заслуженный деятель науки РФ, член группы советников ВОЗ, эксперт ВОЗ. АНТИБАКТЕРИАЛЬНОЕ ЛЕЧЕНИЕ ОСТРЫХ ЗАБОЛЕВАНИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ У ДЕТЕЙ
Основная масса (92-94%) острых заболеваний верхних дыхательных путей у детей обусловливается респираторными вирусами (ОРВИ) и в антибактериальном лечении не нуждается. К сожалению, частота назначения противомикробных препаратов у детей с ОРВИ достигает в поликлиниках 65-85%, а в некоторых стационарах 98%. Конечно, в некоторых случаях антибиотики назначать приходится и при неуверенности в бактериальном происхождении болезни из-за сложности диагностики, но лечить ими всех подряд - тактика негодная.
Такую частоту иногда пытаются объяснить попыткой предотвратить бактериальные осложнения вирусной инфекции; эта тактика, как правило, не дает результатов по двум причинам. Во-первых, бактериальные осложнения развиваются обычно быстро, уже в первый день заболевания, на фоне вызываемых вирусами нарушений мукоцилиарного клиренса (система очищения дыхательных путей) и кратковременной иммуносупрессии, так что их отсутствие в начале болезни позволяет прогнозировать гладкое дальнейшее ее течение. Во-вторых, подавляемые антибиотиком чувствительные к нему представители обычной флоры дыхательных путей (пневмококки, стрептококки, гемофильная палочка - Haemophilus influenzae) быстро замещаются устойчивой флорой (стафилококки, Moraxella catarrhalis), на которую в случае развития осложнения он действовать не будет.
Какие же заболевания следует лечить антибиотиками? Очевидно, что повышение температуры, насморк, кашель, головная или мышечная боль сами по себе не являются поводом для назначения антибиотиков, так как сопровождают ОРВИ.
Ангина, острый тонзиллит, тонзил-лофарингит проявляются покраснением зева и миндалин, гнойными пробками или налетами, болью в горле при глотании. Чаще всего, особенно у детей раннего возраста, их вызывают адено- или энтеровирусы; но в возрасте старше 4-5 лет повышается доля ангин, вызванных гемолитическим стрептококком группы А, что может привести к развитию ревматизма. Для выявления стрептококка, а также для исключения дифтерии делают посевы из зева, без посева диагноз можно поставить лишь предположительно, впрочем этого достаточно для назначения антибиотика с целью профилактики ревматизма.
Ангина может сопровождаться нагноением тканей глотки (глоточный абсцесс) или вовлечением в процесс лимфатического узла, обычно у угла нижней челюсти или на шее. Увеличение узлов часто сопутствует ангине, о лимфадените говорят при его нагноении. Эти осложнения проявляются болезненностью, высокой температурой, интоксикацией.
Средний отит - самое частое заболевание маленьких детей - проявляется болями в ухе, высокой температурой, симптомами интоксикации; при перфорации барабанной перепонки видны выделения из уха. Отит вызывают пневмококки, реже стрептококки и гемофильная палочка, а у детей, получавших недавно антибиотики, - стафилококки, Moraxella catharalis.
Во многих странах мира в последнее десятилетие наблюдается рост устойчивости флоры дыхательных путей, в значительной степени в связи с неоправданно широким применением антибиотиков.
Синусит. Изменения в придаточных пазухах носа сопровождают большинство ОРВИ и не нуждаются в антибактериальном лечении. При присоединении бактериальной инфекции (гемофильная палочка, пневмококк) эти изменения сохраняются более 3 недель и обусловливают упорный насморк, заложенность носа, боли в области пазух. Стафилококковый синусит протекает остро, с покраснением и отеком мягких тканей лица и глазницы.
Острый бронхит - заболевание в основном вирусное, оно проявляется кашлем, сухими и разнокалиберными влажными хрипами, обычно невысокой температурой. Лишь в 5-15% случаев у детей дошкольного и школьного возраста, особенно в осенний период, лечение бронхита антибиотиками оправдано - это бронхиты, вызванные микоплазмой (Mycoplasma pneumoniae). Для них характерны обилие мелкопузырчатых хрипов и их асимметрия, а также наличие конъюнктивита. При сочетании бронхита с ангиной (что наблюдается нечасто) можно думать о хламидийной его этиологии (Clamidia pneumoniae). Остальные бронхиты в применении антибактериальных средств не нуждаются, в том числе и в поздние сроки, при усилении отхождения мокроты (нередко зеленоватой).
У части больных при отсутствии указанных выше достаточно легко выявляемых бактериальных заболеваний все-таки нельзя снять подозрение на наличие бактериального осложнения, прежде всего пневмонии. Диагностика пневмонии несложна при наличие характерных физикальных изменений (укорочение перкуторного звука, бронхиальное или ослабленное дыхание, мелкопузырчатые хрипы над ограниченным участком грудной клетки), но эти признаки наблюдаются далеко не всегда. Поэтому назначение антибактериальных средств оправдано и при наличии одного или нескольких следующих признаков:
- температура выше 38°С более 3 дней;
- одышка в отсутствие бронхиальной обструкции: у детей до 2 месяцев при наличии более 60 вдохов в минуту, у детей 3-12 мес - более 50 и у детей 1-3 лет - более 40;
- втяжения уступчивых мест грудной клетки или кряхтящее дыхание в отсутствие бронхиальной обструкции;
- выраженный токсикоз;
- лейкоцитоз > 12 000 в 1 мкл, >5% палочкоядерных, СОЭ >20 мм/час.
У детей с повторными синуситами и отитами, у леченных ранее антибиотиками можно ожидать устойчивости флоры (особенно гемофильной палочки, моракселл, стафилококков) к антибиотикам. Moraxella catharalis обычно устойчива к пенициллинам, но чувствительна к макролидам, цефалоспоринам 2-3-го поколения, аминогликозидам. Стафилококки помимо пенициллина и ампициллина часто резистентны к цефалоспоринам.
Эти данные позволяют сделать рекомендации по рациональному выбору антибактериального препарата. До недавнего времени отечественные педиатры отдавали предпочтение инъекционным антибиотикам, что было связано как с силой традиций, так и с нехваткой эффективных оральных препаратов. Среди последних получили распространение оральный феноксиметил-бензатин-пенициллин (оспен), новые макролиды (рокситромицин, мидекамицин и др., имеющие лучшие органолептические свойства, чем эритромицин), цефалоспорины 1-го поколения (цефалексин, цефадроксил), действующие на пневмо- и стрептококки, но они слабо или совсем не действуют на гемофильную палочку. Ампициллин, действующий на оба этих возбудителя, при приеме внутрь плохо всасывается; однако его аналог - амоксициллин имеет такой же широкий спектр противомикробного действия и прекрасно всасывается при приеме внутрь (даже при приеме вместе с пищей). Если биодоступность ампициллина составляет 40%, то амоксициллин в капсулах в кишечнике всасывается на 70%, в виде суспензии - на 80-90%, а в форме растворимых таблеток Флемоксин Солютаб - на 93%. Высокая биодоступность Флемоксина Солютаб приближена к парентеральным формам, что, с одной стороны, обеспечивает терапевтическую концентрацию препарата в очаге инфекции, с другой - позволяет значительно снизить частоту и степень выраженности такого побочного эффекта, как кишечный дисбактериоз. Неудивительно, что амоксициллин во всем мире стал наиболее широко применяемым антибиотиком при заболеваниях дыхательных путей у детей. Расширяется его использование и в России. В комбинации с клавуланатом (коамоксиклав, аугментин) амоксициллин действует и на возбудители (гемофильная палочка, стафилококк, моракселлы и др.), выделяющие фермент лактамазу, разрушающую большинство природных и полусинтетических пенициллинов.
Антибиотики при бактериальных инфекциях верхних дыхательных путей
| Форма | Возбудитель | Стартовый препарат | Замена при неэффективности |
| Отит средний острый | Пневмококк, стрептококк, гемофилюс | Внутрь: амоксициллин; оспен, макролид | Внутрь: амоксициллин/клавуланат, цефуроксим (внутрь, в/м) |
| Синусит острый негнойный | Пневмококк, гемофилюс | Внутрь: амоксициллин, амоксициллин/клавуланат | Внутрь: цефуроксим, цефаклор (внутрь, в/м), азитромицин |
| Синусит гнойный | Золотистый стафилококк | В/в, в/м: оксациллин или цефазолин + гентамицин | Линкомицин в/м или ванкомицин в/в |
| Отит, синусит рецидивирующий, леченный антибиотиками | Устойчивые стафилококк, гемофилюс, реже Moraxella catharalis | Внутрь: амоксициллин/клавуланат, внутрь или в/м цефуроксим, цефаклор | В/м: оксациллин, цефалоспорин 2-3-го поколения, в том числе в комбинации с гентамицином или др. аминогликозидом |
| Тонзиллит острый | бета-гемолитический стрептококк группы А | Внутрь: оспен, гамма-пенициллин, амоксициллин, макролид, цефалексин, цефадроксил, доксициклин (у детей старше 8 лет) 10 дней | |
| Бронхит | Вирусы | Антибактериальное лечение не проводится | |
| Бронхит | Микоплазма, хламидии | Внутрь: эритромицин, другие макролиды, доксициклин (у детей старше 8 лет) | |
| Подозрение на пневмонию | Пневмококк, микоплазма | Внутрь: амоксициллин, оспен, макролид | |
Особая форма амоксициллина - Флемоксин Солютаб. Это таблетка, которую можно глотать целиком, разжевывать или растворять в воде. Приятный вкус и удобный режим приема (два раза в день) позволяют с успехом применять препарат у детей.
Рекомендации по лечению бактериальных ОРЗ противомикробными средствами представлены в таблице. В лечении стрептококковых ангин используют любые оральные пенициллины, макролиды, цефалоспорины 1-го поколения в обычных дозах, у детей старше 8 лет - также доксициклин в растворимой форме (Юнидокс Солютаб - 2-4 мг/кг/сут). Повторный посев желателен через 10 дней и через 4-6 недель, когда нередко наблюдаются бактериологические рецидивы.
Для лечения среднего отита и синусита наиболее подходит амоксициллин (Флемоксин Солютаб - 40 мг/кг/сут), активный в отношении как пневмококка, так и гемофильной палочки. При отите, где ведущими возбудителями являются пневмо- и стрептококки, вполне пригоден Оспен (50 мг/кг/сут), при аллергии к пенициллинам назначают макролиды (эритромицин 30-50 мг/кг/сут и др.). При синусите вместо амоксициллина надежны амоксициллин/клавуланат (Аугментин - 50 мг/кг/сут) или азитромицин (Сумамед - 5 мг/кг/сут). Длительность лечения отита - не менее 10 дней, при применении азитромицина - 3 дня.
При неэффективности этих средств, как и у детей, получавших до заболевания антибиотики, следует применять препараты второго выбора - амоксициллин/ клавуланат, внутрь цефуроксим-аксетил (Зиннат) 25-50 мг/кг/сут, цефаклор (20 мг/ кг/сут). В тяжелых случаях цефалоспорины вводят парентерально одни или в комбинации с гентамицином (5 мг/кг/сут). При рецидивирующих формах следует руководствоваться результатами посева отделяемого из уха.
Гнойный синусит требует интенсивной противостафилококковой терапии и, часто, хирургического вмешательства. Вводят оксациллин (150 мг/кг/сут) или цефамизин (Кефзол - 100 мг/кг/сут), лучше в комбинации с гентамицином (5 мг/кг/сут).
Острый бронхит у дошкольников и школьников с указанными выше признаками микоплазменной инфекции (особенно в период ее эпидемического подъема) допустимо лечить макролидами (эритромицин - 30-50 мг/кг/сут, рокситромицин - Рулид - 50-100 мг/кг/сут, мидекамицин - Макропен - 30-50 мг/кг/ сут). У детей старше 8 лет возможно применение и доксициклина (Юнидокс Солютаб) в указанной выше дозе. Те же препараты эффективны и при хламидийных бронхитах.
При указанных признаках возможной пневмонии есть два подхода. Если состояние ребенка тяжелое, выражен токсикоз, целесообразна госпитализация, лучше с предварительным введением пенициллинового антибиотика (предпочтительно внутримышечно). При нетяжелом состоянии желательно подтвердить подозрение, сделав, например, рентгенографию. Если это в данный момент невозможно, следует назначить оральные препараты (амоксициллин, оспен, макролид) и постараться как можно скорее подтвердить или снять подозрение на пневмонию; в последнем случае антибиотик следует сразу отменить.
Прогресс наших знаний о бактериальных инфекциях дыхательных путей и расширение спектра антибактериальных средств существенно улучшили их прогноз. Сейчас стоит задача сузить показания к антибактериальному лечению случаями, где оно действительно эффективно. Важно сделать лечение целенаправленным и менее травмирующим, более безопасным и дешевым. Но и педиатры, и родители должны контролировать себя, стремиться сокращать излишнее использование антибактериальных средств, уменьшая травматизацию и другие нежелательные эффекты их применения.
Читайте также:

