Почему официально снят в россии препарат реатаз от вич
Обновлено: 19.04.2024
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
Прошло ровно три года с тех пор, как российский Минздрав парафировал международную программу ЮНЭЙДС, запущенную ООН в 2014 году. Прописанные в документе цели и пять лет назад выглядели амбициозно, причем не только для нашей страны. Напомним, что к 2020 году 90% людей, живущих с ВИЧ, должны знать о своем статусе, 90% из выявленных должны быть охвачены терапией, а 90% из них – иметь неопределяемую вирусную нагрузку. Vademecum, ввиду заветного дедлайна, решил выяснить, как далеко Россия продвинулась в сторону целевых показателей.
ПРОГРАММНОЕ ОБИЛЕЧИВАНИЕ
Подписавшись под программой ЮНЭЙДС, Россия не спешит вписываться в заданные ею правила. Например, единого регистра ВИЧ‑инфицированных, знающих о своем статусе, у нас нет. Независимо друг от друга, данные о пациентах собирают Федеральный научно-методический центр по профилактике и борьбе со СПИДом академика РАН Вадима Покровского и Минздрав (регистр пополняется за счет сведений, поступающих из регионов, и доступен только узкому кругу специалистов в ЕГИСЗ). Да и региональная статистика фактурой не блещет: о терапии, которую получают люди, живущие с ВИЧ, отчитывается только Москва. По словам курировавшей статистику регионов по ВИЧ в 2017-2018 годах в Центральном НИИ организации и информатизации здравоохранения Минздрава Марии Афониной, именно с тем, что регистры пока не сведены и не проверены, связаны существенные статистические разбросы данных о числе пациентов, знающих о диагнозе, и прогнозируемом общем числе ВИЧ‑инфицированных россиян.
Наиболее узкой аудиторией пациентов считается та, что стоит на диспансерном учете. В конце сентября таких было 714 тысяч человек. Как поясняет Афонина, в регистр попадают все пациенты, получившие положительный подтверждающий анализ на ВИЧ, но на диспансерный учет становятся только те, кто прошел консультацию с инфекционистом. В сентябре 2019 года Минздрав заявил, что намерен в 2020 году поставить на учет еще 80 тысяч пациентов. Эта цифра сопоставима с ежегодным числом новых случаев выявления ВИЧ‑инфекции, то есть фактически о существенном приближении диспансерной аудитории к общему числу зафиксированных ВИЧ‑положительных людей речи не идет.
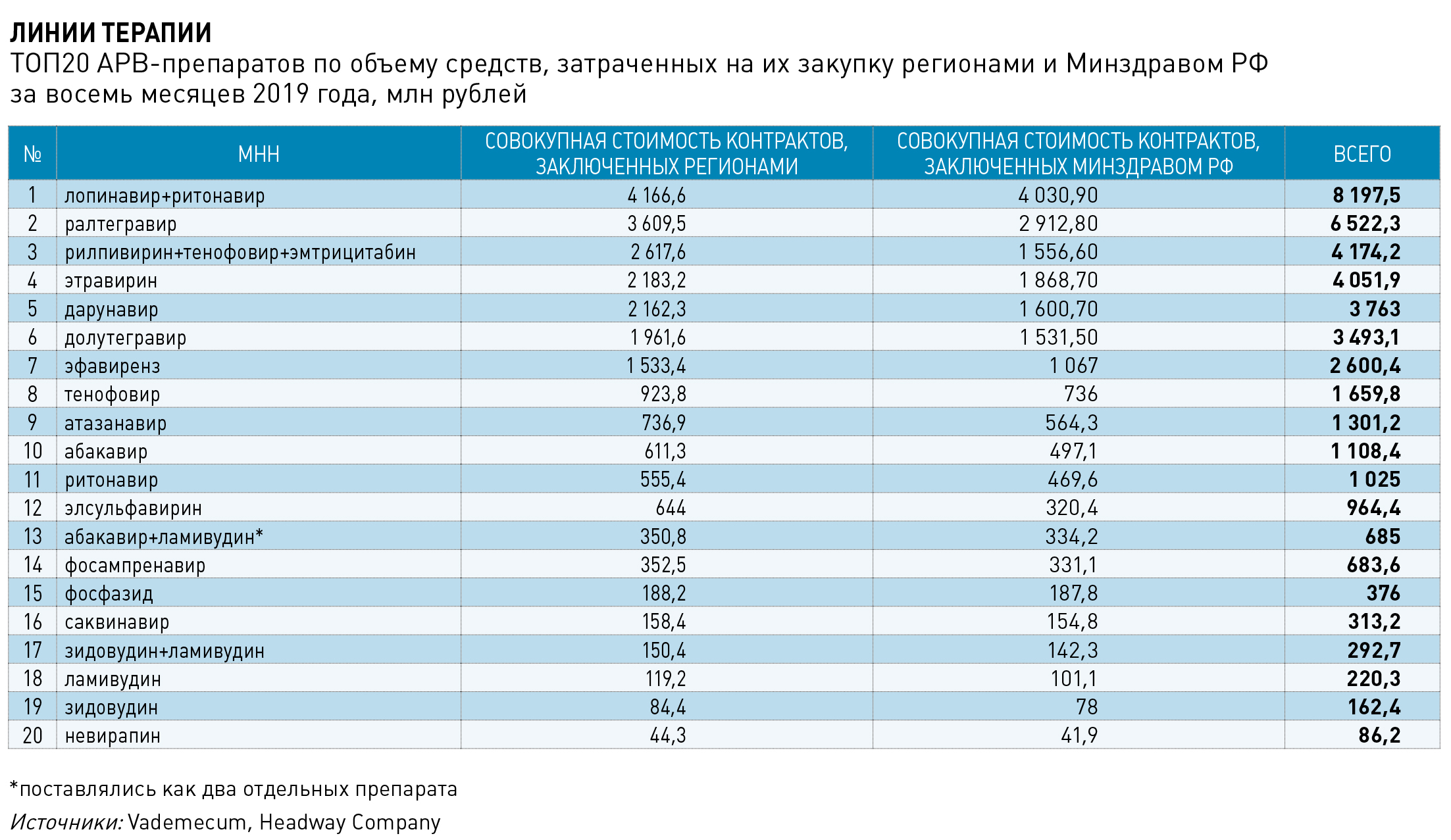
Одной из проблем борьбы с ВИЧ в России Афонина называет качество схем лечения. Наиболее употребительной и одной из самых доступных на сегодняшний день является схема, включающая прием эфавиренза, ламивудина, тенофовира. Комплекс входит в первую линию терапии – как по стандартам оказания медицинской помощи пациентам с ВИЧ, так и по до сих пор не утвержденным клинрекомендациям. Международные стандарты рекомендуют подобные схемы как альтернативные для стран с низким уровнем дохода. Годовая стоимость такой терапии, подсчитали в Коалиции по готовности к лечению (ITPCru), составляет 12 тысяч рублей на пациента. Схема второго ряда с Калетрой или Калидавиром (лопинавир+ритонавир) стоит 60 тысяч рублей и по‑прежнему обширно закупается, хотя в мире, как утверждает специалист ITPCru Денис Годлевский, давно предпочитают более современные ингибиторы ВИЧ‑протеазы. Наконец, наиболее оптимальный, по рекомендациям ВОЗ, режим содержит в составе современные ингибиторы интегразы (в России представлены МНН долутегравир, ралтегравир и элвитегравир), но входит в России только в третью линию терапии, используемую при неэффективности первых двух. Такое лечение в России, даже согласно действующим национальным рекомендациям, показано всего 15% целевой аудитории, но получают ее только 25 тысяч больных, поскольку бюджету схема обходится в 120 тысяч рублей в год на пациента.
В итоге получается, что российский Минздрав фокусируется только на одном из трех целевых показателей стратегии – 90‑процентном обеспечении терапией пациентов, состоящих на диспансерном учете. Но и этот рубеж едва ли достижим. Помимо проблем со статистикой выявляемости и качеством схем лечения, Афонина называет еще одну до сих пор не решенную – маршрутизацию. Несмотря на изменения, внесенные в ПП №1512, пациенту, узнавшему о своему диагнозе в регионе пребывания, по‑прежнему необходимо сначала встать на учет по месту регистрации, а уже потом открепиться и получать терапию там, где ему удобно. Выполнение этой процедуры полностью зависит от комплаентности пациента, в то время как некоторые из них, даже встав на учет, могут вовсе не появляться в диспансере. С этим отчасти связан низкий процент получающих терапию больных. Елена Максимкина отчиталась в сентябре 2019 года о 63,7% охвата против плановых 75%.
ОКАЗИИ УКУПНИКОВ
Модель лекарственного обеспечения пациентов с ВИЧ менялась Минздравом уже дважды: в 2016 году, одновременно с подписанием стратегии, ведомство вернуло профильные закупки на федеральный уровень, чтобы покончить с разбросом цен и, снизив логистические издержки, закупать препаратов больше за те же деньги. По словам главы Минздрава Вероники Скворцовой, централизация должна была привести к миллиардам экономии бюджетных средств. В 2019 году на профильные препараты было потрачено 23,6 млрд рублей, на 2020 год проектом бюджета запланировано 29,3 млрд.
Следуя регламенту контрактной системы и предписаниям ФАС, Минздрав в 2019 году объявил к закупке 200 тысяч годовых курсов ламивудина. НМЦК ведомство сформировало по итогам торгов прошлого года в 3,6 рубля в пересчете на одну таблетку. Не найдя поставщика, Минздрав дважды переобъявлял тендер, увеличивая цену с шагом в 10 копеек. В ведомстве на вопрос Vademecum о причинах такого осторожного подхода не ответили.

Сразу после обращения Минздрав собрал держателей регудостоверений на ламивудин, чтобы выяснить, что случилось. Оказалось, что препарата в объеме годовой потребности ни у кого из поставщиков нет. Производственные планы фармкомпаний верстаются задолго до объявления аукционов: уже в январе из плана‑графика Минздрава стало ясно, что будет объявлено к закупке и каков объем средств, выделенных на каждое МНН. Проиграв в аукционе Минздрава, производитель рискует заморозить остатки на весь последующий год, поскольку никто из регионов такое количество не приобретет.
Слова Алейникова красноречиво подтверждают показатели импорта ламивудина: за первую половину 2019 года в Россию было ввезено всего 4 кг субстанции от азиатских партнеров, подсчитали для Vademecum в RNC Pharma, тогда как годом ранее было ввезено 33,9 тонны, а в 2017 году – 45,7 тонны. Причиной низкого интереса к отдельно взятому МНН, помимо прочего, могла стать возросшая цена субстанции: в 2017‑2018 годах цена за килограмм составляла около 8,5 тысячи рублей, а в 2019 году поднялась до 16,9 тысячи. По словам участников рынка, сильно подорожали прежде всего субстанции из Китая, где власти ужесточили требования к экологичности химических производств. Российские держатели регудостоверений на субстанцию ламивудина хоть и числятся в госреестре, по‑видимому, заняли производственные мощности под что‑то другое.
НАРОДНОЕ ДОСТАВАНИЕ
Пуния также допускает, что ситуация с ламивудином может повториться и с другими препаратами от ВИЧ, если Минздрав продолжит следовать действующей методике расчета НМЦК, а субстанции продолжат дорожать.
КТО СВЕТЕЛ, ТОТ И СВАТ
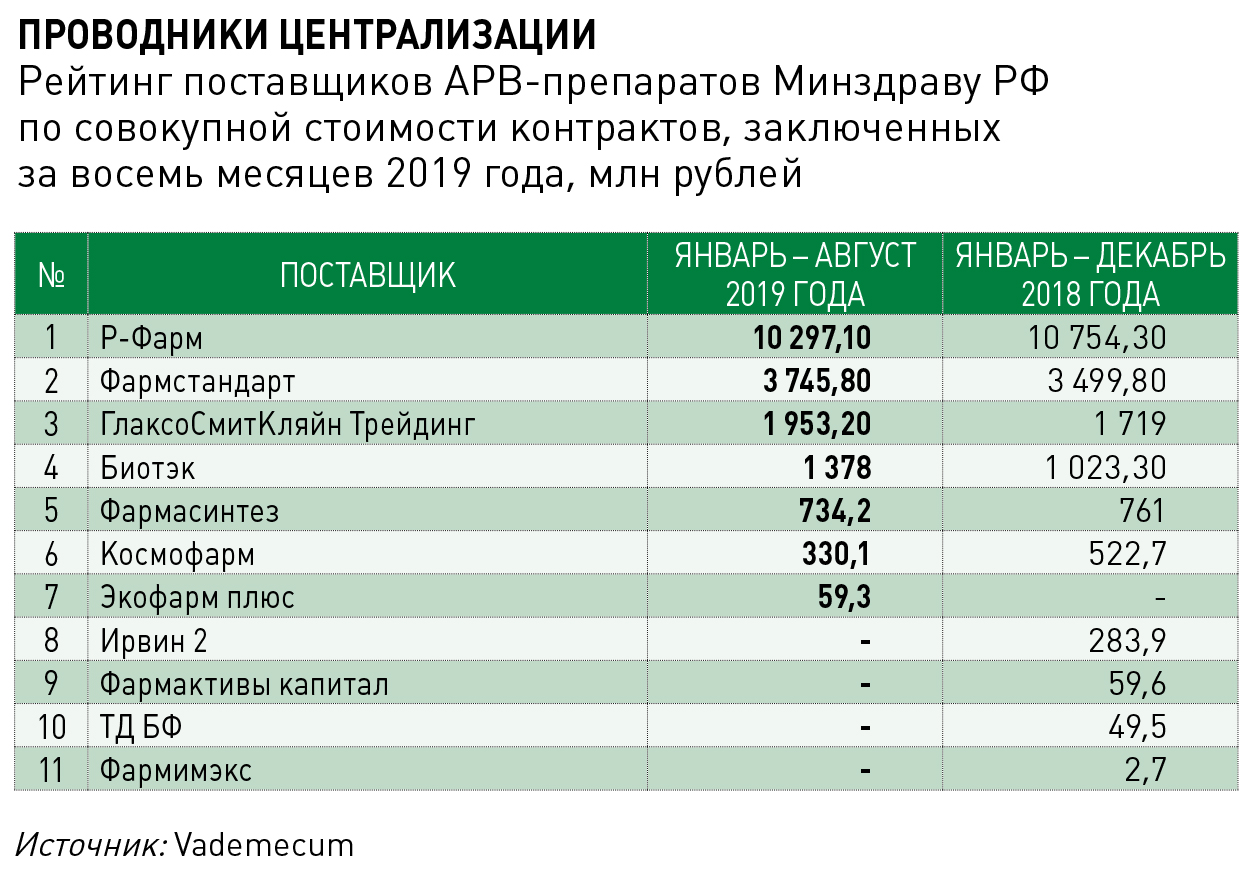
Наблюдатели отмечают, что сложившуюся в 2019 году конфигурацию рынка устоявшейся считать не следует. По мнению Вадима Покровского, летний кейс с ламивудином – тревожный сигнал о том, что предел в удешевлении стоимости терапии уже достигнут, и теперь для увеличения охвата требуется выделение дополнительных средств. По оценкам академика, на лекарственное обеспечение всех пациентов с ВИЧ может потребоваться 50 млрд рублей, на сдерживание эпидемии заболевания – 100 млрд рублей, что предполагает не только увеличение закупок АРВ‑препаратов, но и траты на логистику, профилактику, снижение вреда и прочие подходы, примененные в других странах.
В 2019 году ЮНЭЙДС признала, что цели ее стратегии слишком амбициозные и повсеместно достичь к 2020 году показателей не удастся. Одним из успешных примеров в реализации глобальной программы может служить Германия. Помимо охвата терапией в стране использовалось в первую очередь информирование о ВИЧ, профилактика, в том числе проведение политики снижения вреда для наркопотребителей, работа с группами риска, доконтактная профилактика ВИЧ. В 2017 году Германии удалось достичь следующих показателей: 87% осведомленности о своем диагнозе, 92% охвата терапией пациентов с подтвержденным диагнозом и 95% числа пациентов с неопределяемой вирусной нагрузкой, то есть уже не способных к передаче вируса. В тематические отчеты ЮНЭЙДС входят не только европейские страны, приблизиться к целевым показателям стратегии удалось Ботсване, Зимбабве и ряду стран с низким уровнем дохода. Россия в их число пока, увы, не входит.
Общая информация
Более 20 лет прошло с тех пор, как на фармацевтическом рынке появился новый класс антиретровирусных препаратов — ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ). В 1996 году американское Управление по санитарному надзору по качеству пищевых продуктов и медикаментов FDA одобрило невирапин, в 1997 году — делавирдин, а годом позже — эфавиренц. Однако, у значительной части пациентов с помощью ННИОТ не удалось добиться оптимального терапевтического ответа вследствие накопленной устойчивости вируса к монотерапии и/или неоптимальных режимов комбинированной терапии, поэтому усилия учёных всего мира были направлены на разработку новых молекул, с улучшенным профилем устойчивости. И они увенчались успехом.
Сегодня FDA одобрено применение пяти ННИОТ [1]:
-
;
- делавирдина;
- эфавиренца;
- этравирина;
- рилпивирина.
Представители ННИОТ принадлежат к разным классам ЛС по химической структуре, но имеют общий уникальный механизм действия: их взаимодействие с обратной транскриптазой ВИЧ-1 запускает цепь изменений, подавляющих активность этого фермента. Для ННИОТ характерна специфичность к ВИЧ-1, что делает их селективными ингибиторами вируса [1, 2].
Сегодня разрабатываются ННИОТ следующего, третьего поколения. Для улучшения приверженности лечению и снижения риска ошибок в дозировках при приёме препаратов была создана комбинация эфавиренц + два НИОТ (эмтрицабин и тенофовир) в одной таблетке, которую принимают один раз в день.
Фармакологическое действие
По всей видимости, ННИОТ вмешиваются в различные этапы реакций обратной транскриптазы ВИЧ-1. За счёт этого препараты блокируют активность РНК- и ДНК-зависимой ДНК-полимеразы, вызывая разрушение активного центра фермента [1, 2].
ННИОТ не оказывают значимого ингибирующего эффекта на ДНК-полимеразу клеток эукариот, таких как ДНК-полимеразы человека.
Следует отметить, что большинство ННИОТ не активны в отношении ВИЧ-2 — второго серотипа вируса иммунодефицита, который встречается гораздо реже ВИЧ-1 (преимущественно в Африке), является менее вирулентным и агрессивным по сравнению с первым серотипом [2]. При этом, исследования in vitro демонстрируют активность этравирина в отношении ВИЧ-2 [3].
Устойчивость к ННИОТ
ВИЧ-инфекция характеризуется очень высокой скоростью репликации: вирус производит от 1 до 10 миллиардов новых вирусных частиц в день у нелеченного инфицированного. Наряду со специфическими свойствами обратной транкриптазы ВИЧ, а также большой длиной вирусного генома (около 10 000 нуклеотидов) это создаёт предпосылки к высокой частоте развития мутаций: мутантный ген в каждом положении нуклеотида в вирусном геноме вырабатывается каждый день.
Как правило, развитие мутаций тесно связано с неоптимальной схемой лечения, например, монотерапией. Оно также ставит под угрозу эффективность последующих схем антиретровирусной терапии, поскольку в каждом классе препаратов наблюдается перекрёстная резистентность [4].
Мутации в домене гена обратной транскриптазы изменяют способность ННИОТ связывать фермент. Устойчивость препаратов первого поколения была связана с мутациями в нескольких кодонах. Однако, чтобы вызвать клиническую неэффективность делавирдина, эфавиренца или невирапина, достаточно наличия мутации К103N или Y181C [4].
Препараты второго поколения более устойчивы, для развития резистентности к ним необходимо более одной мутации. Клинические исследования выявили 17 мутаций устойчивости, связанных со снижением ответа на терапию этравирином [5]. Различные мутации в разной степени влияют на восприимчивость вирусов к этравирину. Рилпивирин, будучи препаратом с более высоким генетическим барьером, чем ННИОТ первого поколения, всё же связан с более частыми случаями развития устойчивости по сравнению с этравирином [6].
Фармакокинетика ННИОТ
ННИОТ демонстрируют значительную индивидуальную фармакокинетическую вариабельность. Все одобренные в настоящее время препараты этой группы используют систему цитохрома Р450 для метаболизма и оказывают или индукционное, или ингибирующее действие на определённые изоферменты (например, CYP3A4, CYP2C9). Это приводит к значительному потенциалу лекарственного взаимодействия [7].
За исключением невирапина, ННИОТ в существенной степени связываются с белками (98–99 %), в первую очередь с альбумином и альфа-кислотным гликопротеином. Периоды полураспада ННИОТ в сыворотке крови довольно продолжительны и составляют от 25 до 55 часов, за исключением делавирдина, имеющего более короткий период полувыведения (2–11 часов) [7].
Побочные эффекты
Самым частым побочным эффектом ННИОТ считается сыпь: она развивается в течение первых нескольких недель терапии и проходит при продолжении лечения. Все препараты этого класса, за исключением этравирина, обладают определённой гепатотоксичностью. Так, делавирдин и эфавиренц могут повышать уровень трансаминаз, в то время как невирапин способен вызывать тяжёлое поражение печени, включая некроз [8].
Эфавиренц способен вызывать неблагоприятные реакции со стороны центральной нервной системы — бессонницу, яркие сновидения, головокружение, спутанность создания и галлюцинации. Рилпивирин также связан с неврологическими побочными эффектами, но реже, чем эфавиренц [6].
Устойчивость к побочным эффектам со стороны ЦНС на фоне приёма эфавиренца обычно возникает после нескольких недель терапии. Их можно корректировать за счёт приёма препарата перед сном и отказа от применения во время еды. Лишь у небольшого числа пациентов воздействие на ЦНС может сохраняться и даже потребовать отмены препарата [9].
Использование эфавиренца также связано с повышением риска суицидов примерно в два раза по сравнению с плацебо. Они присутствуют как в начале лечения, так и при длительном применении. К группам риска по развитию суицидальной наклонности на фоне лечения эфавиренцом относятся пациенты, принимающие психоактивные препараты, имеющие психиатрический анамнез, с массой тела менее 60 кг, а также употребляющие инъекционные наркотические средства [10].
Особенности отдельных ННИОТ
Невирапин
Используется, как минимум, в сочетании с двумя другими антиретровирусными препаратами. Относительно безопасен при беременности. Хорошо проникает через гематоэнцефалический барьер, подвергается печёночному метаболизму (период полувыведения — 28 часов). Препарат индуцирует и собственный метаболизм, поэтому дозу увеличивают постепенно. В начале терапии его назначают один раз в день, а спустя две недели увеличивают кратность приёма до двух раз в день (при хорошей переносимости) [1, 4, 10].
Как правило, невирапин применяется в странах третьего мира, в том числе и для антиретровирусной терапии во время беременности. Результаты исследований показали, что он превосходит зидовудин по эффективности при однократном введении во время родов, однако приводит к развитию резистентности у леченных матерей, что может отрицательно повлиять на терапевтический ответ антиретровирусной терапии в дальнейшем [1, 8].
Делавирдин
Принадлежит к семейству бис (гетеро-арил) пиперазинов, открытых учёными компании Upjohn Laboratories. Имеет более объёмную кристаллическую структуру по сравнению с другими ННИОТ, благодаря чему выступает за пределы гидрофобного кармана, с которым связывается. Это объясняет его особый профиль устойчивости. Мутация, связанная с развитием резистентности к делавирдину, расположена на участке места связывания ННИОТ с карманом. Она вызывает гиперчувствительность ко всем другим препаратам этой подгруппы [1, 4].
Как и невирапин, делавирдин применяют в схемах лечения, когда возникает резистентность, которую невозможно предотвратить. Сегодня этот препарат назначают крайне редко.
Эфавиренц
Представитель подкласса бензоксазинов, открытый исследователями Merck в 1995 году. В отличие от невирапина и делавирдина, был изучен в исследованиях III фазы в качестве компонента лечения ННИОТ и продемонстрировал высокую эффективность.
Этравирин
Принадлежит к семейству диарилпиримидиновых соединений, стал результатом многолетних исследовательских усилий учёных из компаний Janssen Research Foundation и Tibotec, направленных на открытие новых ННИОТ с оптимальным профилем устойчивости и повышенным генетическим барьером для развития резистентности. In vitro демонстрирует более высокий генетический барьер устойчивости по сравнению с невирапином и эфавиренцем [4].
Период полувыведения этравирина составляет 41 час. Препарат назначают два раза в день после еды. Самый распространённый побочный эффект — сыпь, которая, как правило, появляется в течение первых 6 недель терапии. Также на фоне применения нередко развивается периферическая нейропатия [1, 10].
Обладает активностью против штаммов ВИЧ, резистентных к ННИОТ. Из-за потенциально значительных побочных эффектов не применяют в комбинации с другими ННИОТ. Обладает аддитивной противовирусной активностью в комбинации с ингибиторами протеазы ВИЧ, нуколеозидными ингибиторами обратной транскриптазы, а также с ингибитором слияния энвуфиртидом [4].
Рилпивирин
Ещё одно соединение, ставшее результатом дальнейшей оптимизации в рамках ННИОТ, направленной на создание препарата с лучшим профилем устойчивости. In vitro демонстрирует профиль резистентности и генетический барьер, сопоставимый с таковым у этравирина. Отличается высокой биодоступностью, в том числе по сравнению с этравирином. Фармакокинетические свойства позволяют применять один раз в день. Переносится лучше, чем эфавиренц, с более низкой частотой невропсихиатрических нежелательных явлений, сыпью, меньшим количеством липидных нарушений [4, 10].
— Совсем скоро в России начнут вакцинировать российской вакциной от коронавируса сначала медиков и учителей, а потом все остальное население. Можно ли пациентам с ВИЧ-инфекцией прививаться такой вакциной? От чего это зависит?
— Людям с ВИЧ, как и любым другим людям, прививаться нужно, здесь я ограничений не вижу. Если по аналогии с гриппом и другими похожими заболеваниями, то пациентам с ВИЧ-инфекцией нужно вакцинироваться. Это безопасно, потому что вакцины, о которых мы слышали и читали, неживые, то есть в них присутствуют только фрагменты вируса, они не жизнеспособные. С другой стороны, мы знаем: если у человека с ВИЧ-инфекцией количество клеток СД-4 выше 500, его можно прививать и живой вакциной.
— В вашей практике в этом году были люди с ВИЧ, которые переболели ковидом?
— Их много. У меня еженедельный прием и наблюдается порядка пятисот пациентов. Я каждого опросила, был ли у него ковид или похожее на него заболевание, результаты пока неокончательные, но они показывают, что четверть пациентов в той или иной степени перенесли что-то очень похожее на ковид.
Еще были данные, которые собирали мои коллеги по нашему региону (Московская область) о ВИЧ-положительных людях, попавших в стационар с положительным анализом на ковид. Их нашлось примерно двести человек, из них умерли двадцать. При этом из умерших только двое получали терапию: один из них мой пациент, он принимал АРВТ, но был с лимфомой и на химиотерапии. Второй пациент принимал АРВТ, но, видимо, как-то нерегулярно, у него была плохая приверженность, никогда не было подавленной вирусной нагрузки. А все остальные умершие люди ни одного раза не были у нас в центре СПИДа и никогда не получали терапию. Но делать вывод, что антиретровирусная терапия защищает от ковида или от тяжелого течения болезни, я не могу.
— Эти вопросы обсуждались и продолжают обсуждаться. Были какие-то исследования, которые подтвердили эффективность Трувады относительно тяжелого течения и даже профилактики ковида. Но понять, как действуют препараты, мы до конца не можем.
— Если бы к вам пришел ВИЧ-отрицательный пациент и сказал, что боится заразиться ковидом, вы бы ему посоветовали профилактику Трувадой?
— В каком-то конкретном случае — может быть. Но в целом еще недавно в большом обзоре по ковиду и ВИЧ говорилось, что перепрофилирование лекарств — это совсем неверно и даже вредно. Мы видели на примере гидроксихлорохина, который применяется в ревматологии, при лечении малярии и так далее, как его просто тотально начали назначать всем подряд. И он не достался больным с тяжелыми ревматическими болезнями, которые тоже смертельны. Поэтому про ту же Труваду — если ее эффективность в отношении ковид докажут в исследованиях, то тогда можно рекомендовать.
по теме

Общество
Вне социальных рамок: психиатр и социолог Дмитрий Исаев — о трансгендерных людях
— Вернемся к ВИЧ. В последние годы значительная часть новостей про попытки полностью излечить ВИЧ-инфекцию была связана с экспериментами по пересадке костного мозга. Насколько, на ваш взгляд, эта технология перспективна? И может ли она в будущем стать массовым способом излечения от ВИЧ-инфекции?
— На мой взгляд, это казуистические, очень редкие случаи, которые произошли. Мы знаем, что выздоровели три человека, а пересаживали костный мозг тридцати восьми. То есть не всегда помогает. Плюс это очень дорого и почти невозможно найти донора, надо чтобы он был невосприимчив к ВИЧ и одновременно совместим по другим показателям.
Ну и, конечно, это очень серьезная и опасная для жизни манипуляция: у человека полностью убивают его костный мозг, и пока не приживется новый, он какое-то время живет вообще без костного мозга в стерильных условиях. Такой метод лечения может применяться только у тех, у кого заболевание более серьезное, чем этот метод лечения, то есть у людей с онкологией. Поэтому рассчитывать на этот метод не стоит. С другой стороны, это показывает, что излечение от ВИЧ все-таки возможно.
— Насколько близко сейчас человечество подошло к границе, после которой мы сможем не поддерживать здоровье пациентов в течение всей жизни, а уже полностью излечивать от вируса?
— Давайте поговорим про новые режимы терапии. Обычно она состоит из трех компонентов, препаратов. Даже если таблетка всего одна, то в ней одной содержатся все три компонента. Но в последние годы все чаще говорят о режимах из двух лекарств. Зачем вообще нужна такая терапия? И она так же эффективна, как и обычная?
— В первую очередь, исследование и применение усеченных схем оправдывают тем, что чем меньше препаратов в схеме, тем меньше побочных эффектов. Например, в России применяется относительно новый препарат Долутегравир, он может сочетаться с Ламивудином или Рилпивирином, то есть составлять двухкомпонентную схему. Чем он хорош? Тем, что в схеме нет Тенофовира, который у кого-то может вызывать осложнения со стороны почек и со стороны костной системы. То есть смысл этих режимов именно в уменьшении количества побочных эффектов, но без ущерба эффективности. Обязательно в такой схеме присутствует препарат с высоким барьером резистентности — тот же Долутегравир способен выдержать не одну мутацию ВИЧ, а до четырех. Сейчас, когда действительно доказана эффективность таких схем, они применяются достаточно широко.
— Была публикация, что двойные схемы чреваты большей вероятностью хронического воспаления.
— В англоязычной литературе это называется хронической иммунной активацией. Это хроническое воспаление, которое развивается в организме каждого ВИЧ-положительного человека в ответ на присутствие антигена, то есть вируса иммунодефицита человека. Когда человек начинает получать терапию, уровень этого воспаления снижается, но он не исчезает совсем. Чем это неприятно? Иммунитет реагирует на вирус и постоянно находится в подзаведенном состоянии, выделяя большое количество медиаторов воспаления, которые могут быть вредны. По такому механизму развиваются всякие васкулиты, в очень острой форме при ковиде развивается цитокиновый шторм.
— Стоит ли бояться хронического воспаления?
— Это просто механизм течения ВИЧ-инфекции. Когда развивается СПИД, то уже никакое хроническое воспаление особенного значения не имеет, поскольку все эти болезни гораздо тяжелее. А когда СПИД не развивается благодаря терапии, то да, имеет значение.
Мы знаем, что сопутствующие болезни у ВИЧ-положительного человека в среднем накапливаются примерно на десять лет раньше, чем у ВИЧ-отрицательного. Но что такое десять лет, если жизнь удлиняется до нормальных ее значений? Здесь ведь дело не только в ВИЧ-инфекции, но вообще всегда, приобретая что-то хорошее, мы не обращаем внимания на не очень хорошее, если первое перевешивает. Так, мы никогда не назначим лечение, осложнения от которого могут быть сильнее, чем то, что мы лечим.
С 21 по 22 сентября в онлайн-формате пройдет III Международная научно-практическая конференция PROHIV 2020. Стать участником может любой желающий — для этого нужно зарегистрироваться на сайте и заполнить анкету.
История Георгия — не единственная. Сейчас обеспокоены все люди с положительным ВИЧ-статусом. И это понятно. Перерывы в терапии пациентов с ВИЧ опасны тем, что вирус снова начинает размножаться, приобретет лекарственную устойчивость, а значит, постепенно будет угнетать иммунную систему.
Что делать в случае перебоев с АРТ
«Всегда хорошо иметь запас, но также важно не устраивать „ажиотажные визиты“ в центры борьбы со СПИДом. Если таблетки в центре закончились, врач может предложить перейти на другую схему лечения. Если и таких вариантов нет, то можно попробовать самостоятельно найти препарат бесплатно в резервных аптечках (часто на базе НКО) или за деньги в обычных аптеках.
В крайнем случае перерыв в приеме терапии — если у вас нормальный иммунный статус и нет вторичных заболеваний на фоне ВИЧ — не должен сказаться на здоровье в долгосрочной перспективе.
Какие препараты вошли в список ЖНВЛП в 2022 году
По словам Норова, иностранные граждане также могут рассчитывать на качественную и эффективную помощь на территории России.
Справка: еще раз объясняем про схемы АРТ и их смену
-
Какие используются схемы терапии?
Сам смысл терапии, как известно, в комбинации нескольких препаратов. Бывает комбинация в одной таблетке (в России встречается нечасто), бывает в разных, от трех до восьми. Как правило, меняются один или два компонента. Есть так называемая основа схемы, препараты, которые используются чаще всего, и к ним добавляется третий, иногда третий плюс четвертый препарат. Чаще всего проблемы возникают именно с этим третьим или четвертым препаратом либо с какими-то комбинированными их формами.
Это очень сильно зависит от самой схемы. Например, если мы говорим о замене внутри одного класса препаратов, то есть из той же группы, то не грозит практически ничем.
Сказать однозначно, чем грозит замена терапии, нельзя, потому что может быть, наоборот, произойдет оптимизация схемы: какой-то препарат начинает использоваться меньше и будет заменен на более современный. Такое тоже бывает.
В теории пропасть может любой препарат, другое дело, что на практике во многих центрах этого не происходит уже довольно давно. Сейчас ситуация у нас, конечно, нестандартная, и предсказать что-либо сложно.
Но важно помнить, что любая полноценная современная схема АРТ лучше, чем отказ от приема терапии.
Почему не стоит бояться смены схемы терапии АРТ
— Понятно, что врачи исходят из того, что доступно на сегодняшний день. Они прекрасно понимают, что необходимо следовать трем основным принципам: эффективность лечения (подавление вирусной нагрузки), хорошая переносимость (отсутствие побочных эффектов) и долгосрочное влияние на организм пациента во избежание каких-либо ассоциированных с препаратом побочных действий длительного эффекта (речь идет о влиянии на сердечно-сосудистую систему, на метаболизм и прочее).
Если схема терапии неизбежна, то в идеале препараты должны меняться на более современные и более благоприятные для пациента по всем этим трем параметрам, в чем и заключается весь смысл индивидуального подбора терапии.
Если говорить о реалиях, то бывает по-разному. Конечно, мы всегда ожидаем перебоев, готовы к сложностям, но однозначно сейчас сказать, что это ударит по пациентам, нельзя. Дело в том, что не всегда смена терапии может нести негативную коннотацию. Бывало, что измененная схема не подходила какому-то человеку, но ведь это возможно с любой схемой терапии. Врачи не заинтересованы в том, чтобы безосновательно менять схемы, создавая тем самым сложности пациенту — безусловно, они всегда будут искать и ищут какой-то компромисс, баланс.
Пока мы не понимаем, насколько серьезно все отразится на препаратах и их доступности, но мне хотелось бы дать умеренно обнадеживающий прогноз, все-таки это сфера, попадающая под санкции далеко не в первую очередь, область эта достаточно сильно локализована (не всегда полностью) и важная стратегически, находящаяся на особом контроле. Надеюсь, что так и будет продолжаться.
Читайте также:

