Почка при системной красной волчанке микропрепарат
Обновлено: 17.04.2024
Нефросклероз (nephrosclerosis; греч. nephros почка + склероз) — замещение паренхимы почки соединительной тканью, приводящее к их уплотнению, сморщиванию и нарушению функций.
Этиология и патогенез
Замещение почечной паренхимы соединительной тканью может наблюдаться при далеко зашедшей гипертонической болезни (см.) и связано чаще всего с сужением почечных артерий — первичный Нефросклероз (ангиогенный Нефросклероз), первично-сморщенная почка. В связи с недостаточным кровоснабжением, нарастающей гипоксией наступают дистрофические и атрофические изменения паренхимы почек с последующим разрастанием соединительной ткани. В зависимости от характера процесса, ведущего к сужению почечных артерий, различают Н. гипертонический, или артериолосклеротический, и атеросклеротический. В патогенезе первичного Н. имеет значение также хроническое венозное полнокровие, при к-ром разрастание соединительной ткани в почках связано с повышенным синтезом тропоколлагена в условиях кислородной недостаточности. К первичному Н. относят постинфарктный Н., развивающийся при рубцевании множественных инфарктов почек (см.).
Разрастание в почках соединительной ткани может происходить вторично, в результате различных заболеваний (вторичный Н., вторичносморщенная почка). Вторичный Н. представляет собой исход воспалительных и дистрофических процессов, возникающих в почках при хрон, гломерулонефрите, пиелонефрите (пиелонефритическое сморщивание почек, пиелонефритически сморщенные почки), почечнокаменной болезни (калькулезный Н.), туберкулезе (туберкулезный Н.), сифилисе (сифилитический Н.), ревматизме (ревматический Н.), системной красной волчанке (волчаночный Н.), амилоидозе (амилоидное сморщивание почек, или амилоидно-сморщенные почки), сахарном диабете (диабетический Н.).

Рис. 1. Электронограмма приносящего сосуда почечного клубочка при доброкачественной форме нефросклероза: скопление гиалиновых масс под эндотелием (указано стрелкой); х 6000.

Рис. 2. Микропрепарат почки при доброкачественной форме нефросклероза: склероз и гиалиноз почечного клубочка, ШИК-реакция; X 750.
Вторичный Нефросклероз может развиться после таких неблагоприятных воздействий, как травма (в т. ч. после повторных операций на почках), действия ионизирующего излучения, а также при тяжелых формах нефропатии беременных — преэклампсии и эклампсии. Свойственные нефропатии спазм артерий, воспаление почечных клубочков и дистрофия канальцев после родоразрешения в ряде случаев трансформируются в хронический гломерулонефрит, к-рый, медленно прогрессируя, приводит к сморщиванию почек, выраженности изменений и особенностей течения выделяет две формы — доброкачественную и злокачественную. Доброкачественная форма характеризуется артериолосклерозом (рис. 1), нередко в сочетании с атеросклерозом почечной артерии и ее крупных ветвей, атрофическими изменениями групп нефронов с вторичным гиалинозом клубочков (рис. 2), увеличением соединительнотканной стромы, гиалинозом сосочков пирамид. Макроскопически поверхность почек мелкозернистая, а при сочетании с атеросклерозом — крупнобугристая. По мере нарастания артериолосклеротических изменений, сочетающих
Такие острые инфекционные болезни, как геморрагический нефрозонефрит, лептоспироз, брюшной и сыпной тиф, скарлатина, корь, а также сепсис, сопровождаются различными по механизму поражения и по тяжести изменениями паренхимы, интерстиции и сосудов почек — от очагового гломерулонефрита без нарушения функции почек до канальцевого некроза и острой почечной недостаточности. После этих воспалительных и некротических изменений развивается различной степени выраженности Н., к-рый обычно не прогрессирует.
Выделяют также инволютивный Н., к-рый обусловлен возрастными изменениями сосудов почек, а также атеросклерозом или гипертонической болезнью, часто наблюдаемыми у лиц пожилого и старческого возраста.
Патологическая анатомия

Рис. 3. Микропрепараты почки при злокачественной форме нефросклероза: а — в центре виден почечный клубочек с фибриноидным некрозом приводящего сосуда (1) и клубочковых кровеносных капилляров (2); окраска гематоксилин-эозином; х 310; б— почечный клубочек с резким склерозом петель кровеносных капилляров и уменьшением числа эндотелиоцитов; окраска гематоксилин-эозином; х 525.

Рис. 4. Макропрепарат почки при злокачественной форме нефросклероза: слева — общий вид (капсула почки снята, поверхность почки неровная, мелкозернистая, пестрая за счет многочисленных кровоизлияний); справа — сагиттальный разрез почки (рисунок строения нарушен, видны многочисленные кровоизлияния различной величины).
Из первичных Нефросклерозов наиболее распространен гипертонический, или артериоло-склеротический, нефросклероз. Фар (Th. Fahr) в зависимости от характера, распространенности, степени плазморрагию (см.) и гиалиноз (см.), и выключения новых групп нефронов развивается почечная недостаточность (см.).
Злокачественной форме свойственны фибриноидный некроз артериол (артериолонекроз) и капиллярных петель клубочков (рис. 3, а), отек стромы, кровоизлияния, белковая дистрофия эпителия канальцев.Очень быстро в ответ на некротические изменения развивается склероз почек (рис. 3, б). Подобные изменения могут возникать и при эклампсии (злокачественный постэкламптический Нефросклероз).
По Лелейну (М. Lohlein), доброкачественная форма артериолоскле-ротического Н. соответствует первой стадии Н. (начальный Н.), протекающей клинически без проявлений со стороны почек, а злокачественная форма — второй стадии Н. (прогрессирующий Н.), для которой характерно быстрое течение с развитием почечной недостаточности.
Однако такая последовательность процесса признается далеко не всеми.
По мнению H. Н. Аничкова, К. Г. Волковой, М. А. Захарьев-ской, морфология артериолосклероз тического нефросклероза отражает особенности течения гипертонической болезни.
Атеросклеротический Н. возникает при сужении (вызванном атеросклеротической бляшкой) почечной артерии у места ее отхождения или деления на ветви первого и второго порядка.
Чаще этот процесс односторонний, реже двусторонний. В почке развиваются клиновидные участки атрофии паренхимы с коллапсом стромы и замещением этих участков соединительной тканью или инфаркты с последующей их организацией и формированием рубцов (атеросклеротическая сморщенная почка, атеросклеротический нефроцирроз). Макроскопически при этом ночка становится крупнобугристой, нередко ее трудно отличить от почки при иостинфарктном Н. Функция такой почки (почек) страдает мало, т. к. большая часть ее паренхимы остается сохранной. В результате ишемии почечной ткани в ряде случаев при стенозирующем атеросклерозе почечных артерий развивается симптоматическая (почечная) гипертензия.
Поэтому морфологические критерии дифференциальной диагностики первичного (гипертонического) и вторичного (нефритического) сморщивания почек, как правило, нечеткие.
Инволютивные изменения в почках выявляются начиная с 40—50 лет и к 70 годам приводят к сокращению массы действующих нефронов примерно на 40% .
Возрастная атрофия почек сопровождается постепенным истончением коркового слоя обеих почек, атрофией канальцевого эпителия вплоть до гибели и замещения канальцев рубцовой тканью. Клубочки подвергаются гиалинозу, и их число постепенно уменьшается. Увеличивающаяся с возрастом резистентность сосудов приводит к запустеванию капилляров клубочков, формированию анастомозов между приводящей и отводящей артериями в обход клубочков.
Нефросклероз в старческом возрасте связан прежде всего с возрастными изменениями сосудов почек, поэтому он приближается по механизму развития к первичному.
Основные клинические признаки. Клин, проявления первичного Н. возникают обычно в поздних стадиях гипертонической болезни как при доброкачественном, так и злокачественном ее течении. Одним из ранних признаков поражения почек могут быть полиурия (см.) и никтурия (см.), однако никтурия не всегда является следствием полиурии и может свидетельствовать о нарушении суточного ритма работы почек. Протеинурия (см.), наблюдаемая при Н., обычно небольшая и непостоянная.
Нередко при Н. наблюдается микрогематурия, в ряде случаев может быть макрогематурия (см. Гематурия). Уменьшение почечного клиренса (см.) при относительном увеличении фильтрационной фракции проявляется уменьшением концентрационной способности почек (гипостенурия), что выявляется с помощью пробы Зимницкого. Соответственно падает удельный вес мочи и ее осмолярность. В случае выраженного сосудистого поражения почек, приводящего к значительному уменьшению почечного кровотока, возрастает их прессорное влияние на уровень АД, к-рое стабилизируется на высоком уровне и трудно поддается медикаментозной коррекции (см. Гипертензия артериальная).
Особенно характерно повышение диастолического артериального давления, к-рое бывает всегда выше 120—130 мм рт. ст.
В связи с этим могут возникать явления перегрузки и недостаточности миокарда левого желудочка, коронарная недостаточность, церебральные геморрагии, отек сосочка зрительного нерва, отслойка сетчатки, а в ряде случаев и прогрессирующая почечная недостаточность.
На обзорных снимках выявляется уменьшение пораженной почки (всей или части), неровность ее контуров.
При урографии (см.) отмечается уменьшение объема почки и величины коркового слоя. На ангиограммах (см. Почечная ангиография) наблюдается сближение и деформация мелких артериальных сосудов (в фазе нефрограммы отчетливо видны уменьшение коркового слоя и неровность очертаний пораженной лочки).
При радиоизотопной ренографии (см. Ренография радиоизотопная) отмечается замедленное накопление, а также замедленное выведение радиофармацевтического препарата из почек.
При сцинтиграфии (см.) определяется неравномерное распределение радионуклида в ткани пораженной почки, в ряде случаев ее изображение может отсутствовать или сохраняются отдельные участки паренхимы.
Проявления вторичного Н. могут варьировать от незначительных нарушений функций почек (клинически не выраженных) до состояний, сопровождающихся тяжелой артериальной гипертензией, отеками, нефротическим синдромом, существенным снижением функции почек, развитием тяжелой почечной недостаточности.
Общие принципы лечения и профилактики. При Н. без признаков почечной недостаточности и неустойчивом повышении АД лечение состоит гл. обр. в ограничении употребления в пищу поваренной соли (до 0,5 г в сутки) и применении гипотензивных средств (производных раувольфии, ганглиоблокаторов, до-пегита, салуретиков).
При развитии почечной недостаточности при нефросклерозе также показано применение гипотензивных средств, однако интенсивная гипотензивная терапия может привести к падению почечного кровотока и нарастанию азотемии; применяют диету с ограничением соли и белков, анаболические средства, леспене-фрил, салуретики.
При злокачественном течении гипертонической болезни с быстрым развитием нефросклероза и прогрессированием почечной недостаточности, в целях выключения ренин-ангиотензивного механизма прибегают к эмболизации почечных артерий или нефрэктомии (см.), больных переводят на гемодиализ (см.) или производят трансплантацию почки (см. Пересадка почки).
Профилактика нефросклероза заключается в своевременном лечении заболеваний, приводящих к его развитию.
Лучевой нефросклероз
Лучевой нефросклероз относится к отдаленным последствиям действия на организм ионизирующего излучения (см.) и выявляется через многие месяцы или годы после облучения.
Морфологически лучевой Н. выражается атрофией почечных канальцев, интерстициальным фиброзом и склерозом сосудов почек. Единого взгляда на развитие лучевого Н. нет. Доминирующей является гипотеза о первичном повреждении почечных клубочков, к-рое, по мнению ряда исследователей, может быть вызвано факторами иммунологического характера. Существует точка зрения, что лучевой Н. развивается в результате первичного повреждения ионизирующим излучением сосудов. Возможно, что в основе этого процесса лежит повреждение генетического аппарата эндотелия сосудов почек. Предполагают также, что причиной лучевого Н. является первичное повреждение почечных канальцев. Иногда лучевой Н. рассматривают как результат одновременного повреждения паренхимы почек и сосудистой системы. Существует мнение, что в основе лучевого Н. лежат взаимообусловленные сосудистые нарушения и изменения межуточного вещества почек.
Основные сведения о лучевом Н. получены в экспериментах на животных, а также в результате наблюдений за пострадавшими от взрывов атомных бомб в Хиросиме и Нагасаки и больными, подвергавшимися локальному облучению по поводу опухолей поясничной области. Степень выраженности лучевого Н. зависит от вида ионизирующего излучения, его дозы и характера распределения дозы во времени и пространстве (см. Дозы ионизирующих излучений, Фактор времени облучения). После острого облучения в абсолютно смертельных дозах лучевой Н. не возникает, т. к. за короткий период, предшествующий гибели организма, склеротические процессы в почках не успевают развиться. Острая лучевая болезнь легкой и средней степени тяжести в отдаленные сроки может завершиться развитием лучевого Н. При тотальном облучении развитие лучевого Н. по крайней мере у 50% животных, по данным большинства исследователей, наступает при воздействии в дозе, близкой к 500 рад. Имеются сведения о возникновении лучевого Н. после тотального воздействия ионизирующего излучения в дозах 100— 300 рад. В условиях локального облучения почек может наблюдаться развитие Н. в диапазоне доз ионизирующего излучения от 1000 до 2500 рад.
В радиол, практике почки рассматривают как критические органы (см.) при лучевой терапии по поводу метастазов рака в параортальные лимфатические узлы, ребра или позвонки с ThXI по LIV, а также по поводу опухолей кишечника, матки, кардиального отдела пищевода и некоторых других органов. Наибольшую осторожность следует соблюдать при проведении нейтронной и протонной терапии, т. к. эти виды ионизирующего излучения обладают более выраженным эффектом в отношении лучевого Н. Высокой эффективностью в этом отношении характеризуется также альфа-излучение. В экспериментах показано, что при поражении полонием, выведение которого в основном осуществляется через почки, в отдаленные сроки лучевой Н. формируется на фоне развивающейся хрон, лучевой болезни.
Клинически лучевой Нефросклероз в легких случаях проявляется протеинурией, незначительной гипертензией; функция почек не нарушается. В тяжелых случаях развивается гипертензия, не поддающаяся медикаментозному лечению, почечная недостаточность.
Лечение симптоматическое (ограничение поваренной соли, гипотензивные средства).
Библиография: Вепхвадзе Р. Я. Лучевые осложнения почек, Тбилиси, 1967; Захарьевская М. А. Патологическая анатомия сосудистого нефросклероза, М., 1952; Калугина Г. В. Дифференциальная диагностика сосудистого нефросклероза, Л., 1975, библиогр.; Кушаковский М. С. Гипертоническая болезнь, М., 1977; Ланг Г. Ф. Гипертоническая болезнь, Л., 1950; Обмен веществ при лучевой болезни, под ред. И. И. Иванова, с. 198, М., 1956; Основы нефрологии, под ред. E. М. Тареева, т. 1, с. 372 и др., М., 1972; Постнов Ю. В., Перов Ю. Л. и Трибунов Ю. П. Склероз мозгового слоя почки при гипертонической болезни, Арх. патол., т. 36, № 7, с. 75, 1974; Почки, под ред. Ф. К. Мостофи и Д. Е. Смита, пер. с англ., с. 294, М., 1972; Чеботарев Д. Ф. Гериатрия в клинике внутренних болезней, Киев, 1977; Fahr Th. Nephrosklerose, Handb, spez. path. Anat. u. Histol., hrsg. v. V. F. Henke u. O. Lubarsch, Bd 6, T. 1, S. 368, B., 1925, Т. 2, S. 909, В., 1931; HeptinstallR. H. Pathology of the kidney, Boston, 1974; Yolhard F. a. Fahr Th. Die Brightsche Nierenkrankheit (Klinik, Pathologie und Atlas), B., 1914; Zollinger H. U. Niere und ableitende Harnwege, в кн.: Spez. path. Anat., hrsg. v. W. Doerr u. E. Uehlinger, Bd 3, B. u. a., 1966.
E. М. Тареев; P. Я. Вепхвадзе (мед. рад.), B. B. Серов (пат. ан.).
Диагноз системной красной волчанки (СКВ) в последние десятилетия стал все чаще встречаться в нефрологическом стационаре. Судить о том, насколько актуальна проблема СКВ, можно хотя бы на основании того, что статья
Системная красная волчанка — аутоимунное заболевание, характеризующееся изменениями со стороны клеточного и гуморального иммунного ответа. Фундаментальным нарушением в иммунной системе у больных с СКВ в настоящее время принято считать генетически обусловленный дефект апоптоза (программированной смерти) аутореактивных клонов Т- и В-клеток. В индукции заболевания помимо генетических факторов важную роль играет уровень половых гормонов. Отрицательное влияние эстрогенов подтверждается развитием заболевания преимущественно у женщин детородного возраста, высокой частотой дебюта и/или обострения заболевания после родов и абортов, а также низким уровнем тестостерона и повышенным — эстрадиола у мужчин с СКВ. Среди экзогенных факторов большое значение придается ультрафиолетовому облучению, бактериальным липополисахаридам и различным группам вирусов, активирующих В-клетки, и применению некоторых лекарственных препаратов, в особенности гормональных контрацептивов.
Потеря иммунной толерантности к собственным, в первую очередь ядерным, антигенам приводит к продукции множества комплемент-связывающих аутоантител к компонентам клеточного ядра, цитоплазмы и мембран, в частности к двухцепочечной ДНК и нуклеосомам. Аутоантитела оказывают как прямое повреждающее действие на различные органы и ткани, так и опосредованное — через формирование иммунных комплексов и активацию системы комплемента. Характерно также не только иммунокомплексное, но и тромботическое поражение сосудов, последнее обусловлено наличием антител к кардиолипину, а также развитием антифосфолипидного синдрома (АФС) и вторичного ДВС. Таким образом, системные повреждения имеют смешанный (цитотоксический, иммунокомплексный и тромботический) генез.
Прогрессирующее поражение жизненно важных органов — почек, центральной нервной системы, сердца, легких, системы крови — определяет тяжесть и прогноз заболевания. Поражаются также и другие органы, суставы, серозные оболочки, кожа. Характерной особенностью СКВ является тот факт, что даже через много лет после начала заболевания процесс сохраняет свою активность.
Диагноз устанавливается при наличии четырех и более из следующих клинических и серологических критериев (критерии Американской ревматологической ассоциации, 1982):
Системный характер заболевания и вовлечение почек в патологический процесс именно в период его максимальной активности приводят к тому, что в большинстве случаев в нефрологической клинике приходится сталкиваться с разнообразными экстраренальными проявлениями СКВ (см. таблицу 1). К ним относятся легочные инфильтраты и альвеолярные кровотечения, цереброваскулит и поперечная миелопатия, тромботические поражения сосудов легких, конечностей, кишечника, головного мозга, эндо-, мио- и перикардит, поражения печени, суставов, тромбоцитопения, анемия, лимфоаденопатия, серозиты, разнообразные кожные проявления и другие симптомы. Наибольшее прогностическое значение имеют поражения ЦНС и легких.
Вовлечение центральной и периферической нервной системы при СКВ встречается довольно часто — до 50% случаев. Отмечаются цереброваскулит, двигательные нарушения, моно- и полинейропатия, асептический менингит, острые психозы, цефалгии, дисфория, судороги. Поперечная миелопатия представляет собой хотя и довольно редкое — 1—3%, но прогностически неблагоприятное и плохо поддающееся терапии проявление заболевания.
Поражение легких чаще всего отмечается в виде пульмонита и тромбоэмболии легочной артерии (ТЭЛА). Диффузные альвеолярные кровотечения развиваются менее чем у 2% больных с СКВ, смертность при этой патологии составляет 70—90%.
Большое значение придается в настоящее время антифосфолипидному синдрому. В рамках АФС рассматриваются такие проявления заболевания, как поражения клапанов сердца, тромбозы коронарных артерий, тромботическая легочная гипертензия, пурпура и язвы голеней, синдром Эванса (сочетание гемолитической анемии с тромбоцитопенией), синдром Снеддона (артериальная гипертензия, рецидивирующие тромбозы мозговых артерий и мраморный рисунок кожи).
Среди поражений сердца наиболее часто встречается перикардит (до трети случаев), причем среди пациентов с активной стадией заболевания распространенность перикардита еще выше — он отмечается более чем у половины больных. У некоторых из них перикардит оказывается первым проявлением СКВ. Грозным осложнением является тампонада сердца, встречающаяся, однако, достаточно редко — примерно 1% случаев.
Волчаночный гломерулонефрит (ВГН) представляет собой одно из наиболее серьезных и прогностически значимых проявлений СКВ. Механизм развития люпус-нефрита иммунокомплексный. Связывание антител к ДНК и других аутоантител с базальной мембраной почечных клубочков ведет к активации комплемента и рекрутированию клеток воспаления в гломерулы.
Клинически почечная патология выявляется, по данным разных авторов, у 50—70% больных, а морфологические изменения — еще чаще. Изучение почечных биоптатов больших групп пациентов показало, что вовлечение почек имеет место практически во всех случаях СКВ. Даже при отсутствии мочевого синдрома в биопсийном материале крайне редко не обнаруживаются изменения, особенно при использовании методов иммунофлюоресценции и электронной микроскопии. Помимо собственно ВГН могут развиваться также почечная тромботическая микроангиопатия, тромбозы почечных артерий и вен, обусловленные наличием антифосфолипидных аутоантител, и иммунокомплексные тубулоинтерстициальные повреждения.
Клиническая картина гломерулонефрита (ГН) при СКВ многообразна (см. таблицу 2) и включает в себя практически все выделяемые в настоящее время варианты: минимальный мочевой синдром; выраженный мочевой синдром в комбинации с гипертонией; нефротический синдром (НС), часто сочетающийся с гематурией и гипертонией, и быстро прогрессирующий гломерулонефрит. При этом каких-либо специфических клинических признаков, характерных именно для люпус-нефрита и позволяющих только на основании симптомов поражения почек диагностировать СКВ, нет.
Доминирующим симптомом является протеинурия — до 100% случаев, НС развивается примерно у половины больных. Микрогематурия присутствует почти всегда, но не бывает изолированной; макрогематурия встречается достаточно редко. Преобладают тяжелые формы заболевания, распространенность которых достигает 63%. Артериальная гипертензия зафиксирована в 50% случаев, более чем у половины больных отмечается снижение скорости клубочковой фильтрации, нарушаются также канальцевые функции. Поражение почек часто развивается в начале заболевания, на фоне высокой активности процесса, иногда становится его первым проявлением или возникает в период обострения.
Разнообразны также и морфологические изменения. Имеются характерные для ВГН признаки (фибриноидный некроз капиллярных петель, гиалиновые тромбы, проволочные петли), что в некоторых случаях позволяет поставить диагноз СКВ на основании результатов биопсии почки, но могут обнаруживаться и изменения, свойственные ГН в целом. Согласно отечественной классификации В. В. Серова (1980), выделяют очаговый пролиферативный волчаночный нефрит, диффузный пролиферативный волчаночный нефрит, мембранозный ГН, мезангиопролиферативный ГН, мезангиокапиллярный и фибропластический ГН. Классификация ВОЗ (1995), базирующаяся на данных световой, иммунофлюоресцентной и электронной микроскопии, позволяет выделить шесть классов изменений.
При сопоставлении этих двух классификаций (см. таблицу 3) можно отметить параллели между мезангиопролиферативным гломерулонефритом и II классом и, отчасти, между очаговым пролиферативным волчаночным нефритом и III классом. Класс IV включает в себя диффузный пролиферативный волчаночный нефрит, а также случаи мезангиокапиллярного гломерулонефрита. Класс V соответствует мембранозному нефриту, а VI — фибропластическому.
Частота обнаружения различных морфологических классов варьирует, чаще всего — до 60% случаев — выявляются изменения IV класса, считающегося, по мнению большинства исследователей, прогностически наиболее неблагоприятным. Помимо морфологического типа отрицательное прогностическое значение имеют нарушение функции почек, артериальная гипертензия, выраженная гематурия, а также мужской пол, высокие титры антител к ДНК, низкий уровень комплемента, анемия, тромбоцитопения и наличие полисерозита.
Течение заболевания и прогноз при СКВ вообще и при ВГН в частности в настоящее время не могут рассматриваться вне связи с результатами лечения. За последние 40 лет прогноз заболевания существенно улучшился (см. таблицу 4). Пятилетняя актуариальная выживаемость увеличилась почти в два раза как при СКВ в целом, так и при ВГН. При ВГН с изменениями IV класса динамика еще более яркая. Если 30 и более лет назад выживаемость пациентов с ВГН IV класса редко превышала один-два года, то в последующем пятилетняя актуариальная выживаемость возросла более чем в четыре раза.
Эффективность терапии высокими дозами КС в сочетании с ЦС при ВГН, в том числе с изменениями IV класса, показана во множестве работ и контролированных исследований. Преимущества терапии комбинацией ЦФ с преднизолоном, по сравнению с монотерапией ПЗ у больных с пролиферативным ВГН, наглядно подтверждены показателями почечной выживаемости.
В заключение хочется еще раз подчеркнуть, что проблема диагностики и лечения СКВ весьма актуальна не только для ревматологии и нефрологии, но и для других, на первый взгляд далеких от нее областей медицины. Пациентов с СКВ нередко длительное время обследуют и лечат с различными диагнозами амбулаторно или госпитализируют в инфекционные, неврологические, гинекологические, туберкулезные и другие стационары, из-за чего больные не получают своевременно адекватного лечения. Между тем современная иммуносупрессивная терапия может радикально изменить их судьбу. В связи с этим необходимо еще раз напомнить врачам различных специальностей, что системная красная волчанка — это не так уж редко встречающееся, грозное, опасное для жизни заболевание, требующее своевременной диагностики и лечения.
Е. В. Захарова
ГКБ им. С. П. Боткина, Москва
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения
Волчаночный нефрит — это деструкция гломерулярного аппарата почек вследствие аутоиммунного воспаления при системной красной волчанке. Проявляется отеками, уменьшением диуреза, макрогематурией, повышением АД, нарастающей интоксикацией, которые обычно усугубляют основную симптоматику СКВ, реже являются самостоятельными симптомами волчанки. Диагностируется с помощью общего анализа мочи, определения уровней сывороточного креатинина, аутоантител, волчаночного антикоагулянта, пункционной биопсии почек с гистологическим исследованием биоптата. Для лечения применяют цитостатики, кортикостероиды, ингибиторы рецепторов ангиотензина, проводят ЗПТ, трансплантацию почки.
МКБ-10
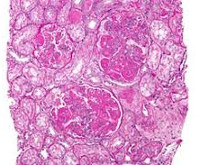
Общие сведения
Клинические признаки волчаночного гломерулонефрита определяются почти у половины больных с установленным диагнозом СКВ. Судя по результатам биопсий, распространенность почечной патологии при волчанке может превышать 90%. Заболевание одинаково часто поражает женщин и мужчин, страдающих волчанкой, однако у пациентов мужского пола волчаночный нефрит отличается более ранним началом, тяжелым и агрессивным течением. При возникновении в возрасте старше 40 лет гломерулонефрит имеет меньшую активность и протекает благоприятнее. Актуальность своевременной диагностики нефрологической патологии у больных СКВ обусловлена ухудшением общего прогноза при аутоиммунном поражении почек. Активный люпус-нефрит остается второй по частоте причиной смерти от волчанки и составляет до 23% в структуре летальности при этом заболевании.

Причины
Поражение почек при СКВ обусловлено характерными нарушениями иммунитета. Непосредственной причиной нефрита становится повреждение паренхимы и интерстиция вследствие специфической аутоиммунной деструкции тканей. Специалистами в сфере клинической урологии, нефрологии и ревматологии выявлено два этиологических фактора развития почечной патологии у пациентов, страдающих системной красной волчанкой:
- Иммунные комплексы. При СКВ неконтролируемо усиливается образование антител к собственным клеткам организма. Осаждение циркулирующих иммунных комплексов (ЦИК) в почках потенцирует возникновение специфического воспалительного процесса (гломерулонефрита).
- Волчаночный антикоагулянт. Антифосфолипидные антитела, вытесняя фосфолипид-связывающие протеины, провоцируют усиление коагуляции. Возникающие артериальные и венозные микротромбозы приводят к ишемии и атрофии почечной паренхимы, усугубляя течение нефрита.
Патогенез
Ключевым звеном в развитии волчаночного нефрита является повреждение почечных тканей вследствие аутоиммунной деструкции. В результате поликлональной активации B-лимфоцитов, недостаточной активности T-супрессоров, низкой толерантности к аутоантигенам в организме больного в большом количестве образуются антитела к ДНК, нуклеосомам, кардиолипину, некоторым фракциям комплемента. Первыми в гломерулах обычно осаждаются иммунные комплексы, антигеном в которых являются нуклеосомы, тропные к анионным участкам базальных мембран. В дальнейшем происходит осаждение ЦИК с другими антигенами.
Классификация
В качестве основного критерия систематизации вариантов люпус-нефрита использованы морфологические изменения почечных структур, их распространенность и клинические проявления. Такой подход позволяет максимально точно спрогнозировать течение заболевания и подобрать оптимальную схему лечения. Эксперты ВОЗ различают 6 классов волчаночного нефрита:
- КлассI – мезангиальный нефрит с нормальными клубочками. Морфологические изменения мезангия не выражены, при электронной или иммунофлуоресцентной микроскопии в нем определяются иммунные комплексы. Клиническая симптоматика отсутствует. Наиболее прогностически благоприятный вариант патологии. Пациенты нуждаются в динамическом наблюдении и скрининговых исследованиях для контроля над состоянием почек.
- КлассII – пролиферативный мезангиальный нефрит. Отмечается расширение мезангия, увеличение количества мезангиальных клеток, наличие осажденных ЦИК. В осадке мочи могут выявляться эритроциты, суточная протеинурия не превышает 500 мг. Клинические симптомы поражения почек отсутствуют. Прогноз благоприятный. Базисная терапия предполагает прием блокаторов ангиотензиновых рецепторов, глюкокортикостероидов в низких и средних дозировках.
- КлассIII – пролиферативный очаговый гломерулонефрит. До половины гломерул подверглись эндо- и экстракапиллярной клеточной пролиферации. Участки воспаления сегментарно распределены в паренхиме. Определяется протеинурия и гематурия. Гипертензия, нефротический синдром, повышение концентрации сывороточного креатинина наблюдаются редко. Кроме кортикостероидов назначают цитостатические препараты. Прогноз различный.
- КлассIV – пролиферативный диффузный гломерулонефрит. Иммуновоспалительному некрозу и склерозированию подверглось больше половины гломерул. В клинической картине кроме лабораторных изменений часто выявляется повышение давления, нефротический синдром. Уровень сывороточного креатинина обычно увеличен. Необходима комплексная терапия цитостатиками и стероидами. Прогноз серьезный.
- КлассV – мембранозный гломерулонефрит. Гломерулярная мембрана утолщена. Обнаруживается субэпителиальное и интрамембранозное отложение иммунных комплексов. Преобладает клиника нефротического синдрома, у некоторых больных возможно увеличение АД, появление эритроцитов в моче, изредка повышается уровень креатинина. Рекомендована иммуносупрессорная терапия разными препаратами и ЗПТ. Прогноз сомнительный.
- КлассVI – склерозирующий гломерулонефрит. Склерозировано более 90% клубочковых капилляров. Быстро возникает и нарастает хроническая почечная недостаточность при минимальных изменениях мочевого осадка. Прогноз неблагоприятный. Пациентам требуется раннее назначение заместительной почечной терапии и пересадка почек. Без радикального лечения заболевание переходит в терминальную стадию.
Отечественными специалистами предложена классификация люпус-нефрита с учетом тяжести, особенностей течения и исходов патологического процесса. Быстропрогрессирующую форму аутоиммунного воспаления почек с нефротическим синдромом, злокачественной гипертензией, ранним возникновением ХПН, плохим прогнозом выявляют у 10-12% больных СКВ. Активный нефрит с признаками волчаночного нефротического синдрома обнаруживают у 30-40% пациентов. В 30-33% случаев определяется активный гломерулонефрит, в картине которого преобладает мочевой синдром. У 15-30% больных нефрит протекает латентно и диагностируется только лабораторно.
Симптомы волчаночного нефрита
Заболевание развивается в среднем через год после постановки диагноза СКВ, хотя может быть и единственным висцеральным проявлением волчанки. В 40% люпус-нефрит имеет бессимптомное течение и выявляется лабораторно. В клинике обычно преобладают признаки основной патологии (поражения суставов, характерная эритема, серозиты), к которым присоединяются отеки, локализованные на лице и наиболее выраженные по утрам, уменьшение суточного количества мочи. 2-5% больных отмечают появление видимой примеси крови в моче. При прогрессировании процесса у 60-70% пациентов возникает стойкая артериальная гипертензия с высокими значениями диастолического давления, рефрактерная к традиционным гипотензивным препаратам. Общее состояние зависит от выраженности морфологических изменений, при нефрите легкой степени нарушения отсутствуют, при тяжелом течении нарастают симптомы интоксикации, появляется кожный зуд, сильные головные боли.
Осложнения
Заболевание часто приводит к формированию или обострению сердечно-сосудистой патологии. Наиболее распространенными осложнениями волчаночного нефрита, развивающимися вследствие поражения сосудов при симптоматической артериальной гипертензии с дислипидемией, являются ишемическая болезнь сердца, инсульты. У пациентов могут возникать тяжелые инфекционные процессы (сепсис, некурабельные пневмонии, туберкулез), связанные с резким снижением иммунитета при длительном лечении кортикостероидами и цитостатиками. Нефрит при волчанке повышает риск злокачественной трансформации клеток, в частности – лейкоцитов с развитием В-клеточных лимфом. Почечная недостаточность как исход волчаночного гломерулонефрита обнаруживается у 10-15% больных. У 36% пациентов с быстропрогрессирующим заболеванием наблюдается ДВС-синдром.
Диагностика
Постановка диагноза волчаночного нефрита обычно не представляет сложностей при наличии характерной симптоматики заболевания. Диагностика может быть затруднена, если гломерулонефрит является единственным органным проявлением СКВ. При подозрении на волчаночный генез поражения почек рекомендованы следующие методы исследований:
- Общий анализ мочи. Соответственно клиническому варианту люпус-нефрита в осадке могут определяться эритроциты, лейкоциты, цилиндры. Для всех форм волчаночного гломерулонефрита кроме I класса характерна протеинурия от 200 до 3000-3500 мг белка/сут и более.
- Содержание креатинина в крови. Обычно показатель повышен у пациентов с диффузным пролиферативным люпус-нефритом, реже — при очаговом, мембранозном поражении, склерозирующей форме заболевания. Высокий креатинин служит прогностически неблагоприятным признаком.
- Исследование крови на антитела. Обнаруживается наличие антинуклеарного фактора, антинуклеарных антител, антител к ds-ДНК, нуклеосомам, гистонам. С1q. При проведении анализа применяют иммунофлуоресцентные и иммуногистохимические методы.
- Волчаночный антикоагулянт(LA). Умеренные и высокие показатели теста характерны для сочетания нефрита с антифосфолипидным синдромом. Положительные результаты свидетельствуют о повышенном риске усугубления аутоиммунного воспаления тромботическими процессами.
- Пункционная биопсия почек. Гистологическое исследование биоптата позволяет выявить патогномоничные морфологические изменения тканей. Проводится всем больным с подозрением на люпус-нефрит при измененном общем анализе мочи или повышенном сывороточном креатинине.
В общем анализе крови часто определяется снижение уровня лейкоцитов, эритроцитов, тромбоцитов, ускорение СОЭ. В качестве вспомогательных методов, позволяющих оценить выраженность структурных изменений и функциональную состоятельность почечной паренхимы, могут выполняться УЗИ, КТ, МСКТ, МРТ почек, экскреторная урография, нефросцинтиграфия, комплексное биохимическое исследование крови, нефрологический комплекс, оценка системы гемостаза. Дифференциальная диагностика люпус-нефрита проводится с быстропрогрессирующим и хроническим гломерулонефритом, лекарственной нефропатией, поражениями почек при ревматоидном артрите, других системных заболеваниях соединительной ткани, миеломной болезни, аутоиммунном гепатите, геморрагическом васкулите, первичном и наследственном амилоидозе. По показаниям пациента кроме уролога, нефролога и ревматолога консультирует терапевт, гепатолог, гематолог, онколог, онкогематолог, токсиколог.
Лечение волчаночного нефрита
Основными терапевтическими задачами при ведении пациентов с СКВ, у которых диагностирован специфический гломерулонефрит, являются индукция ремиссии, максимально долгое сохранение функциональной состоятельности паренхимы, профилактика рецидивов и осложнений, улучшение качества жизни и показателей выживаемости. При выборе схемы лечения учитывают активность аутоиммунного процесса, потенциальную обратимость деструктивных изменений, выраженность почечной недостаточности. Больным с неактивным процессом (I класс люпус-нефрита) рекомендован периодический скрининг состояния почек и назначение препаратов для коррекции других клинических проявлений СКВ.
При волчаночном гломерулонефрите II класса терапию начинают с ингибиторов АПФ, оказывающих антигипертензивный и нефропротективный эффекты за счет снижения системного артериального давления без ущерба ренальному кровотоку. Терапевтическая резистентность состояния, нарастание протеинурии, появление признаков гематурии является основанием для дополнительного применения глюкокортикостероидов и имидазольных цитостатиков. Больным с активным люпусным воспалением гломерул III-V класса в качестве базисных назначают иммуносупрессивные лекарственные средства:
- Цитостатические препараты. Являются обязательным элементом индукционного и поддерживающего лечения. При агрессивном течении заболевания предпочтительна пульс-терапия сверхвысокими дозами алкилирующих производных диамидофосфата, которые ингибируют активность B-лимфоцитов. В последующем больных переводят на поддерживающие дозировки имидазольных цитостатиков или селективных производных микофеноловой кислоты.
- Глюкокортикостероиды. В качестве монопрепаратов в настоящее время практически не используются. Эффективно дополняют цитостатическую терапию, обеспечивая более длительное сохранение почечных функций и лучшие показатели выживаемости. Обычно назначаются в низких дозировках и альтернирующих режимах приема. На начальных этапах лечения возможно проведение активной пульс-терапии высокими дозами.
Альтернативными методами ведения больных с терапевтически резистентными вариантами волчаночного гломерулонефрита являются применение ингибиторов кальциневрина, синтетических моноклональных антител к CD20 и CD22-антигенам мембран B-лимфоцитов, антицитокиновых препаратов, молекулярных блокаторов иммунной реакции. Апробируются и внедряются технологии тотального облучения лимфоидной ткани, костного мозга с последующей трансплантацией стволовых клеток.
Симптоматическая терапия люпус-нефрита направлена на коррекцию отдельных клинических проявлений заболевания. При развитии артериальной гипертензии и значительной протеинурии рекомендован прием ингибиторов АПФ или селективных блокаторов рецепторов ангиотензина II. Для устранения возможной дислипидемии используются статины. Пациентам с признаками антифосфолипидного синдрома показаны антикоагулянты и антиагреганты. Нарастание признаков почечной недостаточности, особенно при волчаночных гломерулонефритах V-VI класса, служит основанием для проведения ЗПТ (гемодиализа, перитонеального диализа, гемофильтрации, гемодиафильтрации и др.), а затем трансплантации почки после 3-6-месячного снижения активности аутоиммунного воспаления.
Прогноз и профилактика
Хотя развитие почечной патологии в целом ухудшает прогноз СКВ, при своевременной диагностике и адекватной терапии пятилетняя выживаемость наблюдается у 80-85% больных с тяжелыми формами гломерулонефрита и у 95% с процессами средней тяжести. Первичная профилактика волчаночного нефрита заключается в скрининговых обследованиях пациентов из группы риска по СКВ с целью раннего выявления и назначения комплексного лечения основной патологии, что позволяет снизить вероятность развития поражения почек. Для предупреждения прогрессирования уже имеющегося нефрита необходимо проведение длительной поддерживающей терапии.
1. Лечение волчаночного нефрита с позиций доказательной медицины/ Сущук Е.Л., Торгашина Л.В.// Научно-практическая ревматология. - №6.
2. Патогенез волчаночного нефрита/ Р.М. Стернер, С.П. Хартоно, Д.П. Гранде// Журнал клинической и клеточной иммунологии. – 2004.
3. Волчаночный нефрит: подходы к диагностике и лечению/ Макарова Т. П., Сенек С.А., Фирсова Н.Н., Мрасова В.К., Осипова Н.В., Садыкова Д.И., Ашрафуллина Ч.И.// Практическая медицина. – 2008.
4. Особенности современного течения волчаночного нефрита и факторы риска его прогрессирования: Автореферат диссертации/ Самокишина Н.А. – 2008.
Читайте также:

