Подберезовики подосиновики при туберкулезе легких
Обновлено: 25.04.2024
Представлен обзор отечественных и зарубежных исследований, посвященных применению на фоне противотуберкулезной терапии гепатопротекторов, в том числе препаратов производных метионина и содержащих янтарную кислоту.
Ключевые слова: гепатопротекторы, полихимиотерапия, туберкулез, нежелательные явления, препараты янтарной кислоты, производные метионина
Use of hepatoprotectors during tuberculosis chemotherapy: review of the russian and international studies
А. А. Stаrshinovа 1,2 , E. N. Belyaevа 1,3 , А. M. Рanteleev 3,4 , M. V Pаvlovа 1
1 St. Petersburg Research Institute of Phthisiopulmonology, St. Petersburg, Russia
2 St. Petersburg University, St. Petersburg, Russia
3 Tuberculosis Hospital no. 2, St. Petersburg
4 Pavlov First Saint Petersburg State Medical University, St. Petersburg, Russia
The article presents the review of the Russian and international studies devoted to the use of hepatoprotectors during anti-tuberculosis treatment, including methionine derivatives and agents containing succinic acid.
Key words: hepatoprotectors, polychemotherapy, tuberculosis, adverse events, drugs containing succinic acid, methionine derivatives
Основными причинами распространения туберкулеза с лекарственной устойчивостью возбудителя являются проблемы в организации лечения: прерывание лечения пациентами, невыполнение стандартных режимов химиотерапии. Этому способствует высокая частота возникновения нежелательных явлений на прием отдельных противотуберкулезных препаратов (ПТП) и их сочетаний [1, 20, 25].
При лечении туберкулеза, оказывая влияние на жизнедеятельность микобактерий туберкулеза, ПТП одновременно влияют на макроорганизм, вызывая функциональные нарушения многих систем организма пациента [1, 2, 14, 20, 25].
Систематизации нежелательных явлений на препараты уделяется значительное внимание с момента появления химиотерапии, что привело к созданию нескольких классификаций, одни разработаны на основе повреждения определенных органов и систем, другие - с учетом особенностей патогенеза нежелательных воздействий препаратов [3, 6].
Гепатотоксические реакции на фоне ПТП отмечаются, по данным разных авторов, в 44-60% случаев и связаны с образованием метаболитов, вызывающих в 60% случаев токсическое повреждение печени, что проявляется нарушением дезинтоксикационной, белковосинтетической и других функций. Лекарственные гепатиты могут сопровождаться синдромом цитолиза в 34,1%, явлениями холестаза - в 50% и их сочетанием - в 15,9% случаев [3, 5, 8, 28].
Механизмы гепатотоксичности бывают разными, что доказано в экспериментальных исследованиях [13] (рис.).
Рис. Механизмы гепатотоксичности (фармакотерапия лекарственных поражений печени при туберкулезе [13])
Fig. Mechanisms of hepatotoxicity (pharmacotherapy of drug-induced liver damage in case of tuberculosis [13])
Основными виновниками развития гепатотоксических реакций являлись рифампицин (67% случаев), пиразинамид (30%) и изониазид (7%) [3, 4, 8, 23, 27]. По данным ряда авторов, гепатотоксические реакции вызывают протионамид, парааминосалициловая кислота, линезолид, бедаквилин и тиоуреидоиминометилпиридиния перхлорат. Как правило, наряду с ними, развиваются гиперурикемия, артралгия, поражение желудочно-кишечного тракта, центральной нервной системы, полинейропатия, кардио- и нефропатические реакции [10, 16].
Поражение печени при туберкулезе может быть обусловлено не только токсическим влиянием препаратов, но и интоксикационным воздействием самого инфекционного процесса, а также развитием системного воспалительного ответа. При этом факторами риска развития гепатотоксических реакций являются хронические заболевания печени и желчевыводящих путей [4, 11, 26].
В клинической практике встречаются от 1,7 до 90,0% случаев, когда нежелательные явления на фоне противотуберкулезной терапии носят как токсический, так и аллергический характер (токсико-аллергические проявления) [2, 3, 12].
По данным немногочисленных исследований, риск развития лекарственно-индуцированных нарушений органов и систем, а также электролитного обмена на фоне полихимиотерапии туберкулеза у больных с множественной лекарственной устойчивостью возбудителя отмечается в 86-90% случаев, что в несколько раз чаще, чем у больных с лекарственно-чувствительным к изониазиду и рифампицину возбудителем [1, 2, 5, 10].
Отечественные и международные подходы по ведению больных туберкулезом на фоне полихимиотерапии различаются в отношении применения терапии сопровождения. В международной практике возможно проведение коррекции нежелательных явлений при их возникновении, тогда как в отечественной практике рекомендуют назначение корригирующей терапии одновременно с началом химиотерапии для предотвращения нежелательных явлений, особенно со стороны печени и желудочно-кишечного тракта. Вопрос применения гепатопротекторов остается нерешенным, что связано с отсутствием достаточной доказательной базы, а также клинических исследований по определению эффективности их применения.
Согласно результатам доклинических исследований, на крысах гепатотоксическое влияние изониазида в дозе 100 мг/кг отмечалось уже через 21 день. При приеме ежедневной комбинации изониазида (50 мг/кг) и рифампицина (100 мг/кг) у мышей происходили нарушения окислительно-восстановительной функции печени с апоптотическим повреждением ее клеток. В исследовании не было найдено доказательств того, что прием данных препаратов три раза в неделю снижает риск развития этих реакций [21].
Поскольку изониазид и рифампицин являются высокоэффективными препаратами, их применение при лечении латентной или активной туберкулезной инфекции является оптимальным. Только у пациентов с нестабильным или прогрессирующим заболеванием печени, если уровень аланина аминотрансферазы в сыворотке крови более чем в 3 раза выше нормы уже на исходном уровне, не следует рассматривать совместное применение данных препаратов. Авторами сделан вывод о необходимости сокращения количества гепатотоксических препаратов и длительности их применения в зависимости от тяжести течения заболевания печени [24].
В одном из проспективных исследований, проведенном в Китае на когорте больных туберкулезом (n = 4 488), оценена эффективность применения гепатопротективных препаратов (силимарина, глюкуроновой кислоты, инозина) для предотвращения развития гепатотоксических реакций на фоне противотуберкулезной терапии. Пациенты принимали гепатопротекторы в течение 183 дней и более. Согласно мониторингу биохимических показателей крови, характеризующих функциональное состояние печени, значимых отличий с группой контроля не получавших эти препараты, не обнаружено [27].
Интересны данные метаанализа [19], проведенного по публикациям 1970-2011 гг., обнаруженным в информационных системах, соответствующим обозначенным требованиям. Описаны результаты лечения 40 034 пациентов с туберкулезом легких, из которых у 1 208 (3,1%) были проявления гепатотоксичности на прием препаратов, из них 339 пациентов имели возраст старше 60 лет. Было доказано, что у пациентов старше 60 лет гепатотоксическая реакция чаще всего связана с приемом пиразинамида и несколько реже - рифампицина и изониазида. Однако различия в уровнях трансаминаз на прием каждого из этих препаратов не были статистически значимыми. Полученные данные потребовали пересмотра нормативных документов по лечению туберкулеза в США и улучшения мониторинга проявлений гепатотоксичности у пациентов от 60 лет и старше. Обозначена необходимость проведения мониторинга клинической симптоматики и биохимических показателей каждые две недели у лиц данной категории, чего ранее не проводилось.
Сопоставимые данные были в исследовании Суханова Д. С. и др. (2013), которые показали, что применение сукцинатсодержащих инфузионных растворов [меглюмина натрия сукцината (в виде препарата реамберина) и комбинации N-метилглюкамина (меглумина) - 8,725 г; янтарной кислоты -5,280 г; инозина - 2,0 г; метионина - 0,75 г; никотинамида - 0,25 г (в виде препарата ремаксола)] эффективно снимает гепатотоксические реакции, индуцированные применением ПТП у больных туберкулезом легких [14].
В проведенном Д. А. Ивановой исследовании получены данные о факторах риска лекарственного поражения печени, которыми являются: женский пол, лекарственная аллергия в анамнезе, дефицит питания. Ею доказано, что первые две недели противотуберкулезной химиотерапии являются периодом наибольшего риска развития неблагоприятных вариантов лекарственного поражения печени (40,9% всех случаев лекарственного поражения печени, 95%-ный ДИ 33,2-50,3%) [4].
Причины возникновения нежелательных явлений во многом обусловлены не только непосредственным действием лекарственного средства, возрастом и полом больного, но и тяжестью его состояния и спектром сопутствующих заболеваний, длительностью приема и способом введения лекарственного средства, а также взаимодействием препарата в организме (фармакодинамические и фармакокинетические аспекты). Нежелательные явления различной степени тяжести развиваются в 10-30% случаев у пациентов стационара и в 40% - при амбулаторном лечении, а также являются причиной госпитализации от 6 до 16% пациентов. В странах Европы 10-25% бюджета стационаров расходуется на лечение осложнений лекарственной терапии [17, 20].
Аналогичные результаты получены и в других исследованиях. При этом появление нежелательных явлений в виде лекарственного поражения печени являлось основной причиной, препятствующей получению хорошего эффекта противотуберкулезной терапии из-за ее прерывания и коррекции [8, 19].
Положительный эффект применения гепатопротекторов при противотуберкулезной химиотерапии чаще подтверждается по результатам отечественных исследований.
Среди препаратов, применяемых для фармакотерапии различных поражений печени, выделяют относительно небольшую группу лекарственных средств, для которых гепатотропное действие является основным, преобладающим или имеющим самостоятельное клиническое значение. Фармакологическое действие данных препаратов заключается в повышении резистентности печени к повреждающему действию различных патогенов, в восстановлении функциональной активности гепатоцитов и регуляции репаративно-регенераторных процессов [6]. В патогенезе повреждения гепатоцитов при хронических поражениях печени важную роль играет развитие тканевой гипоксии, которая приводит к нарушению функций митохондрий и, как следствие, снижению запасов АТФ с активацией высвобождения свободных радикалов [7, 11].
Сегодня на медицинском рынке представлено большое количество гепатопротекторов различных групп: эссенциальные фосфолипиды, производные метионина, препараты на основе расторопши и других растений, холелитолитики, производные део- и урсоксихолевой кислот. Исследования, доказывающие их эффективность, проведены только по некоторым из них.
Ремаксол является раствором, его наиболее активный компонент янтарная кислота - универсальный энергообеспечивающий интермедиат цикла Кребса. В физиологических условиях она диссоциирована, являясь продуктом пятой и субстратом шестой реакции цикла трикарбоновых кислот Кребса, поэтому название ее аниона - сукцинат - часто используют как синоним янтарной кислоты. При этом мощность системы энергопродукции, использующей сукцинат, в сотни раз превосходит все другие системы энергообразования организма [6, 7].
При проведении рандомизированного многоцентрового плацебо контролируемого клинического исследования на базе 7 клинических центров с включением 494 пациентов с хроническим гепатитом С и В различной степени активности отмечено, что у них после курсового приема ремаксола (раствор для инфузий) зафиксировано снижение уровня трансаминаз в 1,8 раза по сравнению с группой контроля, в том числе за счет антихолестатического эффекта препарата [11].
В исследованиях показано, что, обладая выраженным гепатопротекторным действием, ремаксол улучшает энергетическое обеспечение гепатоцитов, повышая устойчивость мембран клеток к перекисному окислению липидов и восстанавливая активность ферментов антиоксидантной защиты. Это позволяет применять его в качестве терапии сопровождения при различных патологических состояниях. Детоксицирующая активность препарата обеспечивается стимуляцией оттока желчных кислот, предотвращая застой желчи и отравление организма желчными кислотами, в результате чего восстанавливается функция печени, нет влияния на реологические свойства крови. Происходит нормализация показателей, характеризующих степень поражения гепатоцитов (АлТ, АсТ, ЩФ, ГГТП) и функциональное состояние печени за счет уменьшения цитолитического и холестатического синдромов [7, 12].
В исследовании Д. С. Суханова получены доказательства эффективности препаратов ремаксола и реамберина в эксперименте [13]. Так, зафиксировано их положительное влияние на показатели липидного обмена: уровень триглицеридов статистически значимо уменьшился, нормализовались показатели АлАТ и АсАТ. При морфологическом исследовании печени установлено, что параллельно с улучшением биохимических показателей уменьшался некробиоз гепатоцитов с сокращением распространенности жировой дистрофии, которая регистрировалась только на периферии долек и в междольковом пространстве. При применении адеметионина (независимо от способа введения и дозы) в 45,5% случаев обнаруживали очаги некроза различной величины, что свидетельствовало о стимуляции альтерации печеночной ткани, это связано с процессом карбоксиметилирования белков, продуктами которого являются метанол, формальдегид и муравьиная кислота, обладающие цитотоксическим действием [14, 13].
В детской практике на фоне полихимиотерапии в 72,2% случаев отмечалось нарушение функции печени, которое отражалось в биохимических показателях крови (повышение уровня общего билирубина, трансаминаз, тимоловой пробы, уровня щелочной и кислой фосфатаз) [9]. Нормализация биохимических показателей на фоне применения гепатопротекторов (Лив 52) отмечалась через 1 мес. в 23% случаев, через 2 мес. - в 67% случаев, к концу 3-го мес. - в 100% случаев, что обусловлено стимулирующим действием на регенерацию гепатоцитов, а также мембраностабилизирующим действием, что особенно ценно при длительной противотуберкулезной терапии. Снижение активности щелочной и кислой фосфатаз свидетельствовало о нормализации функциональной активности печени и функции желчеобразования [15].
Следовательно, применение гепатопротекторов является желательным на фоне лечения туберкулеза, в особенности при появлении нежелательных явлений, связанных с нарушением функции печени. Согласно международным рекомендациям, коррекция нежелательных явлений со стороны печени и желчевыводящих путей должна осуществляться только после появления функциональных нарушений третей и четвертой степени тяжести [17]. Однако отечественные исследователи считают необходимым назначение гепатопротекторов одновременно с применением ПТП не только при появлении нарушений функции печени, но и при тяжелом течении процесса для снятия интоксикационного воздействия на печень [3, 4, 12].
Назначение корригирующей терапии при возникновении нежелательных явлений на фоне лечения туберкулеза (в том числе при сочетании с ВИЧ-инфекцией) в настоящее время является обоснованным [4, 14].
При оценке нежелательных явлений, развивающихся в ходе химиотерапии туберкулеза, следует учитывать, что возможна суммация побочного действия разных ПТП, если они направлены на одни и те же органы-мишени (например, на печень). При серьезных нежелательных явлениях необходима временная отмена и/или замена всей схемы химиотерапии [4, 18].
Согласно проведенным исследованиям, назначение и выбор гепатопротективных препаратов должны проводиться в зависимости от степени повышения биохимических показателей (АЛТ, щелочной фосфатазы и билирубина), а также на основании оценки факторов риска развития нежелательных явлений со стороны печени [4].
Современная фармакотерапия заболеваний печени строится на комплексном использовании нескольких направлений [3, 5-7]:
1) профилактического, призванного обеспечить первичную защиту печени от различных повреждений;
2) этиотропного, направленного на элиминацию патологического возбудителя из организма;
3) патогенетического, нацеленного на коррекцию универсальных мультифакторных звеньев патогенеза заболевания;
4) симптоматического.
Основной целью лечения болезней печени является восстановление морфологической и функциональной полноценности органа.
Заключение
Повышение эффективности лечения туберкулеза легких является одной из важнейших задач в борьбе с туберкулезом. Современные схемы противотуберкулезной терапии включают прием нескольких ПТП, обладающих выраженным токсическим эффектом, вызывающим нарушения функции печени в 70-80% случаев. Применение эффективных гепатопротекторов для профилактики и устранения лекарственного поражения печени при лечении туберкулеза является необходимым и обоснованным.
Препаратом выбора для купирования гепатотоксичности является инфузионный гепатотропный препарат ремаксол, обладающий мультимодальным фармакологическим действием на патогенетические механизмы развития лекарственных и токсических поражений печени.
Конфликт интересов. Авторы заявляют об отсутствии у них конфликта интересов.
Conflict of Interests. The authors state that they have no conflict of interests.
ЛИТЕРАТУРА
Висцеральные микозы и микогенная аллергия, вызываемые условно патогенными грибами, до середины XX века описывались как спорадические наблюдения. Только с начала пятидесятых годов в связи с применением антибактериальных антибиотиков, цитостатиков и стероидных гормональных препаратов микотически обусловленная заболеваемость стала резко возрастать. Самыми частыми возбудителями микозов и микогенной аллергии на территории России являются дрожжеподобные грибы рода Candida и мицелиальные, плесневые грибы родов Aspergillus, Penicillium, Mucor и некоторые другие.
Из внутренних органов наиболее часто поражаются грибами органы пищеварения и дыхания, потому что по отношению к внешней среде это открытые системы. Клетки дрожже-подобных грибов - колониеобразующие единицы (КОЕ), попадая на слизистые оболочки полости рта, затем пищевода, а также трахеи и бронхов, трансформируются в тканевую форму и начинают активно вегетировать, используя для своего питания сначала мертвый субстрат, например, десквамированный эпителий, а затем приобретают паразитарные свойства и внедряются в живые ткани. Споры мицелиальных грибов с током вдыхаемого воздуха попадают непосредственно в дыхательные пути и там колонизируют участки цилиндрического эпителия с нарушенной мукоцилиарной функцией.
Грибковая инфекция в большинстве случаев вторична. Она представляет собой суперинфекцию, развивающуюся на фоне инфекционного процесса, вызванного другими возбудителями.
Одним из таких фоновых для развития микозов хронических инфекционных заболеваний является туберкулез органов дыхания. Микотическая инфекция может осложнить туберкулез легких в любой его форме и фазе. Можно считать, что микоз - патогенетический и экологический спутник туберкулеза. Как и туберкулез, микоз возникает на фоне иммунодефицита, ему способствует дальнейшее медикаментозное подавление иммунитета у больного. Его развитию способствуют неблагоприятные бытовые условия - проживание в сырых помещениях, полы, стены и потолки которых поражаются плесенью. Таким образом, заболеваемость микозом, наряду с заболеваемостью туберкулезом, отражает не только состояние здоровья популяции, но и социальное положение общества.
По данным специалистов Санкт-Петербурга профессоров М.С. Греймер и Т.Н. Соловьевой, грибковая инфекция у больных туберкулезом легких утяжеляет течение последнего и способствует развитию осложнений, а во многих случаях и решает исход заболевания.
При этом у большинства больных не появляется принципиально новых симптомов, просто основное заболевание начинает протекать с некоторыми не всегда объяснимыми особенностями. Так, у больного может проявиться резистентность к терапии основного заболевания, неожиданное повышение температуры тела, нарушение функции внешнего дыхания в виде бронхообструктивного синдрома и др. Поэтому чисто клинические возможности постановки диагноза микоза легких у больного туберкулезом весьма ограничены. Только лабораторное микологическое исследование биосубстратов - мокроты или промывных вод бронхов - позволяет обнаружить вегетативные формы грибов.
По данным НИИ медицинской микологии им. П.Н. Кашкина, микологическое исследование мокроты при заболеваниях легких и бронхов имеет лишь ориентировочное значение и не может служить основанием для постановки диагноза, поскольку элементы возбудителя в изучаемый субстрат могут попасть из полости рта. В этом отношении обнаружение возбудителя в промывных водах бронхов несомненно диагностически более значимо.
Мы рекомендуем следующую последовательность проведения микологической диагностики: микроскопическое исследование биосубстрата, затем культурное исследование с посевом на селективные среды и последующей видовой идентификацией гриба, а в качестве дополнительных исследований - серологические пробы, предпочтительно иммуноферментный анализ - с антигенами дрожжеподобных и мицелиальных грибов.
При обнаружении возбудителя рекомендуется его качественная оценка. Так, отдельные КОЕ не имеют диагностического значения, диагностически значимы только активно вегетирующие формы - почкующиеся клетки и нитчатые образования - мицелий и псевдомицелий. Имеет значение и количество КОЕ. Принято считать допустимым наличие до тысячи клеток грибов в исследуемом субстрате. Превышение этой количественной "нормы" свидетельствует о трансформации миконосительства в новую стадию - микотический инфекционный процесс. Поэтому больные туберкулезом - "миконосители", подлежат микологическому мониторингу. В принципе, все больные туберкулезом должны быть обследованы микологически. Эта рекомендация предусмотрена обязательными медицинскими стандартами, утвержденными Комитетом по здравоохранению Администрации Санкт-Петербурга.
У больных фиброзно-кавернозным туберкулезом легких возможно образование аспергиллем - гигантских колоний грибов, свободно перемещающихся в полостях каверн при изменении положения тела. Это единственная форма аспергиллеза легких, относительно достоверно диагностируемая рентгенологичсски. Ее патогномоничным признаком является наличие в полости каверны круглой тени с полулунным просветом над ней, сохраняющим свое положение вверху полости при изменении положения тела больного (симптом погремушки). В случае сомнения в достоверности диагноза традиционные рентгенологические методы уточняются с помощью компьютерной томографии.
Кроме поверхностных и инвазивных форм кандидоза и аспергиллеза возможно развитие микогенной аллергии, вызванной этими грибами и диагностируемой серологическими исследованиями с их антигенами. В микологической клинике НИИ медицинской микологии наблюдалась больная туберкулезом легких (ВК-) с множественными аспергиллемами, бронхообструктивным синдромом и положительными серологическими пробами с антигенами мицелиальных грибов. Проведение противовоспалительной терапии в сочетании с фунгистатическими препаратами позволяло повторно добиваться ремиссии в течении заболевания.
Лечение микозов и микогенной аллергии на фоне туберкулеза легких требует соблюдения некоторых условий. К ним относятся лечение фонового заболевания, если это показано в данный период, иммунокоррекция в зависимости от особенностей нарушения иммунитета, терапия, направленная на снятие тягостных для больного синдромов (кашель, бронхиальная обструкция), и применение фунгистатических препаратов с учетом их биодоступности, эффективности, переносимости больными и удобства применения. С этих точек зрения получен большой опыт применения полиеновых антибиотиков - амфотерицина-В (фунтизон), амфоглюкамината, дактарина, эффективных в отношении дрожжеподобных и плесневых грибов, кетоконазола (низорал) - при лечении кандидоза и производных триозола - флюконазола (дифлюкан) итраконазола (орунгал); последний препарат обладает широким спектром противогрибкового действия и хорошо переносится больными. Но при кандидозе бронхов и легких - наиболее частом осложнении туберкулеза - дифлюкан имеет преимущества перед другими препаратами, потому что выпускается в разнообразных лекарственных формах (капсулы для приема внутрь, растворы для внутривенного введения, сироп для детей) и практически не обладает побочными эффектами. Это качество позволяет рекомендовать его и для превентивной терапии при миконосительстве или угрозе рецидива микоза. Нистатин и леворин при микозах легких неэффективны, их довольно часто практикуемое назначение в этих случаях следует считать ошибочным.
Перед назначением противогрибкового лечения необходима консультация больного микологом для решения вопросов о показаниях, схемах фунгистатической терапии, совместимости антибиотиков с уже назначенными больному препаратами. При отсутствии собственного специалиста можно обратиться за консультацией в НИИ медицинской микологии. Однако для туберкулезных больниц и отделений совершенно необходима подготовка собственных нештатных микологов из числа фтизиатров. Рекомендации о подготовке таких специалистов в ЛПУ города были даны Комитетом по здравоохранению Администрации Санкт-Петербурга в 1993 году.
Профилактика микотических осложнений туберкулеза легких должна предусматривать своевременное микологическое обследование больных, при миконосительстве - проведение профилактического лечения системными антимикотиками или ингаляций растворимых фунгистатиков (амфотерицин-В, леворин-натриевая соль) при хорошей переносимости их больными, а также иммунокоррекцию, в основном, адъювантными средствами.
Очень большое значение для каждого больного туберкулезом имеет приведение жилища в соответствие с гигиеническими нормами. Для профилактики микозов легких у жителей города необходимо микологическое обследование жилищ, причем не только самих жилых помещений, но и подвалов и чердаков, могущих быть источниками микогенного загрязнения квартир. При обнаружении колоний грибов на поверхности или в толще стен жилых домов и больничных зданий должен проводиться их капитальный ремонт с дезинфекцией и последующим микологическим контролем эффективности проведенной работы.
Только своевременная диагностика микозов у больных туберкулезом, их раннее профессионально грамотное лечение, а также сочетание индивидуальной и общественной (муниципальной) профилактической работы может способствовать снижению количества этих осложнений, а значит - повышению эффективности лечения самого туберкулеза и, в конечном счете, снижению заболеваемости туберкулезом.
Туберкулез легких – это инфекционная патология, вызываемая бациллой Коха, характеризующаяся различными в клинико-морфологическом отношении вариантами поражения легочной ткани. Многообразие форм туберкулеза легких обусловливает вариабельность симптоматики. Наиболее типичны для туберкулеза легких респираторные нарушения (кашель, кровохарканье, одышка) и симптомы интоксикации (длительный субфебрилитет, потливость, слабость). Для подтверждения диагноза используются лучевые, лабораторные исследования, туберкулинодиагностика. Химиотерапия туберкулеза легких проводится специальными туберкулостатическими препаратами; при деструктивных формах показано хирургическое лечение.
МКБ-10

Общие сведения
На сегодняшний день туберкулез легких представляет не только медико-биологическую, но и серьезную социально-экономическую проблему. По данным ВОЗ, туберкулезом инфицирован каждый третий житель планеты, смертность от инфекции превышает 3 млн. человек в год. Легочный туберкулез является самой частой формой туберкулезной инфекции. Удельный вес туберкулеза других локализаций (суставов, костей и позвоночника, гениталий, кишечника, серозных оболочек, ЦНС, глаз, кожи) в структуре заболеваемости значительно ниже.

Причины
Характеристика возбудителя
Отличительной чертой МБТ является их высокая устойчивость к внешним воздействиям (высоким и низким температурам, влажности, воздействию кислот, щелочей, дезинфектантов). Наименьшую стойкость возбудители туберкулеза легких демонстрируют к солнечному свету. Для человека опасность представляют туберкулезные бактерии человеческого и бычьего типа; случаи инфицирования птичьим типом микобактерий крайне редки.
Пути заражения
Основной путь заражения при первичном туберкулезе легких – аэрогенный: от больного открытой формой человека микобактерии распространяются с частичками слизи, выделяемыми в окружающую среду при разговоре, чихании, кашле; могут высыхать и разноситься с пылью на значительные расстояния. В дыхательные пути здорового человека инфекция чаще попадает воздушно-капельным или пылевым путем.
Меньшую роль в инфицировании играют алиментарный (при употреблении зараженных продуктов), контактный (при использовании общих предметов гигиены и посуды) и трансплацентарный (внутриутробный) пути. Причиной вторичного туберкулеза легких выступает повторная активация ранее перенесенной инфекции либо повторное заражение.
Факторы риска
Однако попадание МБТ в организм не всегда приводит к заболеванию. Факторами, на фоне которых туберкулез легких развивается особенно часто, считаются:
- неблагоприятные социально-бытовые условия
- курение и другие химические зависимости
- недостаточное питание
- иммуносупрессия (ВИЧ-инфекция, прием глюкокортикоидов, состояние после трансплантации органов)
- онкологические заболевания и др.
В группе риска по развитию туберкулеза легких находятся мигранты, заключенные, лица, страдающие наркотической и алкогольной зависимостью. Также имеет значение вирулентность инфекции и длительность контакта с больным человеком.
Патогенез
При снижении местных и общих факторов защиты микобактерии беспрепятственно проникают в бронхиолы, а затем в альвеолы, вызывая специфическое воспаление в виде отдельных или множественных туберкулезных бугорков или очагов творожистого некроза. В этот период появляется положительная реакция на туберкулин - вираж туберкулиновой пробы. Клинические проявления туберкулеза легких на этой стадии часто остаются нераспознанными. Небольшие очажки могут самостоятельно рассасываться, рубцеваться или обызвествляться, однако МБТ в них длительно сохраняются.
Классификация
Первичный туберкулез легких - это впервые развившаяся инфильтрация легочной ткани у лиц, не имеющих специфического иммунитета. Диагностируется преимущественно в детском и подростковом возрасте; реже возникает у лиц старшего и пожилого возраста, которые в прошлом перенесли первичную инфекцию, закончившуюся полным излечением. Первичный туберкулез легких может принимать форму:
- первичного туберкулезного комплекса (ПТК)
- туберкулеза внутригрудных лимфоузлов (ВГЛУ)
- хронически текущего туберкулеза.
Вторичный туберкулез легких развивается при повторном контакте с МБТ или в результате реактивации инфекции в первичном очаге. Основные вторичные клинические формы представлены:
Отдельно различают кониотуберкулез (туберкулез, развивающийся на фоне пневмокониозов), туберкулез верхних дыхательных путей, трахеи, бронхов; туберкулезный плеврит. При выделении больным МБТ в окружающую среду с мокротой говорят об открытой форме (ВК+) туберкулеза легких; при отсутствии бацилловыделения – о закрытой форме (ВК–). Также возможно периодическое бацилловыделение (ВК±).
Течение туберкулеза легких характеризуется последовательной сменной фаз развития:
- 1) инфильтративной
- 2) распада и обсеменения
- 3) рассасывания очага
- 4) уплотнения и обызвествления.
Симптомы туберкулеза легких
Первичный туберкулезный комплекс
Первичный туберкулезный комплекс сочетает в себе признаки специфического воспаления в легком и регионарный бронхоаденит. Может протекать бессимптомно или под маской простудных заболеваний, поэтому выявлению первичного туберкулеза легких способствуют массовые скрининги детей (проба Манту) и взрослых (профилактическая флюорография).
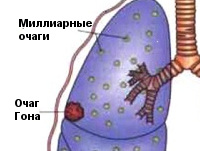
Чаще возникает подостро: больного беспокоит сухой кашель, субфебрилитет, утомляемость, потливость. При острой манифестации клиника напоминает неспецифическую пневмонию (высокая лихорадка, кашель, боль в груди, одышка). В результате лечения происходит рассасывание или обызвествление ПТК (очаг Гона). В неблагоприятных случаях может осложняться казеозной пневмонией, образованием каверн, туберкулезным плевритом, милиарным туберкулезом, диссеминацией микобактерий с поражением почек, костей, мозговых оболочек.
Туберкулез внутригрудных лимфоузлов
Признаки туберкулезной интоксикации включают отсутствие аппетита, снижение массы тела, утомляемость, бледность кожи, темные круги под глазами. На венозный застой в грудной полости может указывать расширение венозной сети на коже грудной клетки. Данная форма нередко осложняется туберкулезом бронхов, сегментарными или долевыми ателектазами легких, хронической пневмонией, экссудативным плевритом. При прорыве казеозных масс из лимфоузлов через стенку бронхов могут формироваться легочные очаги туберкулеза.
Очаговый туберкулез легких
Клиническая картина очагового туберкулеза малосимптомна. Кашель отсутствует или возникает редко, иногда сопровождается выделением скудной мокроты, болями в боку. В редких случаях отмечается кровохарканье. Чаще больные обращают внимание на симптомы интоксикации: непостоянный субфебрилитет, недомогание, апатию, пониженную работоспособность. В зависимости от давности туберкулезного процесса различают свежий и хронический очаговый туберкулез легких.
Течение очагового туберкулеза легких относительно доброкачественное. У больных с нарушенной иммунной реактивностью заболевание может прогрессировать в деструктивные формы туберкулеза легких.
Инфильтративный туберкулез легких
Клиническая картина инфильтративного туберкулеза легких зависит от величины инфильтрата и может варьировать от нерезко выраженных симптомов до острого лихорадочного состояния, напоминающего грипп или пневмонию. В последнем случае отмечается выраженная высокая температура тела, ознобы, ночная потливость, общая слабость. Со стороны органов дыхания беспокоит кашель с мокротой и прожилками крови.
В воспалительный процесс при инфильтративной форме туберкулеза легких часто вовлекается плевра, что обусловливает появление болей в боку, плеврального выпота, отставание пораженной половины грудной клетки при дыхании. Осложнениями инфильтративного туберкулеза легких могут стать казеозная пневмония, ателектаз легкого, легочное кровотечение и др.
Диссеминированный туберкулез легких
Может манифестировать в острой (милиарной), подострой и хронической форме. Тифоидная форма милиарного туберкулеза легких отличается преобладанием интоксикационного синдрома над бронхолегочной симптоматикой. Начинается остро, с нарастания температуры до 39-40 °С, головной боли, диспепсических расстройств, резкой слабости, тахикардии. При усилении токсикоза может возникать нарушение сознания, бред.
При легочной форме милиарного туберкулеза легких с самого начала более выражены дыхательные нарушения, включающие сухой кашель, одышку, цианоз. В тяжелых случаях развивается острая сердечно-легочная недостаточность. Менингеальной форме соответствуют симптомы поражения мозговых оболочек.
Подострое течение диссеминированного туберкулеза легких сопровождается умеренной слабостью, понижением работоспособности, ухудшением аппетита, похуданием. Эпизодически возникают подъемы температуры. Кашель продуктивный, не сильно беспокоит больного. Иногда первым признаком заболевания становится легочное кровотечение.
Хронический диссеминированный туберкулез легких при отсутствии обострения бессимптомен. Во время вспышки процесса клиническая картина близка к подострой форме. Диссеминированный туберкулеза легких опасен развитием внелегочного туберкулеза, спонтанного пневмоторакса, тяжелых легочных кровотечений, амилоидоза внутренних органов.
Кавернозный и фиброзно-кавернозный туберкулез легких
Характер течения кавернозного туберкулезного процесса волнообразный. В фазу распада нарастают интоксикационные симптомы, гипертермия, усиливается кашель и увеличивается количество мокроты, возникает кровохарканье. Часто присоединяется туберкулез бронхов и неспецифический бронхит.
Фиброзно-кавернозный туберкулез легких отличается формированием каверн с выраженным фиброзным слоем и фиброзными изменениями легочной ткани вокруг каверны. Протекает длительно, с периодическими обострениями общеинфекционной симптоматики. При частых вспышках развивается дыхательная недостаточность II-III степени.
Осложнениями, связанными с деструкцией легочной ткани, являются профузное легочное кровотечение, бронхоплевральный свищ, гнойный плеврит. Прогрессирование кавернозного туберкулеза легких сопровождается эндокринными расстройствами, кахексией, амилоидозом почек, туберкулезным менингитом, сердечно-легочной недостаточностью – в этом случае прогноз становится неблагоприятным.
Цирротический туберкулез легких
Является исходом различных форм туберкулеза легких при неполной инволюции специфического процесса и развитии на его месте фиброзно-склеротических изменений. При пневмоциррозе бронхи деформированы, легкое резко уменьшено в размерах, плевра утолщена и нередко обызвествлена.
Изменения, происходящие при цирротическом туберкулезе легких, обусловливают ведущие симптомы: выраженную одышку, тянущую боль в груди, кашель с гнойной мокротой, кровохарканье. При обострении присоединятся признаки туберкулезной интоксикации и бацилловыделение. Характерным внешним признаком пневмоцирроза служит уплощение грудной клетки на стороне поражения, сужение и втянутость межреберных промежутков. При прогрессирующем течении постепенно развивается легочное сердце. Цирротические изменения в легких необратимы.
Туберкулома легкого
Представляет собой инкапсулированный казеозный очаг, сформировавшийся в исходе инфильтративного, очагового или диссеминированного процесса. При стабильном течении симптомы не возникают, образование выявляется при рентгенографии легких случайно. В случае прогрессирующей туберкуломы легкого нарастает интоксикация, появляется субфебрилитет, боль в груди, кашель с отделением мокроты, возможно кровохарканье. При распаде очага туберкулома может трансформироваться в кавернозный или фиброзно-кавернозный туберкулез легких. Реже отмечается регрессирующее течение туберкуломы.
Диагностика
Диагноз той или иной формы туберкулеза легких выставляется врачом-фтизиатром на основании совокупности клинических, лучевых, лабораторных и иммунологических данных. Для распознавания вторичного туберкулеза большое значение имеет подробный сбор анамнеза. Для подтверждения диагноза проводится:
- Лучевая диагностика.Рентгенография легких является обязательным диагностической процедурой, позволяющей выявить характер изменений в легочной ткани (инфильтративный, очаговый, кавернозный, диссеминированный и т. д.), определить локализацию и распространенность патологического процесса. Выявление кальцинированных очагов указывает на ранее перенесенный туберкулезный процесс и требует уточнения данных с помощью КТ или МРТ легких.
- Анализы. Обнаружение МБТ достигается неоднократным исследованием мокроты (в т. ч. с помощью ПЦР), промывных вод бронхов, плеврального экссудата. Но сам по себе факт отсутствия бацилловыделения не является основанием для исключения туберкулеза легких. Современные иммунологические тесты позволяют выявить туберкулезную инфекцию почти со 100%-ной вероятностью. К ним относятся QuantiFERON и Т-спот. ТБ.
- Туберкулинодиагностика. К методам туберкулинодиагностики относятся диаскин-тест, пробы Пирке и Манту, однако сами по себе данные методы могут давать ложные результаты. Иногда для подтверждения туберкулеза легких приходится прибегать к пробному лечению противотуберкулезными препаратами с оценкой динамики рентгенологической картины.
По результатам проведенной диагностики туберкулез легких дифференцируют с пневмонией, саркоидозом легких, периферическим раком легкого, доброкачественными и метастатическими опухолями, пневмомикозами, кистами легких, абсцессом, силикозом, аномалиями развития легких и сосудов. Дополнительные методы диагностического поиска могут включать бронхоскопию, плевральную пункцию, биопсию легкого.

Лечение туберкулеза легких
Во фтизиатрической практике сформировался комплексный подход к лечению туберкулеза легких, включающий медикаментозную терапию, при необходимости - хирургическое вмешательство и реабилитационные мероприятия. Лечение проводится поэтапно: сначала в тубстационаре, затем в санаториях и, наконец, амбулаторно. Режимные моменты требуют организации лечебного питания, физического и эмоционального покоя.
- Противотуберкулезная терапия. Ведущая роль отводится специфической химиотерапии с помощью препаратов с противотуберкулезной активностью. Для терапии различных форм туберкулеза легких разработаны и применяются 3-х, 4-х и 5-тикомпонентные схемы (в зависимости от количества используемых препаратов). К туберкулостатикам первой линии (обязательным) относятся изониазид и его производные, пиразинамид, стрептомицин, рифампицин, этамбутол; средствами второго ряда (дополнительными) служат аминогликозиды, фторхинолоны, циклосерин, этионамид и др. Способы введения препаратов различны: перорально, внутримышечно, внутривенно, эндобронхиально, внутриплеврально, ингаляторно. Курсы противотуберкулезной терапии проводят длительно (в среднем 1 год и дольше).
- Патогенетическая терапия. При туберкулезе легких включает прием противовоспалительных средств, витаминов, гепатопротекторов, инфузионную терапию и пр. В случае лекарственной резистентности, непереносимости противотуберкулезных средств, при легочных кровотечениях используется коллапсотерапия.
- Хирургическое лечение. При соответствующих показаниях (деструктивных формах туберкулеза легких, эмпиеме, циррозе и ряде др.) применяются различные оперативные вмешательства: кавернотомию, торакопластику, плеврэктомию, резекцию легких.
Профилактика
Профилактика туберкулеза легких является важнейшей социальной проблемой и приоритетной государственной задачей. Первым шагом на этом пути является обязательная вакцинация новорожденных, детей и подростков. При массовых обследованиях в дошкольных и школьных учреждениях используется постановка внутрикожных туберкулиновых проб Манту. Скрининг взрослого населения осуществляется путем проведения профилактической флюорографии.
Очаговый туберкулез легких – форма вторичного туберкулеза, протекающая с формированием в легких очагов специфического воспаления не более 10 мм в диаметре. Протекает бессимптомно или малосимптомно. У части больных очаговый туберкулез легких может сопровождаться недомоганием, субфебрилитетом, болью в боку, сухим кашлем. В диагностике очагового туберкулеза наиболее информативны рентгенография легких, выявление МБТ в мокроте или бронхиальных смывах. В начальном периоде больным очаговым туберкулезом легких назначается комбинация из трех-четырех основных противотуберкулезных химиопрепаратов с последующим уменьшением до двух наименований.
МКБ-10

Общие сведения
Очаговый туберкулез легких – специфическое туберкулезное поражение, характеризующееся наличием в легких немногочисленных небольших (в пределах 1-2-х сегментов) фокусов продуктивного воспаления. Очаговый туберкулез относится к вторичной туберкулезной инфекции, т. е. обычно возникает через много лет после излечения первичного туберкулеза. Именно поэтому преобладающее большинство заболевших составляют взрослые пациенты. Среди других клинико-морфологических форм туберкулеза легких на долю очаговой формы приходится 15-20%. Отличительными особенностями очагового туберкулеза легких являются ограниченность зоны поражения одним-двумя сегментами, недеструктивный характер воспаления и латентное течение инфекции.
Причины
Очаговый туберкулез легких может возникнуть в результате экзогенной суперинфекции либо эндогенной активации инфекции в старых первичных очагах (кальцинатах). Экзогенное инфицирование возможно при тесном контакте с больными открытой формой туберкулеза в семье, противотуберкулезном диспансере, различных замкнутых коллективах. Заражение происходит аэрогенным путем. При этом вновь заболевшие выделяют микобактерии, устойчивые к тем же противотуберкулезным препаратам, что и источник инфекции. Роль экзогенной суперинфекции велика в районах с неблагополучной эпидемической ситуацией, неблагоприятными социально-бытовыми условиями проживания, при отсутствии специфической иммунизации населения.
Реактивация эндогенной инфекции происходит в старых туберкулезных очагах в легких (очаг Гона) или внутригрудных лимфатических узлах. В остаточных очагах микобактерии туберкулеза могут длительно персистировать в виде L-форм. Реверсия инфекции обычно происходит на фоне ослабления ранее сформированного противотуберкулезного иммунитета, чему способствуют:
- стрессы
- плохое питание
- переутомление
- лечение иммунодепрессантами
- сопутствующие заболевания (пневмокониозы, сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки)
- вредные зависимости (алкоголизм, табакокурение, наркомания).
Патогенез
В патогенезе реактивации эндогенной инфекции, как причины очагового туберкулеза легких, определяющую роль играет лимфогематогенное рассеивание микобактерий по организму. Очаговый туберкулез легких имеет преимущественно верхнедолевую локализацию. Многочисленные исследования в области фтизиатрии и пульмонологии объясняют это различными факторами: ограниченной подвижностью верхушки легкого, ее слабой аэрацией, замедленным крово- и лимфотоком в этой области, вертикальным положением тела человека и даже гиперсенсибилизацией, способствующей избирательной фиксации микобактерий в верхушке легких.
Классификация
По давности течения очаговый туберкулез легких может быть свежим (мягкоочаговым) и хроническим (фиброзно-очаговым).
- Свежий туберкулез является начальной стадией вторичного процесса, развившегося у пациента, ранее инфицированного микобактериями и переболевшего первичной инфекцией. Морфологически характеризуется эндобронхитом и перибронхитом в области сегментарных бронхов, при вовлечении альвеол - лобулярной бронхопневмонией.
- Хронический очаговый туберкулез может развиваться как в результате рассасывания свежего очагового туберкулеза, так и в исходе других легочных форм – инфильтративной, диссеминированной, кавернозной. При этом воспалительные очаги инкапсулируются, замещаются соединительной тканью или обызвествляются. По сути, они представляют собой остаточные фиброзные очаги, однако при определенных условиях могут реактивироваться, вызывая обострение туберкулезного процесса и увеличение границ поражения. В свою очередь, при прогрессировании хронический очаговый процесс также может трансформироваться в инфильтративный, кавернозный или диссеминированный туберкулез легких.
В своем развитии очаговый туберкулез проходит фазы инфильтрации, распада и уплотнения. В зависимости от размеров различают мелкие (до 3 мм в диаметре), средние (до 6 мм), крупные (до 10 мм) очаги.
Симптомы очагового туберкулеза
Особенностью клинического течения туберкулеза легких является стертость или отсутствие симптоматики, поэтому большая часть случаев выявляется при профилактической флюорографии. Примерно у трети пациентов определяется слабо выраженный интоксикационный синдром и признаки поражения органов дыхания.
Признаки интоксикации включают в себя субфебрильную температуру по вечерам, ощущение жара, сменяющееся кратковременным познабливанием, потливость, недомогание, снижение аппетита, нарушение сна. Иногда при очаговом туберкулезе легких, как проявление специфической интоксикации, возникают признаки гипертиреоза: увеличение размеров щитовидной железы, тахикардия, блеск глаз, колебания веса, раздражительность. У женщин могут отмечаться нарушения менструального цикла по типу опсоменореи или пройоменореи.
Возможны жалобы на боль в боку, между лопатками, в плечах. Кашель обычно носит непостоянный характер, может быть сухим или сопровождаться скудным отделением мокроты. Изредка возникает кровохарканье.
Диагностика
Физикальные данные, выявляемые при объективном обследовании больного с подозрением на очаговый туберкулез легких, неспецифичны. Пальпация позволяет выявить небольшую болезненность и ригидность мышц плечевого пояса; лимфоузлы не увеличены. Перкуторный звук над очагом поражения приглушен, при аускультации прослушивается жесткое дыхание, во время покашливания больного определяются единичные мелкопузырчатые хрипы.
Туберкулиновые пробы при очаговом туберкулезе легких, как правило, нормергические, поэтому не играют существенной роли в диагностике. В редких случаях больные могут реагировать на подкожное введение туберкулина повышением температуры тела, увеличением количества мокроты, ускорением СОЭ и т. п. Методом скрининга также могут служить иммунологические реакции крови (Т-Спот.ТБ, квантиферон-тест), которые используются для подтверждения инфицированности.
Для определения активности туберкулеза исследуется мокрота на КУБ, производится бронхоскопия с забором бронхоальвеолярных смывов. Эндоскопическая картина при свежем очаговом туберкулезе легких характеризуется признаками эндобронхита.
Основную информацию о форме туберкулеза дает рентгенография легких, однако рентгенологическая картина может быть различной в зависимости от фазы и длительности процесса. При свежем очаговом туберкулезе обычно определяется 1-2 крупных очага и несколько средних или мелких; тени слабоконтурирующие, малоинтенсивные, округлой формы. Хронический очаговый туберкулез рентгенологически проявляется наличием плотных фокусов с очагами обызвествления и фиброзных тяжей; тени средней и высокой интенсивности, обычно малого и среднего размера. Дифференциальная диагностика проводится с неспецифической очаговой пневмонией, пневмомикозами, периферическим раком легкого.

КТ органов грудной клетки. Множественные очаговые изменения верхней доле правого легкого (верифицированный туберкулез)
При сомнительных данных прибегают к проведению тест-терапии: пациенту на 2-3 месяца назначают противотуберкулезные средства и отслеживают клинико-рентгенологическую и лабораторную динамику. При уменьшении или частичном рассасывании очагов диагноз очагового туберкулеза несомненен.
Лечение очагового туберкулеза легких
Лечение активного очагового туберкулеза легких проводится в противотуберкулезном стационаре, неактивного – в амбулаторных условиях под наблюдением фтизиатра. Стандартный режим химиотерапии предусматривает назначение не менее трех противотуберкулезных препаратов (рифампицин, изониазид, пиразинамид, этамбутол) на срок 2-3 месяца. В начальном периоде также может применяться стрептомицин. В фазе продолжения, которая длится 4-6 месяцев, оставляют прием двух препаратов (рифампицин+изониазид, изониазид+этамбутол). Общая длительность терапии очагового туберкулеза легких составляет 6-9 месяцев, а у отдельных пациентов – до одного года. Реабилитация после курса лечения осуществляется в условиях противотуберкулезного санатория.
Прогноз
Исход очаговой формы туберкулеза легких, как правило, благополучный. В результате полноценного лечения свежие очаги полностью рассасываются, наступает полное клиническое излечение. При хроническом течении очагового туберкулеза возможен переход в менее прогностически благоприятные формы (инфильтративную, кавернозную, диссеминированную). Чаще всего исходом служит пневмосклероз с формированием очагов фиброза или кальциноза. Такие пациенты в течение 1—2 лет нуждаются в проведении химиопрофилактики. Наибольшую сложность представляет лечение устойчивых к химиопрепаратам случаев. Профилактика очагового туберкулеза легких состоит в проведении рентгенологического обследования населения, санпросветработы, повышении неспецифической резистентности организма. В сокращении числа случаев вторичного туберкулеза легких большое значение имеет вакцинопрофилактика.
Читайте также:

