Покажет ли гистология туберкулез
Обновлено: 08.05.2024
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Колоноскопия в диагностике туберкулеза органов брюшной полости
Журнал: Эндоскопическая хирургия. 2014;20(3): 31‑33
Решетников М.Н., Матросов М.В., Антипов А.Г., Мальцев Р.В., Богородская Е.М., Зубань О.Н. Колоноскопия в диагностике туберкулеза органов брюшной полости. Эндоскопическая хирургия. 2014;20(3):31‑33.
Reshetnikov MN, Matrosov МV, Antipov АG, Maltsev RV, Bogorodskaya ЕМ, Zuban’ ОN. Colonoscopy in the diagnosis of abdominal cavity organs tuberculosis. Endoscopic Surgery. 2014;20(3):31‑33. (In Russ.).
Статья посвящена оценке возможности колоноскопии в диагностике туберкулеза органов брюшной полости (кишечника). На основании результатов колоноскопий приводятся достоверные признаки туберкулеза кишечника. Описаны виды туберкулезного поражения кишечника: милиарная форма, инфильтративная и инфильтративно-язвенная. Показана эффективность колоноскопии в диагностике и оценке эффективности лечения данной категории больных.
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
Московский городской научно-практический центр борьбы с туберкулезом Департамента здравоохранения Москвы
В последние годы отмечается увеличение числа больных с внелегочными и генерализованными формами туберкулеза, числа случаев туберкулеза органов брюшной полости (ТОБП), что связано прежде всего с увеличением числа больных ВИЧ-инфекцией. Особенно часто поражение ТОБП наблюдается у больных ВИЧ-инфекцией в стадии вторичных заболеваний. При ТОБП наиболее часто поражаются забрюшинные и мезентериальные лимфатические узлы, кишечник, брюшина, селезенка [1—4].
Диагностика ТОБП из-за сходства клинических проявлений с другими неспецифическими заболеваниями органов брюшной полости представляет трудности, клиническая картина не имеет патогномоничных симптомов, наиболее часто данная категория больных обследуется в лечебных учреждениях общего профиля по поводу хронического болевого синдрома в животе, колитов, мезаденитов, асцитов неясной этиологии. Высокоэффективным методом диагностики, позволяющим установить диагноз ТОБП, а именно туберкулеза кишечника, является колоноскопия [5—8].
Нами поставлена цель исследования — оценить эффективность колоноскопии в диагностике и эффективности лечения больных ТОБП.
Материал и методы
В хирургическом отделении МНПЦ БТ в период с 2010 по 2012 г. находились на обследовании и лечении 63 больных с подозрением на ТОБП в возрасте от 22 до 77 лет — 40 (63,5%) мужчин и 23 (36,5%) женщины. Туберкулез легких диагностирован у 49 (77,7%) больных, 5 (7,9%) находились на обследовании с подозрением на ТОБП без туберкулеза легких. ВИЧ-инфицированных па-циентов было 31 (49,2%). Всего выполнено 76 колоноскопий, исследование выполнялось как для диагностики, так и для оценки эффективности лечения.
Всем больным в программе комплексного обследования для диагностики ТОБП выполняли стандартные клинические и инструментальные исследования: УЗИ органов брюшной полости, эзофагогастродуоденоскопия, ирригоскопия, компьютерная томография органов брюшной полости и исследование кала на Mycobacterium tuberculosis (МБТ) методом люминесцентной микроскопии и посева на твердые питательные среды.
Колоноскопию выполняли по общепринятой методике с обязательным забором материала для гистологического исследования, люминесцентной микроскопии и посева на твердые питательные среды, полимеразной цепной реакцией (ПЦР).
При выполнении колоноскопии использовали стандартную методику подготовки кишечника к исследованию — при помощи клизм или препарата фортранс.
При оценке колоноскопической картины ориентировались на 3 вида туберкулезного поражения кишечника: милиарную, инфильтративную и инфильтративно-язвенную форму (см. рисунок).

Милиарная (а), инфильтративная (б) и инфильтративно-язвенная (в) формы туберкулеза кишечника.
При колоноскопии чаще всего находили эрозии в толстой кишке, туберкулезные язвы во всех случаях локализовались в правой половине толстой кишки, наиболее часто в слепой кишке, в области баугинеиевой заслонки и подвздошной кишке. Учитывали, что эндоскопическая картина при туберкулезе кишечника может быть разнообразной, хотя изменения не являются специфичными. Могут наблюдаться язвы овальной или округлой формы, псевдополипы, сужение просвета, ригидность стенок кишки. При эндоскопии кишечника отмечаются отек, гиперемия слизистой оболочки, наличие язв с подрытыми краями, ригидность стенки, сужения кишки. Одиночные, чаще множественные, язвы локализуются в слепой, подвздошной, восходящей, ободочной кишках. Туберкулезные язвы чаще окружены перифокальным воспалительным валом, часто сливаются между собой, занимая значительное протяжение кишки, рубцуясь, дают кольцевидные сужения кишечника. Туберкулез кишечника иногда встречается в виде изолированного гиперпластического псевдоопухолевого процесса с локализацией в слепой кишке, с резким утолщением стенки слепой кишки, иногда ее восходящей части, с воспалительным процессом специфических бугорков, казеозным распадом, с последующим рубцеванием, сужением просвета кишки. Для распознавания туберкулеза кишечника и проведения дифференциальной диагностики (с болезнью Крона, неспецифическим язвенным колитом, опухолями кишечника, амебной дизентерией, аппендицитом) очень важны результаты гистологического исследования: при туберкулезе кишечника наряду с саркоидоподобными гранулемами появляются очаги казеозного некроза. В ряде случаев в биопсийном материале обнаруживается картина хронического неспецифического воспаления, а микобактерии и эпителиоидные гранулемы с клетками Пирогова—Лангханса, составляющие основу гистологических изменений при туберкулезе, обнаружить не удается. Это может быть обусловлено недостаточной глубиной биопсии или преимущественно подслизистой локализацией патологического процесса. В таких случаях диагноз устанавливают на основании совокупности клинических, лабораторных и инструментальных данных.
Результаты и обсуждение
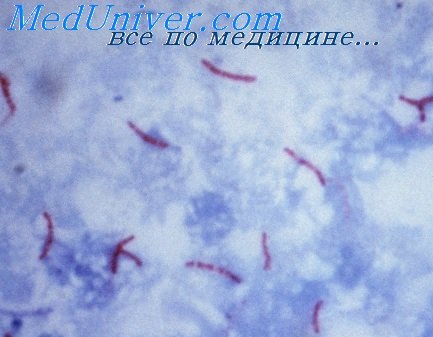
Визуальные признаки туберкулеза кишечника выявлены у 47 (74,6%) больных, они характеризовались наличием эрозий, инфильтратов и язв в толстой кишке. Всем больным выполнена биопсия из эрозий или язв для гистологического исследования, люминесцентной микроскопии и посева на твердые питательные среды, ПЦР. В 24 (38%) случаях при микроскопии выявили наличие эпителиоидно-гигантоклеточных гранулем, при окраске по Цилю—Нильсену обнаружены кислотоустойчивые микобактерии, в 2 (3,2%) случаях диагностирована аденокарцинома толстой кишки, в 4 (6,4%) — цитомегаловирусный язвенный колит, что характерно для больных ВИЧ-инфекцией, в остальных 37 (58,7%) случаях выявлен неспецифический колит. В обязательном порядке брали биопсию из язв и эрозий для исследования на МБТ методом люминесцентной микроскопии — в 17 (27%) случаях обнаружены МБТ. При посеве на твердые питательные среды положительный результат получен у 21 (33,3%) больного, причем у 4 больных этой группы люминесцентная микроскопия дала отрицательный результат. Исследование методом ПЦР для обнаружения фрагментов МБТ дало положительный результат в 28 (44,4%) случаях. Однако исследование методом ПЦР, обладающим высокой чувствительностью, нельзя отнести к строго специфичным методам диагностики, так как обнаружение фрагментов МБТ в биопсии из туберкулезных язв возможно не только при туберкулезе кишечника, но и при заглатывании мокроты у больных туберкулезом легких.
По результатам колоноскопий с биопсиями диагноз туберкулеза органов брюшной полости был установлен у 54 (85,7%) больных.
Всем больным проводилась химиотерапия туберкулеза в соответствии со стандартными схемами противотуберкулезной химиотерапии. У 46 (85,2%) больных на фоне противотуберкулезной терапии отмечена отчетливая положительная динамика в виде улучшения общего самочувствия, уменьшения выраженности симптомов туберкулезной интоксикации, исчезновения болевого синдрома в животе, нормализация стула. У 9 (16,6%) больных, несмотря на противотуберкулезную химиотерапию, отчетливой положительной динамики не отмечено: небольшое улучшение общего самочувствия, сохранялся умеренный болевой синдром в животе, поносы. Этим больным выполнена контрольная колоноскопия, 6 — однократно, 3 — двукратно. При контрольной колоноскопии по сравнению с предыдущей отчетливой положительной динамики не отмечено: сохранялись туберкулезные язвы или даже появлялись новые, инфильтрация кишечной стенки. При гистологическом исследовании отмечен активный туберкулезный процесс. Данным больным изменена схема противотуберкулезной терапии, у всех наступило клиническое улучшение.
Полученные результаты позволили нам заключить, что колоноскопия является быстрым, недорогим и диагностически ценным методом диагностики туберкулеза органов брюшной полости (кишечника), позволяющим достоверно установить данный диагноз у 80,6% больных. В ряде случаев выполнение контрольной колоноскопии на фоне противотуберкулезной терапии позволяет оценить динамику лечения и при необходимости произвести смену режима противотуберкулезной химиотерапии.
Гистология активности туберкулеза. Классификация туберкулом
Предлагаемое деление на основании морфологических признаков имеет целью классифицировать туберкуломы по степени их активности и тяжести прогноза.
Действительно, к I группе отнесены случаи, где гистологические проявления активности туберкулеза несомненны. Оказалось, что чаще всего (в 44 случаях из 63) имеется то или иное их сочетание в капсуле, казеозных массах и окружающей ткани.
Значит, прогрессирование таких туберкулом возможно всеми путями: лимфогенным, бронхогенным (при прорыве расплавленных мате в бронх, и путем перехода воспаления с капсулы на прилегающую легочную ткань. В 78% случаев уже обычная бактериоскопия казеозных масс обнаружила здесь микобактерии туберкулеза и, как правило, в большом количестве.
Наоборот, отложения извести удалось выявить лишь в 4 случаях из 63. Высокая активность этих туберкулом подтверждается, наконец, и тем, что они сравнительно часто вызывали характерные клинические симптомы. Все это позволяет считать их прогноз плохим, а оперативное удаление — абсолютно показанным.
Отличительная особенность туберкулом II группы — сочетание старого расплавления творожистых масс с незначительными специфическими изменениями в капсуле. Расплавление, пусть и старое, повышает опасность кавернизации туберкуломы, тем более, что в подавляющем большинстве случаев (в 16 из 18 на нашем материале) оно захватывает либо всю туберкулому, либо ее краевые отделы.
Бактериоскопия казеозных масс выявила микобактерии туберкулеза в 61% наблюдений. Клинические проявления в виде бациллярности мокроты и рентгенологических симптомов распада, инфильтрации и свежих очагов вокруг были у каждого шестого больного. Все это дает основания для неблагоприятного прогноза: аппозиционный рост или лимфогенное распространение здесь маловероятны ввиду выраженности фиброзной капсулы, но бронхогенный путь вполне реален, а потому показания к хирургическому лечению вряд ли можно оспаривать.
В туберкуломах группы 3 морфологическая картина указывает на процессы заживления. В 8 туберкуломах из 22 найдены отложения извести. Рентгенологически определяемый распад был только у 1 больного, интоксикация тоже у одного. Наряду с этим, микобактерии туберкулеза в казеозных массах выявлены в 77% случаев, бациллярность мокроты отмечена у каждого четвертого больного, изменения рентгеновской тени в пределах последних 6 месяцев — у каждого третьего.
Ясно, что здесь еще необходимо лечение. Но не исключено, что к окончательной потере активности туберкулезного процесса могут привести консервативные меры, а, значит, показания к оперативному удалению становятся сомнительными.
В туберкуломах 4-й группы морфологических признаков активного специфического воспаления нет. В 11 из 12 таких туберкулом найдены отложения солей кальция. Микобактерии туберкулеза обнаружены лишь в каждой четвертой туберкуломе. Однократное бацилловыделение в дооперационном периоде было лишь у одного больного. По-видимому, такие туберкуломы, если они не сопровождаются клиническими проявлениями, не должны быть поводом ни для оперативного, ни для консервативного лечения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Активность туберкулеза при резекции легких. Послеоперационная активность туберкулеза
У всех больных в оставшихся после резекции отделах легких пальпаторно определялись различных размеров плотные туберкулезные очаги; у 19 больных было констатировано наличие единичных очагов, у 22 — очаги обсеменения были разбросаны по всей паренхиме легкого, у 11 — определялись множественные густо расположенные очаги. Результаты гистологических исследований показали, что несмотря на стойкую клиническую стабилизацию туберкулезного процесса к моменту операции морфологические изменения в очагах обсеменения в большинстве случаев свидетельствовали о наличии в них активного туберкулезного процесса в той или иной фазе его развития.
Так в 9 случаях из 52 в препаратах на фоне обилия морфологических реакций были обнаружены пневмонические фокусы специфического характера по типу десквамативной пневмонии, вокруг которых определялась формирующаяся грануляционная ткань, состоящая преимущественно из эпителиодных клеток и фибробластов. Наряду с этим имелись отдельные туберкулезные бугорки, преимущественно, эпителиоидного характера с единичными гигантскими клетками Пирогоза-Ланганоа. В зоне пневмонических реакций наблюдался казеоз с явлениями расплавления, вокруг бронхов обнаруживались воспалительные инфильтраты.
У 32 больных туберкулезные изменения в оставшихся после резекции отделах легких характеризовались наличием казеозных очагов. В 20 случаях из них очаги казеоза находились в состоянии инкапсуляции; причем, в одних случаях отграничивающая казеоз капсула определялась не совсем отчетливо и была она представлена в виде разрастаний специфической грануляционной ткани, а в других она выглядела в виде фиброзного кольца, в 7 случаях пролиферативные процессы проявлялись не только в инкапсуляции, но и в организации казеозных масс (наряду с наличием соединительной капсулы вокруг очага одновременно отмечалось проникновение коллагеновых волокон внутрь казеоза), а в 5 — процессе инкапсуляции и организации очагов сопровождался явлениями петрификации, которая в одних случаях начиналась с периферии очага, в других — с центра.
В 5 наблюдениях (из 52) морфологические изменения в очагах обсеменения указывали на продуктивный характер специфических изменений без экссудативных наслоений; в препаратах обнаруживались туберкулезные бугорки, преимущественно эпителиоидного типа, вокруг которых отмечались явления выраженного фиброза.

И, наконец, у 6 больных из общего числа обследованных (52) в участках уплотнения, определявшихся пальпаторно в оставшихся частях легких, при гистологическом исследовании элементов специфического воспаления в них не было обнаружено:
Морфологические изменения в этих участках характеризовались наличием фиброзных полей и разрастанием соединительной ткани по ходу сосудов и бронхоз (параспецифические изменения).
Таким образом, результаты проведенных исследований показали, что у больных, оперированных по поводу кавернозных форм туберкулеза легких и туберкулом с распадом в очагах обсеменения, оставляемых в легком после его резекции, в большинстве случаев, обнаруживались изменения, 'Свидетельствующие о наличии в них активного туберкулезного процесса (специфическая десквалеативная пневмония, участки казеоза без выраженной отграничивающей капсулы вокруг, лимфоидная инфильтрация).
Законченный туберкулезный процесс и пролиферативные процессы, близкие к заживлению, наблюдались значительно реже.
Клинико-морфологические сопоставления показали, что эксудативные реакции с явлениями десквамативной пневмонии наблюдались, в основном, у больных с длительным сроком заболевания, у которых в оставшихся после резекции отделах легких пальпаторно определялись множественные очаги обсеменения. Благоприятное течение туберкулезного процесса (фиброзная трансформация, петрификация очагов) наблюдалось в основном при наличии в легком единичных очагов и при сравнительно небольшом сроке заболевания (6—20 мес. с момента выявления).
Таким образом, результаты гистологических исследований очагов обсеменения, взятых из оставшихся после резекции отделов легких, позволяют с определенной достоверностью рассматривать их в дальнейшем как потенциальный источник рецидива заболевания в связи с чем профилактическую антибактериальную терапию целесообразно проводить с учетом активности туберкулезного процесса в них.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Цитологические методы диагностики туберкулеза. Гистологические методы диагностики туберкулеза.
Цитологические и гистологические методы играют важную, а нередко и решающую роль в распознавании заболеваний органов дыхания. Большое значение имеет исследование клеточного состава мокроты. В нативных и специально окрашенных препаратах находят лейкоциты, эритроциты, клетки плоского и цилиндрического эпителия, альвеолярные макрофаги, пылевые, эпителиоидные, гигантские и опухолевые клетки, кристаллы холестерина и Шарко—Лейдена, неизмененные, обызвествленные коралловидные волокна, микобактерии туберкулеза, неспецифическую флору, друзы актиномицетов, аспергиллы, дрожжевые грибы, сферулы кокцидиоидногэ микоза и т. д.
Следует иметь в виду, что обызвествленные очаги в легких определяются иногда при хроническом абсцессе легкого и гистоплазмозе. Клетки метаплазированного эпителия бронхов со значительной атипией, весьма сходные с элементами злокачественного новообразования, встречаются при хронической пневмонии или бронхите.
Эпителиоидные и гигантские клетки Пирогова— Лангханса можно обнаружить не только при туберкулезе, но и при саркоидозе. Вот почему результаты цитологического анализа мокроты приобретают важное диагностическое значение, если они подтверждаются другими методами исследования.
Частота обнаружения тех или иных клеточных элементов в мокроте или в смывах из бронхов зависит от фазы и динамики процесса, локализации патологического образования в легких, например, при центральном или периферическом раке. Результативность цитологического диагноза, указывал в 1961 г. Umiker, обратно пропорциональна расстоянию опухоли от бифуркации трахеи. Этими факторами следует объяснить различную частоту выявления клеток опухоли при раке легких: в 70—87,6% по данным А. Я. Альтгаузена (1962), Н. Н. Шиллер-Волковой и соавт. (1964), в 24,6—38—45% по наблюдениям Р. Д. Блиновой (1972).
Тот же метод исследования оправдывает себя в диагностике периферических лимфаденитов. При туберкулезе характер обнаруживаемых тканевых изменений зависит от фазы процесса (Е. Д. Тимашева, 1953; М. Г. Абрамов, 1974). В I гиперпластической стадии определяется лишь гиперплазия лимфаденоидной ткани, во II стадии (гранулематозной) находят элементы туберкулезного бугорка, в III — массивный казеозный некроз, в IV — гной, в V (фиброзной) — соединительнотканные волокна, мелкие клеточные элементы.
При раке в пунктатах из лимфатических узлов обнаруживают клетки опухоли, при саркоидозе — эпителиоидные и гигантские клетки без признаков творожистого некроза, при лимфогранулематозе — клетки Березовского—Штернберга и большое число эозинофилов, при лимфолейкозе— картину мономорфной гиперплазии лимфоидной ткани и т. д.
Те или иные патологические изменения удается обнаружить при цитологическом исследовании пунктатов печени, селезенки, костного мозга. Пользуясь этим методом, Olderhauser и соавт. выявили туберкулезные бугорки в печени у 25,3 % больных диссеминированным туберкулезом и у 7,3% — при других его формах. Почти в 60% случаев при пункции печени находят гранулемы, характерные для саркоидоза, особенно при I его стадии (Scadding, 1967, и др.). Сочетая этот способ исследования с пери-тонеоскопией, Tachibana и соавт. (1971) выявили такие тканевые изменения в печени у 70%, a Liehr (1971) — у 90% больных саркоидозом.
Известное значение в дифференциальной диагностике приобретает цитологическое изучение материала, полученного при трансторакальной пункции легкого. Этот метод исследования, который впервые использовал Leyden .еще в 1883 г., в последнее время получил более широкое применение. В пунктате, помимо альвеолярного и бронхиального эпителия, можно обнаружить при туберкулезе эпителиоидные и гигантские клетки и элементы творожистого некроза, при саркоидозе — эпителиоидные и гигантские клетки, при раке и других злокачественных новообразованиях — клетки опухоли и т. д.
Sabow и соавт. при изучении пунктатов установили диагноз рака легкого у 117 больных, между тем как при бронхоскопии — у 81, а при цитологическом исследовании мокроты — лишь у 59 из них. По данным Р. Д. Блиновой (1972), диагноз рака удается верифицировать при пункции легкого у 91,9% больных, по наблюдениям И. С. Мечевой (1973), Н. А. Шмелева (1959) и др. — у 57—80%, а по материалам М. Г. Виннера и М. Л. Шулутко (1971) — у 50% больных. Менее результативна диагностическая пункция при аденоме, гамартохондроме и других доброкачественных образованиях легких. Однако Otto и Frick (1971) на обширном материале (1000 диагностических пункций легкого, произведенных на протяжении 1967—1971 гг. у больных со злокачественными и доброкачественными новообразованиями, туберкулезом, микозами, пневмокониозом, хроническим воспалительным процессом и т. д.) удалось подтвердить диагноз в среднем в 3/4 случаев.
Пункцию легкого целесообразно производить при периферической локализации процесса и достаточной величине патологического образования в легком. Не рекомендуется пользоваться этим методом при подозрении на асбсцесс или гангрену, кисту или эхинококкоз ввиду возможности инфицирования плевральной полости, а также при аневризме легочных сосудов. Его нельзя применять у больных с геморрагическим диатезом, при легочно-сердечной недостаточности у пожилых людей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ФГУ "НИИ пульмонологии" ФМБА России
ФГУ "НИИ пульмонологии" ФМБА России
Гистологическая дифференциальная диагностика гранулематозных болезней легких (часть II)
Журнал: Архив патологии. 2019;81(2): 59‑65
ФГУ "НИИ пульмонологии" ФМБА России
Гранулематозные болезни — это гетерогенная группа заболеваний различной этиологии, проявляющихся разнообразными клиническими синдромами и вариантами тканевых изменений, неоднородной чувствительностью к терапии и преобладанием общего доминирующего гистологического признака — наличия гранулем, определяющих клинико-морфологическую сущность каждой болезни. Гранулема является хронической воспалительной реакцией, в которой принимают участие клетки макрофагальной системы и другие клетки воспаления. После воздействия антигена происходит активация T-лимфоцитов, макрофагов, эпителиоидных клеток и гигантских многоядерных клеток, приводящая к образованию гранулемы. Гранулема включает также внеклеточный матрикс, продуцируемый фибробластами, позволяющий отграничить и изолировать антиген. Гранулематозные заболевания классифицируются по этиологии на инфекционные и неинфекционные. Однако, согласно последним исследованиям, патогенные микроорганизмы могут быть причиной развития гранулем при заболеваниях, ранее считавшихся неинфекционными. В ряде случаев классифицировать гранулематозный процесс как инфекционный и неинфекционный представляется затруднительным. Цель исследования — привлечь внимание читателей к разнообразию гранулематозных заболеваний, описать ключевые моменты патолого-анатомических проявлений различных болезней инфекционной природы, а также определить подход к дифференциальной диагностике гранулематозов.
ФГУ "НИИ пульмонологии" ФМБА России
ФГУ "НИИ пульмонологии" ФМБА России
Наиболее частой причиной развития гранулематозного процесса в легких является инфекция. Дифференциальная диагностика инфекционных гранулематозов основывается на характеристике гранулематозного воспаления и выявлении микроорганизма.
Грибы
Грибы, вызывающие глубокие микозы, как правило, не формируют гранулематозное воспаление в легких. В большинстве наблюдений такие грибы, как Aspergillus, Candida и некоторые другие, вызывают локальную мицетому, диффузный инвазивный микоз или аллергические реакции (аллергический бронхолегочный аспергиллез/микоз). Гранулематозные реакции, вызванные этими грибами, возникают редко [1].
Гистоплазмоз
Гистоплазмоз вызывается Histoplasma capsulatum (Северная Америка, долины рек) и H. duboisii (Африка), представляющими собой почкующиеся дрожжевые клетки диаметром 2—4 мкм. Микроорганизмы обнаруживают в цитоплазме макрофагов и гистиоцитов, а также и в некротическом детрите. Капсулы организма окрашиваются при окраске по Гимзе или ШИК-реакции. Формирование эпителиоидно-клеточных гранулем вызывают оба организма, однако некротизирующий гранулематоз чаще описан при H. сapsulatum [2].
Криптококкоз (европейский бластомикоз)

Cryptococcus neoformans встречается повсеместно, находится в почве, голубином помете, размер клетки 4—7 мкм, размножается почкованием, окрашивается гематоксилином и эозином, муцикармином, при ШИК-реакции. Криптококки вызывают различные изменения в легких. Типичная гранулематозная реакция представляет собой сливающиеся ненекротические гранулемы с множеством гигантских многоядерных клеток и нерезко выраженной воспалительной реакцией, гигантские клетки располагаются преимущественно вне гранулем и содержат клетки криптококков. Эти грибы можно также обнаружить внутри некротических гранулем (криптококкома), напоминающих таковые при микобактериальной инфекции и других видах грибов (рис. 1). Рис. 1. Фрагмент некротической гранулемы с округлыми образованиями диаметром 10—20 мкм (клетки криптококка). Окраска гематоксилином и эозином, ×400. У иммунокопрометированных лиц клетки криптококка можно обнаружить внутри альвеол, в их стенках и интерстиции при отсутствии выраженной воспалительной реакции, могут быть разрозненные гигантские многоядерные клетки [3].
Коккцидиоз
Coccidioides наиболее часто приводит к образованию некротической гранулемы, при этом эозинофильная реакция может быть выраженной или отсутствовать, нейтрофилы также могут быть многочисленны. Как и при других инфекциях, гранулемы располагаются перибронхиолярно или сообщаются с разрушенными бронхиолами. Процесс сопровождается формированием по периферии мелких ненекротизирующих гранулем. Coccidioides обычно находят в центре некротических гранулем, они состоят из больших сферических структур (сферул), содержащих дрожжеподобные структуры (эндоспоры), эндоспоры различного размера могут располагаться в некрозе или клеточном детрите, напоминая другие грибы. Наличие сферул и эндоспор свидетельствует в пользу коккцидиоза. Как и Histoplasma, Coccidioides не растут в культуре, таким образом, диагноз может быть установлен только при гистологическом исследовании [2].
Бластомикоз
Пневмоциста
Паразиты

К наиболее частым паразитам, способным приводить к развитию гранулематозного воспаления в легких, относится Dirofilaria. Этот круглый червь поражает чаще собак, но также встречается и у человека, заражение происходит путем укуса насекомыми. Личинка червя попадает в правые отделы сердца, при эмболии — в легочные артерии, вызывая тромбоз последних с развитием инфарктоподобных некрозов (рис. 3). Рис. 3. Личинка Dirofilaria в ветви легочной артерии, инфильтрация плазматическими клетками и эозинофилами. Окраска гематоксилином и эозином,×100. При этом в 1/3 наблюдений отмечается развитие гранулем в прилежащей ткани легкого, в половине — некротического или ненекротического васкулита, в 2/3 — эозинофильной инфильтрации [6].
Туберкулез

Туберкулезное воспаление вызывают члены семейства Mycobacterium tuberculosis, а именно M. tuberculosis, M. bovis, M. africanum, принадлежащие к группе быстрорастущих микобактерий. Вирулентность этих микобактерий варьирует от умеренных до высоковирулентных штаммов. В зависимости от вирулентности микобактерии, с одной стороны, и состояния иммунной защиты, с другой — изменения в легких при туберкулезе могут быть самыми разнообразными от распространенных некротических гранулем, милиарных некротических гранулем, ненекротических гранулем, туберкулемы, зажившей фиброзированной гранулемы (рис. 4) Рис. 4. Туберкулезная гранулема с лимфогистиоцитарным валом и гигантскими многоядерными клетками Пирогова—Лангханса по периферии. Окраска гематоксилином и эозином, ×100. [7]. Гранулемы при туберкулезе обычно бронхиолоцентричной локализации, но следует помнить, что они могут быть таковыми при любом инфекционном гранулематозе и даже при саркоидозе. Гистологические изменения при туберкулезе неотличимы от таковых при нетуберкулезном микобактериозе. Это было подтверждено в исследовании R. Corpe и I. Stergus [8], в котором 27 патологам, специалистам в диагностике микобактериальных заболеваний, было предложено оценить 25 гистологических препаратов без информации о культурально-подтвержденной инфекции. В большинстве случаев различить туберкулез или микобактериоз или не представлялось возможным, или сформулированный диагноз был ошибочным. Таким образом, диагностика туберкулеза должна быть основана на выявлении и последующем определении вида микобактерии! Сталкиваясь в процессе консультационной работы с пациентами, которые несколько месяцев (а иногда и не один год!) получали эмпирически назначенное лечение противотуберкулезными препаратами без подтверждения микобактериальной инфекции, полагаем, что такой подход приводит к повышению в нашей стране числа наблюдений с мультирезистентными штаммами микобактерий или штаммами с множественной лекарственной устойчивостью.
Нетуберкулезный микобактериоз
Нетуберкулезный микобактериоз — воспаление, вызываемое микобактериями, не относящимися к семейству микобактерий туберкулеза M. avium, M. fortuitum, M. gordonae, M. kansasii, M. xenopi и M. marinum, определяемых так же, как комплекс MAC. В отличие от микобактерий туберкулеза эти микобактерии могут быть обнаружены внутриклеточно в макрофагах (гистиоцитах), у иммунокопрометированных лиц они могут быть многочисленны. Диагностируются при проведении окраски на кислотоустойчивость, культуральных или молекулярно-биологических исследований. Как уже сказано выше, зачастую гистологические изменения сходны с таковыми при туберкулезе. Могут быть также выявлены ненекротические гранулемы, гистиоцитарные гранулемы, гранулемы, состоящие из пенистых, зернистых макрофагов, содержащих микобактерии. И.П. Соловьева и соавт. [9] описывают следующий спектр гистологических изменений при микобактериозах: туберкулезная гранулема — эпителиоидно-клеточная, число клеток Лангханса и интенсивность некроза варьируют, микобактерий немного; ареактивная, некротическая мультибациллярность — воспалительный ответ представлен слабо, в зоне некроза обилие микобактерий; мультибациллярный гистиоцитоз — диффузная макрофагальная инфильтрация с внутриклеточным обилием микобактерий, некрозы отсутствуют; мультибациллярный минимальный гистиоцитоз — слабая воспалительная реакция с внутриклеточным обилием микобактерий; гистиоидное поражение — узелковые скопления веретенообразных макрофагов с обилием микобактерий; неспецифическая грануляционная ткань; острый гнойный абсцесс.
Разнообразие заболеваний, приводящих к развитию гранулематозного воспаления, определяет определенные трудности в проведении дифференциальной диагностики даже при выполнении резекционных (операционных, видеоассистированных) биопсий, позволяющих получить достаточное количество материала для гистологического исследования [11]. Тем не менее установить причину гранулематозного воспаления удается не всегда. По данным T. Ulbright, A.-L. Katzenstein [12], проанализировавших 86 одиночных гранулем легких, выявленных при рентгенологическом исследовании, инфекционный процесс, вызванный кислотоустойчивыми микобактериями или грибами, был подтвержден в 70% случаев. В 25 наблюдениях инфекционная этиология не была доказана, при этом в 2 диагностирована гиалинизированная гранулема, в 1 — полиангиит с гранулематозом и в 22 классифицировать процесс не удалось. При этом было обнаружено значительное сходство гистологических изменений при инфекционных гранулемах и полиангиите с гранулематозом, вполне возможно, что последний явился отражением нарушений иммунного ответа на инфекционный агент, который уже не мог быть обнаружен в ткани. Это означает, что диагностировать полиангиит с гранулематозом и другие ангииты легких в случае солитарных узлов при отсутствии поражения других органов следует с крайней осторожностью. В таких случаях следует рекомендовать проведение тщательного обследования и динамического наблюдения за пациентами.
Данное исследование, на наш взгляд, представляется крайне интересным, поскольку прежде всего свидетельствует о преобладании саркоидоза и инфекционного гранулематозного воспаления в структуре гранулематозных заболеваний по данным гистологических исследований, проведенных в разных странах и географических регионах. Грибковая инфекция чаще явилась причиной гранулематозного воспаления в США, тогда как в других странах чаще была диагностирована микобактериальная инфекция, что является отражением эндемичности этих инфекций. Для улучшения качества этиологической диагностики следует обязательно направлять материал одновременно в гистологическую и микробиологическую лабораторию во всех наблюдениях, в которых подозревается гранулематозное заболевание. Причина гранулематозного воспаления, по данным этого исследования, не установлена более чем в трети наблюдений даже после гистологического исследования [10].

Проанализировав результаты консультативно-диагностических исследований нашей лаборатории, выявили, что число наблюдений, представляющих гранулематозные или гранулематозно-некротические процессы, составило практически треть от общего числа биопсий (284 на 1000 наблюдений) (см. табл. 2), Таблица 2. Частота встречаемости специфических гранулематозных инфекций [10] Примечание. *— микобактерия, выявленная при окраске на кислотоустойчивость в срезах, при отрицательном или невыполненном культуральном исследовании. в 36,2% наблюдений нам не удалось установить причину гранулематозного процесса в легких.
Частота инфекционного гранулематоза велика, исключая другие процессы, в диагностике которых существенную помощь оказывают данные анамнеза, клинических проявлений, лабораторных исследований и специфических морфологических изменений, о которых было сказано выше, остальные гранулематозные заболевания с наибольшей вероятностью следует относить к инфекционным.

Важным вопросом при дифференциальной диагностике инфекционных гранулематозов является выявление в срезах инфекционного агента. Для этого необходимо и обязательно применять дополнительные окраски. При выявлении грибковой инфекции прежде всего следует внимательно оценивать срезы, окрашенные гематоксилином и эозином. Большинство грибов, такие как Cryptococcus, Blastomyces, Coccidioides и Aspergillus, можно увидеть при окраске гематоксилином и эозином чаще в зонах некроза, чем в окружающей ткани. При проведении дополнительных окрасок следует выбирать срезы, в которых присутствует некроз. Как правило, для диагностики грибковой инфекции наиболее часто используют окраску серебрением по Грокотту, ШИК-реакцию, предлагают также окраски альциановым синим (по Моури), основным коричневым (по методу Шубича) или комбинированную окраску — ШИК-реакция с обработкой альциановым синим с докраской гематоксилином (рис. 5) Рис. 5. Клетки криптококка в гигантских многоядерных клетках в гранулеме. Комбинированная окраска альциановым синим, реактивом Шиффа и гематоксилином, ×200. [1].

Для диагностики микобактериальной инфекции используют окраску по Цилю—Нильсену, однако микобактерии, как правило, немногочисленны, их поиск трудоемок, использование альтернативных окрасок аурамином или аурамином/родамином повышает чувствительность метода, однако требует использования флюоресцентного микроскопа (рис. 6, а, Рис. 6. Кислотоустойчивые микобактерии. а — окраска по Цилю—Нильсену; б — аурамином/родамином (флюоресценция), ×1000. б). Для повышения выявляемости микобактерий T. Ulbright, A. Katzenstein рекомендуют проводить окрашивание по крайней мере с двух блоков [12]. При диагностике сифилиса рекомендуют проводить серебрение по Гомори или по Вартину—Старри [3].

При подозрении на гранулематозное заболевание и проведении резекции ткани необходимо оставлять часть ткани нефиксированной для возможного проведения культурального исследования и, если доступно, использовать метод быстрой заморозки при –70 °С для последующего проведения ДНК- и РНК-диагностики. При дифференциальной диагностике гранулематозных заболеваний следует прежде всего определить, является или гранулема инфекционной, или имеют место признаки других заболеваний, в том числе гранулематоза Вегенера. Если диагноз неинфекционной этиологии исключен, необходимо выполнить специальную окраску для обнаружения микроорганизмов, при этом желательно окрашивать срезы как минимум с двух блоков, при этом убедившись, что в материале присутствуют очаги некроза. Если на первый взгляд выявить микроорганизмы не удалось, рекомендуется просмотреть срезы еще раз при большем увеличении, а также использовать для окраски дополнительный блок. При отрицательном результате и клинических данных, свидетельствующих в пользу туберкулеза или других инфекций, рекомендуется проведение ПЦР. Если опять получен отрицательный результат, следует рекомендовать дополнительные культуральные и серологические исследования, исключающие инфекционный процесс (рис. 7). Рис. 7. Алгоритм диагностики некротических гранулематозных заболеваний легких [10]. Тем не менее по результатам этого алгоритма у определенной части гранулематозных заболеваний этиология не выяснена.
Таким образом, дифференциальная диагностика гранулематозных заболеваний легких сложна для патологоанатомов с целью достижения успеха желательно не только соблюдать правила исследования материала, приведенного в предложенном выше алгоритме, необходимы также тесное взаимодействие врача-пульмонолога, хирурга, выполняющего биопсию, а также коллегиальный подход.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Читайте также:

