Полиорганная недостаточность при отравлениях
Обновлено: 19.04.2024
Синдром полиорганной недостаточности развивается в результате одновременного или последовательного нарушения функций нескольких органов. В большинстве случаев полиорганная недостаточность является терминальной стадией тяжелых заболеваний, в том числе и последних стадий рака. Термин был введен относительно недавно — в 1973 году и на протяжении более 45 лет продолжает оставаться одной из самых частых причин смерти среди пациентов, которые находятся в реанимационных отделениях.
Особенности полиорганной недостаточности
Патологические изменения в органе или системе органов не развиваются одномоментно. Этот процесс протекает в три основные стадии:
- Компенсация. Длится от трех до пяти дней. В ответ на повреждение, организм старается компенсировать утраченную функцию. На начальных этапах ему удается сделать это относительно просто, поэтому полного отказа в работе органа не возникает. Если на этом этапе провести лечение, то можно будет избежать серьезных последствий, которые характерны для других стадий.
- Субкомпенсация. В этот период организм не может в полной мере восполнить утраченную функцию, поэтому пациент нуждается в медикаментозном лечении. Для того чтобы скорректировать имеющиеся нарушения, достаточно небольших доз лекарственных препаратов.
- Декомпенсациия. Эта стадия характеризуется выраженными изменениями в органах и полной утратой работоспособности. Состояние пациента становится крайне тяжелым. Он нуждается в больших дозировках лекарственных препаратов и проведении дополнительных мероприятий, которые призваны поддерживать жизнеобеспечение (ИВЛ, гемодиализ).
Степень тяжести полиорганной недостаточности определяется исходя из объема поражения. Декомпенсация двух систем соответствует тяжелой, а трех — крайне тяжелой степени.
Как проявляется синдром полиорганной недостаточности
Точный набор симптомов зависит от поражения тех или иных органов. Как правило, самыми отчетливыми являются признаки нарушения функций дыхательной системы. Об этом могут свидетельствовать следующие клинические проявления:
- Одышка.
- Активация вспомогательных мышц в процессе дыхания.
- Цианоз кожных покровов.
- Выраженная потливость.
- Нарушение сознания и заторможенность на поздних стадиях.
При поражении сердечно-сосудистой системы отмечаются боли за грудиной, различные нарушения гемодинамики, отеки мягких тканей и внутренних органов. На начальном этапе присутствует выраженная тахикардия, вплоть до 180 ударов в минуту. Она развивается с целью компенсации нарушений и со временем сменяется брадикардией, при которой частота сердечных сокращений может опускать до 40 ударов в минуту и даже ниже. На поздних стадиях пациент слабо отвечает на препараты, которые помогают нормализовать деятельность сердечно-сосудистой системы. Это одна из причин, по которой лечение полиорганной дисфункции становится сложным.
Нарушение деятельности желудочно-кишечного тракта при полиорганной недостаточности проявляется симптомами механического сдавления кишечника. К этим симптомам относятся:
- Нарушение процесса дефекации.
- Задержка газов.
- Вздутие и асимметрия живота.
- Рвота.
- Потеря аппетита.
В некоторых случаях развивается желудочно-кишечное кровотечение, которое усугубляет течение основного заболевания и нередко становится причиной смерти пациента.
Достаточно часто в клинической картине присутствуют признаки, которые характерны для почечной недостаточности. Прежде всего, это выраженное снижение объема мочи с последующим развитием анурии, что является показанием для проведения гемодиализа. Кроме того, у пациентов выявляется снижение уровня калия в крови, почечные отеки, нарушение водно-электролитного баланса и др.
Почему развивается полиорганная недостаточность
Среди причин, которые приводят к развитию синдрома полиорганной недостаточности, отмечаются тяжелые заболевания и состояния, которые оказывают существенное влияние на функции организма. К ним относятся тяжелые травмы, сепсис, инфекционно-токсический шок и др.
У онкологических пациентов синдром полиорганной недостаточности развивается после радикального удаления опухоли. Отличительной особенностью оперативных вмешательств в онкологии является необходимость удаления части одного или нескольких органов, которые поражены опухолевым процессом. При этом часто такие операции сопровождаются массивной кровопотерей, что увеличивает вероятность развития синдрома.
Полиорганная недостаточность развивается постепенно. В ее течении выделяют три основных этапа:
- Выработка различных активных молекул, которые приводят к развитию системного воспалительного ответа. Такими молекулами могут быть интерлейкины, фактор активации тромбоцитов, фактор некроза опухоли, гормоны, ферменты, свободные радикалы и др. В результате нарушается проницаемость и тонус сосудов, изменяются механизмы иммунной защиты и важнейшие биохимические процессы. Все эти изменения соответствуют индукционной фазе полиорганной недостаточности.
- Во время каскадной фазы отмечается развитие системных повреждений, которые проявляются характерными симптомами — тромбоцитопенией, лейкоцитозом, нарушением микроциркуляции, гипоксией и т.д.
- Фаза вторичной аутоагрессии характеризуется выраженной дисфункцией органов и нарушением гомеостаза.
Для полиорганной недостаточности характерно несколько повреждающих механизмов, среди которых ведущее значение имеет ишемия, активное тромбообразование и нарушение мозгового кровообращения.
Методы диагностики заболевания
Симптомы полиорганной недостаточности могут быть похожими на другие заболевания, поэтому для подтверждения диагноза врач назначает комплексное обследование, в которое входят следующие методы диагностики:
- Осмотр пациента, анализ жалоб, сбор анамнеза. Уже на этом этапе специалист может заметить характерные признаки, которые свидетельствуют о поражении одного или нескольких органов. Это могут быть нарушения дыхательной и сердечной деятельности, метаболические изменения, отклонения в гемодинамике.
- Инструментальное обследование. Его объем зависит от проявлений полиорганной недостаточности. В распоряжении врача имеются все неинвазивные методы, например, УЗИ, рентген, КТ, МРТ и др. Кроме того, важно регулярно отслеживать основные показатели жизнедеятельности организма — артериальное давление, частоту сердечных сокращений, частоту дыхания и др.
- Лабораторные методы диагностики. Обычно назначаются базовые анализы, которые позволяют оценить и в дальнейшем контролировать основные показатели гемодинамики, уровень электролитов и ферментов в крови и др.

С учетом того факта, что пациенты в большинстве случаев находятся в условиях палаты реанимации и интенсивной терапии, полиорганную недостаточность удается выявить на ранних стадиях, когда полного отказа органа или системы не произошло.
Лечение полиорганной недостаточности должно носить комплексный характер и проводиться в условиях отделения интенсивной терапии.
Основная цель лечения пациента заключается в восстановлении утраченных функций, устранении негативных последствий полиорганной недостаточности и предупреждении осложнений. Для этого назначаются медикаментозные препараты из группы антибиотиков, НПВС, гормонов, антикоагулянтов и др. При необходимости выполняется переливание крови или ее компонентов, проводится профилактика ДВС-синдрома, внутренних кровотечений, коллапса. На всем протяжении лечения пациент должен соблюдать строгий постельный режим.
При синдроме полиорганной недостаточности зачастую требуется замещение функций жизненно важных органов, которые не могут справляться со своей работой. Для этого применяется искусственная вентиляция легких, заместительная почечная терапия, различные методы поддержания сердечной функции.
При тяжелом течении применяются хирургические методы. К ним относятся экстракорпоральная детоксикация, устранение кишечной непроходимости, удаление нежизнеспособных органов, которые начали некротизироваться.
Питание при полиорганной недостаточности
При синдроме полиорганной недостаточности организм пациента нуждается в повышенном количестве энергии. Энергопотребление возрастает в 2–3 раза по сравнению с нормой. При этом состояние пищеварительной системы не позволяет полноценно усваивать питательные вещества. Поэтому кормление осуществляется специальными смесями через зонд или внутривенно. Постепенно, по мере выздоровления, разрешается переходить на обычное питание, поначалу небольшими порциями.
Питание должно быть полноценным и сбалансированным. Организму пациента необходимо достаточное количество белка, витамины, микроэлементы, антиоксиданты. При этом применяются смеси с низким гликемическим индексом, чтобы предотвратить развитие инсулинорезистентности, сахарного диабета.
Чем опасна полиорганная недостаточность
Основная опасность полиорганной недостаточности заключается в высоком риске летального исхода. В зависимости от объема поражения, смертность может составлять от 30% до 100%. Даже если основные проявления синдрома удается своевременно устранить, вероятность развития отсроченных заболеваний остается очень высокой. Среди наиболее частых осложнений отмечаются:
- Хроническая почечная недостаточность.
- Ишемическая болезнь сердца.
- Различные заболевания легких.
- Блокады проводящих путей сердца.
- Неврологические нарушения.
- Энцефалопатия и др.
Несмотря на развитие методов хирургического лечения и систем мониторинга основных показателей работы организма во время операции, а также подходов к послеоперационному ведению пациентов, частота развития полиорганной недостаточности продолжает оставаться высокой. Ввиду актуальности данной проблемы специалисты ищут новые пути ее решения, начиная от своевременной диагностики и заканчивая эффективным лечением.
Отравление ядовитыми растениями — острая или хроническая интоксикация, вызванная ядами, содержащимися в травах, цветах, частях кустов, деревьев. Клиническая симптоматика различается в зависимости от типа растения. Отравление может протекать с преобладанием холинолитического или никотиноподобного синдрома, признаков поражения сердца, почек, печени, кожи, пищеварительного аппарата. Диагностируется на основании токсико-химического анализа крови и мочи, клинической картины и анамнеза. Методы лечения: антидотная терапия, дезинтоксикационные мероприятия, поддержание витальных функций организма.
МКБ-10

Общие сведения
На долю интоксикаций природными ядами приходится около 2-5% от общего количества острых отравлений. Токсичность некоторых растительных ксенобиотиков выше, чем синтетических. Например, смертельная доза цианистого калия составляет 10 мг/кг веса, мускарина, присутствующего в мухоморах — 1,1 мг/кг. Растения могут содержать несколько разновидностей отравляющего вещества: кураре, атропин, никотин, стрихнин, палитокин, рицин, фаллоидин. Наиболее опасные представители флоры — дурман, белена, болиголов, вех, паслен ядовитый, волчье лыко, лютик, чемерица.

Причины
Отравление ядовитыми растениями обычно возникает при пероральном употреблении токсичных трав или тактильном контакте с дерматотропными ядами. Группа риска: дети, люди, использующие рецепты народной медицины, работники фармацевтических предприятий. К возможным причинам относятся:
- Нечаянное употребление ядовитых растений. Чаще страдают жители городов, приезжающие на отдых в загородную зону. Они не обладают необходимыми познаниями и не способны дифференцировать опасные растения (молочай, волчье лыко) от безвредных. Интоксикации также могут развиваться при неграмотном использовании средств нетрадиционной медицины.
- Преднамеренное отравление. Токсичные растения могут использоваться для убийства человека или его нейтрализации. В средние века природные яды активно применялись в ходе дворцовых переворотов. Эксплуатировались вытяжки из аконита, болиголова, цикуты. Сегодня подобные случаи редки, так как разработаны более действенные синтетические поражающие соединения.
- Лечение алкоголизма кукольником. При одновременном использовании со спиртным растение вызывает дисульфирамоподобный эффект. Если терапия проводится тайно, человек может погибнуть, так как не осознает существующей опасности. Причина смерти — эндогенное отравление метаболитами этанола с развитием острой сердечно-сосудистой недостаточности.
- Употребление продуктов с примесью ядовитых трав. Возникает при попытках улучшить вкусовые качества блюда с помощью самостоятельно собранных растений, если человек не обладает достаточными познаниями в сфере гербологии. Количество подобных случаев не превышает 0,5-1% от всех природных экзотоксикозов.
- Кожный контакт с соком растений. Обычно вызывает местные признаки поражения. Наиболее распространены ожоги, спровоцированные соком борщевика. Они проявляются только под влиянием солнечного света. В ночное время растение безопасно. При массивных повреждениях возможна гибель пострадавшего от интоксикации и полиорганной недостаточности.
Патогенез
Патогенез напрямую зависит от вида растения и яда, содержащегося в нем. При отравлениях красавкой и беленой на первый план выходят признаки холинолитического синдрома. Нарушается выделение ацетилхолина и проводимость нервного импульса в синапсах. Никотиноподобное влияние болиголова, хвоща и веха ядовитого приводит к блокированию никотиновых рецепторов организма, что сопровождается ухудшением координации, гиперсаливацией, психическими изменениями.
Сердечные гликозиды, содержащиеся в наперстянке, горицвете, ландыше, приводят к нарушениям коронарного ритма. Происходит ингибирование действия некоторых ферментов на мембраны кардиомиоцитов, в них накапливаются ионы натрия, снижается количество внутриклеточного калия. Гелиотроп и крестовник обладают гепатотоксическим влиянием. Они провоцируют нарушение функции печени, развитие диффузных изменений паренхимы. Комплексным действием на ЦНС и сердце обладает аконит, на сердце и ЖКТ — чемерица.
Классификация
Отравление ядовитыми растениями подразделяют по причинам (бытовые, суицидальные, криминальные), по степени тяжести (легкие, средние, тяжелые и крайне тяжелые), по токсичности самого растения (высокотоксичные, среднетоксичные, слаботоксичные). Нужно учитывать, что отравляющая способность трав изменяется в зависимости от времени года и того, какая именно ее часть была употреблена в пищу. Наиболее распространенной является классификация по способности флоры поражать ту или иную систему организма:
Симптомы отравлений
Отравление нейротоксичными растениями
Клиническая картина интоксикации растительными ядами варьирует в широких пределах. Употребление нейротоксичных субстанций приводит к возникновению делирия, психомоторного возбуждения, галлюцинаций, головной боли. Позднее развивается угнетение сознания, сопор, кома. Помимо непосредственных признаков поражения ЦНС, у пациента обнаруживается рвота, тошнота, осиплость голоса, тахикардия, сухость слизистых оболочек. Длительность латентного периода зависит от дозы токсиканта и пути его поступления, может составлять от 10 минут до 10-15 часов.
Отравление кардиотоксичными растениями
Основные симптомы при приеме кардиотропных растений: аритмия, тахикардия, желудочковая экстрасистолия. Пациенты жалуются на ощущение перебоев в работе сердца, чувство сдавления в груди. Кроме того, может возникать абдоминалгия, рвота, мелькание мушек перед глазами. Если отравление ядовитыми растениями имеет хронический характер, развиваются невриты, маниакально-депрессивный психоз. Существует риск полной атриовентрикулярной блокады, остановки сердца.
Отравление гепатотоксичными растениями
Гепатотоксическое влияние трав приводит к появлению желтухи, атаксии, сосудистых звездочек на коже. Определяются явления диспепсии. Живот вздут, отхождение газов нарушено. Кал приобретает светло-серый оттенок, что свидетельствует об ухудшении оттока желчи. Токсический гепатит, развивающийся как результат отравления, нередко сочетается с поражением почек. У пострадавшего снижается количество суточной мочи, нарастают показатели мочевины и креатинина.
Поражение дерматотропными растениями
Попадание сока обжигающих растений на кожу сопровождается возникновением эритемы, пузырей, наполненных серозным содержимым. Возможны системные и местные аллергические реакции. При небольшом размере поражения угроза жизни отсутствует. Массивные травмы проявляются симптоматикой полиорганной недостаточности и интоксикации. Отравления ядами смешанного действия провоцируют картину, которая включает симптомы экзотоксикоза, относящиеся к разным группам.
Осложнения
Распространенным осложнением поражений нейротоксическими ядами считается нарушение работы дыхательных структур головного мозга и паралич респираторных мышц. Развивается у 10-15% пострадавших, при отсутствии медицинской помощи оканчивается летально. Кардиотропные яды приводят к блокаде проводимости I-II степени у 45% больных, III степени – у 3-5%. Поражение печени сопровождается формированием ДВС-синдрома, внутренних кровотечений, полиорганной недостаточности.
Химические ожоги, спровоцированные растительным соком, могут инфицироваться. При этом существует риск сепсиса, инфекционно-токсического шока. Отравляющие вещества, выделяющиеся в кровь при распаде некротизированных тканей, способны нарушить работу систем выделения. Подобная патология встречается у 6-8% больных. Отравление ядовитыми растениями смешанного действия нередко является причиной острой дыхательной и сердечно-сосудистой недостаточности, коматозного состояния. У пациентов, длительно пребывающих на ИВЛ, развиваются пневмонии.
Диагностика
- Физикальное обследование. При нарушении дыхания определяются хрипы, брадипноэ, диффузный цианоз. Может возникать неадекватное поведение, ослабление координации. Кожа бледная или синеватого оттенка, зрачки сужены при интоксикациях атропиноподобными веществами. Присутствует изменение зрения.
- Функциональные методы. На ЭКГ деформированные внеочередные комплексы QRS, волны фибрилляции F, выпадение части желудочковых сигналов, сокращение интервала R-R. АД выше или ниже нормы, характерна тахикардия.
- Лучевые исследования. На УЗИ живота — увеличение размеров печени, диффузные изменения печеночной и почечной паренхимы. На рентгенограмме больных, длительно находящихся на искусственной дыхательной поддержке, могут определяться признаки отека легких.
- Лабораторные анализы. Проводятся качественные пробы, позволяющие определить наличие токсиканта в крови или моче. Показан биохимический анализ, который обнаруживает рост активности ферментов печени. Почечная патология сопровождается увеличением количества креатинина, мочевины. Возможно снижение концентрации факторов свертывания крови.
Лечение отравлений ядовитыми растениями
Доврачебная помощь
При появлении симптомов интоксикации травами следует вызвать медиков и оказать пострадавшему первую помощь. Если яд был употреблен внутрь, необходимо произвести беззондовое промывание желудка: дать выпить 400-500 мл воды, вызвать рвоту. Процедуру повторить 3-5 раз. После контакта с кожными ядами пораженный участок необходимо промыть большим количеством чистой воды, прикрыть тканью, чтобы предотвратить попадание на него прямых солнечных лучей.
Первая медицинская помощь
Отравление ядовитыми растениями требует немедленного введения антидотов. При интоксикации беленой, дурманом вводят прозерин; наперстянкой, ландышем — лидокаин и другие антиаритмические препараты. Требуется зондовое промывание желудка с последующим введением кишечных адсорбентов. Отравляющие вещества, всосавшиеся в кровоток, нейтрализуют с помощью тиосульфата натрия, унитиола. При тяжелой патологии показана симптоматическая коррекция, инфузионная терапия.
Реанимационное пособие
В ОРИТ помещают пострадавших с тяжелой и крайне тяжелой степенью поражения. Здесь проводится круглосуточный аппаратный мониторинг состояния, массивный форсированный диурез (до 10 литров за сутки), строгий контроль водного баланса. При необходимости осуществляется респираторная поддержка с помощью аппарата ИВЛ. Полная блокада внутрисердечной проводимости требует установки внешнего кардиостимулятора. Для поддержания гемодинамики вливается дофамин, норадреналин. При остановке сердца проводятся мероприятия, направленные на восстановление жизнедеятельности.
Лечение в условиях стационара
Во время стационарного лечения пациент продолжает получать адсорбенты и антидоты. Используются способы активной детоксикации (гемосорбция или гемодиализ), форсированный диурез, солевые слабительные или кишечный лаваж. С целью купирования судорог применяют антиконвульсанты, психомоторное возбуждение устраняют нейролептическими средствами. Показано профилактическое введение антибиотиков. Это особенно актуально в отношении пациентов, длительно сохраняющих лежачее положение.
Прогноз и профилактика
Прогноз в большинстве случаев благоприятный. Отравление ядовитыми растениями в 90% наблюдений проходит без последствий. Гибель пострадавшего возможна при тяжелых интоксикациях и отсутствии специализированной помощи. Отсроченные осложнения возникают редко. Подобное происходит, если имела место полиорганная недостаточность, токсический гепатит.
Профилактика заключается в отказе от употребления незнакомых растений внутрь, исключении самолечения с помощью средств народной медицины, содержащих опасные травы, внимательном изучении информации о собираемых растениях.
3. Руководство по скорой медицинской помощи/ Багненко С.Ф., Мирошниченко А.Г., Верткин А.Л., Хубутия М.Ш. — 2007.
Постреанимационная болезнь – специфическое состояние организма, возникающее после успешных реанимационных мероприятий. Вызывается временной тотальной ишемией тканей и синдромом восстановления кровотока. Проявляется выраженным увеличением концентрации ферментов крови, гипоперфузией, уменьшением ОЦК, развитием диссеминированного внутрисосудистого свертывания, полиорганной недостаточностью. Диагностируется по наличию соответствующей симптоматики и остановки кровообращения в недавнем прошлом. Специфическое лечение включает гормоны, кардиотоники, инфузии солевых растворов и компонентов крови, противоишемические и ноотропные лекарственные средства.
МКБ-10
Общие сведения
Впервые постреанимационная болезнь (ПРБ) как самостоятельная нозологическая единица была описана советским ученым, членом АМН В. А. Неговским в 1979 году. Труды других специалистов расширили и укрепили знания о патологии, тем самым упрочив в медицинском мире позиции реаниматологии как науки. Согласно статистической информации, более половины больных, перенесших сердечно-легочную смерть (СЛР), умирает от острой недостаточности кровообращения или изменений в головном мозге, вызванных глобальной ишемией. Выживаемость после успешных СЛР-мероприятий, по данным разных источников, составляет от 29 до 40%. Постреанимационная болезнь возникает в первые часы после восстановления перфузии, протекает 7-10 дней. Прогноз для жизни ухудшается пропорционально времени от остановки сердца до начала реанимационных мероприятий.

Причины
ПРБ развивается под действием нескольких патогенетических факторов, воздействующих на пациента, подвергшегося клинической смерти. Комплексное негативное влияние на ослабленный болезнью организм приводит к значительным изменениям в работе органов и ферментативных систем, что может послужить причиной гибели больного. К числу наиболее важных этиофакторов формирования ПРБ относятся:
- Тотальная ишемия. Длительное недостаточное поступление O2 потенцирует отмирание части клеток. В первую очередь происходит поражение головного мозга (постреанимационная энцефалопатия) как структуры, наиболее чувствительной к гипоксии. Наблюдается спазм сосудов, компенсаторная тахикардия, уменьшается сердечный выброс, что усугубляет кислородное голодание. Происходят изменения в тканях миокарда, скелетной мускулатуре. Начинаются процессы миолиза с выделением в кровь продуктов распада мышц.
- Синдром реперфузии. В условиях гипоксии ткани выходят на анаэробный режим гликолиза, клетки перенастраиваются на данный путь получения энергии. Резкое восстановление кровотока и поступление большого количества кислорода ведет к избыточному накоплению его токсичных форм, активации процессов апоптоза и некроза клеток.
- ДВС. Выявляется при шоковых состояниях, проявляется образованием в сосудистом русле микротромбов. Последние блокируют просвет капилляров, ухудшают микроциркуляцию в тканях, становятся причиной образования множественных мелких ишемических очагов. В дальнейшем это в сочетании с другими факторами провоцирует полиорганную недостаточности.
- Кровотечения. Возникают как отсроченный результат ДВС в момент, когда возможности системы гемостаза истощаются, концентрация факторов свертывания уменьшается. Состояние характеризуется практически полным отсутствием в плазме субстанций, ответственных за формирование тромба. Сопровождается развитием геморрагического синдрома.
- Метаболическая буря. После восстановления кровотока у больных отмечаются массивные изменения механизмов регуляции гомеостаза. Происходит закисливание внутренней среды со снижением pH ≤ 7,34, падает уровень электролитов, в том числе калия, кальция и прочих. При активном вливании натрия гидрокарбоната на этапе СЛР вместо ацидоза может определяться ятрогенный алкалоз. Выявляется уменьшение ОЦК за счет депонирования части крови в печени, скелетных мышцах, селезенке.
Патогенез
Патогенез основывается на изменениях, наступающих в результате остановки кровообращения. У больного развивается ОПН, вторичный септический шок, недостаточность дыхания и ССС, сбои в работе рецепторных структур. На вскрытии определяют дистрофические изменения в почках, в легких часто присутствуют признаки двухсторонней многоочаговой пневмонии. Здесь же выявляют большое количество миоглобина. В тканях обнаруживают кровоизлияния различной степени тяжести. Головной мозг может содержать отмершие участки, что свидетельствует о возникновении ишемического инсульта. При церебральной смерти (декортикация) отмечаются необратимые изменения ствола, шейных сегментов, коры больших полушарий.
Классификация
Постреанимационная болезнь систематизируется по стадиям, каждая из которых соответствует времени, прошедшему с момента восстановления кровотока. Согласно классификации Е.С. Златокрылиной от 1999 года, существует 5 основных этапов прогрессирования ПРБ. Все они характеризуются определенными трансформациями в состоянии пациента. Различают следующие фазы развития патологических изменений:
- Этап №1. Протекает на протяжении 6-8 часов со времени реанимационных мероприятий. Отмечается выраженное снижение тканевой перфузии (в 4-5 раз меньше нормы). Присутствуют явления циркуляторной гипоксии – состояния, возникающего при недостаточном давлении в капиллярах.
- Этап №2. Наступает к 10-12 часу болезни. Отмечается относительная стабилизация функций организма, временное улучшение состояния. Имеет место дефицит объема циркулирующей крови, тканевый кровоток снижен в 2-3 раза. Увеличиваются потери электролитов, преимущественно K + . Стадия имеет важное прогностическое значение, позволяет с высокой долей вероятности определить дальнейшее течение и исход патологического состояния.
- Этап №3. Наблюдается со вторых суток болезни. Замедляется фибринолитическая активность плазмы, формируется смешанная гипоксия, обусловленная изменением свойств гемоглобина и развитием респираторного дистресс-синдрома. Возникают первые признаки микротромбоза капиллярной сети внутренних органов. Нарушения носят функциональный характер, необратимые процессы отсутствуют.
- Этап №4. Переломный момент в течении болезни. Наступает к 3-4 дню. Может характеризоваться общим улучшением состояния или дальнейшим прогрессированием патологических изменений. При неблагоприятном исходе усиливаются явления катаболизма, возникает интерстициальный отек легких, гидрогенизация головного мозга. Начинается генерализованный воспалительный ответ, обнаруживаются признаки недостаточности внутренних органов.
- Этап №5. Манифестирует к 5-7 суткам. Диагностируются объемные септические процессы: пневмонии, сепсис, внутренние абсцессы. Антибактериальная терапия неэффективна. Причина инфекции – угнетение иммунитета из-за длительной гипоксии. Максимально проявляется энцефалопатия токсического происхождения, усугубляется полиорганная недостаточность, в крови накапливаются продукты обмена веществ. Гибель пациента наступает спустя 1-5 дней. Причиной смерти становится поражение нескольких жизненно важных систем, инфекционно-токсический шок, сепсис.
Симптомы постреанимационной болезни
Существует множество клинических признаков ПРБ, свидетельствующих о негативных изменениях. На начальном этапе у больного присутствует симптоматика шока: мраморный оттенок кожи, резкое снижение АД вплоть до неопределяемых значений, компенсаторная тахикардия, расширение зрачков. Как правило, пациент находится в глубокой коме. Отсутствует сознание, двигательная активность. Рефлексы резко угнетены или полностью выключены. Мышечный тонус снижен.
В дальнейшем выявляются изменения сердечного темпа по причине недостатка электролитов и ишемического поражения ССС. Возможны блокады проводимости, аритмии, что проявляется в виде неритмичного, отрывочного пульса. Артериальное давление может оставаться сниженным или приходить в норму. Часто гемодинамику поддерживают медикаментозными методами. Визуально различимы признаки сердечной и дыхательной недостаточности – диффузный цианоз и акроцианоз, сохраняющиеся даже при проведении искусственной вентиляции легких.
Осложнения
К числу осложнений ПРБ относится смерть мозга, при которой соматические функции сохраняются, однако ЦНС подвергается необратимым изменениям. Такие пациенты переходят в вегетативное состояние без надежды на восстановление. Диагноз подтверждается по результатам электроэнцефалографии. Тяжелое последствие остановки кровотока – полиорганная недостаточность, при которой происходит отказ двух и более систем организма. В большинстве случаев деструкции подвергаются почки, гепатобилиарный аппарат, легкие, сердце, головной мозг. Возможно появление массивных геморрагий, при которых гибель больного наступает от острой кровопотери.
Диагностика
Диагноз устанавливают на основании клинического, лабораторного и аппаратного изучения работы жизненно важных органов пациента. Определением состояния занимается врач анестезиолог-реаниматолог в тандеме со специалистами другого профиля (неврологом, кардиологом, нефрологом и пр.), представителями службы лабораторной и функциональной диагностики. Обычно диагностические затруднения отсутствуют. Используют такие методы, как:
Лечение постреанимационной болезни
ПРБ требует проведения ряда лечебных процедур, направленных на восстановление жизненных функций и работы головного мозга. Существенное значение имеют общережимные мероприятия, которые становятся особенно важными при долговременном пребывании больного в бессознательном состоянии. К числу восстановительных мер относятся:
- Общие способы. Актуальны в отношении реанимационных пациентов любого профиля. Требуется тщательный уход с ежедневным мытьем и изменением положения тела каждые 2 часа. Участки мацерации кожи обрабатывают камфарным спиртом или специализированными дерматопротекторными средствами. При отсутствии ОПН показано полноценное белковое питание, обильное питье. Несоблюдение этих требований влечет за собой развитие пролежней, углубление интоксикации, усиление нагрузки на иммунную систему, повышение риска сепсиса.
- Медикаментозная терапия. Направлена на защиту тканей от гипоксии, улучшение перфузии, стимуляцию работы сердца, головного мозга. Применяются такие группы препаратов, как кардиотоники, прессорные амины, антигипоксанты, средства, улучшающие микроциркуляцию, спазмолитики, ноотропы. Показана обязательная инфузионная терапия с использованием коллоидных и кристаллоидных растворов.
- Оперативные методы. К их числу условно можно отнести проведение гемодиализа, необходимого для удаления токсичных продуктов обмена веществ. При почечной недостаточности осуществляется плазмаферез для устранения излишних объемов воды, содержащей продукты обмена. Полноценные операции, предназначенные для лечения ПРБ, не разработаны.
Прогноз и профилактика
Постреанимационная болезнь имеет неблагоприятный для жизни пациента прогноз. В течение первого полугодия погибает около 80% людей, подвергшихся длительной гипоксии. Среди больных, получивших помощь немедленно после остановки сердца, этот показатель значительно ниже. Причиной смерти становятся неврологические и сердечные заболевания, хроническая дыхательная недостаточность. Часть выживших подвергается постгипоксической энцефалопатии, при которой ухудшаются умственные способности. Профилактика заключается в своевременном начале СЛР, минимизации периода отсутствия кровотока, полноценной медикаментозной поддержке на всех этапах восстановительного процесса, начиная с первых его минут.
3. Сердечно-легочная реанимация, пособие для студентов, ординаторов, аспирантов и врачей / НИИ общей реаниматологии им. В. А. Неговского – 2017.
Полиорганная недостаточность – одновременное или последовательное поражение нескольких систем с первоначальным преобладанием симптомов отказа одной из них. Определяющими признаками являются цианоз, одышка, отеки, анурия, гипотония, шоковое состояние. Диагноз устанавливается на основании клинической картины, данных лабораторного и аппаратного обследования. Специфическое лечение: поддержка дыхания и сердечной деятельности, стабилизация гемодинамики, устранение патогенетического фактора (борьба с инфекцией, коррекция метаболических нарушений, восстановление ОЦК, нормализация гемостаза), искусственная и естественная детоксикация.
МКБ-10
Общие сведения
Полиорганная недостаточность (ПОН) – патология, возникающая преимущественно у пациентов реанимационных отделений. Как самостоятельная нозологическая единица впервые была описана в 1973 году, до этого считалась сочетанием двух и более не связанных между собой нарушений. Частота встречаемости составляет около 5-10% от общего количества больных. Смертность в этой группе приближается 60%. Чаще погибают пациенты, имеющие сбои в работе трех органов. Состояние развивается на 3-5 сутки после успешного восстановления сердечной деятельности, при тяжелых сочетанных травмах, отравлениях, эндотоксикозах. В основе развития лежит синдром системного воспалительного ответа.

Причины полиорганной недостаточности
ПОН возникает в результате патологических изменений, происходящих в организме после остановки и последующего восстановления работы сердца. Кроме того, она может формироваться на фоне тяжелой политравмы, инфекционно-токсического шока, сепсиса, перитонита. Чаще развивается, если один из органов, вовлеченных в процесс, ранее был поражен хронической патологией или изменен в результате воздействия первичного фактора (контузия легкого при ДТП, снижение сократительной способности миокарда при остром коронарном синдроме). В число этиофакторов включают:
Патогенез
Полиорганная деструкция имеет несколько механизмов развития, основным из которых является ишемическое повреждение органов. Часть клеток отмирает, остальные переходят в анаэробный режим гликолиза. Основные повреждения возникают при восстановлении кровотока. В этот период образуется большое количество свободных радикалов, вызывающих перикисное окисление тканей. Вторым патогенетическим механизмом является интенсивное тромбообразование на начальной стадии ДВС-синдрома. Образующиеся микроэмболы нарушают проходимость капиллярной сети, что усиливает ишемию.
Отеки в результате повышенной проницаемости сосудов приводят к накоплению жидкости в брюшной полости, усилению внутриабдоминальной компрессии. Происходит механическое сжатие органов живота, подъем диафрагмы с ограничением подвижности легких. Отмечается рост внутригрудного давления, уменьшение рабочего пространства сердца. Нарушается отток крови от мозга. В процесс вовлекается центральная нервная система, развивается церебральный отек с появлением неврологической симптоматики.
Классификация
Деление ПОН на группы производится по результатам оценки деятельности органов и систем, общего состояния пациента. Для этого может быть использована шкала Apache II или Д. Маршалла, созданная в 1995 году специально для работы с больными, страдающими полиорганной недостаточностью. На практике более актуальным является метод А. Л. Левита, представленный в 2000 году. Согласно ему, каждая из систем может находиться в компенсированном, субкомпенсированном или декомпенсированном состоянии. Полиорганная недостаточность определяется как тяжелая при декомпенсации двух систем, как крайне тяжелая – при значительных изменениях в трех органах. Оценка проводится отдельно по каждому органу.
Симптомы полиорганной недостаточности
Клиническая картина зависит от наличия поражения тех или иных структур. Обычно на первый план выходят признаки изменений со стороны дыхательной системы. Отмечается одышка, диффузный цианоз, включение вспомогательной мускулатуры в процесс вдоха, потливость, психомоторное возбуждение. Пациенты, способные самостоятельно передвигаться, занимают вынужденное положение сидя с упором руками в кровать. Позднее активность сменяется заторможенностью, угнетением сознания.
Полиорганная недостаточность с поражением сердца проявляется загрудинными болями, нестабильностью гемодинамики, накоплением жидкости в мягких тканях за счет усиления пролиферации плазмы сквозь сосудистую стенку. Может возникать отек легких, сопровождающийся появлением розоватой пены изо рта. Выявляется компенсаторная тахикардия до 180 уд./мин, позднее сменяющаяся брадикардией с урежением ЧСС до 40 и ниже. На терминальной стадии происходит снижение чувствительности к инотропным средствам и альфа-адреномиметикам.
При почечно-печеночной разновидности болезни объем диуреза заметно снижается. Затем возникает анурия, требующая проведения гемодиализа. Обнаруживается гипогликемия, влекущая за собой нарушения сознания. У пациента развивается асцит, диспепсия, белковые отеки. Кожа и слизистые оболочки желтеют, возможна геморрагическая сыпь. Через несколько часов или дней обнаруживаются признаки печеночной энцефалопатии: больной не отдает себе отчет в своих действиях, не понимает, где находится, что с ним происходит.
Поражения ЖКТ характеризуются признаками обструкции, обусловленной механическим сдавлением кишечника. Определяется боль, вздутие, асимметрия передней брюшной стенки, задержка стула и газов, рвота. Отсутствует толерантность к кормлению. Возможно развитие стрессовой язвы и кишечной геморрагии, которая проявляется снижением уровня Hb, бледностью пациента, падением АД, возникновением или усилением ДВС синдрома при массивной кровопотере.
Осложнения
При успешном купировании полиорганное поражение может завершаться развитием отсроченных заболеваний. У 5% пациентов, повторно обратившихся за помощью в ЛПУ, диагностируют хроническую почечную недостаточность, примерно 2% больных испытывают симптомы ишемической болезни сердца или имеют признаки ХСН. Легочные изменения отмечаются в 3% случаев. В остром периоде осложнением является фибрилляция желудочков на фоне токсического поражения миокарда и тахикардии с ЧСС выше 160-180/мин. Возможно повреждение проводящей системы сердца с формированием СА или АВ блокады. Ишемия мозга нередко приводит к снижению умственных способностей, энцефалопатии, парезам, параличам.
Диагностика
Диагностика осуществляется по результатам клинического, лабораторного и инструментального обследования. Курировать пациентов должен анестезиолог-реаниматолог, однако провести первичный осмотр и установить предварительный диагноз для направления больного в профильное отделение может врач любой специальности, в том числе сотрудник бригады СМП. Дифференциальную диагностику проводят с сочетанной патологией нескольких систем организма, этиологически не связанной с механизмами развития рассматриваемого заболевания. Полная программа обследования включает:
- Физикальный осмотр. В ходе консультации специалист выявляет характерные внешние признаки поражения того или иного органа, определяет наличие субъективных жалоб. В большинстве случаев обнаруживаются симптомы нарушений гемодинамики, сердечной деятельности и дыхания, метаболических изменений.
- Лабораторная диагностика. В анализах отмечается снижение уровня гемоглобина до 60-80 г/л, падение глюкозы до 2,5 ммоль/л, рост АСТ, АЛТ более чем в два раза от нормальных показателей, повышение содержания билирубина ≥ 30 ммоль/литр. PaO2 находится в пределах 64-50, PaCO2 – 56-90 мм рт. ст., pH изменяется в кислую сторону (≤ 7.3).
- Аппаратное обследование. Основной метод – постоянное мониторирование жизненных функций. Показатели часто находятся в следующих границах: САД ≤ 50 мм рт. ст. (при отсутствии медикаментозной поддержки), ЧСС ≥ 180 или ≤ 40 в минуту. Центральное венозное давление ≥ 14 мм или отрицательное. ЧДД ≥ 5 или ≤ 50 (без ИВЛ и оксигенотерапии). При проведении рентгенографии легких визуализируются затемнения, при выполнении УЗИ брюшной полости выявляется уровень свободной жидкости.
Лечение полиорганной недостаточности
Терапия направлена на восстановление ОЦК, нормализацию реологических свойств крови, поддержку витальных функций, предотвращение последствий отсроченного характера. Полиорганная недостаточность должна быть купирована на стадии компенсации, это увеличивает вероятность полного восстановления. Применяются следующие лечебные воздействия на больного:
- Общережимные мероприятия: соблюдение строжайшего постельного режима, круглосуточное наблюдение с использованием анестезиологического кардиомонитора. Контролю подлежат показатели АД, ЧСС, ЧДД, сатурации, сердечного ритма. Каждые 4 часа производится забор крови на КЩС, ежедневно – на биохимию и общий анализ. Для предупреждения трофического повреждения кожи осуществляется полноценный гигиенический уход, питание назначается в соответствии с имеющимися нарушениями (щадящее, жидкое, парентеральное).
- Консервативное лечение. Показаны обильные инфузии кристаллоидных и коллоидных растворов. При гипотонии вводится допамин. При дефиците факторов свертывания и наличии ДВС-синдрома необходима трансфузия свежезамороженной плазмы. Усиленное тромбообразование требует приема ацетилсалициловой кислоты, курантила, гепарина. При выраженной симптоматике производится антимедиаторная терапия ибупрофеном, ингибиторами фактора активации тромбоцитов. Рекомендовано внутривенное введение стероидных гормонов, антибиотиков.
- Хирургическое лечение. К числу инвазивных процедур относят экстракорпоральную детоксикацию (гемо- и перитонеальный диализ). Открытое вмешательство может потребоваться при полном отказе или некрозе внутренних органов (печень, почки), а также при кишечной непроходимости. Для удаления асцитической жидкости выполняют лапароцентез.
Прогноз и профилактика
Полиорганная недостаточность имеет благоприятный исход при раннем начале лечения. По мере прогрессирования процесса в организме накапливаются необратимые изменения, повышающие риск возникновения осложнений. Декомпенсированная форма болезни имеет неблагоприятный прогноз, в 60% случаев приводит к гибели пациента. Профилактика заключается в предотвращении ПОН. Следует купировать очаги инфекции, при объемных травмах начинать массивную инфузию еще на догоспитальном этапе, своевременно устранять имеющиеся нарушения гемодинамики и сердечного ритма. Важным моментом является контроль диуреза пациента, находящегося на лечении в ОРИТ. Разница между употребленной и выделенной жидкостью не должна составлять более 100-200 мл в сутки.
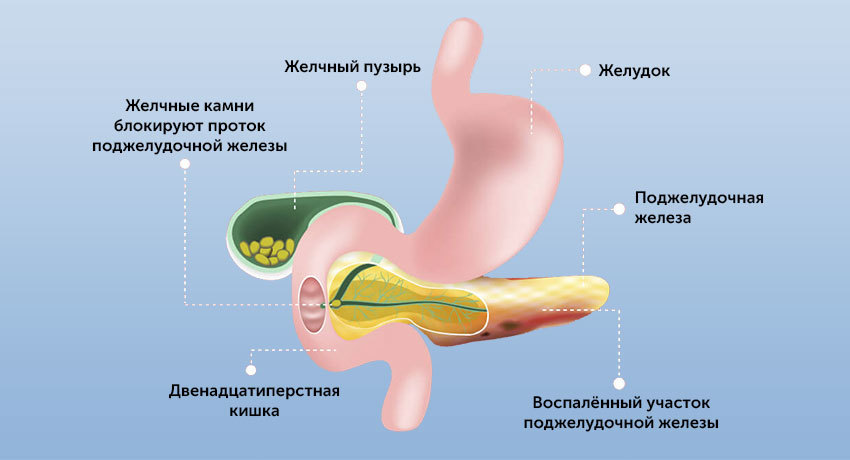
Воспаление поджелудочной железы называется панкреатитом, острым или хроническим.


Поджелудочная железа — орган небольших размеров, но она играет большую роль, как в пищеварении, так и в гормональной регуляции.
Панкреатический сок содержит ферменты, необходимые для переваривания жиров и белков. Он поступает в кишку, где смешивается с желчью.
Отдельные группы клеток поджелудочной железы, называемые островками Лангерганса, вырабатывают инсулин, который необходим для утилизации глюкозы крови. При нарушении их работы развивается сахарный диабет.
Таким образом, воспаление поджелудочной железы представляет опасность как для пищеварительной, так и для эндокринной системы организма.
Острый панкреатит требует срочной госпитализации и экстренного лечения. В противном случае он может привести к инвалидности или даже смерти человека. Поэтому важно знать признаки, при которых нужно немедленно вызвать скорую помощь.
Большое значение имеет то, как быстро начнется хирургическое лечение. Счет может идти на часы или даже на минуты.
Врачи отделения реанимации и интенсивной терапии, хирургического отделения международной клиники Медика24 имеют большой опыт оказания экстренной помощи и срочного лечения острого панкреатита.
Госпитализация в нашу клинику возможна обычной каретой скорой помощи или реанимобилем, в зависимости от состояния больного.
Консервативное и хирургическое лечение острого панкреатита в нашей клинике позволяет купировать осложнения или избежать их.
Почему возникает болезнь?
Острый панкреатит занимает третье место среди болезней ЖКТ, требующих экстренной госпитализации и неотложного хирургического лечения (после аппендицита и холецистита). Этим заболеванием чаще страдают мужчины.
Он имеет два пика заболеваемости. Первый приходится на 40 лет, второй — на 70 лет. Первый связан с употреблением алкоголя, второй (билиарный) — с желчекаменной болезнью.
Непосредственные причины развития острого панкреатита бывают разными, но суть заболевания во всех случаях одна — это самопереваривание поджелудочной железы.
Это защитный механизм, созданный природой для сохранения поджелудочной железы. В силу разных факторов он блокируется.
Это может быть ранняя активизация и преждевременное созревание ферментов, когда они становятся агрессивными до того, как покинут место своего образования.
Или это может быть блокировка панкреатического сока при желчекаменной болезни, дискинезии желчевыводящих путей (билиарный панкреатит). В этом случае желчь поступает в кишку в виде резких выбросов. Это может стать причиной обратного заброса панкреатического сока и самопереваривания поджелудочной железы.
Застой или ранняя активация ферментов приводит к тому, что поджелудочная железа начинает переваривать сама себя.
Самопереваривание поджелудочной железы вызывает воспаление, некроз тканей и разрушение островков Лангерганса (это может стать причиной развития сахарного диабета).
До тех пор, пока воспалительный процесс развивается без присоединения инфекции, он остается асептическим. С присоединением инфекции ситуация резко усугубляется. Заболевание переходит в гнойную форму.
Причины и факторы развития панкреатита
- Неправильное питание. Поджелудочная железа относится к пищеварительной системе, поэтому чувствительна к неправильному питанию. Злоупотребление острой, жирной, жареной пищей вызывает повышенную выработку желчи и панкреатических ферментов. Усиленное поступление желчи в кишку становится причиной обратного заброса ферментов в поджелудочную железу, развивается билиарный панкреатит.
- Злоупотребление алкоголем.
- Желчекаменная болезнь, калькулезный холецистит. Выход протока поджелудочной железы находится прямо напротив фатерова сосочка — выхода общего желчного протока (холедоха). Это напрямую связывает билиарный панкреатит с заболеваниями желчевыводящих путей.
- Травмы. Воспаление поджелудочной железы может развиться на фоне травмы или повреждения (например, вследствие хирургического вмешательства).
- Вирусные или бактериальные инфекции. Воспалительный процесс может быть спровоцирован бактериальной инфекцией (кампилобактериями, микоплазмой, др.) или вирусами (Коксаки, гепатита, свинки, др.).
- Прием лекарственных препаратов. Поджелудочная железа чувствительна к приему гормональных препаратов (кортикостероидов, эстрогенов), а также ряда других лекарственных средств.
- Гастрит, гастродуоденит. Повышенная концентрация соляной кислоты в желудке стимулирует выработку ферментов поджелудочной железы и может спровоцировать их раннее созревание с развитием воспалительного процесса. Воспаление желудка (гастрит) зачастую сочетается с дуоденитом — воспалением кишки, из которой оно может распространиться на поджелудочную железу.
- Гельминтоз. Гельминты — это паразиты, которые выделяют в процессе жизнедеятельности токсины, способные спровоцировать воспаление.
- Эндокринные заболевания. Поскольку поджелудочная железа относится не только к пищеварительной, но также к эндокринной системе, ее воспаление бывает вызвано гормональными сбоями.
В 40% случаев острый панкреатит бывает связан с алкоголизмом, в 20% случаев — с болезнями желчевыводящих путей (желчекаменной болезнью, холециститом), в остальных 40% случаев — с другими причинами.
Читайте также:

